Протопопов А.В., Комарова Н.Г. Лабораторный практикум по коллоидной химии
Подождите немного. Документ загружается.

41
«димер»). Таким образом, в этом случае элементарный акт процесса коагуляции может
состояться.
2) Если преобладает электростатическое отталкивание (|f
d
| <|f
e
|), то частицы могут не
вступать в непосредственное соприкосновение, и коагуляция золя не происходит.
Таким образом, в качестве основного фактора термодинамической устойчивости
дисперсной системы в теории ДЛФО принимают электростатическое (кулоновское)
отталкивание дисперсных частиц.
Для расчета условий коагуляции вводятся дополнительные концепции:
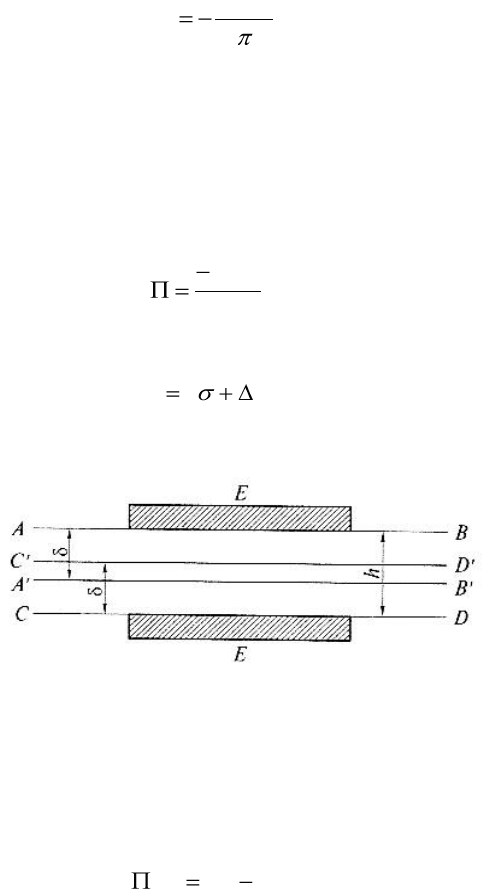
1) Частицы имеют призматическую форму и разделены плоскопараллельным зазором
шириной h (см. рис. 11).
2) Частицы перемещаются только в направлении, перпендикулярном зазору.
Броуновское движение исключается.
Для расчета условий сопоставляются не силы притяжения, а соответствующие им
энергии взаимодействия (U
d
, U
e
).
2
*
12
12 h
A
U
d
(19.1)
где
*
2,1
A
– сложная константа Гамакера; знак «–» указывает на взаимное притяжение.
Энергия электростатического взаимодействия (U
e
) создается вследствие
перекрывания диффузных слоев противоионов в тонкой пленке раствора электролита в
зазоре между частицами.
U
e
, которая зависит от толщины пленки, создает в пленке дополнительное давление –
расклинивающее давление (Π). Π – это термодинамический параметр тонкой жидкой пленки
в пространстве между частицами:
dh
dW
f
, (19.2)
где W
f
– это работа, которую нужно затратить для увеличения поверхности тонкой
пленки на единицу площади при постоянной температуре.
ff
WW 2
, (19.3)
где ΔW
f
– это дополнительная энергия пленки, которую нужно затратить для
сближения поверхностных слоев ABB′A′ и CDD′C′.
Рисунок 11 - Возникновение расклинивающего давления в плоской тонкой пенной
пленке с перекрыванием поверхностных слоев (h < 2δ)
По физическому смыслу величину W
f
можно рассматривать как энергетическое
определение поверхностного натяжения тонкой пленки.
Физический смысл величины Π – это избыточное давление в тонкой пленке по
сравнению с гидростатическим давлением в большом объеме жидкости.
of
pph)(
, (19.4)
где p
f
– давление в тонкой пленке.
Положительное расклинивающее давление препятствует утоньшению пленки!
Возникновение Π связано с поверхностными силами разной природы
(электрическими, магнитными, молекулярными). Для коллоидной химии особенно важны
первые и последние.
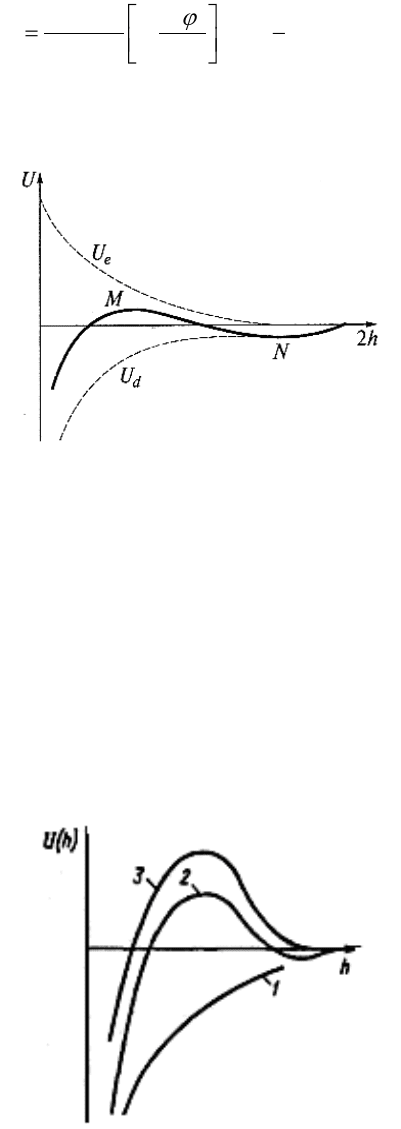
42
При толщине жидкой пленки 1 мкм Π может достигать 400 Па, а 0,04 мкм –
1,88∙10
4
Па.
2
64 2
exp( æ)
æ4
oo
e
C RT e
U th h
RT
,
(19.5)
где 1/æ = δ – толщина ионной атмосферы.
Не обязательно запоминать формулы! Главное уяснить, что U
e
и U
d
имеют разные
знаки и по-разному зависят от толщины разделяющей пленки h:
Рисунок 12 – Изменение энергии (U) тонкой пленки электролита в зависимости от
ее толщины (h)
Как видно из рисунка, U
e
изменяется по экспоненциальному закону (пропорциональна
e
-æh
), U
d
– по степенному (пропорциональна 1/h
2
). Поэтому на малых расстояниях будет
преобладать притяжение (при h → 0 U
d
→ ∞). На больших расстояниях также преобладает
притяжение, т. к. степенная функция убывает медленнее, чем экспонента. На средних
расстояниях возможен локальный (дальний) максимум. Он соответствует энергетическому
(потенциальному) барьеру, который препятствует сближению частиц и их коагуляции.
Анализ уравнения и графика позволяет выделить три случая поведения дисперсной
системы в зависимости от соотношения высоты энергетического барьера U
M
, глубины
потенциальной ямы U
N
на больших расстояниях, и на малых расстояниях энергии тепловых
колебаний k
Б
T.
Рисунок 13 – Изменение энергии (U) тонкой пленки электролита в зависимости от
расстояния
Кривая 1 на рисунке 13 отвечает такому состоянию дисперсной системы, когда при
любом расстоянии между частицами преобладает энергия притяжения над энергией
отталкивания. Не меняет этого соотношения и тепловое движение частиц. При таком
состоянии дисперсной системы наблюдается быстрая коагуляция с образованием агрегатов;
в системах с жидкой и газообразной дисперсными фазами происходит коалесценция. Кривая
2 указывает на наличие достаточно высокого потенциального барьера и вторичного
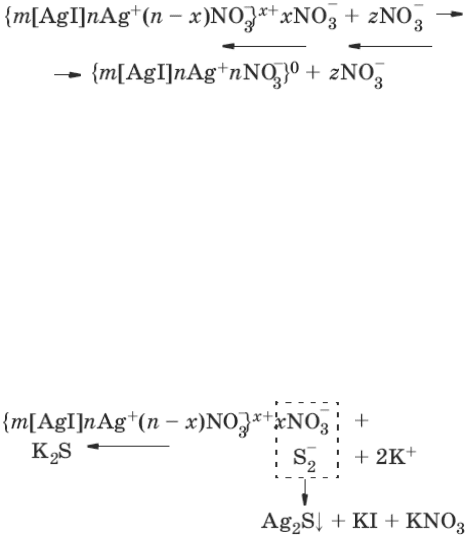
43
минимума. В системе, находящейся в таком состоянии, происходит быстрая флокуляция
частиц на расстояниях, соответствующих вторичному минимуму. Благодаря наличию
потенциального барьера частицы во флокулах не имеют непосредственного контакта и
разделены прослойками среды. Очевидно, что такое состояние отвечает обратимости
коагуляции. Пептизация возможна после устранения вторичного минимума или его
уменьшения до значения меньше кТ. Кривая З отвечает состоянию системы с высоким
потенциальным барьером при отсутствии вторичного минимума или при его глубине,
меньшей тепловой энергии (кТ). Вероятность образования агрегатов частиц в таких условиях
очень мала, и дисперсные системы обладают большой агрегативной устойчивостью
20 Коагуляция лиофобных дисперсных систем
Наибольший теоретический и практический интерес представляет коагуляция
гидрофобных золей электролитами. Как Вы помните, для большинства гидрофобных золей
основным фактором, обеспечивающим их стабильность (наряду с гидратной оболочкой),
является наличие одноименного заряда у частиц дисперсной фазы. Введение электролитов в
гидрозоли может приводить к уменьшению или полной нейтрализации заряда коллоидных
частиц, что ослабляет их электростатическое отталкивание, способствует сближению и
агрегации. Однако механизм электролитной коагуляции может быть различен. Было
обнаружено, что электролиты существенно различаются по способности вызывать
коагуляцию золей. По механизму изменения заряда коллоидных частиц электролиты делятся
на индифферентные и неиндифферентные.
Индифферентными (от лат. indifferens – безразличный) являются электролиты,
которые не способны прочно адсорбироваться на поверхности агрегата. Они вызывают
концентрационную коагуляцию. Такая ситуация обычно реализуется, когда коллоидная
частица имеет значительный заряд, а ионы, входящие в состав электролита, не являются
идентичными с ионами, образующими адсорбционные слои. В этом случае основное
действие вводимого электролита заключается, главным образом, в увеличении ионной силы
дисперсионной среды. Согласно теории Дебая-Хюккеля это приводит к сжатию ионной
атмосферы коллоидной частицы, что вызывает увеличение вероятности проникновения
противоионов из диффузного слоя в адсорбционный. В результате данного процесса заряд
коллоидной частицы, и, следовательно, δ-потенциал уменьшается.
Состояние, при котором диффузный слой исчезнет и коллоидная частица становится
электронейтральной, называется изоэлектрическим – электрокинетический потенциал (δ)
равен нулю, наступает коагуляция. Формула мицеллы в таком состоянии приобретает вид:
{m[AgI]nAg
+
nNO
3¯
}
0
.
Электролиты являются неиндифферентными по отношению к данному гидрозолю,
если они способны прочно адсорбироваться на поверхности агрегата, либо за счет достройки
кристаллической решетки (согласно правилу Пескова-Панета-Фаянса), либо за счет
замещения потенциалопределяющих ионов. Очевидно, что это приведет к изменению как
φ-, так и δ-потенциалов. Данный механизм реализуется лишь тогда, когда заряд коллоидной
частицы невелик. При этом может происходить нейтрализация заряда коллоидной частицы,
поэтому коагуляцию называют нейтрализационной или адсорбционной.
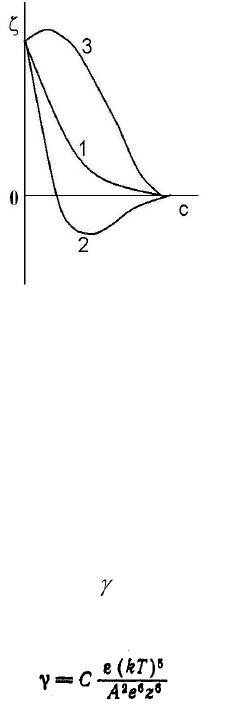
44
Если электролит содержит те же ионы, что и противоионы исходного двойного слоя,
δ-потенциал уменьшается вследствие уменьшения толщины ионной атмосферы
(рис.14, кривая 1). Если добавленный электролит содержит ионы большего знака,
происходит ионный обмен и при наличии сильных электростатических и адсорбционных сил
притяжения ионов к поверхности, может происходить изменение знака δ-потенциала, т.е.
перезарядка частиц золя (рис.14, кривая 2). При добавлении неиндефферентных
электролитов, содержащих ионы одинакового знака с потенциалопредедяющими ионами,
сначала происходит увеличение δ-потенциала (вместе с потенциалом поверхности), а затем
его уменьшение из-за сжатия диффузного слоя (рис.14, кривая 3). Если неиндефферентный
электролит содержит ионы противоположного знака потенциалопределяющим, то
происходит перезарядка поверхности и зависимость δ-потенциала от концентрации
добавленного электролита будет иметь вид кривой 2 рис.14.
Рис.14. Влияние электролитов на δ-потенциал (дзета-потенциал)
Введение любого электролита приводит к увеличению ионной силы и, следовательно,
к сжатию ДЭС. При небольших концентрациях индифферентного электролита его влияние
обычно невелико. Иная ситуация типична для неиндифферентных электролитов – уже
небольшое его количество способно вызвать существенное изменение строения ДЭС.
Коагулирующее действие электролитов определяется, прежде всего, величиной заряда,
электронной структурой и размером тех ионов, знак которых противоположен знаку заряда
коллоидных частиц.
Минимальная концентрация электролита, которая вызывает начало процесса
коагуляции называется порогом коагуляции
к
(ммоль/мл). Она является постоянной
величиной для данной пары золь–электролит при одинаковых внешних условиях
(температура, давление и т. п.).
где С – константа зависящая от отношения числа зарядов катиона и аниона, е – заряд
электрона, z – валентность противоиона, А – постоянная притяжения.
Иногда используют величину, обратную порогу коагуляции, – коагулирующую
способность электролита V
к
.
Правила коагуляции
1. Для протекания коагуляции с заметной скоростью необходимо достижение
некоторой минимальной концентрации электролита – порога коагуляции.
2. Коагулирующим действием обладает тот из ионов электролита, заряд которого
противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем
сильнее, чем больше его заряд (правило Шульце-Гарди). Правило Шульце-Гарди имеет
приближенный характер и справедливо только для неорганических ионов.
Отношение порогов коагуляции одно-, двух- и трехзарядных ионов в соответствии с
эмпирическим правилом Шульце-Гарди приближенно равно:
γ
1
: γ
2
: γ
3
= 500 : 25 : 1,

45
где γ
1
– порог коагуляции для однозарядного иона; γ
2
– то же для двухзарядного иона;
γ
3
– то же для трехзарядного иона.
3. В ряду органических ионов коагулирующее действие пропорционально их
способности адсорбироваться.
4. Началу коагуляции соответствует снижение ξ-потенциала до критической величины
(~0,03 В).
5. В рядах неорганических ионов с одинаковыми зарядами коагулирующее действие
возрастает с уменьшением гидратируемости ионов, или, увеличением радиуса ионов;
например:
Возрастание коагулирующей активности
Li
+
Na
+
К
+
Rb
+
Возрастание степени гидратации
Такие ряды, в которых ионы расположены в порядке убывания или возрастания
коагулирующей способности, называют лиотропными рядами.
6. В осадках, получаемых при коагуляции золей электролитами, всегда присутствуют
ионы, вызвавшие коагуляцию. Например, при коагуляции хлоридом бария золя сульфида
мышьяка, частицы которого имеют отрицательный заряд, в осадке содержится некоторое
количество Ва
2+
.
7. При коагуляции золей смесями электролитов сравнительно редко наблюдается их
независимое (аддитивное) действие; обычно имеет место взаимное усиление (синергизм
ионов) либо ослабление коагулирующего действия (антагонизм ионов).
21 Защита коллоидных частиц и сенсибилизация
При введении в золь определенных высокомолекулярных веществ и образовании на
поверхности частиц соответствующего адсорбционного слоя устойчивость системы может
быть значительно повышена. Такое явление получило название коллоидной защиты.
Веществами, способными обусловливать коллоидную защиту, являются белки, углеводы,
пектины, а для систем с неводной дисперсионной средой — каучук.
Защитное вещество как бы придает золю свойства раствора этого вещества. В
присутствии высокомолекулярных защитных веществ золи, вообще не поддающиеся
концентрированию до высокого содержания дисперсной фазы, можно выпарить досуха и
затем полученный сухой остаток можно снова коллоидно растворить. Электрофоретическая
подвижность частиц золей, адсорбировавших достаточное количество защитного вещества;
обычно равна электрофоретической подвижности молекул полимера. Наконец, защищенные
золи при добавлении электролитов не подчиняются правилу Шульце — Гарди, а ведут себя
как растворы защитного высокомолекулярного вещества, причем для выделения дисперсной
фазы в осадок требуется то же количество электролита, что и для осаждения
высокомолекулярного вещества. Существенно, также, что реагент, способный осаждать
защитное вещество, осаждает и защищенный золь даже в том случае, если исходный золь
индифферентен к этому реагенту.
Для характеристики защитного действия различных высокомолекулярных веществ
Зигмонди предложил так называемое «золотое число». Под золотым числом подразумевают
число миллиграммов высокомолекулярного вещества, которое необходимо—добавить к 10
мл красного золотого золя для того, чтобы предотвратить его .посинение при введении в
систему 1 мл 10%-ного раствора хлорида натрия.
46
Механизм защитного действия сводится к образованию вокруг коллоидной частицы
адсорбционной оболочки из высокомолекулярного вещества.
Иногда введение в коллоидную систему очень малых количеств
высокомолекулярного вещества приводит не к защите, а, наоборот, к сенсибилизации, т. е. к
тому, что порог коагуляции золя, в который введено высокомолекулярное вещество,
оказывается меньшим, чем для исходного золя.
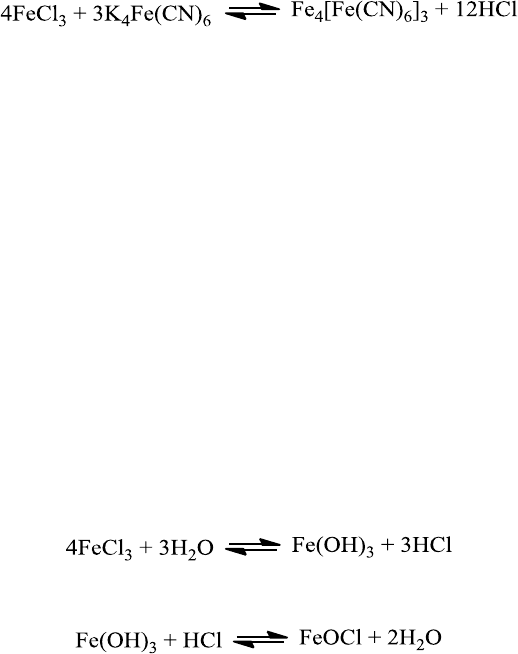
47
Лабораторная работа №2. Получение коллоидных систем конденсационными методами
(При оформлении отчета самостоятельно составить формулы мицелл золей)
.
а) Получение золя берлинской лазури реакцией обмена
В коническую колбу (на 250 мл) наливают 25 мл дистиллированной воды и добавляют
микропипетками (емкостью 1 мл и 2 мл) 0,2 мл концентрированного раствора хлорного
железа (50 %-го) и 2 мл насыщенного раствора желтой кровяной соли K
4
Fe(CN)
6
.
В результате образуется в виде геля не растворимая в воде берлинская лазурь по
реакции
К полученному гелю прибавляют 150 мл дистиллированной воды, встряхивают и
фильтруют через складчатый фильтр. Получается золь с интенсивно синей окраской в
проходящем свете. Стабилизатором является желтая кровяная соль.
б) Получение золя жедезисто-синеродистой меди реакцией обмена
0,5 мл 20 %-го раствора K
4
[Fе(СN)
6
] разбавляют водой до 100 мл в колбе емкостью на
250 мл. В разбавленный раствор прибавляют при взбалтывании 11-12 капель 10%-го
раствора СuSO
4
. Получается очень устойчивый красно-бурый золь.
K
4
[Fе(СN)
6
] + СuSO
4
→ Сu
2
[Fе(СN)
6
] + K
2
SO
4
в) Получение золя гидрата окиси железа (III) методом гидролиза.
Реакция гидролиза есть частный случай реакции двойного обмена. Золь гидрата окиси
железа получается следующим образом: в конической колбе нагревают до кипения 50 мл
дистиллированной воды. Не снимая колбы с плитки, в кипящую воду приливают по каплям
8 мл 2 %-го раствора хлорного железа. После короткого кипячения в результате гидролиза
образуется золь гидроокиси железа красно-коричневого цвета (Fе(ОН)
3
):
Поверхностные молекулы агрегата (Fе(ОН)
3
) вступают в химическое взаимодействие
с HCl по реакции
Образующиеся в этой реакции молекулы FeOCl являются стабилизатором,
диссоциируя на ионы FeO
+
+ Cl
-
.
При охлаждении реакция идет в обратную сторону, поэтому полученный гидрозоль,
если он подлежит длительному хранению, рекомендуется еще горячим подвергнуть диализу.
Строение мицеллы полученного золя можно изобразить следующим образом:
{mFe(OH)
3
nFeO
+
(n-x)Cl
-
}
+
xCl
-
г) Получение гидрозоля перекиси марганца
К 60 мл 0,3 % раствора КМnО
4
приливают 20 мл 1,5 %-го раствора Н
2
О
2
. Приливание
ведется медленно при постоянном взбалтывании. Получается коричневый золь перекиси
марганца, образовавшийся как результат восстановления части KМnО
4
. На нерастворимой
частице MnО
2
адсорбируются ионы МnО
4
-
, определяющие потенциал, в диффузном слое К
+
.
д) Получение золя двуокиси марганца
5 мл 1,5 %-го раствора KMnO
4
разбавляют водой до 50 мл. По каплям из пипетки
вводят 1,5 мл 1 %с-го раствора тиосульфата натрия.
Перманганат калия восстанавливается тиосульфатом натрия до двуокиси марганца.

48
8 KMnO
4
+ 3 Na
2
S
2
O
3
+ H
2
O 8 MnO
2
+ 3 K
2
SO
4
+ 2 KOH + 3 Na
2
SO
4
Потенциалопределящие ионы МnО
4
-
, противоионы К
+
.
е) Получение золя берлинской лазури пептизацией на фильтре
В пробирку пипеткой вводят 1,5 мл насыщенного раствора ферроцианида калия и
0,5 мл 50 %-го раствора хлорида железа (FeCl
3
). Полученный осадок переносят на фильтр,
промывают водой, заливают на фильтре 2-3 мл 2 %-го раствора щавелевой кислоты и
размешивают стеклянной палочкой. Осадок быстро пептизуется и из фильтра стекает
интенсивно окрашенный золь берлинской лазури. Анион С
2
О
4
2-
сильно адсорбируется на
частицах осадка, сообщая им заряд и агрегативную устойчивость.
ж) Получение золя серы методом конденсации
К 50 мл воды добавляют при взбалтывании 4-5 мл насыщенного раствора серы в
ацетоне из капельницы. Образуется голубовато-белый опалесцирующий золь серы в воде с
отрицательно заряженными коллоидными частицами.
Лабораторная работа №3. Очистка коллоидных систем
На широкую часть стакана (1) без дна накладывают смоченный в дистиллированной
воде целлофан (2), являющийся мембраной. Затягивают его круглой резинкой и помещают в
кристаллизатор (3) с дистиллированной водой. Полученный гидрозоль Fе(ОН)
3
еще горячим,
так как при охлаждении идет обратная реакция, наливают в стакан и слегка погружают в
воду (но не ставить на дно кристаллизатора) чуть вращая. Воду в кристаллизаторе меняют
3-4 раза через каждые 2-3 минуты, затем проверяют степень очистки. В пробирку набирают
2-3 мл воды из кристаллизатора и вводят 2-3 капли раствора нитрата серебра. При
отсутствии белого осадка хлорида серебра можно считать золь очищенным.
Установка для очистки
Лабораторная работа №4. Определение знака заряда золя методом капиллярного
анализа
Для окрашенных золей знак заряда можно определить методом капиллярного анализа,
используя зависимость адсорбируемости золей от знака заряда поверхности адсорбента. При
погружении в воду фильтровальной бумаги целлюлозные стенки капилляров заряжаются
отрицательно, а прилегающий к ним слой воды – положительно. За счет сил поверхностного
натяжения вода поднимается по капиллярам бумаги.
49
Если в воду ввести положительно заряженный золь, то его частицы, прилипая к
отрицательно заряженным стенкам капилляров, не будут подниматься вверх.
Частицы отрицательно заряженного золя не притягиваются к отрицательно
заряженным стекам капилляров бумаги и будет наблюдаться передвижение их вверх по
капиллярам в виде окрашивания бумаги.
Опыт проводят, опуская кончик полоски фильтровальной бумаги попеременно в
дистиллированную воду и в коллоидный раствор.
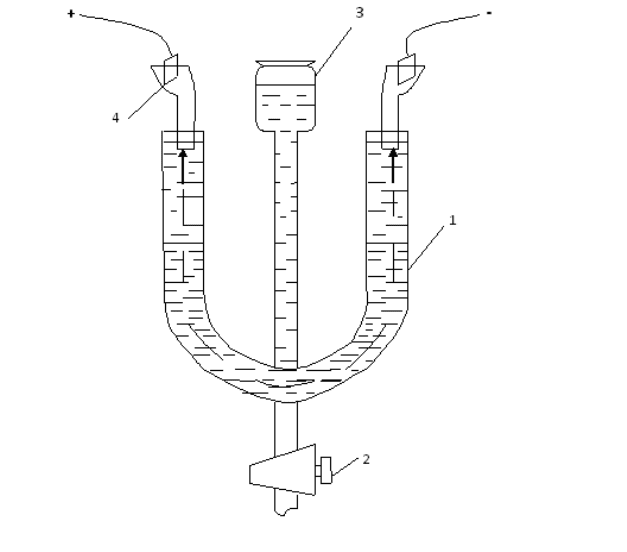
Лабораторная работа №5. Определение электрокинетического потенциала методом
электрофореза
Цель работы: определение знака заряда частиц и электрокинетического потенциала в
дисперсных системах.
Порядок выполнения работы.
Для определения электрокинетического потенциала используется метод подвижной
границы. Принцип его основан на наблюдении за скоростью передвижения границы между
окрашенным золем и прозрачной боковой жидкостью под влиянием электрического поля. В
работе может быть использован прибор, изображенный на рисунке. Перед началом работы
прибор тщательно промывают и высушивают. Затем вынимают кран, протирают его и
осторожно смазывают вазелином так, чтобы вазелин не попал в отверстие крана.
Установка для определения электрокинетического потенциала.
В U-образную трубку (1) до 1/3 ее наливают боковую жидкость при закрытом кране.
Слегка открыв кран (2), заполняют его просвет боковой жидкостью, следя, чтобы в просвете
не оставалось пузырьков. Боковую жидкость готовят из расчета: 50 мл дистиллированной
воды и 3-4 капли насыщенного раствора NaCl. В оба конца U-образной трубки вставляют две
стеклянные трубки (4), заполненные студнем агар-агара, насыщенным хлористым калием
(агар-агаровые сифоны). В верхнюю часть этих трубок наливают раствор сульфата меди.
Приготовленный заранее золь гидрата окиси железа наливают в узкую трубку (3) прибора
через воронку при закрытом кране. Открывают осторожно кран и вводят в U-образную
трубку золь. Если сделать это достаточно осторожно и медленно, то в U-образной трубке
получается резкая граница между золем и боковой жидкостью. Когда уровень коллоидного
50
раствора достигнет трети боковой трубки, а в боковую жидкость войдут агар-агаровые
сифоны, кран закрывают. В агар-агаровые сифоны вставляются электроды и подключаются к
прибору. Включается сначала сеть, затем прибор и фиксируется время, за которое граница
раздела золь – боковая жидкость пройдет 1 см. значение дзета-потенциала вычисляется по
формуле:
E
U4
где δ – электрокинетический потенциал, В;
ε – вязкость, Пз;
- диэлектрическая проницаемость;
U – линейная скорость движения границы, см/с;
Е – напряженность электрического поля, В/см.
Напряженность электрического поля E=V/l,
где V – разность потенциалов на электродах, В;
l – расстояние между электродами, см (на рисунке обозначено пунктиром).
Линейная скорость движения границы U=h/η ,
где h – смещение границы, см;
- время, в течении которого граница сместилась на величину l см, с.
Таблица 3
ε, Пз
h, см
l, см
, с
V, В
E, В/см
U, см/с
ς, В
0.01
1
81
200
Лабораторная работа 6. Определение порога коагуляции
Цель работы: определение порога коагуляции золей различными электролитами.
а) Определение порога коагуляции золя гидроокиси железа.
Так как золь гидроокиси железа заряжен положительно, то коагулирующими ионами
являются анионы. У всех солей должен быть одинаковый катион, так как ион,
сопутствующий коагулирующему иону, также оказывает влияние на порог коагуляции.
Для работы применяют 4М раствор КСl, 0,005 молярный раствор К
2
SO
4
,
0,0005 молярный раствор К
3
[Fе(СN)
6
]. В четыре чистых пробирки наливают по 5 мл золя
гидроокиси железа. Первая пробирка контрольная, в остальные три пробирки добавляют по
каплям из пипетки (на 1-5 мл) растворы KCl (2-я пробирка), К
2
SO
4
(3-я пробирка) и
К
3
[Fе(СN)
6
] (4-я пробирка) до появления мути (сравнить с контрольной пробиркой) и
замеряют объем электролита, пошедшего на коагуляцию.
Порог коагуляции вычисляют по формуле:
,
где γ – порог коагуляции, моль/л, ммоль/л;
С – молярная концентрация электролита, моль/л;
V - наименьшее число миллилитров раствора электролита, достаточное для
коагуляции золя, мл;
v – объем золя, мл.
Найти соотношение γ
+
: γ
2+
: γ
3+
для золя гидроокиси железа и сопоставить полученные
данные с правилом Шульце-Гарди. Рассчитать коагулирующую способность выбранных
электролитов для данного золя.
