Общая химия. Основные понятия и законы химии
Подождите немного. Документ загружается.

[N
+
H
4
] = [OH]
-
= αc = 0,01 • 0,1 = 0,001 моль/л
[NH
4
OH] = c - αc = 0,1 – 0,001 = 0,099 моль/л
Константа диссоциации (K
D
) - отношение произведения равновесных концентраций ионов в
степени соответствующих стехиометрических коэффициентов к концентрации
недиссоциированных молекул.
Она является константой равновесия процесса электролитической диссоциации;
характеризует способность вещества распадаться на ионы: чем выше K
D
, тем больше
концентрация ионов в растворе.
Диссоциации слабых многоосновных кислот или многокислотных оснований протекают по
ступеням, соответственно для каждой ступени существует своя константа диссоциации:
Первая ступень:
H
3
PO
4
↔ H
+
+ H
2
PO
4
-
KD
1
= ([H
+
][H
2
PO
4
-
]) / [H
3
PO
4
] = 7,1 • 10
-3
Вторая ступень:
H
2
PO
4
-
↔ H
+
+ HPO
4
2-
KD
2
= ([H
+
][HPO
4
2-
]) / [H
2
PO
4
-
] = 6,2 • 10
-8
Третья ступень:
HPO
4
2-
↔ H
+
+ PO
4
3-
KD
3
= ([H
+
][PO
4
3-
]) / [HPO
4
2-
] = 5,0 • 10
-13
KD
1
> KD
2
> KD
3
Пример
Получите уравнение, связывающее степень электролитической диссоциации слабого
электролита (α) с константой диссоциации (закон разбавления Оствальда) для слабой
одноосновной кислоты НА.
HA ↔ H
+
+ A
+
K
D
= ([H
+
][A
-
]) / [HA]
Если общую концентрацию слабого электролита обозначить c, то равновесные концентрации
Н
+
и A
-
равны αc, а концентрация недиссоциированных молекул НА - (c - αc) = c (1 - α)
K
D
= (α • c • αc) / c(1 - α) = α
2
c / (1 - α)
В случае очень слабых электролитов (α ≤ 0,01)
K
D
= c • α
2
или α = \⎡(K
D
/ c)
Пример
Вычислите степень диссоциации уксусной кислоты и концентрацию ионов H
+
в 0,1 M растворе,
если K
D
(CH
3
COOH) = 1,85 • 10
-5
Решение
Воспользуемся законом разбавления Оствальда
\⎡(K
D
/ c) = \⎡((1,85 • 10
-5
) / 0,1)) = 0,0136 или α = 1,36%
[H
+
] = α • c = 0,0136 • 0,1 моль/л

Произведение растворимости
Определение
Поместим в химический стакан какую-либо труднорастворимую соль, например, AgCl и
добавим к осадку дистиллированной воды. При этом ионы Ag
+
и Cl
-
, испытывая притяжение со
стороны окружающих диполей воды, постепенно отрываются от кристаллов и переходят в
раствор. Сталкиваясь в растворе, ионы Ag
+
и Cl
-
образуют молекулы AgCl и осаждаются на
поверхности кристаллов. Таким образом, в системе происходят два взаимно противоположных
процесса, что приводит к динамическому равновесию, когда в единицу времени в раствор
переходит столько же ионов Ag
+
и Cl
-
, сколько их осаждается. Накопление ионов Ag
+
и Cl
-
в
растворе прекращается, получается насыщенный раствор. Следовательно, мы будем
рассматривать систему, в которой имеется осадок труднорастворимой соли в соприкосновении
с насыщенным раствором этой соли. При этом происходят два взаимно противоположных
процесса:
1) Переход ионов из осадка в раствор. Скорость этого процесса можно считать постоянной
при неизменной температуре: V
1
= K
1
;
2) Осаждение ионов из раствора. Скорость этого процесса V
2
зависит от концентрации ионов
Ag
+
и Cl
-
. По закону действия масс:
V
2
= k
2
• [Ag
+
] • [Cl
-
]
Так как данная система находится в состоянии равновесия, то
V
1
= V
2
k
2
= k
1
• [Ag
+
] • [Cl
-
]
[Ag
+
] • [Cl
-
] = k
2
/ k
1
= const (при T = const)
Таким образом, произведение концентраций ионов в насыщенном растворе
труднорастворимого электролита при постоянной температуре является постоянной
величиной. Эта величина называется произведением растворимости (ПР).
В приведенном примере ПРAgCl = [Ag
+
] • [Cl
-
]. В тех случаях, когда электролит содержит два
или несколько одинаковых ионов, концентрация этих ионов, при вычислении произведения
растворимости должна быть возведена в соответствующую степень.
Например, ПР
Ag
2
S = [Ag
+
]
2
• [S
2-
]; ПРPbI
2
= [Pb
2+
] • [I
-
]
2
В общем случае выражение произведения растворимости для электролита A
m
B
n
ПРA
m
B
n
= [A]
m
[B]
n
.
Значения произведения растворимости для разных веществ различны.
Например, ПРCaCO
3
= 4,8 • 10
-9
; ПРAgCl = 1,56 • 10
-10
.
ПР легко вычислить, зная раcтворимость соединения при данной t°.
Пример 1
Растворимость CaCO
3
равна 0,0069 или 6,9 • 10
-3
г/л. Найти ПРCaCO
3
.
Решение
Выразим растворимость в молях:
SCaCO
3
= (6,9 • 10
-3
) / 100,09 = 6,9 • 10
-5
моль/л
MCaCO
3

Так как каждая молекула CaCO
3
дает при растворении по одному иону Ca
2+
и CO
3
2-
, то
[Ca
2+
] = [ CO
3
2-
] = 6,9 • 10
-5
моль/л,
следовательно, ПРCaCO
3
= [Ca
2+
] • [CO
3
2-
] = 6,9 • 10
–5
•
6,9 • 10
-5
= 4,8 • 10
-9
Зная величину ПР, можно в свою очередь вычислить растворимость вещества в моль/л или
г/л.
Пример 2
Произведение растворимости ПРPbSO
4
= 2,2 • 10
-8
г/л.
Чему равна растворимость PbSO
4
?
Решение
Обозначим растворимость PbSO
4
через X моль/л. Перейдя в раствор, X молей PbSO
4
дадут X
ионов Pb
2+
и X ионов SO
4
2-
, т.е.:
[Pb
2+
] = [SO
4
2-
] = X
ПРPbSO
4
= [Pb
2+
] = [SO
4
2-
] = X • X = X
2
X = \⎡(ПРPbSO
4
) = \⎡(2,2 • 10
-8
) = 1,5 • 10
-4
моль/л.
Чтобы перейти к растворимости, выраженной в г/л, найденную величину умножим на
молекулярную массу, после чего получим:
1,5 • 10
-4
• 303,2 = 4,5 • 10
-2
г/л.
Образование осадков
Если
[Ag
+
] • [Cl
-
] < ПРAgCl - ненасыщенный раствор
[Ag
+
] • [Cl
-
] = ПРAgCl - насыщенный раствор
[Ag
+
] • [Cl
-
] > ПРAgCl - перенасыщенный раствор
Осадок образуется в том случае, когда произведение концентраций ионов малорастворимого
электролита превысит величину его произведения растворимости при данной температуре.
Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается.
Зная объем и концентрацию смешиваемых растворов, можно рассчитать, будет ли выпадать
осадок образующейся соли.
Пример 3
Выпадает ли осадок при смешении равных объемов 0,2 M растворов Pb(NO
3
)
2
и NaCl.
ПРPbCl
2
= 2,4 • 10
-4
.
Решение
При смешении объем раствора возрастает вдвое и концетрация каждого из веществ
уменьшится вдвое, т.е. станет 0,1 M или 1,0 • 10
-1
моль/л. Таковы же будут концентрации Pb
2+
и Cl
-
. Следовательно, [Pb
2+
] •
[Cl
-
]
2
= 1 • 10
-1
• (1 • 10
-1
)
2
= 1 • 10
-3
. Полученная величина
превышает ПРPbCl
2
(2,4 • 10
-4
). Поэтому часть соли PbCl
2
выпадает в осадок. Из всего
сказанного выше можно сделать вывод о влиянии различных факторов на образование
осадков.
Влияние концентрации растворов
Труднорастворимый электролит с достаточно большой величиной ПР нельзя осадить из
разбавленных растворов. Например, осадок PbCl
2
не будет выпадать при смешении равных
объемов 0,1 M растворов Pb(NO
3
)
2
и NaCl. При смешивании равных объемов концентрации
каждого из веществ станут 0,1 / 2 = 0,05 M или 5 • 10
-2
моль/л. Ионное произведение [Pb
2+
] •
[Cl
1-
]
2
= 5 • 10
-2
• (5 • 10
-2
)
2
= 12,5 • 10
-5
. Полученная величина меньше ПРPbCl
2
, следовательно
выпадения осадка не произойдет.
Влияние количества осадителя
Для возможно более полного осаждения употребляют избыток осадителя.
Например, осаждаем соль BaCO
3
: BaCl
2
+ Na
2
CO
3
→ BaCO
3
↓ + 2NaCl. После прибавления
эквивалентного количества Na
2
CO
3
в растворе остаются ионы Ba
2+
, концентрация которых
обусловлена величиной ПР.
Повышение концентрации ионов CO
3
2-
, вызванное прибавлением избытка осадителя (Na
2
CO
3
),
повлечет за собой соответственное уменьшение концентрации ионов Ba
2+
в растворе, т.е.
увеличит полноту осаждения этого иона.
Влияние одноименного иона
Растворимость труднорастворимых электролитов понижается в присутствии других сильных
электролитов, имеющих одноименные ионы. Если к ненасыщенному раствору BaSO
4
понемногу прибавлять раствор Na
2
SO
4
, то ионное произведение, которое было сначала
меньше ПРBaSO
4
(1,1 • 10
-10
), постепенно достигнет ПР и превысит его. Начнется выпадение
осадка.
Влияние температуры
ПР является постоянной величиной при постоянной температуре. С увеличением температуры
ПР возрастает, поэтому осаждение лучше проводить из охлажденных растворов.
Растворение осадков
Правило произведения растворимости важно для переведения труднорастворимых осадков в
раствор. Предположим, что надо растворить осадок BaСO
3
. Раствор, соприкасающийся с этим
осадком, насыщен относительно BaСO
3
.
Это означает, что [Ba
2+
] • [CO
3
2-
] = ПРBaCO
3
.
Если добавить в раствор кислоту, то ионы H
+
свяжут имеющиеся в растворе ионы CO
3
2-
в
молекулы непрочной угольной кислоты:
2H
+
+ CO
3
2-
→ H
2
CO
3
→ H
2
O + CO
2
↑
Вследствие этого резко снизится концентрация иона CO
3
2-
, ионное произведение станет
меньше величины ПР
BaCO
3
. Раствор окажется ненасыщенным относительно BaСO
3
и часть
осадка BaСO
3
перейдет в раствор. При добавлении достаточного количества кислоты можно
весь осадок перевести в раствор. Следовательно, растворение осадка начинается тогда, когда
по какой-либо причине ионное произведение малорастворимого электролита становится
меньше величины ПР. Для того, чтобы растворить осадок, в раствор вводят такой электролит,
ионы которого могут образовывать малодиссоциированное соединение с одним
из ионов
труднорастворимого электролита. Этим объясняется растворение труднорастворимых
гидроксидов в кислотах
Fe(OH)
3
+ 3HCl → FeCl
3
+ 3H
2
O
Ионы OH
-
связываются в малодиссоциированные молекулы H
2
O.
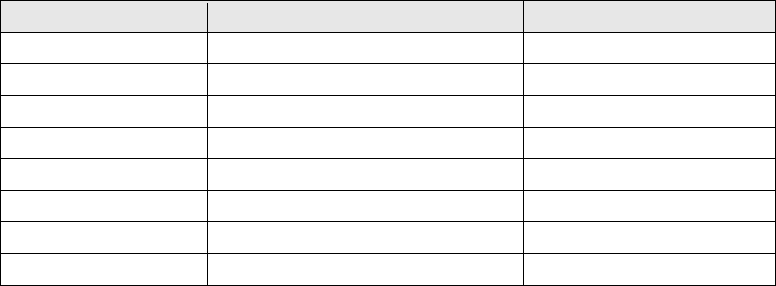
Таблица. Произведение растворимости (ПР) и растворимость при 25°С некоторых малорастворимых веществ
Формула Растворимость ПР моль / л
AgBr 7,94 • 10
-7
6,3 • 10
-13
AgCl 1,25 • 10
-5
1,56 • 10
-10
AgI 1,23 • 10
-8
1,5 • 10
-16
Ag
2
CrO
4
1,0 • 10
-4
4,05 • 10
-12
BaSO
4
7,94 • 10
-7
6,3 • 10
-13
CaCO
3
6,9 • 10
-5
4,8 • 10
-9
PbCl
2
1,02 • 10
-2
1,7 • 10
-5
PbSO
4
1,5 • 10
-4
2,2 • 10
-8

РАСТВОРЫ
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
ИОННЫЕ РЕАКЦИИ. ГИДРОЛИЗ
Ионные реакции в растворе
Реакции ионного обмена - это реакции между ионами, образовавшимися в результате
диссоциации электролитов.
Правила составления ионных уравнений реакций
1. Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты,
основания и соли) не диссоциируют.
2. В реакциях используют растворы веществ, поэтому даже малорастворимые вещества
находятся в растворах в виде ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного
уравнения его считают нерастворимым.
4. Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть
одинаковой.
Порядок составления ионных уравнений реакции
1. Записывают молекулярное уравнение реакции
MgCl
2
+ 2AgNO
3
→ 2AgCl + Mg(NO
3
)
2
2. Определяют растворимость каждого из веществ с помощью таблицы растворимости
p p H p
MgCl
2
+ 2AgNO
3
→
2AgCl + Mg(NO
3
)
2
3. Записывают уравнения диссоциации растворимых в воде исходных веществ и продуктов
реакции:
MgCl
2
↔ Mg
2+
+ 2Cl
-
AgNO
3
↔ Ag
+
+ NO
3
-
Mg(NO
3
)
2
↔ Mg
2+
+ 2NO
3
-
4. Записывают полное ионное уравнение реакции
Mg
2+
+ 2Cl
-
+ 2Ag
+
+ 2NO
3
-
→ 2AgCl↓ + Mg
2+
+ 2NO
3
-
5. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон:
Mg
2+
+ 2Cl
-
+ 2Ag
+
+ 2NO
3
-
→ 2AgCl↓ + Mg
2+
+ 2NO
3
-
Ag
+
+ Cl
-
→ AgCl↓
Условия необратимости реакций ионного обмена
1. Если образуется осадок (↓) (смотри таблицу растворимости)
Pb(NO
3
)
2
+ 2KI → PbI
2
↓ + 2KNO
3
Pb
2+
+ 2I
-
→ PbI
2
↓
2. Если выделяется газ (↑)
Na
2
CO
3
+ H
2
SO
4
→ Na
2
SO
4
+ H
2
O + CO
2
↑
CO
3
2-
+ 2H
+
→ H
2
O + CO
2
↑
3. Если образуется малодиссоциированное вещество (H
2
O)
Ca(OH)
2
+ 2HNO
3
→ Ca(NO
3
)
2
+ 2H
2
O
H
+
+ OH
-
→ H
2
O
4. Если образуются комплексные соединения (малодиссоциированные комплексные ионы)
CuSO
4
• 5H
2
O + 4NH
3
→ [Cu(NH
3
)
4
]SO
4
+ 5H
2
O
Cu
2+
+ 4NH
3
→ [Cu(NH
3
)
4
]
2+
В тех случаях, когда нет ионов, которые могут связываться между собой с образованием
осадка, газа, малодиссоциированных соединений (H
2
O) или комплексных ионов реакции
обмена обратимы ↔.
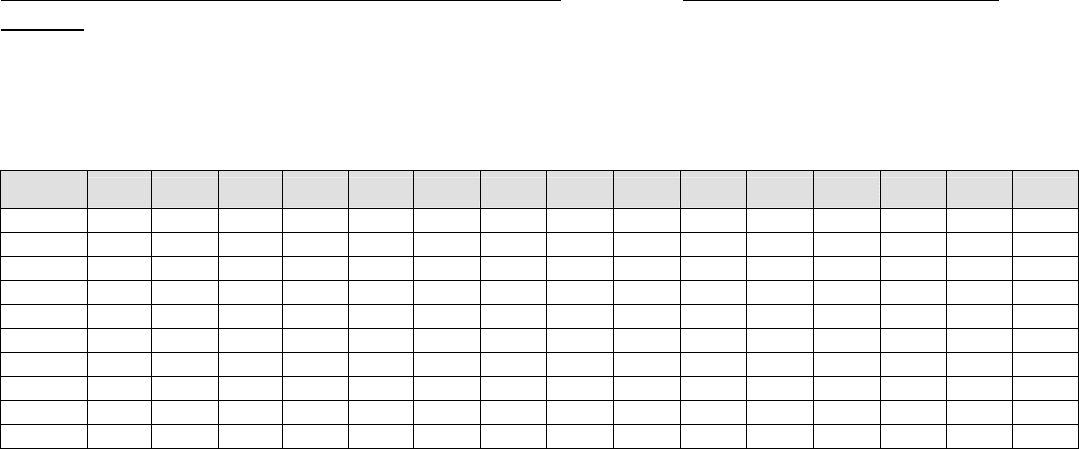
Растворимость солей, кислот и оснований в воде
Таблица. Таблица растворимости солей, кислот и оснований в воде
Катион
анион
H
+
NH
4+
K
+
Na
+
Ag
+
Ba
2+
Ca
2+
Mg
2+
Zn
2+
Cu
2+
Hg
2+
Pb
2+
Fe
2+
Fe
3+
Al
3+
OH
-
P P P – P M M H H – H H H H
NO
3-
P P P P P P P P P P P P P P P
Cl
-
P P P P H P P P P P P M P P P
S
2-
P P P P H P – – H H H H H H –
SO
3
2-
P P P P M M M P M – – H M – –
SO
4
2-
P P P P M H M P P P – M P P P
CO
3
2-
P P P P H H H H H – H H H – –
SIO
3
2-
H – P P H H H H H – – H H – –
PO
4
3-
P P P P H H H H H H H H H H H
CH
3
COO
-
P P P P P P P P P P P P P P P
P - растворимое ( >1 г в 100 г воды);
M - малорастворимое (0,001 г - 1г в 100 г воды);
H - нерастворимое (< 0,001 г в 100 г воды);
– - разлагается водой или не существует.
Ионное произведение воды
Вода является слабым электролитом и в незначительной степени диссоциирует на ионы по
реакции:
H
2
O ↔ H
+
+ OH
-
K = ([H
+
][OH
-
]) / [H
2
O] = 1,8 • 10
-16
(при 22°С)
В знаменателе дроби - концентрация недиссоциированных молекул воды, которую можно
считать постоянной и определить в 1 л, приняв массу 1 л воды за 1000 г.
[H
2
O] = 1000 / 18 = 55,56 молей
Тогда
K = ([H
+
][OH
-
]) / 55,56 = 1,8 • 10
-16
или ([H
+
][OH
-
] = 1 • 10
-14
(ионное произведение воды)
pH раствора
Величина pH используется для характеристики кислотности раствора. Если концентрация
ионов водорода равна [H
+
], то
pH = -lg [H
+
]
В чистой воде
[H
+
] = [OH
-
] = 10
-7
В кислых растворах
[H
+
] > [OH
-
] и pH < 7
например, в 10
-3
М растворе HCl
pH = 3
В щелочных растворах
[H
+
] < [OH
-
] и pH > 7
например, в 10
-2
М растворе NaOH
pOH = -lg2 • 10
-2
= 2 - lg2 = 1,7
pH = 14 - pOH = 14 - 1,7 = 12,3
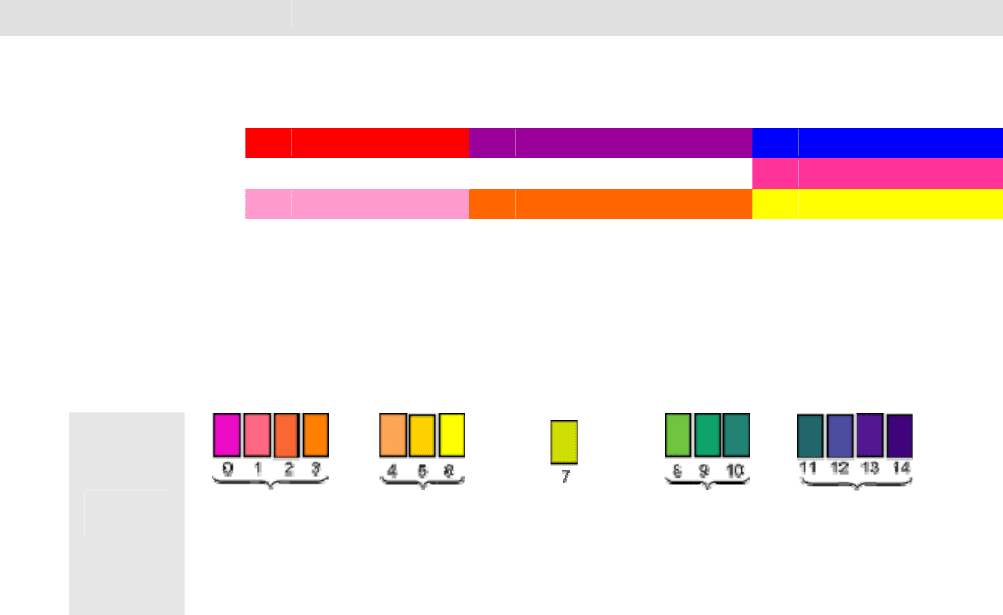
Таблица. Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора
⇒ Название
Окраска индикатора в среде
⇒ Кислая
[H
+
] > [OH
-
]
рН < 7
⇒ Нейтральная
[H
+
] = [OH
-
]
рН = 7
⇒ Щелочная
[OH
-
] > [H
+
]
рН > 7
Лакмус
красный фиолетовый синий
Фенолфталеин бесцветный бесцветный малиновый
Метилоранж розовый оранжевый желтый
Для более точного определения значения pH растворов используют сложную смесь
нескольких индикаторов, нанесенную на фильтровальную бумагу (так называемый
"Универсальный индикатор Кольтгоффа"). Полоску индикаторной бумаги обмакивают в
исследуемый раствор, кладут на белую непромокаемую подложку и быстро сравнивают
окраску полоски с эталонной шкалой для pH:
сильно-
кислая
слабо-
кислая
↓
слабо-
щелочная
сильно-
щелочная
←
нейтральная
→
Реакция
раствора
Усиление кислотности среды
Усиление основности среды

Определение гидролиза
Гидролиз - это химическая реакция ионного обмена между водой и растворённым в ней
веществом с образованием слабого электролита. (В общем случае обменное взаимодействие
растворённого вещества с растворителем носит название - сольволиз).
В большинстве случаев гидролиз сопровождается изменением pH раствора.
Большинство реакций гидролиза - обратимы:
Pb(NO
3
)
2
+ H
2
O ↔ Pb(OH)(NO
3
) + HNO
3
Na
2
HPO
4
+ H
2
O ↔ NaH
2
PO
4
+ NaOH
Некоторые реакции гидролиза протекают необратимо:
Al
2
S
3
+ 6H
2
O ↔ 2Al(OH)
3
↓ + 3H
2
S↑
Причиной гидролиза является взаимодействие ионов соли с молекулами воды из гидратной
оболочки с образованием малодиссоциированных соединений или ионов.
Способность солей подвергаться гидролизу зависит от двух факторов:
a. свойств ионов, образующих соль;
b. внешних факторов.
Отсутствие гидролиза в растворах
Соли, образованные катионом сильного основания и анионом сильной кислоты (например,
LiBr, K
2
SO
4
, NaClO
4
, BaCl , Ca(NO
3
)
2
и др.) гидролизу не подвергаются, т.к. ни катион, ни анион
соли не могут при взаимодействии с водой образовать молекулы слабых электролитов.
Водные растворы таких солей имеют нейтральную реакцию среды (pH = 7). Практически не
гидролизуются также и труднорастворимые соли (CaCO
3
, Mg
3
(PO
4
)
2
и др.) из-за очень низкой
концентрации ионов в водных растворах этих солей.
Гидролиз по катиону
Соли слабого основания и сильной кислоты гидролизуются по катиону:
NH
4
Cl + H
2
O ↔ NH
4
OH + HCl
В ионной форме:
NH
4
+
+ H
2
O ↔ NH
4
OH + H
+
Гидролиз солей, образованных многовалентным катионом протекает ступенчато, через стадии
образования основных солей:
1 ступень:
Al(NO
3
)
3
+ H
2
O ↔ Al(OH)(NO
3
)
2
+ HNO
3
Al
3+
+ H
2
O ↔ [Al(OH)]
2+
+ H
+
2 ступень:
Al(OH)(NO
3
)
2
+ H
2
O ↔ Al(OH)
2
(NO
3
) + HNO
3
[Al(OH)]
2+
+ H
2
O ↔ [Al(OH)
2
]
+
+ H
+
3 ступень:
Al(OH)
2
(NO
3
) + H
2
O ↔ Al(OH)
3
+ HNO
3
[Al(OH)
2
]
+
+ H
2
O ↔ Al(OH)
3
+ H
+
Гидролиз протекает достаточно сильно по первой ступени, слабо - по второй ступени и совсем
слабо - по третьей ступени (ввиду накопления ионов водорода, процесс смещается в сторону
исходных веществ). Более полному гидролизу способствует разбавление раствора и
повышение температуры. (В этом случае можно учитывать гидролиз и по третьей ступени.)
При гидролизе по катиону реакция раствора кислая pH < 7.
Гидролиз по аниону
Соли, образованные сильным основанием и слабой (ассоциированной) кислотой
гидролизуются по аниону:
CH
3
COOK + H
2
O ↔ CH
3
COOH + KOH
В ионной форме:
CH
3
COO
-
+ H
2
O ↔ CH
3
COOH +OH
-
Соли многоосновных кислот гидролизуются ступенчато (с образованием кислых солей):
1 ступень:
K
2
CO
3
+ H
2
O ↔ KHCO
3
+ KOH
CO
2-
3
+ H
2
O ↔ HCO
3
-
+ OH
-
2 ступень:
KHCO
3
+ H
2
O ↔ H
2
CO
3
+ KOH
HCO
3
-
+ H
2
O ↔ H
2
CO
3
+ OH
-
Первая ступень гидролиза протекает достаточно сильно, а вторая - слабо, о чём
свидетельствует pH раствора карбоната и гидрокарбоната калия. (Лишь при сильном
разбавлении и нагревании следует учитывать гидролиз образующейся кислой соли).
Поскольку при взаимодействии с водой анионов слабых кислот образуются ионы OH
-
, водные
растворы таких солей имеют щелочную реакцию (pH > 7).
Гидролиз по катиону и аниону
Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону и по
аниону:
CH
3
COONH
4
+ H
2
O ↔ CH
3
COOH + NH
4
OH
или в ионной форме:
CH
3
COO
-
+ NH
4
+
+ H
2
O ↔ CH
3
COOH + NH
4
OH
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и
слабое основание, и слабая кислота.
Реакция среды в этом случае зависит от сравнительной силы основания и кислоты, т.е. от их
констант диссоциации (K
D
).
Если K
D
(основания)
> K
D
(кислоты)
, то pH > 7;
если K
D
(основания) < K
D
(кислоты), то pH < 7.
В случае гидролиза CH
3
COONH
4
:
K
D
(NH
4
OH) = 6,3 • 10
-5
; K
D
(CH
3
COOH)=1,8 • 10
-5
поэтому реакция водного раствора этой соли будет слабощелочной, почти нейтральной (pH =
7–8).
Если основание и кислота, образующие соль, являются не только слабыми электролитами, но
и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то в
этом случае гидролиз соли протекает необратимо:
