Общая химия. Основные понятия и законы химии
Подождите немного. Документ загружается.


18 19 20 48 50
Радиоактивность
Радиоактивность - самопроизвольное превращение неустойчивого изотопа одного
химического элемента в изотоп другого элемента, сопровождающееся испусканием
элементарных частиц или ядер (например, α- частиц).
Радиоактивность, проявляемая природными изотопами элементов, называется естественной
радиоактивностью.
Самопроизвольный распад ядер описывается уравнением: m
t
= m
0
• (1/2)
t / T
1/2
где m
t
и m
0
-
массы изотопа в момент времени t и в начальный момент времени; Т
1/2
- период полураспада,
который является постоянным для данного изотопа. За время Т
1/2
распадается половина всех
ядер данного изотопа.
Основные виды радиоактивного распада.
α - распад. Сопровождается потоком положительно заряженных ядер атома гелия
4
2
Не (α-
частиц) со скоростью 20000 км/с. При этом заряд Z исходного ядра уменьшается на 2 единицы
(в единицах элементарного заряда), а массовое число А - на 4 единицы (в атомных единицах
массы).
Z' = Z – 2
A' = A – 4
т.е. образуется атом элемента, смещенного по периодической системе на две клетки влево, от
исходного радиоактивного элемента, а его массовое число на 4 единицы меньше исходного.
226
82
Ra →
222
80
Rh +
4
2
He
β - распад. Излучение ядром атома потока электронов со скоростью 100'000 - 300'000 км/с.
(Электрон образуется при распаде нейтрона ядра. Нейтрон может распадаться на протон и
электрон.) При β- распаде массовое число изотопа не изменяется, поскольку общее число
протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1. (Химический элемент
смещается в периодической системе на одну клетку вправо, а его массовое число не
изменяется)
234
90
Th →
234
91
Po +
0
-1
e
γ- распад. Возбужденное ядро испускает электромагнитное излучение с очень малой длиной
волны и высокой частотой, обладающее большой проникающей способностью, при этом
энергия ядра уменьшается, массовое число и заряд остаются неизменными. (Химический
элемент не смещается в периодической системе, его массовое число не изменяется и лишь
ядро его атома переходит из возбужденного состояния в менее возбужденное).
Ядерные реакции - превращения ядер, происходящие при их столкновении друг с другом или с
элементарными частицами. Первая искусственная ядерная реакция была осуществлена
Э.Резерфордом (1919 г.) при бомбардировке ядер азота α- частицами:
14
7
N +
4
2
He →
17
8
O +
1
1
H
С помощью ядерных реакций были получены изотопы многих химических элементов и ядра
всех химических элементов с порядковыми номерами от 93 до 110.

СТРОЕНИЕ АТОМА
При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение
электронных оболочек вследствие перераспределения электронов между атомами.
Способностью атомов отдавать или присоединять электроны определяются его химические
свойства.
Электрон имеет двойственную (корпускулярно-волновую) природу. Благодаря волновым
свойствам электроны в атоме могут иметь только строго определенные значения энергии,
которые зависят от расстояния до ядра. Электроны, обладающие близкими значениями
энергии образуют энергетический уровень. Он содержит строго определенное число
электронов - максимально 2n
2
. Энергетические уровни подразделяются на s-, p-, d- и f-
подуровни; их число равно номеру уровня.
Квантовые числа электронов
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых
чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три
характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность
уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и
соответствует номеру периода. Из периодической системы для любого элемента по номеру
периода можно определить число энергетических уровней атома и какой энергетический
уровень является внешним.
Пример.
Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны
раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет
пятый уровень (n = 5).
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает
значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому
значению орбитального квантового числа соответствует орбиталь особой формы. Набор
орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми
n и l - подуровнем.
Для
l=0 s- подуровень, s- орбиталь – орбиталь сфера
l=1 p- подуровень, p- орбиталь – орбиталь гантель
l=2 d- подуровень, d- орбиталь – орбиталь сложной формы
f-подуровень, f-орбиталь – орбиталь еще более сложной формы
S - орбиталь Три p – орбитали

Пять d – орбиталей
На первом энергетическом уровне (n = 1) орбитальное квантовое число l принимает
единственное значение l = (n - 1) = 0. Форма обитали - сферическая; на первом
энергетическом только один подуровень - 1s. Для второго энергетического уровня (n = 2)
орбитальное квантовое число может принимать два значения: l = 0, s- орбиталь - сфера
большего размера, чем на первом энергетическом уровне; l = 1, p- орбиталь - гантель. Таким
образом, на втором энергетическом уровне имеются два подуровня - 2s и 2p. Для третьего
энергетического уровня (n = 3) орбитальное квантовое число l принимает три значения: l = 0, s-
орбиталь - сфера большего размера, чем на втором энергетическом уровне; l = 1, p- орбиталь
- гантель большего размера, чем на втором энергетическом уровне; l = 2, d- орбиталь сложной
формы.
Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня -
3s, 3p и 3d.
Магнитное квантовое число
(m) характеризует положение электронной орбитали в
пространстве и принимает целочисленные значения от -I до +I, включая 0. Это означает, что
для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в
пространстве.
Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь
разные ориентации в пространстве.
Для p- орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1.
Для d- орбитали (l = 2) -
пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0,
+1, +2.
Таким образом, на s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f-
подуровне - 7 орбиталей.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении
электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие
противоположным направлениям вращения.
Принципы заполнения орбиталей
1. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех
квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться
не более двух электронов (c противоположными спинами).
2. Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый
электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n +
l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию
имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d ≈ 4f < 6p < 7s.
3. Правило Хунда. Атом в основном состоянии должен иметь максимально возможное
число неспаренных электронов в пределах определенного подуровня.
Полная электронная формула элемента
Запись, отражающая распределение электронов в атоме химического элемента по
энергетическим уровням и подуровням, называется электронной конфигурацией этого атома.
В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу
минимальной энергии. Это значит, что сначала заполняются подуровни, для которых:
1) Главное квантовое число n минимально;
2) Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d- (l
минимально);
3) Заполнение происходит так, чтобы (n + l) было минимально (правило Клечковского);
4) В пределах одного подуровня электроны располагаются таким образом, чтобы их
суммарный спин был максимален, т.е. содержал наибольшее число неспаренных
электронов (правило Хунда).
5) При заполнении электронных атомных орбиталей выполняется принцип Паули. Его
следствием является, что энергетическому уровню с номером n может принадлежать не
более чем 2n
2
электронов, расположенных на n
2
подуровнях.
Полная электронная формула элемента
Пример.
Цезий (Сs) находится в 6 периоде, его 55 электронов (порядковый номер 55) распределены по
6 энергетическим уровням и их подуровням. Cоблюдая последовательность заполнения
электронами орбиталей получим:
55
Cs 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
4p
6
4d
10
5s
2
5p
6
5d
10
6s
1

ПЕРИОДИЧЕСКИЙ ЗАКОН
Д. И. МЕНДЕЛЕЕВА
"Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ),
стоят в периодической зависимости от их атомного веса".
Современная формулировка:
"свойства химических элементов (т.е. свойства и форма образуемых ими соединений)
находятся в периодической зависимости от заряда ядра атомов химических элементов".
Физический смысл химической периодичности
Периодические изменения свойств химических элементов обусловлены правильным
повторением электронной конфигурации внешнего энергетического уровня (валентных
электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она
содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного
квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32
(шестой) элементов, в зависимости от количества электронов на внешнем энергетическом
уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а
заканчиваются благородным газом (ns
2
np
6
).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать
электроны, а неметаллические - присоединять электроны из-за стремления атомов
приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s-
подуровня указывает на металлические свойства атома, а формирование внешнего p-
подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1
до 5) усиливает неметаллические свойства атома.
Атомы с полностью сформированной,
энергетически устойчивой конфигурацией внешнего электронного слоя (ns
2
np
6
) химически
инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит
более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d-
подуровня при сохранении внешнего ns
2
- слоя. Большие периоды состоят из четных и
нечетных рядов.
У элементов четных рядов на внешнем слое ns
2
- электроны, поэтому преобладают
металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах
формируется np- подуровень, что объясняет значительное ослабление металлических
свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов,
равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны
которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные
электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d-
подуровне (или (n - 2) f-
подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными
электронами, элементы периодической системы подразделяются на: s- элементы (элементы
главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d-
элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).

В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические
ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы
меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и
их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают
основные свойства, с IV по VIII - кислотные.
Группа I II III IV V VI VII
VIII
(кроме инертных газов)
Высший оксид Э
2
О ЭО Э
2
О
3
ЭО
2
Э
2
О
5
ЭО
3
Э
2
О
7
ЭО
4
Гидрат высшего оксида ЭОН Э(ОН)
2
Э(ОН)
3
Н
2
ЭО
3
Н
3
ЭО
4
Н
2
ЭО
4
НЭО
4
Н
4
ЭО
4
Для элементов главных подгрупп общими являются формулы водородных соединений.
Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в
степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов
главных подгрупп IV группы (ЭН
4
) - нейтральны, V группы (ЭН
3
) - основания, VI и VII групп (Н
2
Э
и НЭ) - кислоты.
От положения элементов в периодической системе зависят свойства атома, связанные с его
электронной конфигурацией: атомный радиус - по периоду слева направо уменьшается, а в
подгруппе сверху вниз возрастает; энергия ионизации - по периоду возрастает, а в подгруппе
уменьшается; электроотрицательность - по периоду увеличивается, а в подгруппе
уменьшается.
По положению элемента в периодической системе можно прогнозировать его основные
свойства как средние всех его соседей:
Пример
На основании периодической таблицы охарактеризуйте химические элементы с порядковыми
номерами 21 и 34.
Для характеристики химического элемента по периодической системе Д.И.Менделеева
следует рассмотреть:
1. Положение в периодической таблице (порядковый номер; период, ряд; группа, подгруппа;
атомная масса).
2. Строение атома (заряд ядра; состав ядра - количество протонов p
1
1
, нейтронов n
0
1
и
электронов ē; число энергетических уровней и подуровней; написать формулу электронной
конфигурации; квантовые ячейки; по числу и характеру валентных электронов определить
тип элемента).
3. Формулы и химический характер соединений (высшего оксида и гидроксида; водородных
соединений).
4. Сравнить с соседями (по периоду, по группе).
a) Порядковый номер элемента Z = 21 обозначает: заряд ядра атома элемента (скандия):
65
21
Sc – +21; число протонов p
1
1
:
21
Sc – 21 p
1
1
; число электронов ē:
21
Sc – 21ē; число
нейтронов n
0
1
= A
r
– Z = 65 – 21 = 44 – 44n
1
0

Формула состава атома
65
21
Sc (
21p
1
1
; 44n
1
0
; 21ē)
состав ядра
Скандий находится в IV периоде; номер периода обозначает число энергетических
уровней - 4.
Скандий расположен в побочной подгруппе. Следовательно, его валентные электроны
будут находится на 4s- и 3d-подуровнях.
Электронная формула скандия
21
Sc
1s
2
2s
2
2p
6
3s
2
3p
6
3d
1
4s
2
[Ar]
или в виде сокращенной записи: [Ar] 3d
1
4s
2
Электронная формула в виде квантовых ячеек:
21
Sc [Ar]
Скандий – d- элемент. Электронное строение атома заканчивается s- электронами,
поэтому элемент будет проявлять металлические свойства.
Формула высшего оксида – Sc
2
O
3
, гидроксида – Sc(OH)
3
обладают слабыми основными
свойствами. Соединений с водородом не образует.
b) Порядковый номер 34 имеет селен Se. Элемент находится в IV периоде, значит в атоме
имеется 4 энергетических уровня. Он находится в главной подгруппе VI группы; его
валентные электроны распределены на 4s и 4p-подуровнях.
Электронная формула селена:
34
Se 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
4
Внешний уровень в виде квантовых ячеек имеет вид:
Атом селена имеет 6 валентных электронов; поэтому высшая валентность равна 6, что
соответствует номеру группы.
Селен - p- элемент, поэтому будет проявлять свойства неметалла.
Высший оксид SeO
3
, его гидроксид H
2
SeO
4
и газообразное водородное соединение H
2
Se
имеют кислотный характер.

ХИМИЧЕСКАЯ СВЯЗЬ
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена
электронами. При образовании химической связи атомы стремятся приобрести устойчивую
восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению
атома ближайшего инертного газа. Различают следующие виды химической связи:
ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная
и металлическая.
Ковалентная связь
Ионная связь
Водородная связь
Металлическая связь
Гибридизация орбиталей
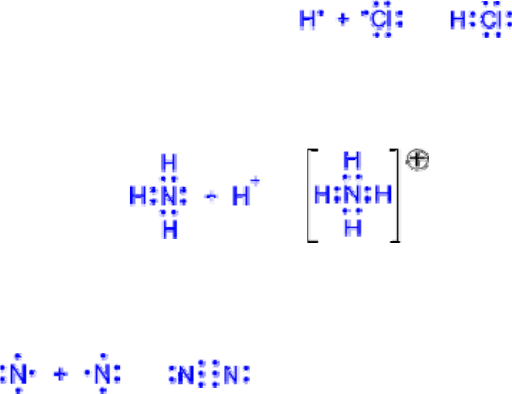
КОВАЛЕНТНАЯ СВЯЗЬ
Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают
обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую
электронную пару:
H
•
+
•
H → H : H →
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а
другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
→
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных
связях:
→ (или N≡N) – тройная связь
Если электронная плотность расположена симметрично между атомами, ковалентная связь
называется неполярной.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь
называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Электроотрицательность - это способность атома притягивать электронную плотность от
других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный -
франций.

ИОННАЯ СВЯЗЬ
Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или
присоединения электронов.
→
(фторид натрия состоит из ионов натрия Na
+
и фторид-ионов F
-
)
Если разность электроотрицательностей атомов велика, то электронная пара,
осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения,
называется ионной связью.
