Общая химия. Основные понятия и законы химии
Подождите немного. Документ загружается.

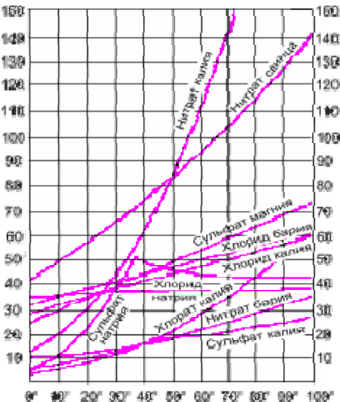
Влияние давления. С повышением давления растворимость газов в жидкостях
увеличивается, а с понижением уменьшается.
РАСТВОРЫ
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Способы выражения концентрации растворов
Существуют различные способы выражения состава раствора. Наиболее часто используют
массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества w
(B)
- это безразмерная величина, равная
отношению массы растворённого вещества к общей массе раствора m :
w
(B)
= m
(B)
/ m
Массовую долю растворённого вещества w
(B)
обычно выражают в долях единицы или в
процентах. Например, массовая доля растворённого вещества – CaCl
2
в воде равна 0,06 или
6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция
массой 6 г и вода массой 94 г.
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение
m(Na
2
SO
4
) = w(Na
2
SO
4
) / 100 = (5 • 300) / 100 = 15 г
где w(Na
2
SO
4
) – массовая доля в %,
m - масса раствора в г
m(H
2
O) = 300 г - 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г
Na
2
SO
4
и 285 г воды.
Молярная концентрация C
(B)
показывает, сколько моль растворённого вещества содержится
в 1 литре раствора.
C
(B)
= n
(B)
/ V = m
(B)
/ (M
(B)
• V),
где М
(B)
- молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH -
двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль
вещества или 80 г (M
(NaOH)
= 40 г/моль).
Пример
Какую массу хромата калия K
2
CrO
4
нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение
M(K
2
CrO
4
) = C(K
2
CrO
4
) • V • M(K
2
CrO
4
) = 0,1 моль/л • 1,2 л • 194 г/моль ≈ 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K
2
CrO
4
и
растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г
растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном
литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное
его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо
или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Э
основания
= М
основания
/ число замещаемых в реакции гидроксильных групп
Э
кислоты
= М
кислоты
/ число замещаемых в реакции атомов водорода
Э
соли
= М
соли
/ произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и
сульфата алюминия.
Э H
2
SO
4
= М H
2
SO
4
/ 2 = 98 / 2 = 49 г
Э Ca(OH)
2
= М Ca(OH)
2
/ 2 = 74 / 2 = 37 г
Э
Al
2
(SO
4
)
3
= М Al
2
(SO
4
)
3
/ (2 • 3) = 342 / 2= 57 г
Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной
кислоты обозначают "0,1 Н раствор H
2
SO
4
". Так как нормальность может быть определена
только для данной реакции, то в разных реакциях величина нормальности одного и того же
раствора может оказаться неодинаковой. Так, одномолярный раствор H
2
SO
4
будет
однонормальным, когда он предназначается для реакции со щёлочью с образованием
гидросульфата NaHSO
4
, и двухнормальным в реакции с образованием Na
2
SO
4
.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H
2
SO
4
(ρ = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H
2
SO
4
в 1 л раствора.
70% -ный раствор H
2
SO
4
содержит 70 г H
2
SO
4
в 100 г раствора. Это весовое количество
раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 • 1000 / 61,92 = 1130,49 г H
2
SO
4
Отсюда молярность данного раствора равна: 1130,49 / М (H
2
SO
4
) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве
двухосновной) равна 1130,49 / 49 =23,06 H
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что
процентная концентрация рассчитывается на определенную массу раствора, а молярная и
нормальная - на объем, поэтому для пересчета необходимо знать плотность раствора. Если
мы обозначим: с - процентная концентрация; M - молярная концентрация; N - нормальная
концентрация; э - эквивалентная масса, ρ - плотность раствора; m - мольная масса, то
формулы для пересчета из процентной концентрации будут следующими:
M = (c • p • 10) / m
N = (c • p • 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или
молярную концентрацию на процентную.
Пример 1
Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность
которого р = 1,08 г/см
3
?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
m(H
2
SO
4
) = 98 и э(H
2
SO
4
) = 98 : 2 = 49.
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (12 • 1,08 • 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (12 • 1,08 • 10) / 49 = 2,64 H.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в
нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе
(Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации.
Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для
большинства соединений эквивалентная масса не равна мольной и, следовательно,
нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (N • Э) / m
N = (M • m) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты
N = (1 • 98) / 49 = 2
H.
Пример
Молярная концентрация 0,5 н. Na
2
CO
3
M = (0,5 • 53) / 106 = 0,25 M.
Упаривание, разбавление, концентрирование,
смешивание растворов
Имеется m
г
исходного раствора с массовой долей растворенного вещества w
1
и плотностью
ρ
1
.
Упаривание раствора
В результате упаривания исходного раствора его масса уменьшилась на Δm г. Определить
массовую долю раствора после упаривания w
2
Решение
Исходя из определения массовой доли, получим выражения для w
1
и w
2
(w
2
> w
1
):
w
1
= m
1
/ m
(где m
1
– масса растворенного вещества в исходном растворе)
m
1
= w
1
• m
w
2
= m
1
/ (m – Δm) = (w
1
• m) / (m – Δm)
Пример
Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в
полученном растворе.
m = 60 г; Δm = 60 – 50 = 10 г; w
1
= 5% (или 0,05)
w
2
= (0,05 • 60) / (60 – 10) = 3 / 50 = 0,06 (или 6%-ный)
Концентрирование раствора
Какую массу вещества (X г) надо дополнительно растворить в исходном растворе, чтобы
приготовить раствор с массовой долей растворенного вещества w
2
?
Решение
Исходя из определения массовой доли, составим выражение для w
1
и w
2
:
w
1
= m
1
/ m
2
,
(где m
1
– масса вещества в исходном растворе).
m
1
= w
1
• m
w
2
= (m
1
+x) / (m + x) = (w
1
• m + x) / (m+x)
Решая полученное уравнение относительно х получаем:
w
2
• m + w
2
• x = w
1
• m + x
w
2
• m – w
1
• m = x – w
2
• x
(w
2
– w
1
) • m = (1 – w
2
) • x
x = ((w
2
– w
1
) • m) / (1 – w
2
)
Пример
Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы
полученный раствор стал 10%-ным?
m = 90 г
w
1
= 8% (или 0,08), w
2
= 10% (или 0,1)
x = ((0,1 – 0,08) • 90) / (1 – 0,1) = (0,02 • 90) / 0,9 = 2 г
Смешивание растворов с разными концентрациями
Смешали m
1
граммов раствора №1 c массовой долей вещества w
1
и m
2
граммов раствора №2
c массовой долей вещества w
2
. Образовался раствор (№3) с массовой долей растворенного
вещества w
3
. Как относятся друг к другу массы исходных растворов?
Решение
Пусть w
1
> w
2
, тогда w
1
> w
3
> w
2
. Масса растворенного вещества в растворе №1 составляет w
1
• m
1
, в растворе №2 – w
2
• m
2
. Масса образовавшегося раствора (№3) – (m
1
– m
2
). Сумма масс
растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся
растворе (№3):

w
1
• m
1
+ w
2
• m
2
= w
3
• (m
1
+ m
2
)
w
1
• m
1
+ w
2
• m
2
= w
3
• m
1
+ w
3
• m
2
w
1
• m
1
– w
3
• m
1
= w
3
• m
2
– w
2
• m
2
(w
1
– w
3
) • m
1
= (w
3
– w
2
) • m
2
m
1
/ m
2
= (w
3
– w
2
) / (w
1
– w
3
)
Таким образом, массы смешиваемых растворов m
1
и m
2
обратно пропорциональны разностям
массовых долей w
1
и w
2
смешиваемых растворов и массовой доли смеси w
3.
(Правило
смешивания).
Для облегчения использования правила смешивания применяют правило креста :
w
1
\
(w
3
– w
2
)
/
m
1
w
3
/
w
2
\
(w
1
– w
3
) m
2
m
1
/ m
2
= (w
3
– w
2
) / (w
1
– w
3
)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w
1
– w
3
), w
1
> w
3
и (w
3
– w
2
), w
3
> w
2
. Затем составляют отношение масс исходных растворов m
1
/
m
2
и вычисляют.
Пример
Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%,
если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида
натрия 10%.
40%
\
5%
/
m
1
10%
/
5%
\
30% m
2
=210-m
1
5 / 30 = m
1
/ (210 - m
1
)
1/6 = m
1
/ (210 – m
1
)
210 – m
1
= 6m
1
7m
1
= 210
m
1
=30 г; m
2
= 210 – m
1
= 210 – 30 = 180 г
Разбавление раствора
Исходя из определения массовой доли, получим выражения для значений массовых долей
растворенного вещества в исходном растворе №1 (w
1
) и полученном растворе №2 (w
2
):
w
1
= m
1
/ (ρ
1
• V
1
) откуда V
1
= m
1
/( w
1
• ρ
1
)
w
2
= m
2
/ (ρ
2
• V
2
)
m
2
= w
2
• ρ
2
• V
2
Раствор №2 получают, разбавляя раствор №1, поэтому m
1
= m
2
. В формулу для V
1
следует
подставить выражение для m
2
. Тогда
V
1
= (w
2
• ρ
2
• V
2
) / (w
1
• ρ
1
)
m
2
= w
2
• ρ
2
• V
2
или

w
1
• ρ
1
• V
1
=
w
2
• ρ
2
• V
2
m
1
(раствор)m
2
(раствор)
m
1
(раствор) / m
2
(раствор) = w
2
/ w
1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли
обратно пропорциональны друг другу.
Пример
Определите массу 3%-ного раствора пероксида водорода, который можно получить
разбавлением водой 50 г его 3%-ного раствора.
m
1
(раствор) / m
2
(раствор) = w
2
/ w
1
50 / x = 3 / 30
3x = 50 • 30 = 1500
x = 500 г
Последнюю задачу можно также решить, используя “правило креста”:
30%
\
3%
/
50
3%
/
0%
\
27% X
3 / 27 = 50 / x
x = 450 г воды
450 г + 50 г = 500 г
РАСТВОРЫ
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ
Теория электролитической диссоциации
( С. Аррениус, 1887г. )
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и
отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к
аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется
моляризацией).
4. Степень электролитической диссоциации (α) зависит от природы электролита
и
растворителя, температуры и концентрации. Она показывает отношение числа молекул,
распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
α = n / N 0<α<1
Механизм электролитической диссоциации ионных веществ
При растворении соединений с ионными связями (например, NaCl) процесс гидратации
начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо
водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое
количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет
на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем
переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Механизм электролитической диссоциации полярных веществ
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной
ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества
(например, HCl), определенным образом ориентируются диполи воды. В результате
взаимодействия с диполями воды полярная молекула еще больше поляризуется и
превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
Электролиты и неэлектролиты
Электролитическая диссоциация веществ, идущая с образованием свободных ионов
объясняет электрическую проводимость растворов.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его
механизма и опуская растворитель (H
2
O), хотя он является основным участником.
CaCl
2
↔ Ca
2+
+ 2Cl
-
KAl(SO
4
)
2
↔ K
+
+ Al
3+
+ 2SO
4
2-
HNO
3
↔ H
+
+ NO
3
-
Ba(OH)
2
↔ Ba
2+
+ 2OH
-
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен
быть равен нулю.
Например, для
Al
2
(SO
4
)
3
–– 2 • (+3) + 3 • (-2) = +6 - 6 = 0
KCr(SO
4
)
2
–– 1 • (+1) + 3 • (+3) + 2 • (-2) = +1 + 3 - 4 = 0
Сильные электролиты
Это вещества, которые при растворении в воде практически полностью распадаются на ионы.
Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными
связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO
4
, H
2
SO
4
,HNO
3
) и
сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)
2
,Sr(OH)
2
,Ca(OH)
2
).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов
(катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слабые электролиты
Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с
ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать
большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH
3
COOH, C
2
H
5
COOH и др.);
2) некоторые неорганические кислоты (H
2
CO
3
, H
2
S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca
3
(PO
4
)
2
;
Cu(OH)
2
; Al(OH)
3
; NH
4
OH);
4) вода.
Они плохо (или почти не проводят) электрический ток.
СH
3
COOH ↔ CH
3
COO
-
+ H
+
Cu(OH)
2
↔ [CuOH]
+
+ OH
-
(первая ступень)
[CuOH]
+
↔ Cu
2+
+ OH
-
(вторая ступень)
H
2
CO
3
↔ H
+
+ HCO
-
(первая ступень)
HCO
3
-
↔ H
+
+ CO
3
2-
(вторая ступень)
Неэлектролиты
Вещества, водные растворы и расплавы которых не проводят электрический ток. Они
содержат ковалентные неполярные или малополярные связи, которые не распадаются на
ионы.
Электрический ток не проводят газы, твердые вещества (неметаллы), органические
соединения (сахароза, бензин, спирт).
Степень диссоциации. Константа диссоциации
Концентрация ионов в растворах зависит от того, насколько полно данный электролит
диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно
считать полной, концентрацию ионов легко определить по концентрации (c) и составу
молекулы электролита (стехиометрическим индексам), например:
c
H
2
SO
4
↔
2c c
2H
+
+ SO
4
2-
Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и
константой диссоциации.
Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу
растворенных молекул (N):
α = n / N
и выражается в долях единицы или в % (α = 0,3 – условная граница деления на сильные и
слабые электролиты).
Пример
Определите мольную концентрацию катионов и анионов в 0,01 М растворах KBr, NH
4
OH,
Ba(OH)
2
, H
2
SO
4
и CH
3
COOH.
Степень диссоциации слабых электролитов α = 0,3.
Решение
KBr, Ba(OH)
2
и H
2
SO
4
- сильные электролиты, диссоциирующие полностью (α = 1).
KBr ↔ K
+
+ Br
-
[K
+
] = [Br
-
] = 0,01 M
Ba(OH)
2
↔ Ba
2+
+ 2OH
-
[Ba
2+
] = 0,01 M
[OH
-
] = 0,02 M
H
2
SO
4
↔ 2H
+
+ SO
4
[H
+
] = 0,02 M
[SO
4
2-
] = 0,01 M
NH
4
OH и CH
3
COOH – слабые электролиты (α = 0,3)
NH
4
OH
+
4
+ OH
-
[NH
+
4
] = [OH
-
] = 0,3 •
0,01 = 0,003 M
CH
3
COOH ↔ CH
3
COO
-
+ H
+
[H
+
] = [CH
3
COO
-
] = 0,3 • 0,01 = 0,003 M
Степень диссоциации зависит от концентрации раствора слабого электролита. При
разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число
молекул растворителя (H
2
O) на одну молекулу растворенного вещества. По принципу Ле
Шателье равновесие электролитической диссоциации в этом случае должно сместиться в
направлении образования продуктов, т.е. гидратированных ионов.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при
увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах,
они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе
слабого электролита можно рассчитать, зная степень диссоциации α и исходную
концентрацию вещества c в растворе.
Пример
Определите концентрацию недиссоциированных молекул и ионов в 0,1 М раствора NH
4
OH,
если степень диссоциации равна 0,01.
Решение
Концентрации молекул NH
4
OH, которые к моменту равновесия распадутся на ионы, будет
равна αc. Концентрация ионов NH
4
-
и OH
-
- будет равна концентрации продиссоциированных
молекул и равна αc (в соответствии с уравнением электролитической диссоциации)
NH
4
OH
↔
NH
4
+
+ OH
-
c - αc
αc
αc
