Оберемок В.В. Методические рекомендации к применению ПЦР-метода
Подождите немного. Документ загружается.


Занятие 2. Амплификация ДНК
Основой данного этапа ПЦР является программируемый
амплификатор. Амплификатор в зависимости от стадии
изменяет температурный режим пробирок и временной
интервал.
Амплификация ДНК включает в себя 3 стадии*:
1. денатурация ДНК (0,5-1 минута, 93
о
С),
2. отжиг праймеров (0,5-1 минута, 35-40
о
С),
3. наращивание цепи (1 минута, 72
о
С).
*Температура и продолжительность цикла подходят для
праймеров типа OPA.
Амплификация фрагмента определенной длины, который
образуется при классическом отжиге праймера, изображенном
на рис. 2, происходит по следующей математической формуле:
F= 2( n -1) + 2
2
( n -2) + 2
3
( n -3) + 2
4
( n -4) + 2
5
( n -5) +... +2
n
-1
( a )
,
где n – количество циклов, F – количество одноцепочечных
фрагментов в начале цикла n+1 (денатурация).
Количество нарабатываемых двухцепочечных фрагментов
описывается следующей математической формулой:
F = 2
1
( n -2) + 2
2
( n -3) + 2
3
( n -4) + 2
4
( n -5) + 2
5
( n -6) +... +2
n
-2
( b ) ,
где n- количество циклов, F-количество двухцепочечных
фрагментов.
Рассмотрим значения формулы b для каждого цикла:
1-й цикл – –
2-й цикл – 0
3-й цикл – 2n-4
4-й цикл – 6n-16
5-й цикл – 14n-48 и т. д.
Каждое значение фрагментов для любого цикла можно
представить в следующем виде:
(2
n-1
-2)n – (2
n-1
-2)(n-2) – 2(n-2) = F,
2(2
n-1
-2) – 2(n-2) = F,
2(2
n-1
- n) = F .
21
Количество ампликонов с каждым циклом(n) увеличивается
почти в два раза. При n→ ∞ это можно записать в следующем
виде:
lim 2
n-1
– 2(n – 1)/ 2
n
– 2n = 1/2
n→ ∞
Для проведения данного этапа ПЦР (амплификации)
используют разные приемы. Рассмотрим два из них.
1. «Горячий старт» («hot start») – прием, при котором
пробирки с реагентами помещаются в амплификатор, нагретый
до температуры 93-94
о
С. Денатурация ДНК 1-го цикла должна
протекать 2-2,5 минуты. Остальные циклы протекают согласно
описанным выше температурным и временным константам.
Данный прием позволяет избежать неспецифического отжига
праймеров. Существуют разные модификации данного приема
(например, с использованием воска).
2. Обычный прием предусматривает помещение пробирок
в амплификатор при комнатной температуре. После достижения
амплификатором температуры в 94
о
С начинается процесс
денатурации и т. д.
Для проведения этапа амплификации ДНК используются
стандартные наборы реактивов. Примером может служить набор
«АмплиСенс – 200 -1» фирмы «АмплиСенс» (Москва, Россия). В
его состав входят:
1. смесь нуклеотидтрифосфатов, 2 mM;
2. 5-кратный реакционный буфер, без Mg
2+
;
3. сульфат магния, 50 mM;
4. деионизованная вода, стерильная, автоклавированная;
5. Taq-полимераза, 5 ед/мкл;
6. воск для ПЦР, 14%-ный, плавление при 37
о
С;
7. минеральное масло, вазелиновое;
8. исследуемая ДНК.
Такой набор рассчитан на 200 реакций в объеме 25 мкл.
Хранится набор при температуре 2-8
о
С.
Смешивание реактивов проводится в такой пропорции
(возможны вариации):
22
1. смесь нуклеотидтрифосфатов – 2,5 мкл;
2. 5-кратный реакционный буфер – 5 мкл;
3. сульфат магния – 1,5 мкл;
4. деионизованная вода – 3 мкл;
5. Taq-полимераза – 0,5 мкл;
6. минеральное масло – 11,5 мкл;
7. исследуемая выделенная ДНК – 5мкл;
8. праймер – 1 мкл.
Общий объем: 30 мкл.
Амплификация ДНК длится приблизительно 2,5 – 3,5 часа
(30-40 циклов).
Количество праймера, необходимое для амплификации
одного ДНК-фрагмента с одной молекулы ДНК в течение n
циклов (рис. 2), описывается математической формулой:
P=2
n+1
– 2, где n - количество циклов, а Р - количество
молекул праймера.
Порядок работы.
1. Промаркировать пробирки.
2. Смешать реактивы, исследуемую ДНК и праймер в пропорции
описанной выше. Процентрифугировать на вортексе в течение 1
минуты, чтобы на стенках пробирок не осталось реагентов.
3. Выбрать подходящую программу на амплификаторе,
загрузить пробирки в амплификатор и запустить амплификацию.
4. По окончанию амплификации можно приступать к 3-му этапу
ПЦР (детекции продуктов амплификации).
Пробирки с наработанными фрагментами ДНК можно
хранить при температуре 2-8
о
С в течение двух недель.
Задание 2.1.
Провести амплификацию ДНК, выделенной из листьев
комнатных растений с использованием праймеров серии OPA.
Задание 2.2.
Провести амплификацию ДНК, выделенной из полиэдров
вируса ядерного полиэдроза непарного шелкопряда со
специфическими праймерами: а) 5’- GCC GGC GGA ACT GGC
CCA -3’, б) 5’- CGA CGT GGT GGC ACG GCG -3’.
23
Занятие 3. Детекция продуктов амплификации
Является финальной стадией ПЦР. Для детекции
амплифицированных фрагментов ДНК используется метод
горизонтального электрофореза в агарозном геле с
использованием трис-боратного буфера. Для того, чтобы
визуально обнаружить ДНК-фрагменты в трис-боратный буфер
добавляют бромистый этидий
*
. Это вещество способно
встраиваться в двухцепочечные молекулы ДНК и
флуоресцировать под ультрафиолетовыми лучами
**.
Именно
флуоресцирующие ДНК-фрагменты являются целью
исследователя, применяющего ПЦР-метод (фото 7). При
помощи цифрового фотоаппарата ДНК-фрагменты
записываются и могут быть проанализированы.
*
Бромистый этидий – сильный канцероген, способный
проникать через кожу в организм (рис. 4). Следует уделять
особое внимание при работе с ним. Для работы с бромистым
этидием используются перчатки.
Рис. 4. Химическое строение бромистого этидия
**
Ультрафиолетовые лучи опасны для глаз. Поэтому при
работе с ультрафиолетовой лампой нужно избегать прямого
попадания лучей в глаза и использовать защищающие глаза
специальные очки или маски. Материалом для очков и
масок может служить стекло с примесями окиси
железа(Fe
2
O
3
), например, оконное стекло (0. 1 % Fe
2
O
3
).
24
Для этапа детекции продуктов амплификации используются
следующие химические вещества:
1. агароза;
2. трис-боратный буфер
*
;
3. бромистый этидий;
4. маркер молекулярных весов.
*Трис-боратный буфер можно приготовить самостоятельно.
Необходимы следующие химические вещества:
Трис-(оксиметил)-аминометан – 10.78 г,
Борная кислота – 5.503 г,
EDTA, pH 8.0 – 4.384 мл,
дистиллят – 86.3 мл,
бромистый этидий – 10-15 мкл (10 мг/мл).
Смешать химические вещества и размешать до полного
растворения. Довести дистиллятом объем раствора до литра.
Хранить трис-боратный буфер нужно при температуре 18-25
о
С.
Порядок работы.
1. Приготовить 1.8%-ный агарозный гель на основе трис-
боратного буфера. Поместить его в камеру для электрофореза.
2. Залить гель трис-боратным буфером, содержащим бромистый
этидий.
3. Нанести по 5 мкл каждой пробы в отдельные лунки. Нанести в
отдельную лунку маркер.
4. Подключить камеру для электрофореза к источнику
электрического питания (50 mA, 100 V).
Через 30-70 минут после начала электрофореза достать гель
и сфотографировать его под ультрафиолетовой лампой,
используя специальные очки для защиты глаз (фото 7).
Количество наработанных фрагментов ДНК определяют
качество визуальной детекции ампликонов. Сколько же нужно
ампликонов одного фрагмента ДНК для визуальной детекции?
Для фрагмента ДНК длиной от 100 до 200 п. н. достаточно 10
8–
10
9
двухцепочечных ампликонов. Теоретически, это
25
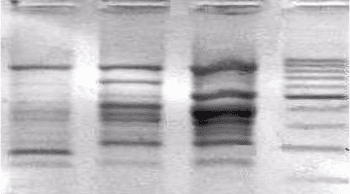
приблизительно 30 циклов ПЦР на ДНК, выделенной из одной
клетки.
1 2 3 М
М-маркер (длина фрагментов от 100 до 1000 п. н.; шаг– 100 п. н.),
1, 2, 3 – фрагменты ДНК дуба пушистого.
Фото 7. Продукты амплификации ДНК дуба пушистого (OPA 14)
Чем меньше длина двухцепочечного ДНК-фрагмента, тем
слабее он флуоресцирует. Это объясняется тем, что в короткий
ДНК-фрагмент встраивается меньшее количество молекул
бромистого этидия, чем в длинный.
Бромистый этидий обладает интересной особенностью, за
которую его и начали использовать в ПЦР-методе. При
встраивании бромистого этидия в двухцепочечную молекулу
ДНК, его способность к флуоресценции возрастает в 20 раз.
Максимум спектра поглощения бромистого этидия находится в
области ультрафиолетовых лучей.
Статистическую обработку данных ПЦР-анализа можно
проводить при помощи различных компьютерных программ:
Treecon for Windows (version 1.3 b), MAPMAKER 3.0, Граф-
анализ и др.
Задание 3.1.
Провести детекцию продуктов амплификации ДНК
комнатных растений (праймеры серии OPА).
Задание 3.2.
Провести детекцию продуктов амплификации ДНК вируса
ядерного полиэдроза непарного шелкопряда (специфические
праймеры).
26
Задачи и вопрoсы
1.Дана последовательность ДНК:
5’-A T C G C C G C A A C G A G A C G A C T G C G C A T C G T C T C G T T G C G – 3’
3’- T A G C G G C G T T G C T C T G C T G A C G C G T A G C A G A G C A A C G C - 5’.
В ходе ПЦР будет использоваться праймер со следующей
последовательностью 5’-C G C A A C G A G A C-3’. Установите длину
ампликона.
2. В ходе этапа выделения было получено ДНК 888 клеток. Был
подобран праймер, который обусловливает амплификацию
фрагмента ДНК длиной 500 п. н. Достаточно ли 29 циклов ПЦР
для визуальной детекции данного фрагмента?
3. Дана последовательность ДНК:
5’-A T G C G G C A T T G G A G A C T C T C T G A G C A C T G C G C A T C G C A A -3’
3’-T A C G C C G T A A C C T C T G A G A G A C T C G T G A C G C G T A G C G T T -5’.
В ходе ПЦР могут быть использованы следующие праймеры:
а. 5’-G C G G C A T T G G-3’,
б. 5’-G A C T C T C T G A-3’,
в. 5’-T T G C GA T G C G-3’,
г. 5’-A G A C T C T C T G-3’.
Отжиг каких пар праймеров даст продукты амплификации?
Какой длины будут ампликоны, если смешать все праймеры?
4. Если бы Кэри Мюллис в 1983 году (25 декабря) запустил
амплификацию одного фрагмента ДНК из одной клетки
эпителия кожи, то сколько бы копий ампликона наработалось к
сегодняшнему дню? Скорость ПЦР – 1 цикл в день.
5. В ходе ПЦР было получено 7 фрагментов разной длины. ДНК
было выделено из 7 клеток. Использовался только один тип
праймера. Сколько раз отжегся праймер в первом цикле ПЦР?
Сколько раз отжегся праймер во втором цикле ПЦР?
27
6. В ходе ПЦР образуется 1 фрагмент ДНК. ДНК была выделена
из одной клетки. Полимеразная цепная реакция была прервана
во время стадии денатурации ДНК 9-го цикла. Насколько
уменьшилось количество свободных молекул праймера?
8. Во время детекции продуктов амплификации можно видеть,
что некоторые ампликоны имеют разную толщину. Почему?
9. Почему для проведения ПЦР нельзя использовать
ДНК-полимеразу человека, растительное масло, обычную воду?
10. В ходе ПЦР амплифицируется 1 ДНК-фрагмент. ПЦР была
прервана на 35 цикле (III стадия). В ходе ПЦР используется
праймер 5’-C A T C A T C A T -3’. Какой будет длина ДНК-фрагмента,
если объединить все молекулы праймера, которые успели
отжечься к этому моменту?
11. Сколько нужно молекул праймера, чтобы амплифицировался
1 фрагмент ДНК в течение 26 циклов?
12. В составе генома человека приблизительно 3,2 миллиарда
пар нуклеотидов. В ходе ПЦР амплифицируется фрагмент ДНК
длиной 512 п.н. Сколько понадобится циклов ПЦР, чтобы сумма
двухцепочечных ампликонов по количеству п. н. стала в 7 раз
больше, чем геном человека?
28
Краткий словарь терминов и дополнительные сведения
А
абиотические факторы – факторы неживой природы (свет,
влажность и т. д.)
агароза – линейный полисахарид, получаемый из клеточных
стенок некоторых родов (например, род Gelidium) красных и
бурых водорослей; обладает ярко выраженным свойством к
формированию гелей, точка образования геля – 45
о
С
анод – положительный полюс источника питания
ампликон – фрагмент ДНК, образующийся в ходе ПЦР
амплификатор программируемый – прибор, в котором
проводят ПЦР
амплификация ДНК – многократное увеличение числа
копий ДНК
Б
биотические факторы – факторы живой природы
(микроорганизмы, растения и т. д.)
бромистый этидий – химическое вещество, способное
встраиваться в двухцепочечную ДНК и флуоресцировать под
ультрафиолетовыми лучами; канцероген; химическая
формула – C
21
H
20
BrN
3
В
водородные связи – электростатическое взаимодействие
атома Н, связанного с сильно электроотрицательным элементом,
с другими атомами
вортекс – центрифуга, имеющая воронку со смещенным
центром тяжести для размешивания веществ
Г
геликаза – фермент, участвующий в процессе репликации,
разрывает водородные связи между комплементарными
основаниями в ДНК
29
ген – определенная последовательность ДНК, в которой
закодирована первичная структура определенного белка или
последовательность определенной молекулы РНК
Д
детекция – обнаружение
денатурация ДНК – явление, сопровождающееся разрывом
водородных связей между комплементарными основаниями в
ДНК под воздействием высокой температуры
ДНК – дезоксирибонуклеиновая кислота; структурой
единицей ДНК является нуклеотид, состоящий из
гетероциклического основания (аденина, гуанина, тимина либо
цитозина), углевода дезоксирибозы и пирофосфорной кислоты
З
затравка – см. праймер
К
канцероген – вещество, способное вызывать раковые
заболевания
катод – отрицательный полюс источника питания
ковалентная связь – химическая связь, образованная при
помощи общей электронной пары атомов; сильная химическая
связь
комплементарность гетероциклических оснований в ДНК
(правило Чаргаффа) – в двухцепочечной молекуле ДНК
количество молекул аденина равно количеству молекул тимина,
а количество молекул гуанина равно количеству молекул
цитозина
константа – постоянная величина
Л
30
