Новикова А.И. Модернизированная сульфатная варка целлюлозы: учебное пособие
Подождите немного. Документ загружается.

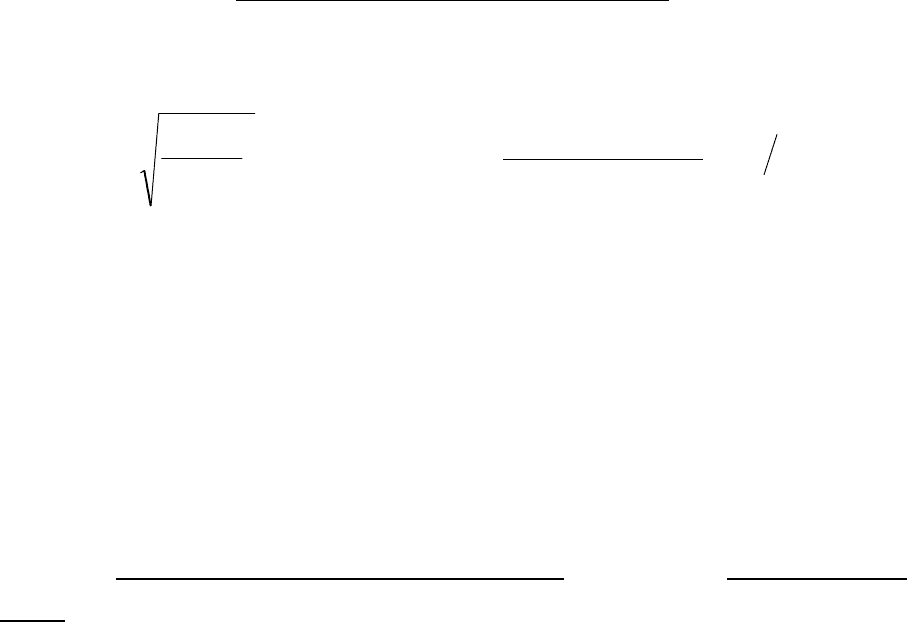
100
Мощность двигателей и тип мешального устройства для перемеши-
вания массы в нижней части выдувного резервуара необходимо выбирать,
исходя из объема V
н
и концентрации массы в нижней части резервуара по-
сле разбавления щелоком из промывного отдела.
10. Размеры диффузора непрерывного действия, работающего при
атмосферном давлении.
Основной размер – это диаметр цилиндрической части диффузора d
Ц
; ,
4
м
V
Q
d
Д
Д
Ц
⋅
⋅
=
π
,минм ,
60
24
)100(
3
⋅
⋅
−
⋅
=
C
CQ
Q
сут
Д
где Q
Д
– объемная производительность, м
3
массы/мин;
C – концентрация массы, %, обычно C = 10 %;
V
Д
– скорость массы в диффузоре (V
Д
= 0,1 м/мин при высоте сит 1м),
м/мин.
Расстояние между ситами диффузора, работающего при атмосфер-
ном давлении, составляет δ = 225 ÷ 250 мм, поэтому число сит зависит от
d
Ц
.
11. Подогреватели для циркулирующего на подогрев варочного рас-
твора можно подобрать по рассчитанному объему варочного котла (V
котла
).
Известно, что на 1 м
3
варочного котла необходимо иметь 0,8 – 1,0 м
2
по-
верхности теплообмена в рабочем цикле и запасную поверхность теплооб-
мена, составляющую не менее 50 % рабочей поверхности теплообмена [5 и
др.].
11. РАСЧЕТ МОЩНОСТИ ЭЛЕКТРОДВИГАТЕЛЕЙ
ДЛЯ ПРИВОДА НАСОСОВ ВАРОЧНОЙ УСТАНОВКИ
Для расчета мощности насосов необходимо знать напор насоса. На-
пор насоса зависит от давления в аппарате, от высоты подачи в аппарат, от
сопротивления в трубопроводах.
Вначале необходимо рассчитать напор насоса [12].
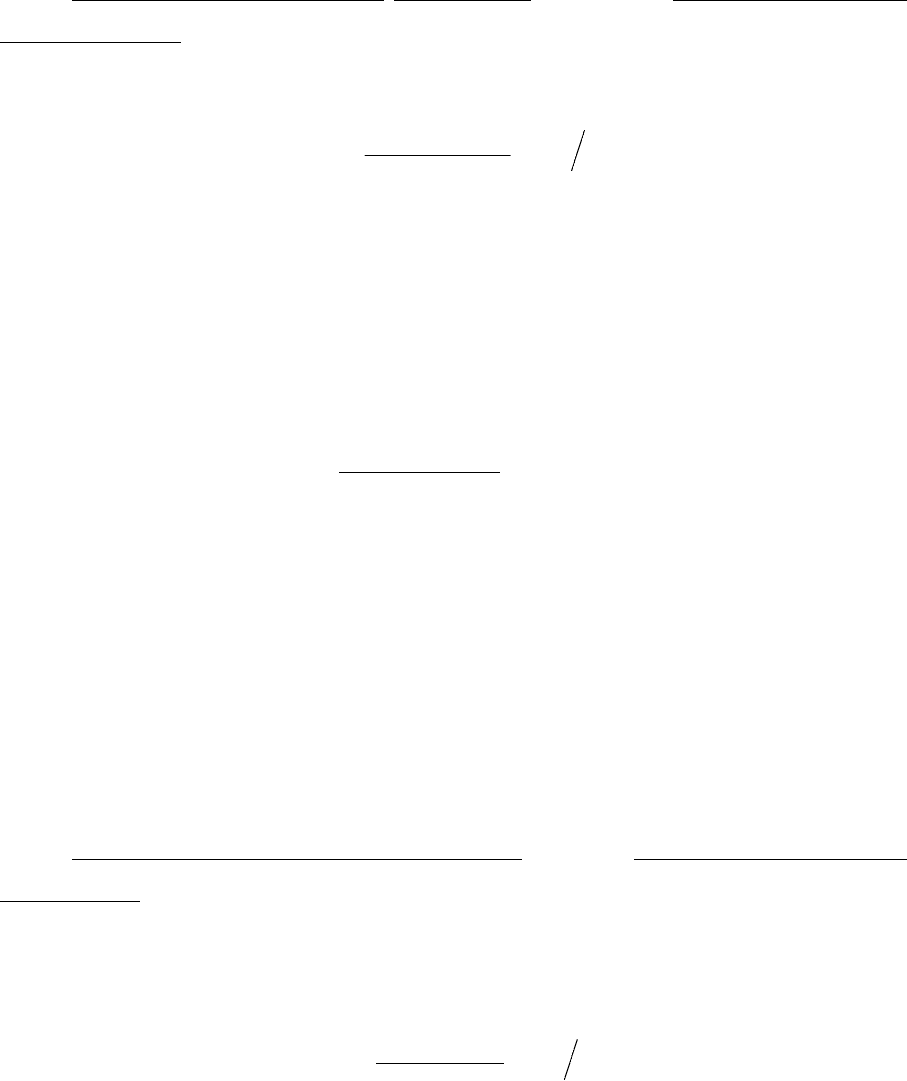
101
Насос высокого давления для подачи варочного щелока в загрузоч-
ное устройство из уравнительного бака.
Производительность насоса
,чм ,
24
3
1
сутзагр
QV
П
⋅
=
где V
загр
– объем щелока, подаваемого насосом высокого давления в загру-
зочное устройство, м
3
/т, в летний и зимний период;
Q
сут
- производительность по воздушно-сухой целлюлозе, т/сут.
Мощность электродвигателя для привода насоса
,кВт ,
1023600
3
111
1
K
НП
N ⋅
⋅⋅
⋅
⋅
=
η
γ
где Н
1
– напор насоса высокого давления для подачи в загрузочное устрой-
ство варочного раствора (от 150 до 200 м), м, необходимо рассчи-
тать;
γ
1
– плотность щелока, γ
1
= 1140 – 1150 кг/м
3
;
η – общий коэффициент полезного действия насоса (0,4…0,9 - повыша-
ется с увеличением производительности насоса);
К
3
- коэффициент запаса, K
3
= 1,15…1,20.
Насос высокого давления для подачи черного щелока в низ варочно-
го аппарата на промывку целлюлозы, на разбавление и охлаждение массы
в разгрузочном устройстве перед выдувкой.
Производительность насоса
,чм ,
24
3
2
2
1
2
γ⋅
⋅
=
сут
QW
П
где
2
1
W - объем черного щелока, м
3
/т;
Мощность электродвигателя для привода насоса
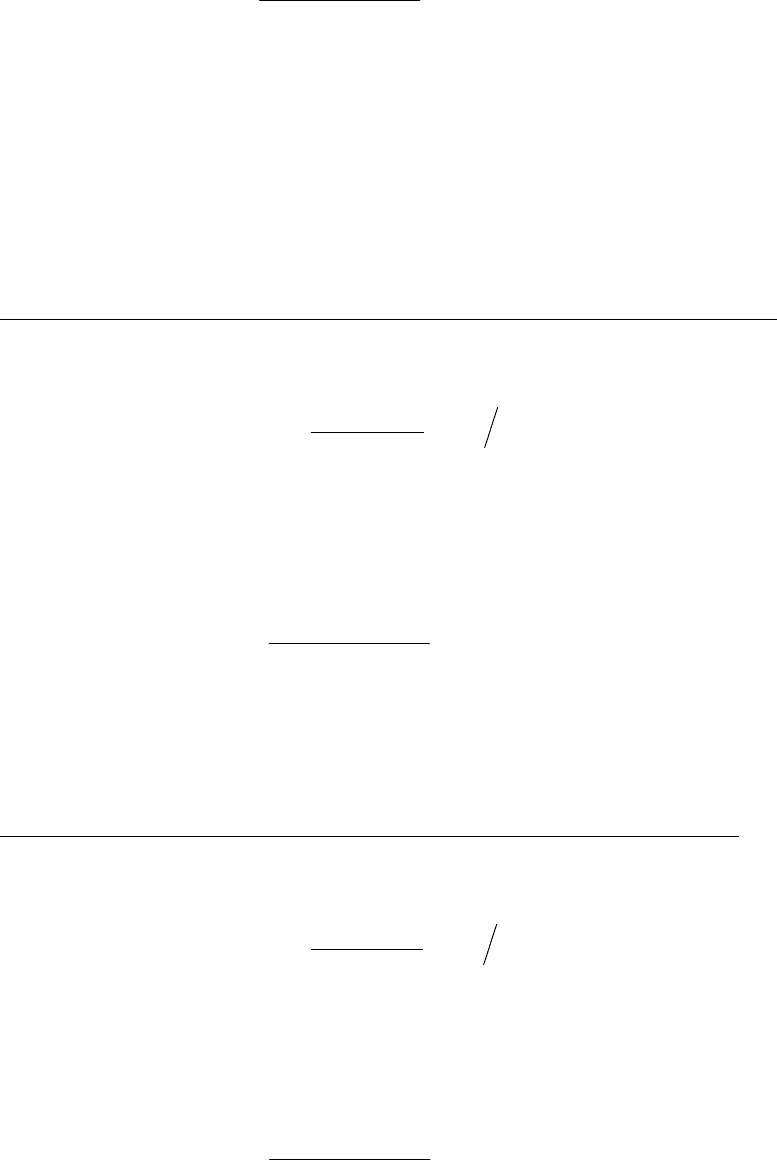
102
,_,
1023600
3
222
2
кВтK
НП
N ⋅
⋅⋅
⋅
⋅
=
η
γ
где Н
2
– напор насоса высокого давления для подачи черного щелока в низ
котла (от 150 до 200 м), м, необходимо рассчитать учитывая дав-
ление в котле, высоту котла, потери напора [12];
γ
2
– плотность щелока зависит от условий промывки массы, γ
2
= 1040 –
1060 кг/м
3
.
Насос обратной циркуляции щелока из загрузочного устройства.
Производительность насоса
,чм ,
24
3
6
3
сут
QV
П
⋅
=
где V
6
- объем циркулирующего щелока, м
3
/т.
Мощность электродвигателя для привода насоса
,кВт ,
1023600
3
333
3
K
НП
N ⋅
⋅⋅
⋅
⋅
=
η
γ
где Н
3
- напор насоса, Н
3
= 20…25 м;
γ
3
– плотность зависит от условий варки, γ
3
= 1080…1120 кг/м
3
.
Насос для циркуляции щелока через подогреватели зон варки
Производительность насоса:
,чм ,
24
3
8
4
сут
QV
П
⋅
=
где V
8
- объем циркулирующего щелока, м
3
/т.
Мощность электродвигателя для привода насоса
,кВт ,
1023600
3
444
4
K
НП
N ⋅
⋅⋅
⋅
⋅
=
η
γ
где Н
4
- напор насоса, Н
4
= 20…25 м;
γ
4
– плотность зависит от условий варки, γ
4
= 1080…1120 кг/м
3
.
После технологических расчетов оборудование варочной установки,
103
теплообменные аппараты и насосы выбирают по специальной литературе,
каталогам и отраслевым стандартам [1, 12 - 15].
12. МЕТОДИКА РАСЧЕТА ОКИСЛИТЕЛЬНОЙ УСТАНОВКИ
ДЛЯ ОКИСЛЕНИЯ ВАРОЧНОГО СУЛЬФАТНОГО ЩЕЛОКА
Исходные данные:
1. Расход белого щелока на варку целлюлозы, м
3
/ч, V
бщ
.
2. Расход черного щелока в качестве катализатора окисления в коли-
честве 1…5 % от объема белого щелока:
чм ,
100
1
3
⋅
=
бщ
чщ
V
V
;
.чм ,
100
5
3
⋅
=
бщ
чщ
V
V
3. Часовой расход воздуха при окислении белого щелока при расходе
воздуха 60…80 м
3
на 1 м
3
белого щелока:
V
возд
= V
бщ
· 60, м
3
/ч; V
возд
= V
бщ
· 80, м
3
/ч.
4. Степень заполнения окислительной установки ψ = 0,7…0,8.
5. Средняя продолжительность нахождения пузырьков воздуха в
окислительной установке 1…2 мин.
6. Объем воздуха в окислительной установке при одноминутном на-
хождении пузырьков воздуха в щелоке:
.минм ,
60
3
1
возд
V
V =
7. Рабочая высота окислительной установки Н = 15…20 м.
8. Рабочий объем окислительной установки:
V
раб
= V
бщ
+ V
чщ
+ V
1
, м
3
.
9. Общий объем окислительной установки с учетом степени запол-
нения емкости рабочей смесью (ψ = 0,8) /белый, черный щелок, воздух/.
V
общ
= V
раб
+ V
раб
· (1 – ψ), м
3
, или V
общ
= V
раб
/ ψ, м
3
.
10. Определение диаметра окислительной установки, если рабочая
высота слоя щелока H равна 15…20 м

104
,
4
2
H
D
V
раб
⋅
⋅
=
π
отсюда . ,
4
м
H
V
D
раб
π⋅
⋅
=
11. Общая высота окислительной установки:
. ,
4
2
1
м
D
V
H
общ
π
⋅
⋅
=
Если окисление осуществляется в течение 2-х часов и более, то в
расчет вносится соответствующее увеличение расхода белого и черного
щелоков, а расход воздуха остается таким же, но его подача распределяет-
ся на более продолжительное время, т.е. в течение 2-х и более часов.
Схемы окисления щелоков см. на рис. 11, 12.
После расчета окислительной установки турбовоздуходувку выби-
рают в литературных источниках [16].
13. ПРИГОТОВЛЕНИЕ И АНАЛИЗ ВАРОЧНЫХ РАСТВОРОВ
ДЛЯ СУЛЬФАТНОЙ ВАРКИ ЦЕЛЛЮЛОЗЫ В ЛАБОРАТОРНЫХ
УСЛОВИЯХ
13.1.Анализ исходных химикатов для приготовления
варочных растворов; приготовление и анализ растворов [17]
13.1.1. Определение щелочности Na
2
CO
3
1 г соды, взвешенной на аналитических весах в бюксе, переносят в
коническую колбу, приливают 50 мл дистиллированной воды и титруют
нормальным раствором HCl в присутствии метилоранжа (1 мл 1 н раствора
HCl соответствует 0,053 г Na
2
CO
3
). По результатам анализа вычисляют
щелочность соды в % по формуле:
%, ,
100053,0
b
ka
A
⋅
⋅
⋅
=
где a - количество мл 1 н раствора HCl, пошедшего на титрование;
k - поправка к 1 н раствору HCl;
b - навеска соды, г.

105
13.1.2. Определение содержания Na
2
S в растворе
В коническую колбу емкостью 250 мл отмеривают пипеткой 25 мл
0,1 н раствора йода, добавляют 5 мл H
2
SO
4
концентрацией 20 % и 30 мл
воды. В подкисленный раствор йода вносят пипеткой 1 мл раствора Na
2
S,
колбу закрывают пробкой, и содержимое ее тщательно перемешивают.
При этом происходит следующая реакция:
Na
2
S + I
2
→ 2NaI + S.
Избыток йода титруют 0,1 н раствором Na
2
S
2
O
3
до появления желтой
окраски, затем добавляют 1 мл 0,5 %-го раствора крахмала и продолжают
титрование до обесцвечивания раствора.
По результатам титрования вычисляют концентрацию раствора сер-
нистого натрия в граммах на литр и выражают в единицах едкого натра (1
мл 0,1 н раствора Na
2
S
2
O
3
соответствует 0,004 г Na
2
S в единицах NaOH):
b = (25 k
1
- a · k
2
) · 0,004 · 1000 г/л,
где a - количество мл 0,1 н раствора Na
2
S
2
O
3
, пошедшего на титрование;
k
1
- поправка к 0,1 н раствору йода;
k
2
- поправка к 0,1 н раствору Na
2
S
2
O
3
.
Примечание. В реакцию с йодом наряду с Na
2
S вступает Na
2
SO
3
и
Na
2
S
2
O
3
, но содержание последних в растворе незначительно, при расчете
ими пренебрегают.
Зная количество граммов Na
2
S, необходимое на варку, и концентра-
цию раствора Na
2
S, вычисляют объем сернистого натрия, который нужно
взять для приготовления варочного раствора:
мл, ,
1000
2
2
b
SNa
V
SNa
⋅
=
где b – содержание Na
2
S в растворе, в единицах NaOH.
13.1.3. Определение концентрации раствора NaOH
1 мл раствора переносят в колбу с 30 мл дистиллированной и осво-
божденной кипячением от CO
2
воды, добавляют 2 капли фенолфталеина и
титруют 1 н HCl до исчезновения розового окрашивания.

106
По результатам титрования вычисляют концентрацию раствора ед-
кого натра в граммах на литр и выражают в единицах NaOH (1 мл 1 н рас-
твора HCl соответствует 0,04 г NaOH в единицах NaOH):
b = a · k · 0,04 · 1000, г/л,
где a - количество мл 1 н раствора HCl, пошедшего на титрование;
k - поправка к 1 н раствору HCl;
0,04 - титр 1 н раствора NaOH.
13.1.4. Определение активности Ca(OH)
2
и активности CaO
На аналитических весах взвешивают 0,5 г тонко измельченного
Ca(OH)
2
, переносят в коническую колбу емкостью 50 мл, куда отмеряют
бюреткой 20 мл 1 н раствора HCl. После перемешивания и полного рас-
творения навески титруют 1 н раствором NaOH в присутствии фенолфта-
леина до появления розового окрашивания.
По результатам титрования вычисляют в процентах активность
Ca(OH)
2
(1 мл 1 н раствора HCl соответствует 0,037 г Ca(OH)
2
):
%, ,
100037,0)20(
21
)(
2
b
kak
b
OHCa
⋅
⋅
⋅
−
⋅
=
где a - количество мл 1 н раствора NaOH, пошедшего на титрование;
k
1
- поправка к 1 н раствору HCl;
k
2
- поправка к 1 н раствору NaOH;
b – навеска Ca(OH)
2
в граммах.
При определении активности CaO необходимо взятую навеску осто-
рожно перемешать в конической колбе с водой для гашения извести и пре-
вращения ее в Ca(OH)
2
, после чего проводить определение по методике,
приведенной выше. В расчетной формуле учесть единицы CaO (1 мл 1 н
раствора HCl соответствует 0,028 г CaO). Активность CaO соответственно
будет:
%. ,
100028,0)20(
21
b
kak
b
CaO
⋅
⋅
⋅
−
⋅
=
Активность химикатов используют при взятии навески для проведе-
ния каустизации зеленого щелока.
107
13.2.Приготовление щелочных варочных растворов
13.2.1.Приготовление натронного варочного раствора
для варки с катализатором делигнификации
Состав варочного раствора
NaOH + Na
2
CO
3
+ H
2
O + добавка антрахинона (АХ) или его аналогов.
Характеристика варочного раствора:
NaOH - активная щелочь, г/л в ед. Na
2
O;
NaOH + Na
2
CO
3
- общая щелочь, г/л в ед. Na
2
O.
Степень активности (СА) варочного раствора
%. ,
100
3
2
CONaNaOH
NaOH
СА
+
⋅
=
Степень каустизации (СК) варочного раствора
%. ,
100
3
2
CONaNaOH
NaOH
СК
+
⋅
=
Для данного раствора степени активности и каустизации равны.
Водный раствор гидроксида и карбоната натрия в своем составе пе-
ред подачей на варку должен содержать добавку АХ, или АГХ, или других
катализаторов. Добавку можно предварительно смешать со щепой перед ее
загрузкой в автоклав. Расход каталитической добавки зависит от вида рас-
тительного сырья и от требований к полуфабрикату.
Исходные данные для расчета:
1.Масса абсолютно-сухой древесины (Д), г.
2.Влагосодержание древесины (W), % .
3.Гидромодуль варки (Г), мл/г .
4.Расход активной щелочи (Р
А
), % от абсолютно сухой древесины в
единицах Na
2
O.
5.Расход каталитической добавки, % от абсолютно сухой древесины.
6.Степень активности варочного раствора (СА).
7.Концентрация исходной щелочи, г/л ед. NaOH.
8.Степень чистоты карбоната натрия (щелочность Na
2
CO
3
), %.

108
ПРИМЕР РАСЧЕТА
Пусть масса абсолютно-сухой древесины (Д) составляет 105 г; вла-
госодержание (W) древесины 20 %; гидромодуль варки (Г) равен 5:1; рас-
ход активной щелочи (Р
А
) 22 % в ед. Na
2
O от массы абсолютно сухой дре-
весины; степень активности варочного щелока (С
А
) – 87 %; расход катали-
тической добавки антрахинона (АХ) 0,1% от массы древесины (Д). Необ-
ходимо определить:
1. Количество активной щелочи (А
Щ
) на варку древесины (Д) в зави-
симости от ее расхода (Р
А
)
ONa ед.г 1,23
100
22
105
100
2
=⋅=⋅=
А
Щ
Р
ДА
или
NaOH. ед.г 8,29
31
40
1,23
2
1
=⋅=⋅=
ONaГ
NaOHГ
АА
ЭКВ
ЭКВ
ЩЩ
2. Объем активной щелочи, V
NaOH
.
Обычно едкий натр в лабораторных условиях хранят в виде раство-
ра, поэтому необходимо определить концентрацию раствора. Для этого
1 мл раствора NaOH переносят в колбу c 30 мл дистиллированной воды,
освобожденной кипячением от углекислого газа, добавляют 2 капли фе-
нолфталеина и титруют 1 н HCl до появления розового окрашивания. Рас-
считывают концентрацию гидроокиси натрия
C
NaOH
= a · k · 0,04 · 1000, г/л,
где a - количество мл 1 н раствора HCl, пошедшего на титрование;
k - поправка к 1 н раствору HCl;
0,04 - титр 1 н раствора NaOH, г/см
3
или г/мл.
Допустим, что концентрация раствора NaOH - 149 г/л ед. NaOH, то-
гда объем раствора составит
мл. 200
149
1000
8,29
1000
1
=⋅=
⋅
=
NaOH
Щ
NaOH
C
А
V

109
3. Количество общей щелочи
O.Na ед.г 55,26
87
100
1,23
100
2
=⋅=⋅=
A
Щ
Щ
С
АО
Масса Na
2
CO
3
O,Na ед.г 45,31,2355,26
2
32
=−=−=
Щ
Щ
CONa
АОm
или
.CONa ед.г 85,5
31
53
45,3
32
2
32
1
32
32
=⋅=⋅=
ONaГ
CONaГ
mm
ЭКВ
ЭКВ
CONa
CONa
При взятии навески необходимо учитывать степень чистоты соды,
для чего берут 1 г Na
2
CO
3
, растворяют в 50 мл дистиллированной воды,
титруют 1 н раствором HCl в присутствии индикатора метилоранжа и рас-
считывают степень чистоты соды
%, ,
100053,0
32
b
ka
C
CONa
⋅
⋅
⋅
=
где a - количество мл 1 н раствора HCl, пошедшего на титрование;
k - поправка к 1 н раствору HCl;
b - навеска Na
2
CO
3
, г; (1 мл 1 н HCl соответствует 0,053 г Na
2
CO
3
).
Допустим,
32
CONa
C составит 98 %, тогда масса соды при взятии на-
вески составит
г. 96,5
98
100
85,5
100
32
32
1
=⋅=⋅=
CONa
CONa
C
mm
4. Количество каталитической добавки, К
Д
, допустим антрахинона
(АХ);
а.антрахинонг 105,0
100
1,0
105
100
=⋅=⋅=
АХ
ДК
Д
