Новиков А.А., Федяева И.М. Физико-химические основы процессов первичной переработки нефти и газа
Подождите немного. Документ загружается.


62
Для газовых смесей, являющихся не столь сложными по
сравнению с нефтяными фракциями, критические параметры
могут быть подсчитаны по правилу аддитивности. Например,
критическая температура газовой смеси, состоящей из n компо-
нентов, определяется по формуле:
Т
кр
= ∑ (Т
кр,i
·Y
мл,i
).
Аналогично можно определить и другие критические пара-
метры. Критические параметры газов также могут быть опреде-
лены в зависимости от молярной массы (М = 30-110):
Т
кр
= –0,026·М
2
+ 6,974·М – 163,3,
Р
кр
= 0,000214·М
2
– 0,0584·М + 6,331.
Приведенные параметры. Приведенные температура и дав-
ление для всех газов рассчитываются по формулам
Т
пр
= Т/Т
кр
, Р
пр
= Р/Р
кр
,
за исключением водорода, гелия и неона, для которых справед-
ливы следующие уравнения [2]:
Т
пр
= Т/(Т
кр
+8), Р
пр
= Р/(Р
кр
+8).
Реальные газовые смеси могут иметь более или менее
значительные отклонения от свойств идеальных газов. Поэтому
для технологических расчетов часто используют уравнение Кла-
пейрона-Менделеева с поправкой z:
Р·V = z·n·R·T,
где z – безразмерная эмпирическая поправка, называемая ко-
эффициентом (фактором) сжимаемости. Коэффициент сжимае-
мости при нормальных условиях z
0
для индивидуальных газов
определяется по формуле
z
0
= М·22,4/ρ
0
,
где ρ
0
– плотность газа при нормальных условиях.
По известному z
0
можно рассчитать коэффициент сжимаемо-
сти при других условиях по уравнению
z = z
0
·(P·V·T
0
)/(P
0
·V
0
·T).

63
2.4. Тепловые свойства газов
Теплоемкость. Для газов различают теплоемкость, опреде-
ляемую при постоянном давлении (изобарная теплоемкость) С
Р
и
при постоянном объеме (изохорная теплоемкость) C
V
.Эти тепло-
емкости идеальных газов связаны между собой соотношением
C
P
0
– C
V
0
= R. Индекс 0 означает нормальное давление. Как и для
жидких нефтепродуктов, теплоемкость газов может быть моляр-
ной, массовой и объемной.
В технологических расчетах преимущественно используются
изобарные теплоемкости газов. Теплоемкость газов слабо зави-
сит от давления, обычно этим влиянием в расчетах пренебрега-
ют. При повышении температуры теплоемкость газов увеличи-
вается, однако, в меньшей степени, чем для жидких нефтепро-
дуктов.
Приближенно теплоемкость насыщенных газообразных угле-
водородов в кДж/(кмоль·К) можно определить как функцию числа
углеродных атомов N
С
в молекуле с учетом температуры Т [2]:
С
Р
= 16,74 + 5,44·N
С
+ 0,05·N
С
·Т.
Теплоемкость реальных газов рассчитывается по формуле
С
Р
= C
P
0
– ∆C
P,
где C
P
0
– изобарная теплоемкость газа или газовой смеси в
расчете на идеальный газ, кДж/(кг·К);
∆C
P
– поправка к теплоемкости, учитывающая неидеальность
газа, кДж/(кг·К).
Теплоемкость газов (как идеальных) определяется по урав-
нению
C
P
0
= E + F·(T/100) + G·(T/100)
2
+ H·(T/100)
3
+ N·(100/T)
,
где E, F, G, H, N – коэффициенты.
Значения этих коэффициентов приведены ниже. Для рас-
сматриваемых газов Е = 0.

64
Таблица 4
Значения коэффициентов F, G, H, N для некоторых газов
Газ F·10
2
–G·10
3
H·10
5
N·10
Водород 329,83 294,05 940,12 200,39
Кислород 21,62 16,46 45,44 12,05
Азот 21,74 16,13 45,18 15,43
Оксид углерода 22,07 16,19 44,59 15,20
Диоксид угле-
рода
25,75 19,43 53,59 6,92
Водяной пар 40,15 27,80 79,22 26,41
Метан 58,43 15,19 –2,94 18,55
Этан 62,46 25,62 35,94 3,34
Пропан 66,22 32,71 62,19 –0,78
Бутан 65,71 33,13 64,19 0
Пентан 65,66 33,76 66,84 –6,11
Поправка теплоемкости на давление рассчитывается по формуле
С
Р
= (R/M)·(∆C
P
0
+ ω·∆C
P
′
)
,
где ∆C
P
0
, ∆C
P
′
− поправки, определяемые графически в зави-
симости от приведенных давления и температуры;
ω − фактор ацентричности.
Фактор ацентричности ω находится приближенно по формуле
ω = 0,1745 + 0,0838·Т
пр
.
Фактор ацентричности газовых смесей подсчитывается по
правилу аддитивности, состав смеси при этом выражается в мо-
лярных долях. Правило аддитивности действует и при расчете
теплоемкости газовой смеси.
Энтальпия. Энтальпия газов или паров при заданной темпе-
ратуре Т численно равна количеству теплоты в джоулях (килод-
жоулях), которое необходимо затратить на нагрев единицы ко-
личества вещества от температуры Т
1
до Т
2
с учетом теплоты
испарения и перегрева газов или паров.
Для подсчета энтальпии нефтяных паров [кДж/кг] применя-
ется формула Итона [2]:
I
п
t
= (0,00059·Т
2
+ 0,134·Т + 129,58)·(4 –
15
15
ρ
) – 308,99.
65
Энтальпия идеального газа (I
г
0
, кДж/кг) при температуре Т и
атмосферном давлении рассчитывается по уравнению
I
г
0
= A·T/100 + B·(T/100)
2
+ C·(T/100)
3
+ D·100/C.
где А, В, С, D – коэффициенты, значения которых для газов
приведены в таблице 5.
Таблица 5
Значения коэффициентов А, В, С, D для некоторых газов
Газ A B C D
Водород 82,27 2,54 0,013 25,12
Кислород 82,72 1,87 0,032 24,37
Диоксид
углерода
58,62 5,05 0,012 –11,08
Метан 154,15 15,12 0,051 59,62
Этан 58.65 23.63 0,414 56,15
Пропан 33,65 26,31 0,538 35,58
изо-Бутан 27,32 27,08 0,583 12,74
н-Бутан 34,72 26,08 0,545 39,22
изо-Пентан 26,69 26,84 0,574 11,61
н-Пентан 33,59 25,99 0,550 28,21
Энтальпия нефтяных паров и углеводородных газов с повы-
шением давления снижается. Энтальпия смеси газов или паров,
как и теплоемкость, рассчитывается по правилу аддитивности.
2.5. Сжиженные углеводородные газы
Теплота испарения, называемая также теплотой парообразо-
вания или энтальпией испарения, для многих газов является из-
вестной величиной. В таблице 6 приведены значения удельной
теплоты испарения индивидуальных углеводородов при нор-
мальном давлении и температуре кипения и некоторые другие их
характеристики.
66
Таблица 6
Теплота испарения для некоторых газов
Газы
Т
кип
,
К
Теплота
испарения,
кДж/кг
Удельный
объем при
НУ, м
3
/кг
Молярный
объем при
НУ, м
3
/кмоль
Метан 111,6 518,1 1,39 22,38
Этан 184,6 486,2 0,74 22,18
Пропан 231,1 425,9 0,49 21,64
изо-Бутан 261,5 366,0 0,37 21,64
н-Бутан 272,7 387,8 0,37 21,46
изо-Пентан 301,1 342,6 0,29 21,03
н-Пентан 309,3 257,7 0,29 20,87
Повышение температуры приводит к уменьшению теплоты
испарения, и в критическом состоянии, когда может существо-
вать только паровая фаза, теплота испарения равна нулю. С рос-
том давления теплота испарения также уменьшается.
Теплота сгорания. Теплотой сгорания называют количество
теплоты, выделяемое при сжигании топлива. В СИ удельную
теплоту сгорания измеряют в Дж/кг и кратных единицах. В тех-
нологических расчетах используют иногда молярную
(кДж/кмоль) и объемную (кДж/м
3
) теплоту сгорания. Различают
высшую и низшую теплоты сгорания. Первая учитывает теплоту,
выделяемую дымовыми газами при их охлаждении, а также теп-
лоту конденсации образующихся при сгорании водяных паров,
вторая - нет. Другими словами, низшая теплота сгорания меньше
высшей на величину указанной теплоты. На практике продукты
сгорания обычно не охлаждаются до температуры конденсации
водяных пар
ов, поэтому в расчетах пользуются низшей теплотой
сгорания, рассчитанной на рабочий состав топлива.

67
III. МЕТОДЫ ИССЛЕДОВАНИЯ И ОЦЕНКИ
КАЧЕСТВА НЕФТЕЙ
Для оценки качества нефтей применяется комплекс методов.
Для исследования новых нефтей приняты три программы:
- основная программа № 1, по которой исследуются нефти
новых месторождений или новых горизонтов на дейст-
вующих месторождениях, имеющих большое промыш-
ленное значение, или уникальные по своему составу;
- сокращенная программа № 2, по которой исследуются
нефти новых малодебитных месторождений, а также
проводятся контрольные исследования нефтей, добывае-
мых на старых площадях;
- короткая программа № 3, предназначенная для исследо-
вания нефтей из разведочных скважин.
Ниже приводится перечень определяемых показателей при
исследовании нефтей по программе № 1.
1. Анализ образца нефти.
Определение содержания низкокипящих углеводородов, дав-
ления насыщенных паров при 38 и 50°С, температуры вспышки
(в открытом и закрытом тигле).
2. Физико-химическая характеристика нефти.
Определение плотности при различных температурах, мо-
лярной массы, вязкости при температуре от 0 до 50°С (через ка-
ждые 10°С), температуры застывания, кислотного числа, кок-
суемости, зольности, содержания смол, асфальтенов, парафина
(и его температуры плавления), серы, азота, воды, механических
примесей, солей, нафтеновых кислот и фенолов, ванадия и нике-
ля. Определение элементного и фракционного состава.
3. Однократное испарение нефти (ОИ).
Зависимость выхода паровой (отгон) и жидкой (остаток) фаз
ОИ от температуры – не менее четырех точек в интервале 200-
350°С при атмосферном давлении.
4. Перегонка нефти в АРН-2.
5. Физико-химическая характеристика узких фракций неф-
ти с целью построения кривых показателей ее качества.

68
3.1. Кривые ИТК и характеристика узких
фракций
Перегонка нефти в АРН-2 (аппарат ректификации нефти)
проводится с целью построения кривых истинной температуры
кипения ИТК (отбираются 3%-ные по объему фракции или
фракции через каждые 10°С).
Для каждой полученной узкой фракции проводится комплекс
исследований физико-химических характеристик. Определяется
плотность
20
4
ρ
, показатель преломления
20
D
n , молярная масса,
вязкость при 20, 50 и 100°С, температура застывания, вспышки
(в открытом тигле), коксуемость, содержание азота и серы.
Полученные результаты суммируются в таблицах и графи-
ках. В табл. 7 [17], приведен пример табличного суммирования
результатов разделения типовой нефти на узкие фракции и ис-
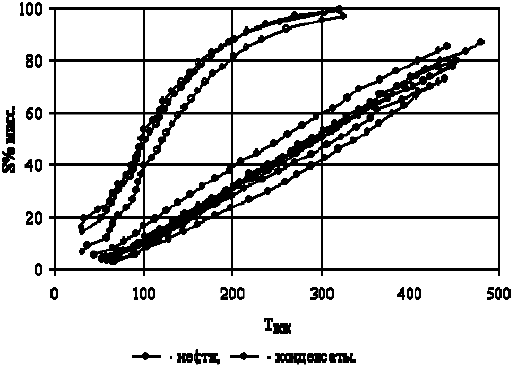
следования их физико-химических характеристик. Кривые ИТК
нефтей и конденсатов Томской области, по данным [17], приве-
дены на рис. 5.
Несмотря на су
щественную разницу в содержании узких
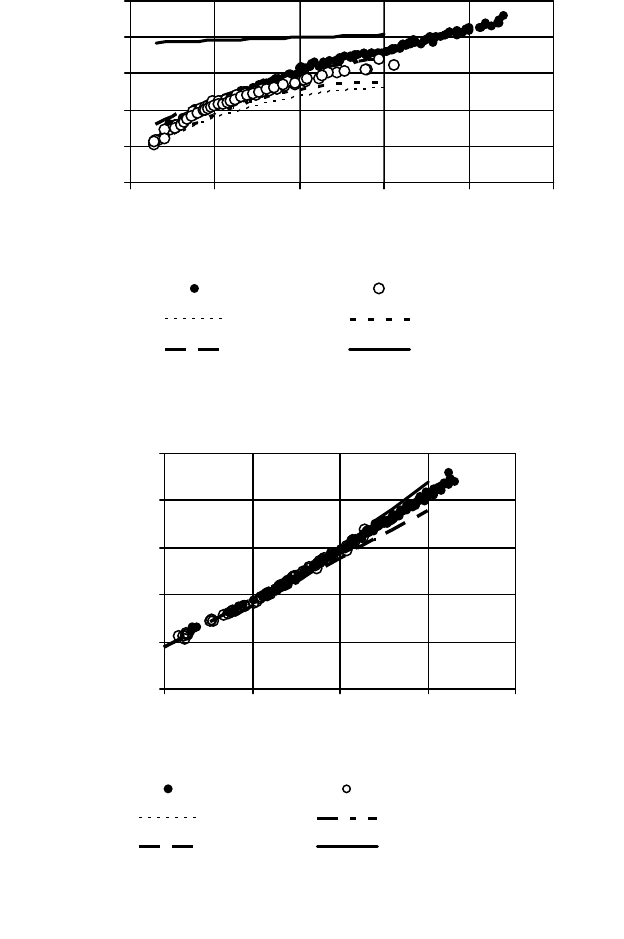
фракций в нефтях и конденсатах, их физико-химические харак-
теристики – плотность (рис. 6), молярная масса (рис. 7), показа-
тель преломления (рис. 8) – достаточно «жестко» определяются
средней температурой кипения фракции.
Для сравнения на этих графиках приведены аппроксими-
рующие кривые соответствующих показателей для индивиду-
альных углеводородов различных групп (рис. 1 – 3): НА – н-
алкан
ы, ИА – изо-алканы, ЦА – циклоалканы, АР – ароматиче-
ские углеводороды. Их сопоставление позволяет качественно
оценить углеводородный состав узких фракций. В частности,
подтверждаются данные о том, что с увеличением температуры
кипения фракций в них уменьшается содержание н- и изо-
алканов и увеличивается содержание циклоалканов и ароматиче-
ских углеводородов. Заметны также различия в содержан
ии раз-
личных групп углеводородов для нефтей и конденсатов.
На рис. 9 приведена зависимость между плотностью и пока-
зателем преломления узких фракций Томских нефтей и конден-
69
сатов Подобные зависимости для индивидуальных углеводоро-
дов представлены на рис. 4.
Данные по ИТК нефтей Коми и Пермской области [1] содер-
жатся в табл. 8 и на рис. 10.
Кривые ИТК позволяют рассчитать потенциальное содержа-
ние фракций в нефтях и их физико-химические свойства.
Например, в типовой нефти потенциальное содержание
фракции 30-200
о
С составляет
S%
(30-200)
= S%
(tкк=200)
– S%
(tкк=30)
= 33,46% – 5,18% = 28,28%.
Массовое содержание узких фракций во фракции 30-200
о
С
пересчитывается по формуле
%
i,фр.30-200
= (%
i,нефть
/ S%
30-200
)·100%
Средние характеристики фракции 30-200
о
С (молярная масса,
плотность) пересчитываются через характеристики узких фрак-
ций по правилу аддитивности.
В таблице 9 приведены расчетные содержание и кривые ИТК
стабилизированных светлых фракций 40-350
о
С в нефтях Коми и
Пермской области. Связь плотности нефти и содержания в ней
стабилизированной светлой фракции 40-350
о
С представлена на
рис. 11.
Рис. 5 Кривые ИТК нефтей и конденсатов Томской области

70
0,6
0,7
0,8
0,9
1,0
0 100 200 300 400 500
Ткип,ср
Плотность, г/см
3
- нефти, - конденсаты,
- НП, - ИП,
- ЦП, - АР.
Рис. 6 Плотность узких фракций нефтей и кондесатов Томской области
0
100
200
300
400
500
0 100 200 300 400 500
Ткип,ср
Молярная масса
- нефти, - конденсаты, - НП,
- ИП, - ЦП, - АР.
Рис. 7 Молярная масса узких фракций нефтей и кондесатов Томской области
71
1,30
1,35
1,40
1,45
1,50
1,55
0 100 200 300 400 500
Ткип,ср
Показатель преломления
- нефти, - конденсаты,
- НП, - ИП,
- ЦП, - АР.
Рис. 8 Показатель преломления узких фракций нефтей и кондесатов Томской
области
1,30
1,35
1,40
1,45
1,50
1,55
0,60 0,70 0,80 0,90 1,00
Плотность, г/см
3
Показатель преломления
- нефти, - конденсаты,
- НП, - ИП,
- ЦП, - АР.
Рис. 9 Связь плотности и показателя преломления узких фракций нефтей и
конденсатов Томской области
