Морозов В.П. Практикум по неорганической химии
Подождите немного. Документ загружается.


41
Существуют различные методы определения молярных масс
газообразных и растворенных веществ.
По закону Авогадро в равных объемах газов при одинаковых
условиях температуры и давлении содержится равное число моле-
кул, т. к. относительная молекулярная масса вещества пропорцио-
нальна массе отдельной молекулы, то из закона Авогадро следует,
что молярная масса любого вещества в газообразном состоянии
при одинаковых условиях занимает один и тот же объем, назы-
ваемый молярным объемом (V
м
). При нормальных условиях мо-
лярный объем газа равен 22400 мл; этот объем занимает (при н.у.)
1 моль любого газа: 2,016 г водорода, 32 г кислорода, 18 г водяно-
го пара и т. д. Следовательно, молярный объем газообразных ве-
ществ не зависит от природы вещества.
Экспериментальное определение молярной массы газообраз-
ных веществ основано на применении закона Авогадро и следствий
из него. Молярная масса может быть определена даже и в том слу-
чае, если состав исследуемого соединения неизвестен.
1. Определение молярной массы газообразных веществ на
основании молярного объема
Согласно следствию из закона Авогадро, 1 моль любого газа
занимает объем 22,4 л. Поэтому, зная массу газа в определенном
объеме, можно найти его молярную массу. Пусть g(г) исследуемо-
го газа занимает при нормальных условиях объем V
o
(л), то моляр-
ная масса определяется как количество газа, занимающее объем
22,4 л, т. е.:
0
*4,22
V
g
М =
. (7)
Выражение g/V
0
представляет массу одного литра газа при н.у.,
т. е. его плотность Д
0
. Следовательно, молярная масса газа (М) мо-
жет быть выражена как произведение его плотности на 22,4 л.:
.4,22*
0
лДМ =
(8)
Если
объемы
газов
измерены
при
температуре
и
давлении
отличных
от
нормальных
,
то
для
вычисления
плотности
объемы
газов
необходимо
привести
к
нормальным
условиям
,
используя
уравнение
(5).

42
2. Определение молярной массы газа по относительной
плотности (по водороду или воздуху)
Для определения молярной массы газа удобно пользоваться
понятием относительной плотности. Относительной плотностью
называется отношение массы одного газа к массе такого же объема
другого газа, взятого при одних и тех же условиях, температуры и
давлении.
В качестве эталона для сравнения берут либо легчайший газ –
водород, либо воздух, как наиболее доступный.
Если исследуемый газ А, находящийся в некотором объеме ве-
сит g1, то его масса равна:
A
Mng *1 =
,
где
n –
число
молекул
, M
А
–
молярная
масса
.
Другой
газ
,
взятый
для
сравнения
в
том
же
объеме
и
при
тех
же
условиях
,
согласно
закону
Авогадро
,
тоже
содержит
число
молекул
n
и
масса
его
равна
:
B
Mng *2 =
.
Отношение
масс
2
1
g
g
,
равное
отношению
молярных
масс
М
А
/
М
В
и
показывающее
,
во
сколько
раз
первый
газ
тяжелее
второ
-
го
,
называется
плотностью
исследуемого
газа
по
отношению
ко
второму
,
или
просто
относительной
плотностью
.
Если
плотность
исследуемого
газа
определяется
по
водороду
,
молярная
масса
которого
равна
2,016,
то
молярная
масса
газа
А
равна
:
)(*2)(*016,2
22
НДНДM
A
=
=
. (9)
Молярная
масса
взятого
для
сравнения
воздуха
определяется
как
«
средняя
по
составу
».
В
воздухе
содержится
по
массе
24 %
ки
-
слорода
и
76 %
азота
.
Средняя
молярная
масса
воздуха
:
(
)
29
100
76*28*32*24
=
.
Следовательно
,
если
плотность
исследуемого
газа
определяется
по
воздуху
,
то
для
расчетов
молярной
массы
газа
применяется
относительная
плотность
по
воздуху
:
.
*29
воздА
ДМ =
(10)

43
Пример. Плотность аммиака по водороду равна 8,44, а по воз-
духу 0,59.
Отсюда, молярная масса аммиака равна 17 г/моль, так как
(
)
1744,8*2*2
2
=
=
=
НДМ
г/моль;
1759,0*29*29
.
===
возд
ДМ
г/моль.
При определении молярной массы газа по относительной
плотности не обязательно приводить газ к нормальным условиям.
3.Определение молярной массы по его весу и объему
Зная массу какого-то газа, можно найти его молярную массу по
уравнению Клайперона – Менделеева.
Уравнение Клайперона:
r
T
PV
=
, (11)
где r – величина постоянная для одной и той же массы газа.
Менделеев показал, что, учтя закон Авогадро, можно получить
уравнение, содержащее вместо постоянных (r), зависящих от вида
и количества газа, только одну постоянную R, не зависящую от
природы газа.
Для 1 моль любого газа (при нормальных условиях) V
o
в отно-
шении
0
00
T
PV
означает объем 22,4 л.
Тогда для всех газов
0
00
T
PV
будет величиной постоянной.
Постоянная R называется газовой постоянной или постоянной
Менделеева. Выражение:
R
T
VP
=
0
00
или
RTPV
=
,
применяемое к 1 молю любого газа, называется обобщенным
уравнением Менделеева – Клайперона. В зависимости от единиц, в
которых выражены V и P, численные значения R различны:
мольград
стртмммл
стртмммл
R
*.
...*62359
273
...760*22400
==
;
мольград
атмл
атмл
R
*.
.*.082,0
273
.1*4,22
==
;
мольград
эрг
R
*.
.107*3,8
=
, если Р в Па, V в м
3
.
44
Для n молей уравнение Клайперона – Менделеева принимает
следующий вид:
nRTPV
=
, (12)
где n – число молей газа может быть выражено как частное от
деления веса вещества на его молярную массу. Тогда уравнение
записывается следующим образом:
RT
M
g
PV *=
. (13)
Из этого уравнения (13) может быть определена молярная мас-
са газа:
PV
RT
gM *=
. (14)
Определение молярной массы диоксида углерода
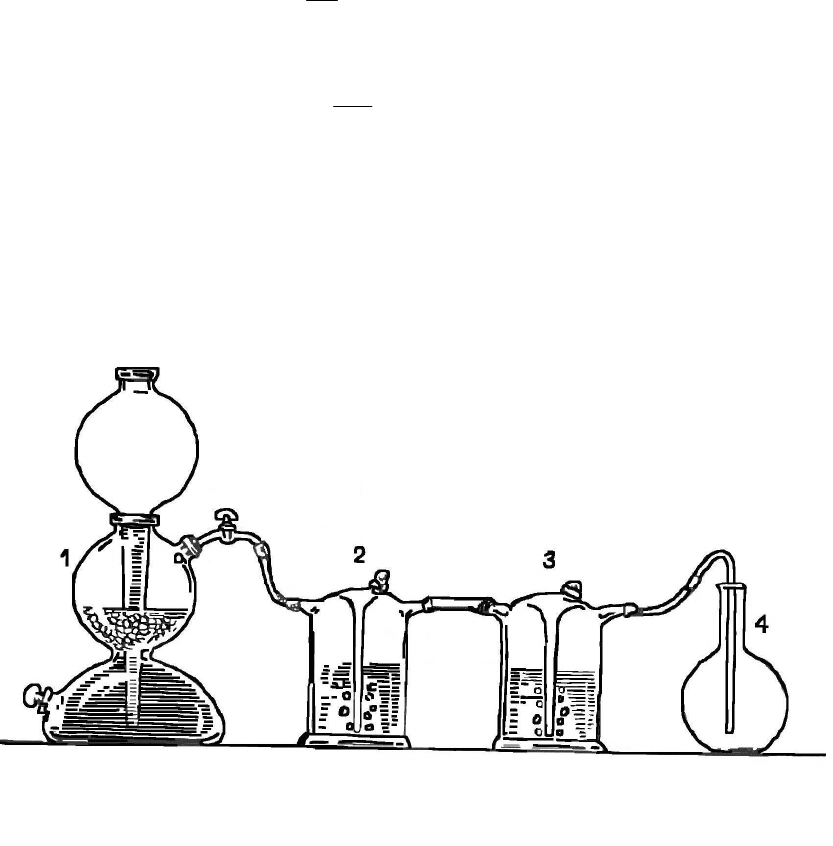
Определение молярной массы диоксида углерода проводится в
приборе, приведенном на рис.2, состоящем из аппарата Киппа (1) и
промывных склянок (2, 3).
Рис.2. Прибор для определения молярной массы
углекислого газа
Диоксид углерода, получаемый в аппарате Киппа действием
10 %-й соляной кислоты на мрамор, пропускают через промывные
склянки. В склянке (2), наполненной водой, CO
2
освобождается от
примеси хлористого водорода, в склянке (3), наполненной концен-
45
трированной серной кислотой, высушивается. Для работы необхо-
дим очищенный сухой газ.
Опыт проводится в следующей последовательности: сухую и
чистую колбу емкостью 250 мл плотно закрыть резиновой проб-
кой. Нижний уровень пробки в горле отметить карандашом для
надписи по стеклу. Взвесить колбу, закрытую пробкой, на техниче-
ских весах с точностью до 0,01 г.
Открыть пробку, опустить в колбу до дна газоотводную трубку
от аппарата Киппа (4) и в течение 3-5 минут пропускать диоксид
углерода с такой скоростью (регулируется краном), чтобы можно
было считать отдельные пузырьки в промывных склянках. Когда
колба наполнится диоксидом углерода (как это определить?), вы-
нуть газоотводную трубку, закрыть отверстие пробкой (пробка
должна входить до метки) и закрыть кран аппарата Киппа. Взве-
сить колбу с диоксидом углерода на тех же весах.
Операцию заполнения колбы газом и последующего взвешива-
ния повторяют до тех пор, пока результаты взвешивания не совпа-
дут или будут отличаться не более чем на 0,01 г. В этом случае
можно быть уверенным, что воздух в колбе вытеснен, и она полно-
стью наполнена диоксидом углерода. Учитывать результаты по-
следнего взвешивания.
Отметить показания термометра и барометра во время опыта.
Запись располагать в следующем порядке:
1. Масса колбы с пробкой и воздухом, г.
2. Масса колбы с пробкой и CO
2
, г.
3. Объем колбы, мл.
4. Абсолютная температура во временя опыта, К.
5. Атмосферное давление, мм.рт.ст.
6. Объем воздуха, приведенный к нормальным условиям, мл.
7. Масса воздуха в объеме колбы, г.
8. Масса CO
2
в объеме колбы, г.
9. Плотность CO
2
по воздуху.
10. Масса колбы, г.
Вычислить молярную массу CO
2
тремя способами и рассчитать
процент ошибки по формуле:

46
(
)
.100*
.
..
теор
пртеор
М
ММ
П
−
=
Контрольные задания
1. Что называется абсолютной плотностью газа?
2. Что называется относительной плотностью газа?
3. Что называется плотностью газа по водороду?
4. Как можно вычислить молекулярную массу веществ, зная
плотность его паров по воздуху?
5. Как изменится плотность газа при изменении давления?
6. Определите давление газа, если известно, что в сосуде объе-
мом 10 л при 57
0
С находится 6*10
22
молекул.
7. Рассчитайте число молекул в м
3
газа при 24
0
С и 10
-7
мм.рт.ст.
8. Вычислить плотность по водороду газовой смеси, состоящей
из одной объемной части аммиака и двух объемных частей окиси
углерода (IV).
9. Средняя плотность по водороду газовой смеси, состоящей из
водорода и кислорода, равна 14,5. Вычислить, сколько объемных
процентов водорода и кислорода содержится в смеси.
10. Вычислить массу 1 л газовой смеси, имеющей объемный
состав: 40 % CO; 12 % O
2
; 48 % N
2
при 740 мм.рт.ст. и 25
0
С.
11. Масса 344 мл газа при 42
0
С и 772 мм.рт.ст. равна 0,865 г.
Вычислить молярную массу газа.
12. Вычислить массу 250 мл хлороформа при 90
0
С и 760
мм.рт.ст.
13. Определить молярные массы газов, если:
а) 0,29 л газа при температуре 27
0
С и давлении 1,064*10
5
Па
имеют массу 0,32 г;
б) 1,56 л газа при температуре 27
0
С и давлении 1,037*10
5
Па
имеют массу 2,86 г.
(Ответ: а) 25,6; б) 44.)
14. Плотность газа по воздуху равна: а) 0,9; б) 2,45. Опреде-
лить массу 1л каждого газа.
(
Ответ: а) 1,16 г; б) 3,17 г.)
47
15. При прокаливании некоторого количества нитрата свинца
(II) масса его уменьшилась на 2,16 г. Определить массу в граммах
и число молей взятой соли, и объемы полученных кислорода и ди-
оксида азота при нормальных условиях.
(Ответ: m (Pb(NO
3
)
2
) = 6,62 г; n (Pb(NO
3
)
2
) = 0,02 моль; V(O
2
) =
0,224 л; V(NO
2
) = 0,448 л).
16. Определить процентное содержание примесей в техниче-
ском сульфиде железа, если при взаимодействии 5 г его с кислотой,
выделилось 0,8 л сероводорода при температуре 39
0
C и давлении
1,617*10
5
Па.
(Ответ: 28 г.)
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ
КОНЦЕНТРАЦИИ
Растворами называются (гомогенные) системы, состоящие
из двух и более компонентов.
Из определения понятия «растворы» следует, что они, как ми-
нимум являются двухкомпонентными системами. Тот компонент,
который количественно преобладает и находится в том же агрегат-
ном состоянии, что и образующийся раствор, называется раствори-
телем. Таким образом, растворы можно рассматривать как систе-
мы, не имеющие строго определенного состава. Основным призна-
ком, характеризующим растворы, является их однородность, по-
этому они больше напоминают химические соединения и отлича-
ются от механических смесей.
Важной характеристикой растворов является концентрация.
Говоря лишь о концентрированных или разбавленных растворах,
подразумевают лишь качественную сторону концентрации этих
растворов. Например, концентрированная серная кислота содер-
жит до 98 % H
2
SO
4
, в то время как этот же термин применительно
к соляной кислоте подразумевает раствор, содержащий 38 % HCl.
Разбавленные растворы содержат наименьшую долю растворенно-
го вещества.
Следовательно, в практическом отношении особое значение
приобретает количественный способ выражения концентрации.
48
Концентрацией раствора называется количество раство-
ренного вещества, содержащееся в определенном количестве рас-
твора или растворителя. Различают два типа обозначений кон-
центраций веществ – аналитические и технические.
Аналитические обозначения употребляются для растворов реа-
гентов, применяемых в анализе веществ, где в качестве основной
массовой единицы веществ используют моль.
Молярность М – число молей растворенного вещества, со-
держащееся в 1 л раствора. Раствор, содержащий в 1 л 1 моль рас-
творенного вещества, называется одномолярным или молярным;
0,1 моль – децимолярным (0,1 М раствор); 0,01 моль – сантимо-
лярным и т. д.
Вместо молярности в последнее время применяют более точ-
ный термин – Формульная концентрация F – число молей веще-
ства, соответствующих его химической формуле, содержащееся в
1 л раствора.
Моляльность – число молей вещества, приходящееся на 1 кг
растворителя.
Молярная концентрация эквивалента вещества, или нор-
мальность, N – число молей эквивалентных масс Мэ, содержа-
щееся в 1 л раствора. Раствор называется однонормальным, или
нормальным, если в 1 л его содержится 1 моль-экв растворенного
вещества (1 н. раствор); полунормальным, если он содержит 0,5
моль-экв в 1 л (0,5 н. раствор) и т. д.
При определении количества вещества, необходимого для при-
готовления раствора той или иной нормальности, знать правила
определения эквивалентов. Например, в 1 л 1 н. H
2
SO
4
содержится
1 моль-экв H
2
SO
4
(49 г), так как Э (H
2
SO
4
) = М/2.
Массовая эквивалентность (массовая нормальность) Ха –
число молей эквивалентных масс, приходящееся на 1 кг раствори-
теля.
Технические обозначения концентраций широко распростра-
нены в технике, медицине, фармации. Наиболее употребительными
из них являются следующие обозначения:
Массовая доля – количество граммов растворенного вещества,
содержащееся в 100 г раствора. Например, 10 % раствор поварен-
ной соли – это такой раствор, в 100 г которого содержится 10 г со-
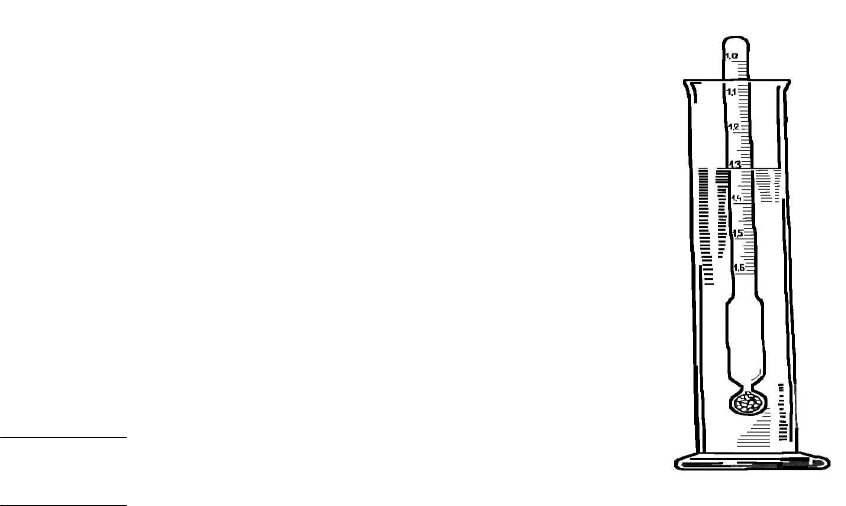
49
ли. Масса раствора представляет собой сумму масс растворенного
вещества и растворителя. Следовательно, в приведенном примере в
каждых 100 г раствора содержится 10 г соли и 90 г растворителя.
Объемная массовая доля употребляются для обозначения
концентрации смесей жидкостей или газов.
Определение плотности растворов
Для быстрого, но приближенного определения плотности слу-
жит ареометр (рис.3).
Он представляет собой поплавок с дробью или ртутью и узким
отростком-трубкой, в которой находится шкала с делениями.
Ареометр погружается в различных жидкостях на различную глу-
бину. При этом он вытесняет объемы этих жидкостей одной и той
же массы, равной массе ареометра, а следовательно, обратно про-
порциональные их плотности. То деление шкалы, до которого
ареометр погружается в жидкость, показывает плотность этой
жидкости. В зависимости от заданной точности применяют один
ареометр с большими интервалами на шкале или набор нескольких
ареометров с мелкими делениями.
Если шкалу ареометра градуируют на
плотность, то расстояния между деления-
ми получают неодинаковыми. Для про-
стоты на шкале ареометра иногда нанесе-
ны равные интервалы, указывающие ус-
ловные градусы Воме (Ве
0
). Такие арео-
метры часто применяют в заводской
практике.
Переводят градусы Воме в плотность
при 15
0
С при помощи специальных таблиц
или по следующим формулам:
( )
0
3,144
3,144
Ве
d
−
=
для жидкостей тяжелее воды;
( )
0
3,144
3,144
Ве
d
+
=
для жидкости легче воды.
Рис.3. Измерение
плотности раствора
при помощи ареометра

50
Ареометры, применяемые для определения плотности жидко-
стей тяжелее воды, имеют нуль вверху шкалы, а для жидкостей
легче воды – внизу шкалы.
От плотности растворов можно перейти к массовой доле, поль-
зуясь специальными таблицами. Если в таблицах не имеется циф-
ры, точно отвечающей сделанному отсчету на шкале ареометра, а
есть близкие величины (немного больше и немного меньше), то
массовую долю растворенного вещества вычисляют методом ин-
терполяции (определение промежуточной величины по двум из-
вестным крайним).
Определяют массовую долю методом интерполяции по сле-
дующей формуле:
(
)
(
)
1
12
121.
*
w
ww
w
эксп
x
+
−
−
−
=
ρρ
ρ
ρ
,
где ρ
эксп.
– экспериментально определенная плотность, которой
соответствует концентрация w
x
в %, ρ
1
– плотность раствора бли-
жайшего меньшего значения концентрации (w
1
), ρ
2
– плотность
раствора ближайшего большего значения концентрации (w
2
).
Можно воспользоваться другим способом определения кон-
центрации методом интерполяции. Предположим, что имеется рас-
твор серной кислоты с плотностью 1,200. По таблице находим, что
для растворов серной кислоты с плотностью 1,174 и 1,205 массовая
доля соответственно равна 24 % и 28 %. Считаем, что в этих ин-
тервалах массовая доля изменяется прямо пропорционально изме-
нению плотности. Разница плотностей равна 1,205 – 1,174 = 0,031,
а разница массовых долей составляет 28 % – 24 % = 4 %. Находим
разницу между плотностью нашего раствора и плотностью раство-
ра кислоты с меньшей концентрацией. Она равна 1,200 – 1,174 =
0,026. Увеличению плотности на 0,031 соответствует увеличение
массовой доли на 4 %, а увеличение массовой доли, соответствую-
щее увеличению плотности на 0,026, находим из пропорции:
X
4
026,0
031,0
=
,
35,3
031,0
026,0*4
==X
%.
Найденную величину прибавляем к массовой доле кислоты в
растворе с меньшей плотностью и получаем искомую массовую
долю: 24 % + 3,35 % = 27,35 %.
