Морозов В.П. Практикум по неорганической химии
Подождите немного. Документ загружается.

31
Аr (Na) = 23; B = 1;
( )
23
1
23
==NaМ
экв
г/моль.
Если элемент образует несколько соединений, проявляя при
этом различную степень окисления, то величины молярных масс
эквивалентов будут различны.
Пример. Определить молярную массу эквивалента азота в со-
единениях: NH
3
, NO, NO
2
.
Решение. Находим эквивалентную массу азота и его степень
окисления в соединениях.
Ar (N) = 14. Степень окисления азота в NH
3
= -3;
( )
66,4
3
14
==NМ
экв
г/моль.
Степень окисления азота в NO = +2;
( )
7
2
14
==NМ
экв
г/моль.
Степень окисления азота в NO
2
= +4;
( )
5,3
4
14
==NМ
экв
г/моль.
Постоянные значения эквивалентной массы имеют элементы с
постоянной валентностью.
Из существа понятий о химическом эквиваленте вытекает
закон эквивалентов: равные количества эквивалентов веществ
взаимодействуют без остатка.
Математическое выражение закона имеет вид:
)2()1( эквэкв
nn =
. (2)
Это же выражение можно записать в другом виде:
,
2
2
1
1
эквэкв
М
m
М
m
=
где m
1
, m
2
– массы веществ; М
экв1
, М
экв2
– молярные массы эк-
вивалентов веществ.
Под молярной массой эквивалента сложного соединения по-
нимают такое количество его, которое в данной реакции взаимо-
действует с молярной массой эквивалента другого соединения.
Молярной массой эквивалента кислоты называется такое
ее количество, которое содержит один моль эквивалента водоро-
да, способного замещаться на металл.
Молярные массы эквивалентов кислот HCl; HNO
3
; CH
3
COOH
составляют соответственно 36,46 г/моль, 63,01 г/моль, поскольку в
них содержится 1,008 г/моль водорода, способного замещаться ме-

32
таллом. Именно поэтому молярная масса эквивалента кислоты мо-
жет быть вычислена как частное от деления ее молярной массы на
основность кислоты. Так, молярная масса эквивалента серной ки-
слоты может быть определена по количеству атомов водорода,
участвующих в реакции:
1) H
2
SO
4
+ NaOH = NaHSO
4
+ H
2
O;
2) H
2
SO
4
+ 2NaOH = Na
2
SO
4
+ 2H
2
O.
В первом случае
1
)(
42
M
SOHМ
экв
=
, т. к. один атом водорода за-
мещен на металл; во втором случае
( )
2
42
M
SOHМ
экв
=
, т. к. оба атома
водорода замещены на металл, т.е:
( )
98
1
98
421
==SOHМ
экв
г/моль;
( )
49
2
98
422
==SOHМ
экв
г/моль.
Молярная масса эквивалента основания – это его масса, со-
держащая один моль эквивалента металла, способного участво-
вать в реакции.
Молярная масса эквивалента основания может быть вычислена
по формуле:
В
М
основМ
экв
=.)(
, (3)
где М – молярная масса основания, В – валентность металла
(число гидроксильных групп или кислотность).
Пример. Найти молярную массу эквивалента гидроксида алю-
миния, исходя из следующих реакций:
1) Al(OH)
3
+ HCl = Al(OH)
2
Cl + H
2
O;
2) Al(OH)
3
+ 2HCl = AlOHCl
2
+ 2H
2
O;
3) Al(OH)
3
+ 3HCl = AlCl
3
+ 3H
2
O.
Решение. Молярная масса эквивалента гидроксида алюминия
для каждого случая будет соответственно равна:
1)
( )( )
1
3
M
OHAlМ
экв
=
, т. к. в этом случае замещен один гидро-
ксид-ион на хлорид-ион.
2)
( )( )
2
3
M
OHAlМ
экв
=
, т. к. 2 гидроксид-иона замещены на хло-
рид-ионы.

33
3)
( )( )
3
3
M
OHAlМ
экв
=
, т. к. все 3 гидроксид-иона замещены на
хлорид-ионы.
Молярные массы эквивалентов солей тоже могут иметь пере-
менные значения. Например, в реакциях:
NaHSO
4
+ BaCl
2
= BaSO
4
+ NaCl + HCl;
MgOHCl + H
2
S = MgS + H
2
O + HCl.
Молярные массы эквивалентов NaHSO
4
, MgOHCl составляют
½ их молярных масс, т. к. две молярные массы эквивалентов соли
участвуют в реакции.
Наиболее употребительные методы экспериментального опре-
деления молярной массы эквивалентов следующие:
1. Метод прямого определения.
Молярная масса эквивалента определяется из данных прямого
синтеза кислородного или водородного соединения данного эле-
мента.
2. Аналитический метод.
Производится точный анализ соединения данного элемента с
любым другим, эквивалент которого известен.
3.Метод вытеснения водорода.
Метод применяется для определения молярной массы эквива-
лентов металлов, способных вытеснять водород из разбавленных
кислот и щелочей. Эквивалент определяется из отношения веса
данного элемента к весу или объему вытесненного им водорода.
Пример. При взаимодействии 0,065 г цинка с серной кислотой
выделилось при нормальных условиях 22,4 мл водорода. Т. к. хи-
мический эквивалент водорода соответствует 1,008 г (или
11200 мл) выделившегося водорода, то эквивалент цинка ока-
зывается равным:
2
2
1
1
эквэкв
М
m
М
m
=
или
эквэкв
V
V
M
m
=
1
1
,
то
./5,32
4,22
11200*.065,0
1
мольг
мл
млг
M
экв
==
4. Электрохимический метод.
Определяется весовое количество элемента, осаждающееся на
электроде при электролизе соли данного элемента. (Эквивалент
рассчитывается по закону Фарадея).

34
5. Теоретический метод.
Химический эквивалент можно вычислить, зная атомный вес и
валентность элемента:
B
Аr
М
экв
=
, (4)
где Ar – атомная масса, В – валентность.
Вопросы допуска к лабораторной работе
1. Какие из приведенных ниже выражений относятся к первому
определению, какие – ко второму?
1) Химические элементы взаимодействуют между собой в ко-
личествах, пропорциональных их эквивалентам.
2) Масса элемента, которая может при химических реакциях
присоединять или замещать одну (точнее, 1,008) часть массы водо-
рода или 8 частей массы кислорода:
а) химический эквивалент элемента;
б) закон эквивалентов;
в) молярная масса эквивалента элемента;
г)
2
2
1
1
эквэкв
М
m
М
m
=
, где m
1
, m
2
– массы веществ; М
экв1
, М
экв2
–
молярные массы эквивалентов веществ.
2. Каким из приведенных методов можно определить химиче-
ский эквивалент золота, которое непосредственно с водородом и
кислородом не соединяется и не вытесняет водород из кислот.
а) метод вытеснения водорода;
б) метод прямого определения;
в) аналитический метод;
г) электрохимический метод.
3. Молярная масса эквивалента азота (г/моль) в соединении
NO
2
равна:
а) 4,66; б) 7;
в) 3,5; г) 6.
4. Молярная масса эквивалента азота в соединении NхOу равна
2,8 г/моль. Определите это соединение:
а) N
2
O; б) NO;
35
в) N
2
O
3
; г) NO
2
;
д) N
2
O
5
.
5. Молярная масса эквивалента гидроксида висмута (г/моль) в
следующей реакции равна:
Bi(OH)
3
+ HNO
3
= Bi(OH)
2
NO
3
+ H
2
O.
а)259,98;
б) 129,99;
в) 86,66 г.
6. Молярная масса эквивалента фосфорной кислоты (г/моль) в
реакции равна:
H
3
PO
4
+ Ca(OH)
2
= CaHPO
4
+ 2H
2
O.
а) 49;
б) 98;
в) 32,67.
7. Молярная масса эквивалента соли NaHSO
4
в следующей ре-
акции равна:
NaHSO
4
+ BaCl
2
= BaSO
4
+ NaCl + HCl.
а) 0,5-, б) 0,25-,
в) 1-, г) 2- молярных масс.
8. 0,05 г металла вытесняют из кислоты 28 мл водорода (н.у.).
Чему равна молярная масса эквивалента металла (г/моль)?
а) 5; б) 1;
в) 15; г) 20;
д) 25.
9. Сколько оксида получится при окислении 3 г металла, мо-
лярная масса эквивалента которого равна 12 г/моль?
а) 3; б) 6;
в) 5; г) 10;
д) 12.
10. Какой объем займёт (при н.у.) 1 моль эквивалента кислоро-
да и 1 моль эквивалента водорода?
V (O
2
): а) 5,6 л; б) 2,8 л;
в) 44,8 л; г) 22,4 л.
V (Н
2
): а) 11,2 л; б) 22,4 л;
в) 22,4 л; г) 20 л.
36
11. 1 г калия соединяется с 0,9 г хлора, а также с 2 г брома.
Найти молярные массы эквивалентов калия и брома (г/моль), если
молярная масса эквивалента хлора равна 35,5 г/моль.
Э (К): а) 39; б) 32;
в) 31; г) 38.
Э (Вr): а) 78; б) 20;
в) 19; г) 75.
Определение молярной массы эквивалента цинка
методом вытеснения
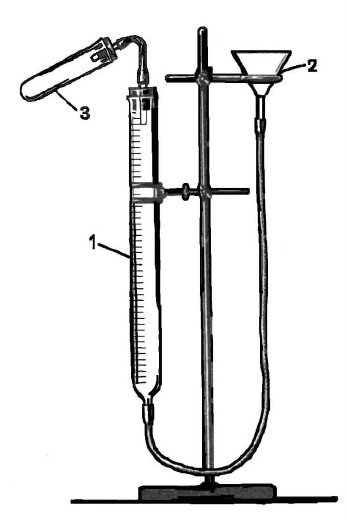
Собрать прибор, приведенный на рисунке 1.
Прибор состоит из: 1) бюретки на 50 мл; 2) воронки, служа-
щей в качестве уравнительного сосуда, 3) пробирки. Для соеди-
нения употребляются каучуковые трубки и пробки с просвер-
ленными отверстиями.
После того как прибор собран, в
уравнительный сосуд наливается вода,
заполняющая бюретку. Бюретка укреп-
ляется в штативе так, чтобы уровни во-
ды в бюретке и воронке совпадали с
нулевым делением (нулевое деление
должно быть на уровне глаз наблюда-
теля). Отсчеты уровня жидкости дела-
ются по нижнему краю мениска.
Прежде чем проводить опыт, необ-
ходимо проверить прибор на герметич-
ность. Для этого бюретку и пробирку
закрывают пробками, соединенными
между собой резиновой трубкой. Затем
уравнительный сосуд опускается вниз
на 15-20 см. Уровень воды в бюретке
несколько снизится и останется без
Рис.1. Прибор для о
п-
ределения молярной ма
с-
сы эквивалента цинка
изменения, если прибор герметичен. При возвращении сосуда на
прежнее место вода в нем и в бюретке должна быть на том же
нулевом делении.
37
Проведение опыта
Взвесить кусочек цинка около 0,03 г. Вынуть пробку из про-
бирки и передвижением воронки установить уровень воды в бю-
ретке на нулевом делении или несколько ниже. Отмерить 5 мл раз-
бавленной серной кислоты, добавить 1 каплю раствора сульфата
меди и влить в одно из колен пробирки. В другое колено поместить
кусочек цинка. Затем в пробирку плотно вставляют пробки. Прове-
ряют герметичность прибора. Затем пробирку поворачивают таким
образом, чтобы кислота перелилась в то колено пробирки, где на-
ходится цинк.
Водород, выделившийся в результате взаимодействия цинка с
раствором кислоты, вытесняет из бюретки воду. Уравнительный
сосуд (воронку) при этом надо опускать и во время опыта старать-
ся держать воду в нем и в бюретке на одном уровне, чтобы давле-
ние газа внутри прибора было все время близко к атмосферному.
По окончании реакции дать пробирке остыть до комнатной
температуры, после чего снова привести воду в бюретке и воронке
к одинаковому уровню, отметить и записать уровень воды в бю-
ретке. Отметить и записать показания комнатного термометра и
барометра во время опыта.
Результаты измерений записываются в следующей таблице:
1. Масса цинка (г).
2. Температура (t,
0
С).
3. Атмосферное давление (Р, мм.рт.ст.).
4. Уровень воды в бюретке до реакции (А1).
5. Уровень воды в бюретке после реакции (А2).
6. Давление насыщенного пара (при температуре t), мм.рт.ст.
Обработка результатов
1. Вычислить объем водорода (в мл), вытесненного цинком
при температуре t и давлении Р:
V = A1 – A2.
2. Привести объем выделившегося водорода к нормальным ус-
ловиям. При этом надо учесть, что водород, собранный над водой,
содержит водяной пар, что давление газа в бюретке, равное атмо-
сферному давлению, складывается из парциальных давлений водо-
рода и водяного пара. Приведение объема газа к нормальным усло-
38
виям производится на основании уравнения состояния идеального
газа, объединяющего законы Бойля-Мариотта и Гей-Люссака:
T
PV
T
VP
=
0
00
, (5)
где P
o
– нормальное давление, равное 760 мм. рт. ст.;
V
o
– объем газа при н. у., выраженный в мл.;
Р – парциальное давление сухого водорода, равное измеренно-
му атмосферному давлению минус парциальное давление водяного
пара при температуре опыта;
Т – температура опыта, равная Т
о
+ t.
Таким образом, объем водорода при нормальных условиях оп-
ределяется по уравнению:
(
)
( )
760*273
273*
0
t
hpV
V
+
−
=
.
3. Вычислить молярную массу эквивалента цинка можно: ис-
пользуя закон эквивалентов (уравнение (2)), заменив массу водо-
рода их объемами, т. е.:
)(
22
НЭ
Zn
экв
H
Zn
V
М
V
m
=
⇒
2
2
)(
*
H
НЭZn
Zn
экв
V
Vm
М =
,
где Vэ(н
2
) = 11,2 л.
4. Вычислить массу вытесненного водорода – g, зная, что 1
моль водорода занимает при нормальных условиях объем, равный
22,4 л.
5. Вычислить молярную массу эквивалента цинка по формуле:
,
)(*
2
g
НМb
М
экв
экв
=
где b – масса взятого цинка, а g – масса выделившегося водо-
рода.
6. Сравнить полученную молярную массу эквивалента цинка с
теоретическим значением и вычислить процент ошибки опыта по
формуле:
(
)
.100*(%)
.
.
теор
экв
экв
теор
экв
М
ММ
ошибка
−
=
(6)
39
Контрольные задания
1. Вычислить молярные массы эквивалентов металлов в соеди-
нениях: Cr
2
O
3
; Mn
3
(PO
4
)
2
; Mn
2
O
7
; KCr(SO
4
)
2
.
2. Найти молярные массы эквивалентов неметаллов в соедине-
ниях: H
4
P
2
O
7
; H
2
Si
2
O
5
; Na
2
B
4
O
7
; NH
4
ClO
4
.
3. Вычислить молярную массу эквивалентов следующих со-
лей: AlCl
3
*6H
2
O; CrPO
4
; FeSO
4
*7H
2
O; Mg
2
P
2
O
7
. С учетом
того, что соли взаимодействуют с кислотой с образованием сред-
них солей.
4. Какую молярную массу эквивалента и какую часть моля со-
держат: 24,5г H
2
SO
4
; 75г CaCO
3
; 8,6 г CaSO
4
*2H
2
O.
5. Вычислить молярную массу эквивалента олова в его кисло-
родных соединениях, содержащих соответственно 21,1 и 11,9 %
кислорода.
6. Некоторый элемент образует гидрид, содержащий 8,87 %
водорода. Вычислить молярную массу эквивалента элемента.
7. Эквивалент металла составляет 56,2 у.е. Вычислить про-
центное содержание металла в его кислородном соединении.
8. Молярная масса эквивалента металла равна 23 г/моль.
Сколько граммов металла надо взять для выделения 135,6 мл водо-
рода (н.у.) из кислоты?
9. Определить молярную массу эквивалента алюминия, если
при сгорании 10 г его образуется 18,88 г оксида.
10. 0,493 г хлорида соединения некоторого металла после об-
работки нитратом серебра образовали 0,861 г хлорида серебра. Вы-
числить молярную массу эквивалента металла.
11. На нейтрализацию 1 г основания израсходовано 2,14 г HCl.
Вычислить молярную массу эквивалента основания.
12. Элемент образует гидрид, с массовой долей водорода 8,87 %.
Вычислите молярную массу эквивалента элемента.
(Ответ: 10,3 г/моль)
13. При сгорании металла массой 5 г образует 9,44 г оксида
металла. Вычислите молярную массу эквивалента металла.
(Ответ: 9 г/моль)
14. Определите молярную массу эквивалента серы, если 6,48 г
некоторого металла образуют 6,96 г оксида и 7,44 г сульфида.
(Ответ: 16 г/моль)
40
15. Молярная масса эквивалента металла составляет 63,5
г/моль. Вычислите массовую долю металла W(Me), в оксиде.
(Ответ: 88,8 %)
16. Определите массу металла, вступившего в реакцию с ки-
слотой, если при этом выделился водород объемом 260 мл при
нормальных условиях. Молярная масса эквивалента металла равна
9 г/моль.
(Ответ: 0,21 г)
17. На нейтрализацию кислоты, массой 2,18 г, израсходовано
KOH массой 2,49 г. Вычислите молярную массу эквивалента ки-
слоты.
(Ответ: 49 г/моль)
18. Кальций, массой 0,69 г, и цинк, массой 1,13 г, вытесняют из
кислоты одинаковые количества водорода. Определите молярную
массу эквивалента цинка, зная, что молярная масса эквивалента
кальция равна 20 г/моль.
(Ответ: 32,7 г/моль).
19. Металл, массой 0,864 г, образовал хлорид массой 1,148 г.
Определите молярную массу эквивалента металла, зная, что мо-
лярная масса эквивалента хлора равна 35,5 г/моль.
(Ответ: 108 г/моль)
20. Металл, массой 2 г, соединяется с 17,78 г брома и 3,56 г се-
ры. Молярная масса эквивалента серы равна 16 г/моль. Определите
молярные массы эквивалентов металла и брома.
(Ответ: 9 г/моль; 80 г/моль).
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ
Относительная молекулярная масса является основной ха-
рактеристикой каждого индивидуального вещества простого или
сложного.
Масса молекул, выраженная в атомных единицах массы, назы-
вается относительной молекулярной массой. Атомная единица
массы – это 1/12 часть массы атома самого легкого природного
изотопа углерода
12
С.
Количество вещества, масса которого в граммах численно
равна относительному молекулярному весу, называется молем.
