Морозов В.П. Практикум по неорганической химии
Подождите немного. Документ загружается.


21
Присутствие ионов Н
3
О
+
в растворах всех кислот объясняет
изменение окраски индикаторов, водные растворы кислот кислые
на вкус и разъедают ткани. Характерным качеством кислот являет-
ся их способность при взаимодействии с металлами замещать свой
водород на металл.
Вторая группа реакций кислот связана со специфическими
особенностями различных кислот. Окислительные свойства за счет
элемента-кислотообразователя характерны для азотной и хромовой
кислот при любых концентрациях, а для серной – при достаточно
высокой концентрации. Бескислородные кислоты также способны
к реакциям не только по водороду, но и по элементу – кислотооб-
разователю.
Амфотерные гидроксиды. Амфотерные гидроксиды являются
соединениями с двойственной функцией; они способны реагиро-
вать как с кислотами, так и с основаниями, это объясняется тем,
что в водном растворе они диссоциируют как по типу основания,
так и по типу кислоты:
Zn
2+
+ 2OH
-
= Zn(OH)
2
= 2H
+
+ ZnO
2
2-
.
Следовательно, гидроксид цинка в кислой среде будет вести
себя как основание:
Zn(OH)
2
+ 2HC1 = ZnCl
2
+ 2H
2
O,
а в щелочной – как кислота:
Zn(OH)
2
+ 2КОН (р) = К
2
[Zn(OH)
4
].
Названия амфотерных гидроксидов строятся как по типу осно-
вания, так и по типу кислот с учетом требований номенклатурных
правил:
Zn(OH)
2
– гидроксид цинка, цинк гидроксид, H
2
ZnО
2
–
цинковая кислота, водород цинкат;
Сг(ОН)
3
– гидроксид хрома (III), хром (III) гидроксид,
Н
3
СгО
3
– ортохромистая кислота, водород ортохромит, НСгО
2
–
метахромистая кислота, водород метахромит.
СОЛИ
Соли – вещества, издавна известные в практике, дошедшие до
нас от раннего алхимического периода. В те времена понятие о со-
лях не отличали от понятий кислот и оснований. Только после ра-

22
бот Глаубера (в середине XVII столетия) понятие о солях стало по-
немногу принимать самостоятельное значение.
В настоящее время солью называют продукт полной или час-
тичной замены водорода кислоты металлом или замены гидро-
ксид-иона на кислотный остаток. В зависимости от полноты за-
мещения ионов водорода на ионы металла и гидроксид-ионов на
кислотный остаток соли, получили название средние, кислые и
основные. Эти соли относятся к типу простых солей. К концу
XVII века был обнаружен сложный тип солей, так называемые
двойные соли. Другой разновидностью солей сложного типа яв-
ляются комплексные соли. Сейчас некоторые авторы современ-
ных учебников по общей химии выделяют еще один тип сложных
солей – смешанные соли.
Простые соли
Средние соли. Средними солями называются продукты полно-
го замещения Н
+
- ионов кислоты ионами металлов: они могут
быть рассмотрены также как продукты полного замещения ОН
-
-
ионов основания ионами кислотного остатка.
Соли представляют собой ионные соединения и их названия
строятся по названиям металлов и кислот. В настоящее время ис-
пользуется два способа названия: отечественный и международ-
ный.
По способу, принятому в отечественной номенклатуре, при на-
звании солей бескислородных кислот используется название ме-
талла, к которому добавляется суффикс -ист (для низких степеней
окисления) или -н (для высоких степеней окисления):
NaCI – хлористый натрий,
FeCl
2
– хлористое железо,
FeCl
3
– хлорное железо.
По международной номенклатуре к латинскому названию не-
металла добавляется суффикс -ид. В случае, если металл имеет пе-
ременную степень окисления, после названия металла указывается
степень окисления его, либо используются греческие числитель-
ные, указывающие на число кислотных остатков.
Например: NaCI – хлорид натрия,
FeCl
2
– хлорид железа (II), дихлорид железа,

23
CrCl
3
– хлорид хрома (III), трихлорид хрома,
SnC1
4
– хлорид олова (IV), тетрахлорид олова.
Правила ИЮПАК рекомендуют называть соли по общему пра-
вилу: вначале называется катион с указанием степени окисления,
затем – анион. При написании степень окисления указывается в
скобках римскими или арабскими цифрами:
СгС1
2
– хром (II) хлорид, хром (2+) хлорид,
СгС1
3
– хром (III) хлорид, хром (3+) хлорид.
При наименовании солей кислородосодержащих кислот в рус-
ской химической литературе пользуются исторически сложившим-
ся порядком: сначала называют кислоту с прибавлением слова
“кислый”, а затем металл.
Например: Na
2
SО
4
– сернокислый натрий,
Сu(NO
3
)
2
– азотнокислая медь,
K
2
SO
3
– сернистокислый калий,
Mg(NO
3
)
2
– азотнокислый магний.
Для металлов с переменной валентностью: соли, отвечающие
низшей валентности, обозначаются как закисные, а высшей – как
окисные.
Например: Fe(NO
3
)
2
– закисное азотнокислое железо,
Fe(NO
3
)
3
– окисное азотнокислое железо.
В настоящее время большое распространение получила но-
менклатура солей, в основе которой лежат латинские названия
элементов-кислотообразователей. Она является до некоторой сте-
пени международной номенклатурой. В основе ее лежат следую-
щие принципы:
При постоянной валентности центрального атома (атома ки-
слотообразующего элемента) название соли оканчивается слогом
-ат.
Например: Na
2
ZnO
2
– цинкат натрия,
Na
2
CO
3
– карбонат натрия,
Na
3
AlO
3
– алюминат натрия,
К
2
ВеО
2
– бериллат калия.
Если элемент-кислотообразователь имеет переменную ва-
лентность, то названия солей, отвечающих высшей валентности,
характеризуются окончанием -ат.
Например: BaSO
4
– сульфат бария,

24
Mg(NO
3
)
2
– нитрат магния.
Низшая степень окисления характеризуется окончанием -ит:
Na
2
SO
3
– сульфит натрия,
Ba(NO
2
)
2
– нитрит бария.
Если кислота имеет несколько форм, то и соли имеют соот-
ветствующее название.
Например: Н
3
РО
4
– Na
3
PO
4
– ортофосфат натрия,
НРО
3
– КРО
3
– метафосфат калия,
H
4
SiO
4
– Na
4
SiO
4
– ортосиликат натрия,
H
2
SiO
3
– Na
2
SiO
3
– метасиликат натрия;
Для солей, образованных кислотами, где элемент-
кислотообразователь имеет несколько степеней окисления, низшая
и высшая степени окисления отмечаются приставками гипо- и пер-:
НСlO – NaClO – гипохлорит натрия,
НС1О
2
– NaClO
2
– хлорит натрия,
НСlO
3
– NaClO
3
– хлорат натрия,
НСlO
4
– NaClO
4
– перхлорат натрия.
В случае, когда катион имеет переменную валентность, ее
указывают после названия катиона и пишут римскими цифрами:
FeSO
4
– сульфат железа (II),
Fe
2
(SO
4
)
3
– сульфат железа (III).
Правила ИЮПАК не исключают тривиальных названий солей,
но рекомендуют следующие правила:
Первой называется электроположительная составляющая с
соответствующим окончанием -ат или -ит:
Na
2
SO
4
– натрий сульфат,
KNO
2
– калий нитрит,
Fe
2
(SO
4
)
3
– железо (Ш) сульфат;
Термины сульфат, фосфат и т. д. были раньше названиями
анионов отдельных кислот, теперь эти названия должны обозна-
чать отрицательную группу с серой или фосфором в качестве цен-
трального атома, независимо от его степени окисления, количества
и природы лиганда:
Na
2
SO
4
– динатрий тетраоксосульфат,
Na
2
SO
3
– динатрий триоксосульфит,
Fe
2
(SO
4
)
3
– дижелезо трио(тетраоксосульфат).
Во многих случаях эти названия могут быть сокращены:
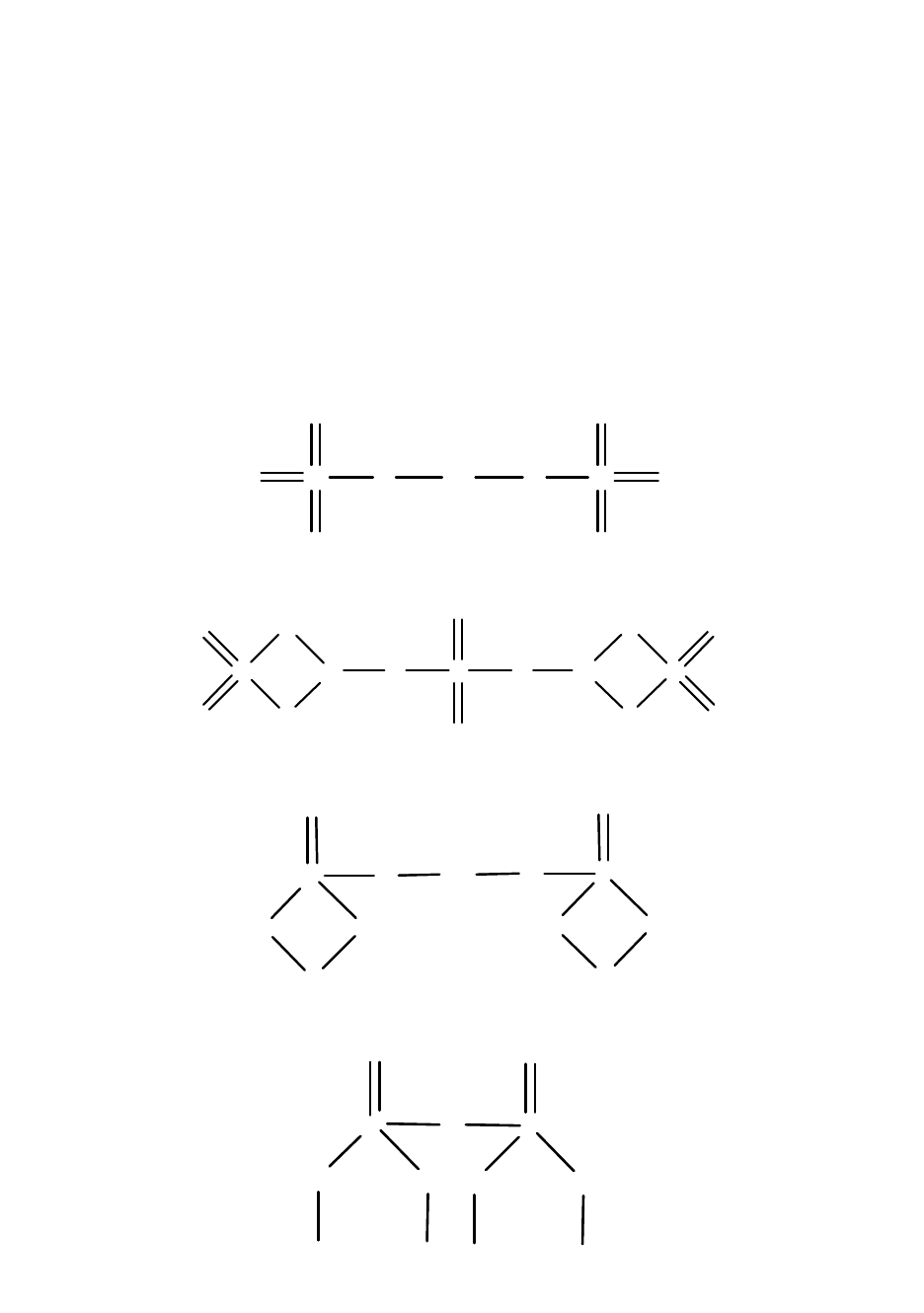
25
Na
2
SO
4
– натрий сульфат,
Na
2
SO
3
– натрий сульфит,
Fe
2
(SO
4
)
3
– железо (III) сульфат.
При изображении графической формулы соли никогда не сле-
дует терять из вида структуры кислотного остатка. Только тогда
решение задачи будет продуманным, лишенным элементов слу-
чайного и беспорядочного распределения связей между атомами.
Кроме того, в солях кислородных кислот связь между атомами ме-
таллов и атомами-комплексообразователя всегда осуществляется
через кислород. Например:
Ва(СlO
4
)
2
– перхлорат бария:
O Cl
O
O
O Ba O Cl
O
O
O
.
A1
2
(SO
4
)
3
– сульфат алюминия:
O
S
O
O
O
Al O S O
O
O
Al
O
O
S
O
O
.
Ca
3
(PO
4
)
2
– фосфат кальция:
P
O
O
O
Ca
Ca O
P
O
Ca
O
O
O
.
Na
4
P
2
O
7
– дифосфат натрия:
P
O
P
O
O
Na
Na
O
O
O
N
a
O
Na
.

26
Кислые соли. Кислые соли – это продукт неполного замеще-
ния ионов водорода на металл.
Одноосновные кислоты не образуют кислых солей, поскольку
содержат только один атом водорода, способный замещаться на
металл. Двухосновные кислоты (H
2
SO
4
, H
2
SO
3
, H
2
CO
3
и т. д.) об-
разуют кислые соли, содержащие соответственно отрицательные
ионы HSO
4
-
, HSO
3
-
, НСО
3
-
. Заряды этих ионов определяются как
результат отрыва положительно заряженного иона Н
+
от ней-
тральной молекулы кислоты. Зная заряд иона, входящего в состав
кислой соли, и иона металла нетрудно записать формулу кислой
соли. Применительно к серной кислоте, кислые соли которой со-
держат ион HSO
4
-
, формулы солей будут иметь вид:
для одновалентных металлов – MeHSO
4
,
для двухвалентных металлов – Me(HSO
4
)
2
,
для трехвалентных металлов – Me(HSO
4
)
3
.
Трехосновные кислоты способны образовывать два типа кис-
лых солей. В случае Н
3
РО
4
происходит замещение одного иона H
+
ионом металла, а два других иона входят в состав отрицательно за-
ряженного иона Н
2
РО
4
-
, образующего кислую соль.
Однозамещенные кислые соли для металлов различной ва-
лентности имеют следующие формулы:
МеH
2
РО
4
,
Ме(Н
2
РО
4
)
2
,
Ме(Н
2
РО
4
)
3
.
Если происходит замещение двух ионов Н
+
ионами металла, а
третий Н
+
входит в состав иона НРО
4
2-
, то с металлами различной
валентности образуются соли состава:
Ме
2
НРО
4
,
МеНРО
4
,
Ме
2
(НРО
4
)
3
.
Названия кислых солей строятся аналогично названиям нор-
мальных солей, но в названиях анионов кислот содержится при-
ставка гидро-, если сохраняется один атом водорода, или эта же
приставка с греческим числительным, показывающим число ато-
мов водорода в анионе:
NaHS – гидросульфид натрия,
NaH
2
PO
4
– дигидрофосфат натрия.

27
Правила ИЮПАК сохраняют названия анионов, но вместо
приставки гидро- на русском языке ставится слово “водород”, в
случае необходимости перед водородом указывается числовой
префикс.
Например: KHS – калий водородсульфид,
NaНСО
3
– натрий водородкарбонат,
LiН
2
РО
4
– литий диводородфосфат.
Основные соли. Основные соли – это продукты неполного за-
мещения гидроксид-ионов основания анионами кислот.
Однокислотные основания не образуют основных солей, по-
скольку их молекулы содержат только один ион ОН
-
, способный
замещаться анионом кислоты.
Двухкислотные основания, имеющие формулу Ме(ОН)
2
, обра-
зуют основные соли, содержащие положительно заряженные ионы
(МеОH)
+
. Заряды этих ионов определяются как результат отрыва
иона ОН
-
от нейтральной молекулы гидроксида металла по схеме:
Ме(ОН)
2
⇔
МеОН
+
+ ОН
-
.
Зная заряд иона, входящего в состав основной соли, а также
заряд кислотного остатка, нетрудно вывести формулу основной со-
ли. Формулы основных солей в зависимости от заряда анионов бу-
дут иметь следующий вид:
для одновалентных кислотных остатков: МеОНС1, МеОНNО
3
,
для двухвалентных кислотных остатков: (MeOH)
2
SO
4
,
(MeOH)
2
SO
3
,
для трехвалентных кислотных остатков: (МеОН)
3
РО
4
,
для четырехвалентных остатков: (МеОН)
4
Р
2
О
7
.
Трехкислотные основания обшей формулы Ме(ОН)
3
способны
образовывать два типа основных солей. В одном случае происхо-
дит замещение одного иона ОН
-
ионом кислотного остатка, а два
другие входят в состав заряженного положительного иона
Ме(ОН)
2
+
, образующегося по схеме:
Ме(ОН)
3
⇔
Ме(ОН)
2
+
+ ОН
-
.
Основные соли этого типа, в зависимости от валентности ки-
слотного остатка, характеризуются следующими формулами:
Me(OH)
2
NO
3
,
(Me(OH)
2
)
2
SO
4
,

28
(Me(OH)
2
)
3
PО
4
.
В другом случае происходит замещение двух ионов ОН
-
иона-
ми кислотного остатка, при этом образуется ион (МеОН)
2+
, кото-
рый может образовывать соли состава:
MeOH(NO
3
)
2
,
MeOHSO
4
,
(МеОН)
3
(РО
3
)
2
.
Согласно международной номенклатуре, остатки MeOH
+
,
MeOH
2+
, Мe(ОН)
2
+
получили название гидроксоионов. Названия
основных солей строятся по общему правилу:
ZnOHCl – хлорид гидроксоцинка,
(MgOH)
2
SO
4
– сульфат гидроксомагния,
Сг(ОН)
2
С1 – хлорид дигидроксохрома (III).
Если металл имеет переменную валентность, то после его на-
звания указывается степень окисления:
(FeOH)
2
SO
4
– сульфат гидроксожелеза (II),
(FеOH)SO
4
– сульфат гидроксожелеза (III),
СгОН(NO
3
)
2
– нитрат гидроксохрома (III).
Правила ИЮПАК сохраняют для ОН
-
- ионов название “гидро-
ксид”. Основные соли следует называть:
MgOНCl – магний гидроксид хлорид,
Fe(OH)
2
Cl – железо (III) гидроксид хлорид.
Сложные соли
Двойные соли. Двойные соли являются продуктами взаимо-
действия кислоты с оксидами или основаниями разных металлов,
что возможно, если кислота содержит минимум два водорода, спо-
собных замещаться металлом.
Например: H
2
SO
4
+ КОН = KHSO
4
+ H
2
O,
KHSO
4
+ NaOH = KNaSO
4
+ Н
2
О.
Двойные соли существуют только в твердом виде. Примерами
двойных солей служат: KFe(SO
4
)
2
, NH
4
Cr(SO
4
)
2
. Такие соли имеют
тривиальное название "квасцы":
KA1(SO
4
)
2
– алюмокалиевые квасцы,
NH
4
Fe(SO
4
)
2
– железоаммонийные квасцы.

29
По международной номенклатуре в названиях двойных солей
названия всех катионов ставятся в родительном падеже и соединя-
ются дефисом:
KA1(SO
4
)
2
– сульфат калия-алюминия,
(NH
4
)
2
Fe(SO
4
)
2
– сульфат аммония-железа (II).
Последовательность катионов зависит от их валентности, если
один из катионов имеет переменную валентность, то она указыва-
ется римскими цифрами.
Номенклатура ИЮПАК рекомендует называть двойные соли
по общему правилу для бинарных соединений:
NH
4
Fe(SO
4
)
2
– аммоний - железо (III) сульфат,
NH
4
MgPO
4
– аммоний - магний фосфат.
Графические формулы строятся так же, как и для нормальных
солей.
Смешанные соли. Этот тип солей аналогичен двойным солям
с той лишь разницей, что молекула смешанной соли образована
различными кислотными остатками при одном и том же металли-
ческом основании:
Са(ОН)
2
+ Сl
2
→
Са(ОС1)С1 + Н
2
O.
При названии таких солей анионы называются в алфавитном
порядке:
Са(ОС1)С1 – гипохлорит-хлорид кальция,
Ca
5
F(PО
4
)
3
– три фосфат-фторид пентакальций.
По правилам ИЮПAK названия этих солей будут отличаться
только положением электроположительной составляющей:
Са(ОС1)С1 - кальций гипохлорит-хлорид.

30
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
Химический эквивалент, или молярная масса эквивалента,
представляет собой одну из важнейших характеристик элемента.
Единица молярной массы эквивалента определяется из сле-
дующих опытных данных:
1. Водород вступает в соединение с кислородом, образуя воду,
в весовых отношениях: 1,00 : 7,9365 или 1,008 : 8,000.
2. Молярная масса эквивалента водорода равна его атомному
весу. Так как атомный вес водорода равен 1,008, то этому же числу
равна и его молярная масса эквивалента. Молярная масса эквива-
лента кислорода тогда равна 8,000 г/моль. Отсюда, точно зная мо-
лярные массы эквивалентов водорода и кислорода, можно дать оп-
ределение эквивалента элемента:
Химическим эквивалентом, или молярной массой эквива-
лента элемента, называется такая масса, которая соединяется
с 8 весовыми частями кислорода или с 1 (точнее, 1,008) массовой
частью водорода, или замещает такие же массы кислорода или
водорода в их соединениях.
Массу одного моля эквивалента элемента называют молярной
массой эквивалента. Например, 1 моль эквивалента водорода равен
1,008 г/моль или 1,008 у.е.
Молярная масса эквивалента связана с атомной массой соот-
ношением:
Z
А
М
экв
=
, (1)
где М
экв
– молярная масса эквивалента, Z – валентность, А –
атомная масса.
Пример. Определить молярные массы эквивалентов алюминия,
кальция и натрия. Для определения молярных масс эквивалентов
этих элементов необходимо найти значение их атомных масс по
Периодической системе, определить их валентность и, используя
зависимость (1), рассчитать молярные массы эквивалентов.
Решение. Аr (Al) = 27; B = 3;
( )
9
3
27
==AlМ
экв
г/моль.
Ar (Ca) = 40; B = 2;
( )
20
2
40
==
СаМ
экв
г/моль.
