Луцкий Д.Л., Николаев А.А. Координационные соединения
Подождите немного. Документ загружается.


21
Примеры:
[Co(-NCS)
4
]
2
– тетракис(тиоцианато-N)кобальтат(II)-ион
[Hg(-SCN)
4
]
2
– тетракис(тиоцианато-S)меркурат(II)-ион
[Fe(H
2
O)
3
(-NCS)
3
] – трис(тиоцианато-N)триакважелезо
K
4
[Fe(-CN)
6
] – гекса(циано-C)феррат(II) калия
Для амбидентатного лиганда NO
2
традиционно существует
два названия: нитро (в случае -NO
2
) и нитрито (в случае -ONO).
Примеры:
[Co(-NO
2
)
6
]
3
– гексанитрокобальтат(III)-ион
[Co(-ONO)
6
]
3
– гексанитритокобальтат(III)-ион
Большое количество координационных соединений имеет по-
лимерное строение. Для того чтобы дать название комплексному по-
лимеру используют специальную приставку катена-, которую пишут
через дефис.
Примеры:
[Cs]
n
[…CuCl
2
-Cl-CuCl
2
-Cl-CuCl
2
-Cl…)
6
]
n
к а т е н а
-(-хлоро)дихлорокупрат(II) цезия
к а т е н а
-ди(-хлоро)палладий
Pd
Cl
Cl
Pd
Cl
Cl
Pd
Cl
Cl
Pd
Cl
Cl
n
22
ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ
СОЕДИНЕНИЯХ. ГЕОМЕТРИЯ ВЕРНЕРОВСКИХ КОМПЛЕКСОВ
Химическая связь в комплексных соединениях по своей при-
роде не отличается от химической связи в простых соединениях. Час-
тицы внешней сферы удерживаются за счет сил электростатиче-
ского ион-ионного взаимодействия. Наибольший интерес представ-
ляет характеристика химической связи между комплексообразовате-
лем и лигандами.
Для описания химической связи в комплексных соединениях
(здесь и далее ради упрощения рассматриваются только вернеров-
ские комплексы) применяют метод молекулярных орбиталей, тео-
рию кристаллического поля и метод валентных связей.
Метод молекулярных орбиталей является наиболее универ-
сальным, но в тоже время сложен для восприятия без достаточной
подготовки.
Теория кристаллического поля имеет ряд ограничений и не
может, в некоторых случаях, объяснить строение и свойства ком-
плексных соединений.
Метод валентных связей также имеет ряд ограничений, но в
отличие от предыдущих методов отличается относительной простотой
и достаточной наглядностью. Поэтому, для объяснения природы хи-
мической связи между комплексообразователем и лигандами, мы вос-
пользуемся методом валентных связей.
Еще до разработки квантово-химических представлений
Льюис в 1916 году предположил, что химическая связь образуется по-
средством электронной пары. В 1927 году В. Гайтлер и Ф. Лондон,
проведя квантово-механический расчет молекулы водорода, дали
обоснование гипотезе Льюиса о роли электронной пары в образовании
ковалентной связи. Позднее развитие этой концепции было продол-
жено Слейтором, Ван Флеком и Полингом. Наибольший вклад в изу-
чение ковалентных связей в многоатомных молекулах и разработку
нового метода внесли Слейтор и, особенно, Л. Полинг, поэтому метод
валентных связей иногда называют методом ГЛСП (Гайтлер-Лондон-
Слейтор-Полинг).

23
Метод валентных связей может быть сформулирован в виде
трех основных положений:
- ковалентную связь образуют два электрона с антипараллель-
ными спинами;
- при образовании ковалентной связи происходит перекрыва-
ние волновых функций электронов, что приводит (за счет увеличения
электронной плотности между взаимодействующими атомами) к
уменьшению энергии системы;
- ковалентная связь направлена в сторону наибольшего пере-
крывания электронных облаков взаимодействующих атомов.
С точки зрения этого метода между комплексообразователем и
лигандом возникает ковалентная двухцентровая двухэлектронная
связь по донорно-акцепторному механизму.
При этом предполагается, что при взаимодействии с лиганда-
ми происходит возбуждение комплексообразователя и гибридизация
его орбиталей.
Используем метод валентных связей для описания связи меж-
ду комплексообразователем и лигандами на конкретном примере.
Примеры:
Рассмотрим образование и геометрию комплекса [Pt(NH
3
)
4
]
2+
.
Внешняя электронная оболочка иона платины Pt
2+
в основном
состоянии записывается как:
У иона платины Pt
2+
имеется четыре свободных орбитали 6s,
6p
x
, 6p
y
, 6p
z
. Но энергетически более выгодно для образования хими-
ческой связи освободить одну из 5d-орбиталей, за счет спаривания
электронов.
При взаимодействии с лигандами вакантные орбитали подвер-
гаются dsp
2
-гибридизации.
В качестве лиганда выступает аммиак, атом азота в котором
находится в sp
3
-гибридном состоянии.
5d
8
6s
0
6p
0
Pt
2+
x
y z
24
Три sp
3
-атомных орбитали азота используются для связи с
атомами водорода. На четвертой находится неподеленная пара элек-
тронов.
У четырех атомов азота в составе четырех молекул аммиака,
соответственно, четыре sp
3
-атомных орбитали с неподеленной парой
электронов перекрываются с четырьмя вакантными dsp
2
-атомными
орбиталями иона платины. Происходит обобществление электронов и
образуются четыре равноценные двухэлектронные -связи.
Схематично это можно записать следующим образом:
При образовании связи атом азота отдает пару электронов, по-
этому называется донором. Ион платины использует электронную па-
ру азота и называется акцептором. При этом комплексный ион пла-
тины [Pt(NH
3
)
4
]
2+
приобретает следующую электронную конфигура-
цию:
N
H
H
H
Pt
2+
H
3
N NH
3
NH
3
NH
3
5d
6s
6p
NH
3
NH
3
NH
3
NH
3
25
Ориентация связей комплексообразователь-лиганд определяет
пространственную конфигурацию всего комплекса. А ориентация свя-
зей зависит от типа гибридизации валентных орбиталей (см. табл. 2).
Таблица 2.
ВЛИЯНИЕ ТИПА ГИБРИДИЗАЦИИ ВАЛЕНТНЫХ ОРБИТАЛЕЙ НА
ГЕОМЕТРИЮ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Тип комплекса Тип гибридизации Конфигурация
ML
2
sp Линейная
ML
3
sp
2
Треугольная
ML
4
sp
3
, sd
3
Тетраэдрическая
dsp
2
Плоскоквадратная
ML
5
spd
3
, sp
3
d Тригональнобипирамидальная
sp
2
d
2
Тетрагональнопирамидальная
ML
6
sp
3
d
2
Октаэдрическая
В приведенном нами примере образуются четыре sp
2
d-
гибридных орбитали. Поэтому комплексное соединение [Pt(NH
3
)
4
]
2+
имеет конфигурацию плоского квадрата. Приведем ещё несколько
примеров конкретных соединений, иллюстрирующих зависимость
геометрии комплекса от типа гибридизации.
Значком – – обозначены электронные пары, которые предоставлены лиган-
дами.
[Cu(NH
3
)
2
]
+
sp
линейная
3
d
4
p
4
s
4
d
[Zn(NH
3
)
4
]
2+
sp
3
тетраэдрическая
3d
4p
4s 4d
[Ni(CN)
4
]
2
-
dsp
2
квадратная
3d
4p
4s 4d
[NiCl
4
]
2
-
sp
3
тетраэдрическая
3d
4p
4s 4d
[Co(NH
3
)
6
]
3+
d
2
sp
3
октаэдрическая
3d
4p
4s 4d
[CoF
6
]
3
-
sp
3
d
2
октаэдрическая
3d
4p
4s 4d
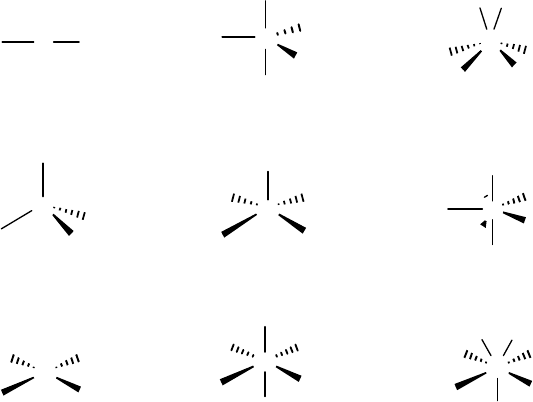
26
В целом, в зависимости от электронного строения комплексо-
образователя и природы лигандов, для комплексных соединений воз-
можны следующие конфигурации:
линейная,
тетраэдрическая,
квадратная,
тригональной бипирамиды,
квадратной пирамиды,
октаэдрическая,
тригональной призмы,
пентагональной бипирамиды,
одношапочной тригональной призмы,
тригональной призмы с тетрагональным основанием,
квадратной антипризмы,
додекаэдра,
гранецентрированной тригональной призмы.
Другие конфигурации могут встречаться, но менее часто.
Схемы некоторых перечисленных конфигураций приведены
ниже.
M
L
L
L
L
M
L
L
M
L
L L
L
L M
L
L
L
L
M
L
L L
L
L
L
M
L L
L
L
L
L
L
L
M
L
L
L
L
L
L
L
L
M
L
L
M
L
L L
L
L
L
L

27
Прочность химической связи возникающей между комплексо-
образователем и лигандами зависит от их поляризуемости, то есть
способности трансформировать свои электронные оболочки под
внешним воздействием.
Малополяризуемые комплексообразователи и лиганды назы-
вают «жесткими», а легкополяризуемые – «мягкими».
Поляризуемость зависит от размера частицы и количества
электроных слоев. Чем больше радиус и больше число электронных
слоев, тем легче протекает поляризация.
Сравнительная поляризуемость некоторых комплексообразо-
вателей и лигандов приведены в таблице 3.
Таблица 3.
СРАВНИТЕЛЬНАЯ ПОЛЯРИЗУЕМОСТЬ НЕКОТОРЫХ
КОМПЛЕКСООБРАЗОВАТЕЛЕЙ И ЛИГАНДОВ
УВЕЛИЧЕНИЕ «МЯГКОСТИ»
Комплексообразователи:
Na
+
, K
+
, Mg
2+
, Ca
2+
, Mn
2+
, Fe
3+
, Cr
2+
, Fe
2+
, Co
2+
, Ni
2+
, Cu
2+
, Zn
2+
, Cd
2+
, Pb
2+
, Hg
2+
Лиганды:
F
, OH
, H
2
O, Cl
, I
, Br
, R-COO
, R
3
-N, R-SH, CN
УВЕЛИЧЕНИЕ «ЖЕСТКОСТИ»
Таким образом, наиболее прочная связь устанавливается при
взаимодействии «мягкого» комплексообразователя с «мягкими» ли-
гандами. Следовательно, более «мягкими» лигандами в комплексном
соединении можно вытеснять более «жесткии» лиганды, а «мягкими»
комплексообразователями – «жесткие» комплексообразователи. Что
имеет важное практическое значение (см. раздел «Медицинское и
биологическое значение некоторых комплексных соединений»).

28
ВИДЫ ИЗОМЕРИИ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Комплексные соединения обладают способностью образовы-
вать изомеры, то есть соединения, имеющие одинаковый состав, но
разное строение и свойства. Для комплексных соединений возможны
следующие виды изомерии:
1. Геометрическая (цис-транс и мер-фас) изомерия. Этот вид
изомерии обусловлен различным расположением лигандов в коорди-
национном полиэдре.
Примеры:
Co
C
l
Cl
(
C
2
H
5
)
2
H
N
(C
2
H
5
)
2
HN
Co
C
l
NH(C
2
H
5
)
2
(
C
2
H
5
)
2
H
N
Cl
цис-форма транс-форма
Pt
H
2
N
H
2
N
N
H
2
N
H
2
C
H
3
H
CH
3
H
CH
3
C
H
3
H
H
Pt
H
2
N
H
2
N
N
H
2
N
H
2
H
CH
3
H
CH
3
CH
3
C
H
3
H
H
цис-форма транс-форма
Cr
O
H
2
N
NH
2
O
O
NH
2
Cr
O
H
2
N
O
H
2
N
O
NH
2
мер-форма
(меридиональный изомер)
фас-форма
(граневой изомер)
29
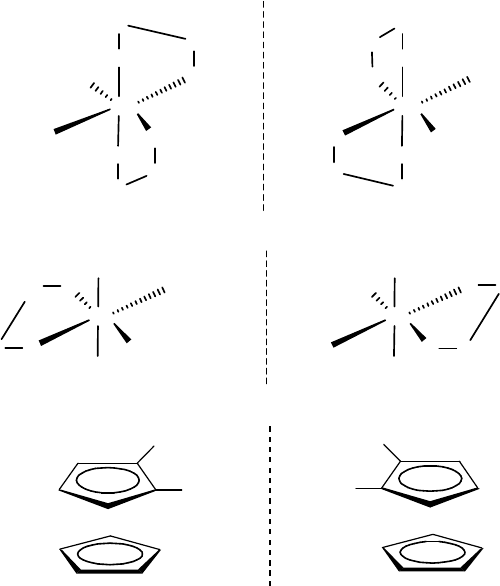
2. Оптическая изомерия. Такой вид изомерии может возни-
кать в ассиметричных комплексных соединениях, имеющих хираль-
ный центр, при этом изомеры соотносятся друг с другом как предмет
и его зеркальное отражение.
Примеры:
3. Сольватная изомерия связана с перераспределением моле-
кул растворителя между внешней и внутренней сферами. Если в каче-
стве растворителя выступает вода, то такой вид сольватной изомерии
называют гидратной.
Примеры:
[Cr(H
2
O)
6
]Cl
3
[Cr(H
2
O)
5
Cl]Cl
2
H
2
O,
[Co(en)
2
(H
2
O)Cl]Cl
2
[Co(en)
2
Cl
2
]ClH
2
O,
[Cr(py)
2
(H
2
O)
2
Cl
2
]Cl [Cr(py)
2
(H
2
O)Cl
3
]H
2
O.
Co
Cl
NH
2
NH
2
Cl
NH
2
H
2
N
Co
H
2
N
Cl
Cl
H
2
N
NH
2
H
2
N
CH
2
H
2
C
H
2
C
CH
2
CH
2
H
2
C
H
2
C
CH
2
Pt
H
2
N
NC
6
H
5
Cl
N
H
2
Cl
H
3
N
H
2
C
H
2
C
Pt
C
6
H
5
N
H
2
N
N
H
2
Cl
Cl
H
3
N
CH
2
CH
2
Fe
Fe
CH
3
H
3
C
COOH
HOOC
30
4. Ионизационная изомерия встречается только в комплексах
катионного типа и обусловлена различным распределением частиц
внешней сферы и лигандов.
Примеры:
[Pt(NH
3
)
4
Cl
2
]Br
2
[Pt(NH
3
)
4
Br
2
]Cl
2
,
[Pt(NH
3
)
4
Br]NO
2
[Pt(NH
3
)
4
(NO
2
)]Br
2
,
[Co(en)
2
(NCS)
2
]Cl [Co(en)
2
Cl(NCS)]NCS.
5. Связевая (солевая) изомерия. Подобная изомерия возможна
для комплексных соединений, имеющих в своем составе амбидентат-
ные лиганды. Связевая изомерия объясняется возможностью амбиден-
татных лигандов координироваться с комплексообразователем разны-
ми способами.
Примеры:
K
3
[Co(-ONO)
6
] К
3
[Co(-NO
2
)
6
],
[Pt(NH
3
)
2
(-NCS)
2
] [Pt(NH
3
)
2
(-SCN)
2
],
Na
3
[Ir(H
2
O)
3
(-SO
3
)
3
] Na
3
[Ir(H
2
O)
3
(-OSO
2
)
3
].
6. Координационная изомерия возникает в комплексных со-
единениях, которые состоят из комплексного катиона и комплексного
аниона, имеющих разные комплексообразователи. Обусловлен такой
вид изомерии различным распределением лигандов между комплек-
сообразователями катионного и анионного комплексов.
Примеры:
[Pt(NH
3
)
4
][Pd
II
Cl
4
] [Pd(NH
3
)
4
][Pt
II
Cl
4
],
[Co(en)
2
(ox)][Cr
III
(en)(ox)
2
] [Cr(en)
2
(ox)][Co
III
(en)(ox)
2
],
[Rh(en)
3
][Ir
III
Cl
6
] [Rh(en)
2
Cl
2
][Ir
III
(en)Cl
4
].
7. Координационная полимерия. Связана с возможностью об-
разования поликомплексных соединений, которые имеют одинаковый
состав, но разное химическое строение.
Примеры:
[Pt(NH
3
)
4
][Pt
IV
Cl
4
(OH)
2
] [Pt(NH
3
)
4
(OH)
2
][Pt
II
Cl
4
],
[Pt(NH
3
)
4
][Pt
II
(NH
3
)Cl
3
]
2
[Pt(NH
3
)
3
Cl]
2
[Pt
II
Cl
4
],
[Cr(H
2
O)
4
F
2
][Cr
III
(H
2
O)
2
F
4
] [Cr(H
2
O)
6
][Cr
III
F
6
].
