Лекции по минералогии
Подождите немного. Документ загружается.

Понятие о фазовых диаграммах.
Когда мы рассматривали определение минерала, то речь шла о твердом веществе со
структурой, имеющей дальний порядок. Порядок в расположении атомов отличает
твердое вещество от газа, жидкости, стекол, и т.д. Поведение твердых, жидких и
газообразных веществ в зависимости от внешних факторов (в первую очередь –
температуры и давления) отражено на фазовых диаграммах (или иначе – диаграммах
стабильности).
Фаза это однородная субстанция с совершенно определенными физико-
химическими характеристиками; фаза отделена от других фаз физическими
поверхностями раздела.
Минерал считается фазой
если он гомогенный, то есть
не имеет переменного
состава. Например, -кварц –
низкотемпературная фаза в
системе Si–O
2
(или SiO
2
);
кианит (Al[AlSiO
4
]O) –
высокобарическая фаза в
системе Al
2
O
3
–SiO
2
. Если же
минерал является твердым
раствором (например,
непрерывный ряд форстерит-
фаялит), то мы говорим о
смеси фаз.
Фаза может быть твердой, жидкой или газообразной (пример – лед, вода, пар).
Величины, при помощи которых может быть описано состояние системы,
называются параметрами. В свою очередь, они могут быть интенсивными и
экстенсивными.
Интенсивные параметры не зависят от размеров системы Т, Р, с (конц.), хим.
потенциал и т.д.
Экстенсивные масса m, объем V, теплосодержание и т.д.
Фазовая диаграмма для Н
2
О.
Думаю, что вам небесполезно будет знать фазовую диаграмму для H
2
O, которую мы
сейчас и рассмотрим.
Такие фазовые диаграммы в координатах «температура – давление» получили
называние РТ-диаграммы.
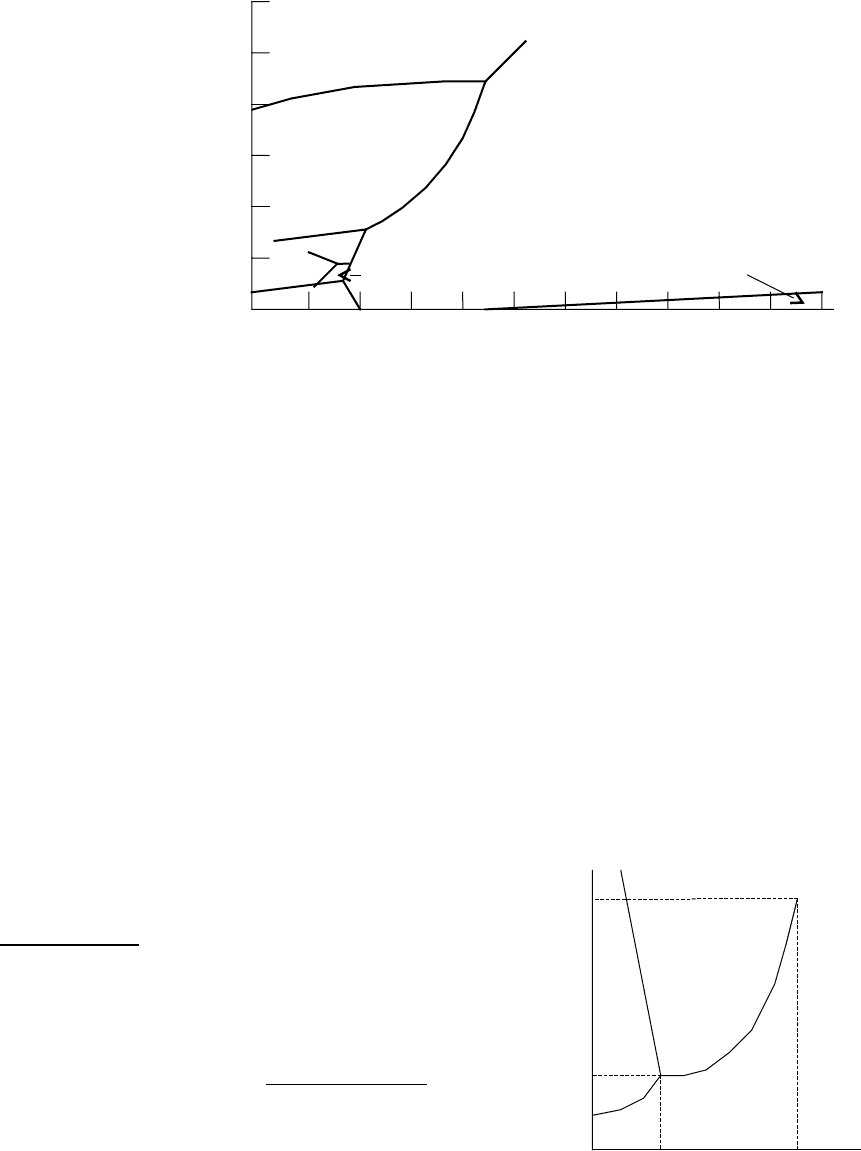
На фазовой диаграмме для Н
2
О видно, что при низких Т и высоких Р газ
конденсируется.
При низких температурах и различных давлениях образуются различные
полиморфные модификации льда. Мы привыкли видеть обычный лед I гексагональной
сингонии, однако на планетах группы Юпитера определенно при более высоких
давлениях существуют другие полиморфы.
Вдоль линий на диаграмме две фазы могут существовать
совместно в равновесии. Можете посмотреть, как ведет себя
точка замерзания воды при различных давлениях. Это
объясняет, почему под ледниками Антарктиды существуют
незамерзшие озера.
На диаграмме есть точки, в которых пересекаются три
линии – они так и называются «тройные точки». В них
сосуществуют сразу три фазы. В точке t – одновременно
присутствуют вода, пар и лед I. Вдоль линии tc вода и пар
1
30
20
10
0
-80 -40 0 40 80 120 240 360
Лед VII
Лед VI
Лед II
Лед I
V
III
Вода
Водяной пар
Р, кбар
Т,
о
С
221
0,006
бар
0,0099 374,3
о
С
t
c
a

сосуществуют, однако при росте Р и Т вода становится менее плотной (рост Т), а пар –
более плотным (рост Р).
Про критическую точку с говорить не буду, вы уже про нее все знаете, и что
существует при более высоких Т и Р – вы тоже догадываетесь.
Теперь разберемся с понятиями стабильность, метастабильность, нестабильность,
энгергия активации и равновесие.
Мы не будем сейчас писать формул, давайте попробуем понять эти явления на
интуитивном уровне. Вот кирпич. Если его положить плашмя – он стабилен. Если
попробовать его ставить на ребро или вершину, то, даже если вы добьетесь временного
успеха, он упадет при малейшем сотрясении (это состояние нестабильное). Наконец,
если поставить кирпич на грань с наименьшей площадью, он будет стоять, но его можно
уронить на грань большей площади, если затратить определенную энгергию. Это и есть
энергия активации, а состояние кирпича называется метастабильным.
Понятие равновесия – связано со временем. Например, если вода и лед сосуществуют
вместе, и при этом ни лед не тает, ни вода не замерзает, значит, они находятся в
равновесии. При неизменных Т и Р они могут находиться в таком состоянии сколь угодно
долго. Однако стоит только изменить любой из параметров (Т или Р), тут же равновесие
будет нарушено.
Если в образце мы не видем реакционных кайм между двумя соприкасающимися
минералами, мы можем сказать, что они вероятно были в равновесии в момент
образования. Однако это еще нужно доказывать методами более детальных исследований
(химия и теукстурный анализ). Наличие кайм свидетельствует о неравновесности
(например, гранат может быть отделен от биотита каймой хлорита).
При постановке экспериментов исследователи говорят о достижении равновесия
между фазами, если не происходит дальнейших изменений в течение определенного
промежутка времени (это могут быть часы, месяцы, и даже годы, в зависимости от
скорости исследуемой реакции и от терпеливости экспериментатора).
Теперь посмотрим, как выбирают компоненты системы, которая интересует.
Компонентами называют наименьшее число химических составляющих, с помощью
которых можно задать все составы фаз данной системы. Например, в примере с Н
2
О
компонентом является Н
2
О, а не Н
2
и О
2
. Для системы андалузит-силлиманит-кианит
компонент – Al
2
SiO
5
. Если мы хотим задать составы пироксенов в системе CaO-MgO-
FeO-SiO
2
, то компонентами будут CaSiO
3
-MgSiO
3
-FeSiO
3
, и так далее.
Основные правила, которым подчиняется состояние равновесной термодинамической
системы:
Принцип Ле-Шателье: если система, находящаяся в равновесии, подвергается
воздействию, изменяющему равновесие, то в системе происходит реакция,
противодействующая этому воздействию.
I закон Вант-Гоффа: нагревание благоприятствует развитию в системе процессов,
идущих с поглощением тепла, а охлаждение с выделением тепла. (Пример лед тает с
поглощением тепла).
II закон Вант-Гоффа: При повышении давления в системе протекают процессы,
ведущие к уменьшению объема, и наоборот.
Пример: Na[AlSi
3
O
8
] (Ab 100.2 cm
2
) NaAl[Si
2
O
6
] (Jad 61 cm
2
) + SiO
2
(Qu 22.7 cm
2
)
100.2 cm
2
> 83.7 cm
2
(61+22.7)
Правило фаз Гиббса.
Количество минералов, сосуществующее в равновесии и слагающее минеральную
ассоциацию (то есть породу) или продукты реакции в эксперименте не безграничны. Их
количество ограничено правилом фаз Гиббса, обычно записываемым как:
2

p+f=c+2, где p число фаз, f число степеней свободы в системе и c число
компонентов.
Выбор компонентов мы только что обсудили. Отметим только, что правило фаз
Гиббса включает в себя не произвольное число компонентов, а только необходимый для
описания системы минимум.
Пример с диаграммой для Н
2
О: тройная точка 0 степеней свободы в координатах Т и
Р, только в ней сосуществуют твердая, жидкая и газообразная фазы. Теперь проверим это
с правилом фаз Гиббса: f=c-p+2. Число компонентов 1 (Н
2
О), число фаз 3, f=1-3+2=0.
Такие точки на диаграммах называются инвариантными.
Точно так же вы можете проверить, что вдоль любой линии существует только одна
степень свободы, то есть это моновариантные (или унивариантные) линии.
В пределах какого-либо поля нельзя заранее сказать, какая температура будет при
данном давлении, у точки есть две степени свободы f=1-1+2=2. Такая область
называется дивариантной.
Очевидно, что наименьшее число степеней свободы 0. Если его подставить в
правило фаз Гиббса, то получим c-p+2=0 или c+2=p. Это означает, что если порода
находится в равновесии, в ней не может быть более, чем с+2 фаз. Поэтому, чем больше
минералов мы видим в породе, тем менее следует ожидать, что все они находятся в
равновесии.
Примеры фазовых диаграмм (диаграмм состояния).
В качестве осей
прежде всего интенсивные параметры!
Однокомпонентные диаграммы:
на вставке см. диаграммы для С, Al
2
SiO
5
, SiO
2
и CaCO
3
.
Двухкомпонентные диаграммы.
Двухкомпонентные диаграммы чаще всего строятся в координатах
температура состав (Т-Х). Они выглядят по-разному в зависимости от того, какие
отношения между компонентами: (1) полная смесимость между крайними членами с
образованием твердых растворов, (2) частичная смесимость с наличием разрыва, (3)
отсутствие смесимости.
Примеры диаграмм с полной смесимостью.
1. Форстерит-фаялит.
2. Альбит-анортит (высокотемпературная область).
Обе диаграммы есть результат экспериментов при атмосферном давлении, то есть 1
атм = 1,01325 бар. Иначе такие диаграммы еще называются ликвидусными, так как они
включают в себя жидкость расплав.
Такие диаграммы весьма конструктивны при разборе реакционных взаимоотношений
в магматических породах, а также последовательности кристаллизации из расплава.
Понятия ликвидус, солидус: все, что выше ликвидуса расплав, все, что ниже
солидуса твердое вещество, в промежутке жидкая и твердая фазы сосуществуют.
Примеры диаграмм с разрывом смесимости.
1. Альбит-анортит при низких температурах.
Разрывы перистеритовый разрыв, срастания Бёггилда, срастания Гуттенлокера.
Иризация лунного камня перистеритовый разрыв, ламелли An
0
An
25
.
Лабрадоризация An
45
An
58
.
3

2. Альбит-микроклин.
Пример диаграммы с очень слабой смесимостью при низких температурах и почти
полной смесимостью при высоких температурах. Причина разрыва ионные радиусы Na
+
(1.18) и K
+
(1.51) в координации 8.
Распад твердых растворов в этой системе (образование ламеллей распада пертитов)
обычное дело.
Для геологов имеет важное значение случай, если в эту систему добавить воду.
Следующая диаграмма для той же системы при P
H2O
=5 кбар. Повышение давления
препятствует смесимости, поэтому максимальная температура разрыва возрастает.
Однако присутствие воды чильно снижает температуры плавления. При 5 кбар
происходит смыкание максимума разрыва и минимума расплава. Эта точка известна как
эвтектическая.
Эвтектика это точка наименьшей температуры на ликвидусе уникальная тем, что в
ней расплав равновесно сосуществует с двумя полевыми шпатами. Это равновесие будет
находиться при неизменной температуре до тех пор, пока весь расплав не
раскристаллизуется. Совместное существование альбита и калишпата в виде крупных
кристаллов характерно для гранитов и гранитных пегматитов. Оно отражает, что оба
минерала кристаллизовались из обогащенного водой расплава. При этом пертиты и
антипертиты в этих минералах указывают на распад твердых растворов при дальнейшем
снижении температуры.
Примеры диаграмм с разрывом смесимости.
1. Альбит-анортит при низких температурах.
Разрывы перистеритовый разрыв, срастания Бёггилда, срастания Гуттенлокера.
Иризация лунного камня перистеритовый разрыв, ламелли An
0
An
25
.
Лабрадоризация An
45
An
58
.
2. Альбит-микроклин.
Пример диаграммы с очень слабой смесимостью при низких температурах и почти
полной смесимостью при высоких температурах. Причина разрыва ионные радиусы Na
+
(1.18) и K
+
(1.51) в координации 8.
Распад твердых растворов в этой системе (образование ламеллей распада пертитов)
обычное дело.
Для геологов имеет важное значение случай, если в эту систему добавить воду.
Следующая диаграмма для той же системы при P
H2O
=5 кбар. Повышение давления
препятствует смесимости, поэтому максимальная температура разрыва возрастает.
Однако присутствие воды чильно снижает температуры плавления. При 5 кбар
происходит смыкание максимума разрыва и минимума расплава. Эта точка известна как
эвтектическая.
Эвтектика это точка наименьшей температуры на ликвидусе уникальная тем, что в
ней расплав равновесно сосуществует с двумя полевыми шпатами. Это равновесие будет
находиться при неизменной температуре до тех пор, пока весь расплав не
раскристаллизуется. Совместное существование альбита и калишпата в виде крупных
кристаллов характерно для гранитов и гранитных пегматитов. Оно отражает, что оба
минерала кристаллизовались из обогащенного водой расплава. При этом пертиты и
антипертиты в этих минералах указывают на распад твердых растворов при дальнейшем
снижении температуры.
Примеры диаграмм при отсутствии смесимости между компонентами.
1. Альбит
кварц.
Простая диаграмма с эвтектическими взаимоотношениями. Если в кварц по-немногу
добавлять альбит, то температура плавления кварца снижается. Кристаллизация всегда
заканчивается в эвтектике.
4

2. Форстерит
кремнезем.
Диаграмма, когда между двумя крайними компонентами образуется промежуточное
соединение, а именно энстатит. Если состав системы менее 30% кремнезема, то при
кристаллизации мы не выйдем из точки р (точка перитектики) до тех пор, пока весь
форстерит не прореагирует с расплавом с образованием энстатита.
3. Еще одна диаграмма такого же типа, что и 2, лейцит
кремнезем.
Промежуточное соединение калишпат.
Из 2 и 3 мы видим, что равновесно могут сосуществовать форстерит
энстатит,
энстатит
кремнезем (кристобалит), лейцит
калишпат, калишпат
кремнезем
(тридимит). Запрещенные (или предельно неравновесные) ассоциации
форстерит
кварц и лейцит
кварц. То же самое касается нефелина.
Трех- и более компонентные диаграммы.
Так как почти все природные системы (магматические, метаморфические или
осадочные) состоят из 6-10 и более химических компонентов, то понятно, что одно- и
двухкомпонентные диаграммы имеют весьма ограниченное практическое применение.
Однако, графическое представление мультикомпонентных систем обычно ограничено
трехкомпонентными диаграммами (треугольниками составов). Возможно, вы
столкнетесь и с четырехкомпонентными диаграммами в виде тетраэдров, однако даже
такие построения становятся графически трудночитаемыми.
Треугольные фазовые диаграммы обычно используются в петрологии для
представления экспериментально изученных путей плавления и последовательностей
кристаллизации магматических пород.
1. Пример: форстерит
кремнезем
кальсилит.
Линии на этой диаграмме тоже моновариантны (посчитайте сами по правилу фаз).
Линии постоянных температур называются изотермами. Ликвидус представляет собой не
линию, а уже некую поверхность. Стрелки вдоль фазовых границ пути кристаллизации
при снижении температуры. Каждая сторона треугольника может быть представлена как
двухкомпонентная система (пример лейцит
кремнезем).
При изучении минералогических ассоциаций и типов пород часто используются
субсолидусные фазовые диаграммы.
2. Схематическое изображение в объеме трехфазной диаграммы
калишпат
альбит
анортит.
В основании лежит треугольник, показывающий фазовые отношения при
температурах 650, 750 и 900
о
С и давлении Р
Н2О
=1 кбар. Такой треугольник обычно
используется при описании твердых растворов полевых шпатов для различных
температур. Сравните этот треугольник с двухфазными диаграммами. Здесь мы видим,
что ряд плагиоклазов непрерывен. Однако, ранее я показал, что ниже 800
о
С в этом ряду
существуют три разрыва. Здесь они не показаны, потому что на момент экспериментов,
по которым строилась эта диаграмма, еще не существовало технических возможностей,
позволяющих зафиксировать сверхтонкие ламелли распада в плагиоклазах.
3. Другая очень часто используемая треугольная диаграмма взаимоотношение
минералов в семействе пироксенов волластонит
ферросилит
энстатит. Эта
диаграмма построена на основании тысяч анализов сосуществующих природных
пироксенов, поэтому она не дает представления о поведении их в высоко- и
низкотемпературной областях (например, пироксены в базальтах и габбро). Эта
диаграмма показательна только при оценке степеней растворимости при образовании
твердых растворов пироксенов. Здесь вы хорошо видите разрыв смесимости между
клино- и ортопироксенами.
Подобные треугольные диаграммы также широко применимы для описания составов,
например, минералов группы оливина и семейства амфиболов.
5

Трехкомпонентные диаграммы могут также использоваться для иллюстрации
ссосуществующих пар минералов или групп из трех минералов. Такие диаграммы
получили название парагенетических.
4. Пример парагенетической диаграммы в системе SiO
2
NaAlSiO
4
(нефелин) KAlSiO
4
(кальсилит) при Т=1000
о
С.
Эта диаграмма важна для магматических пород, так как показывает, что в
недосыщенных кремнеземом ассоциациях равновесного кварца (тридимита,
кристобалита) быть не может.
Пока мы рассматривали только треугольные диаграммы. Однако, петрологи часто
пользуются треугольниками, в которых группируют некоторые минералы попарно в
каком-либо углу, чтобы проиллюстрировать более сложные многокомпонентные
системы. Для примера приведу две диаграммы CaOAl
2
O
3
MgO+FeO для базальта (Р=1-2
кбар, Т=1000-1200
о
С) и для эклогита (Р=12-30 кбар, Т=400-800
о
С).
Еще более сложные диаграммы вы можете увидеть при иллюстрации
взаимоотношений в метаморфических породах. И, наконец, поскольку химизм многих
пород слишком сложен для графического представления парагенезисов, вместо этого
используются математические отношения.
Диаграммы для систем, содержащих СО
2
и Н
2
О.
До этого мы рассматривали Р-Т диаграммы для полиморфных модификаций или
реакций между минералами, не содержащими летучих. Однако экспериментально можно
также установить, например, области стабильности водосодержащих минералов и их
безводных продуктов реакций.
1. Антофиллит энстатит + кварц + Н
2
О.
Mg
7
Si
8
O
22
(OH)
2
7MgSiO
3
+ SiO
2
+ H
2
O, вода уходит во флюидную фазу. Система
может быть задана как MgOSiO
2
H
2
O.
2. Кальцит СаО + СО
2
и кальцит + кварц волластонит + СО
2
.
Видно, что кальцит в системе СаОСО
2
устойчив до 1000
о
С, однако добавление SiO
2
приводит к резкому снижению устойчивости кальцита до 500-600
о
С.
Для анализа отношений между минералами в метаморфических породах часто
используются составные РТ-диаграммы, которые позволяют выделять сосуществующие
ассоциации для заданных систем.
3. Реакционные взаимоотношения в метаморфических породах.
Линии реакций: Al
2
SiO
5
, кальцитарагонит, альбит = жадеит + кварц, мусковит +
кварц = калишпат + силлиманит, антофиллит = энстатит + кварц.
В заключение напомню вам, что для описания экзогенных реакций используются
диаграммы, которые вы уже привыкли видеть на химии, или которые зачастую более
знакомы химикам, чем геологам. Это диаграммы EhpH (окислительный потенциал и
отрицательный логарифм концентрации ионов водорода).
Строение и химизм минералов.
I. Кристаллические структуры минералов.
Эта часть должна быть в основном восстановлена в вашей памяти по материалам
курсов кристаллографии и химии. Мы отметим сейчас лишь самое основное.
1. Когда делалось определение, что такое минерал, речь шла о том, что одной из
важнейших характеристик в этом понятии является его структура т.е. строение
6
кристаллической решетки минерала. Вспомним, что в кристаллической решетке
выделяются узлы т.е. точки, в которых располагаются материальные частицы атомы,
ионы, иногда группа частиц; узлы соединяются в ряды совокупность материальных
точек на прямой линии; и в плоские сетки совокупность тех же точек на плоскости.
Как на кристалле? Вершина узел, ребро ряд, грань плоская сетка.
Чем характеризуется каждая кристаллическая структура? Параметрами элементарной
ячейки т.е. той наименьшей единицы решетки, повторяемость которой дает
возможность построить всю решетку. В зависимости от симметрии кристалла параметры
ячейки будут различны в кубической сингонии достаточно одного, в сингониях средних
категорий двух (а и с), в ромбической -трех, а в низших еще надо учитывать и углы
между осями.
Теперь важнейший момент, который необходимо помнить, что реальная структура
минерала это совокупность не математических точек, а реальных частиц, имеющих
объем, и потому размещение их в пространстве непременно это учитывает. Как
располагаются частицы, так и определяются типы кристаллических структур минералов.
Первое, с чем мы столкнулись, когда начали смотреть минералы, это плотнейшая
упаковка частиц. Вспомним, что ПУ возможна для частиц одинакового размера, что
возможны два способа упаковки ПКУ и ПГУ (пример самородные металлы).
При ПУ заполненным оказывается 3/4 объема, а 1/4 объема приходится на пустоты,
которые бывают двух сортов тетраэдрические и октаэдрические. Соотношение этих
пустот выражается так: при общем числе шаров в упаковке n окт. пустот будет тоже n, а
тетр. 2n. В соединениях с мотивом ПУ в этих пустотах могут располагаться маленькие
частицы, диаметр которых позволяет им там «поселиться». При этом, конечно, эти
маленькие частицы будут полярны по знаку крупным, образующим упаковку, так, чтобы
в целом структура была электронейтральной. В минералах такими крупными частицами
обычно являются анионы, а маленькими, заполняющими пустоты катионы, исходя из
представления об объеме заряженных ионов (в классическом выражении).
Очень важным является при таком заселении число ближайших соседей
противоположного знака то, что называют координационным числом КЧ. При
заселении тетраэдрической пустоты маленький ион будет иметь 4 больших ближайших
соседа следовательно, КЧ=4. Для октаэдрической пустоты КЧ=6. В металлах КЧ=12.
В NaCl все окт. пустоты заселены, соотношение Na:Cl=1, значит, КЧ
(Na)
=6, КЧ
(Cl)
=6.
Возможны более сложные случаи заполнения пространства в кристаллической
структуре, и поэтому КЧ могут быть равны 8, а иногда 3, и даже 2.
В реальных случаях число заселяемых пустот и какие именно пустоты будет
зависеть не только от размеров частиц, но и определяться типом соединения, характером
связи, которую они могут образовать, и, кроме того, зависит от термодинамических
условий. Как зависит?
Влияние Т. Повышение Т ведет к расширению, разрыхлению вещества. Значит, если
вещество одно и то же! способно образовывать различные структуры полиморфные
модификации, то при больших Т оно будет давать структуры с меньшим КЧ.
Когда речь шла о парагенезисе, мы рисовали диаграмму для соединения Al
2
SiO
5
(общий состав) андалузит-силлиманит-кианит.
Так вот. Минерал андалузит, образующийся при более низких Т и Р, чем другие, будет
иметь формулу Al
V
Al
VI
[SiO
4
]O.
Более высокотемпературный силлиманит будет иметь формулу Al
VI
[Al
IV
SiO
5
]
понижение координации части Al с 5 до 4!
А что будет с увеличением давления? Влияние давления будет обратным по сравнению
с влиянием температуры: увеличение давления повышает КЧ (!). Кианит минерал,
образующийся при высоких Р, содержит Al весь с КЧ=VI: Al
VI
2
[SiO
4
]O.
Другой пример: при повышении давления альбит Na[Al
IV
Si
3
O
8
] становится
неустойчивым и переходит в жадеит NaAl
VI
[Si
2
O
6
], координация Al меняется с 4 до 6.
7
Теперь об изображении структур. Возможно изображение в виде шариковых моделей
каждая материальная частица в виде шарика, расстояния между ними увеличены (т.е.
дается без учета объемных соотношений), а кроме того возможно полиэдрическое
изображение центры материальных частиц принимаются за точки, которые при их
соединении образуют полиэдр тетраэдр, куб, октаэдр, треугольник, более сложные с
КЧ=7 трехгранная призма с полуоктаэдром, КЧ=12 кубоктаэдр.
Какие возможны типы кристаллических структур? Заполнение кристаллического
пространства может быть различным, и структуры могут быть очень разные, но среди них
мы будем различать 5 основных типов.
I. Координационные структуры представляют собой ПУ либо одинаковых частиц,
либо крупных анионов с мелкими катионами в пустотах. В них распределение частиц
определяется целиком координацией их друг с другом в зависимости от размеров и знака,
и нет каких-либо обособленных элементов структуры, или каких-либо
преимущественных направлений при формировании структуры. С чем это связано?
Характер связи между элементами структуры одинаковый. Сюда будет относиться
большинство минералов с преобладанием ионного типа связи.
II. Структуры островные можно выделить обособленные элементы структуры,
«острова». Например, замкнутые молекулы серы S
8
. Такие структуры характеризуются
различной связью между структурными единицами внутри «островов» и между
«островами». В сере самородной внутри молекул связь ковалентная, а между молекулами
остаточная. Бывают «острова» очень сложно построенные: в силикатах они нередко
имеют вид тройных, четверных, шестерных колец из кремнекислородных тетраэдров
SiO
4
. Например, берилл с островом в виде шестерного кольца [Si
6
O
18
].
III. Цепочечные и ленточные структуры составляющие их элементы бесконечно
повторяются в одном направлении. Пример: пироксены, амфиболы.
IV. Слоистые структуры характеризуются двухмерной повторяемостью мотивов с
образованием слоя. Пример: графит, молибденит, слюды.
V. Каркасные структуры в этих структурах повторяющиеся элементы связаны
между собой так, что получается очень сложная трехмерная постройка каркас. Пример:
полевые шпаты, кварц.
Для чего нам все эти типы структур нужны? Для понимания свойств, поскольку они
обязательно в свойствах проявляются, и вместо запоминания будет понимание, почему
минерал обладает теми или иными свойствами, и каких свойств от него можно ожидать.
Как типы структур проявляются в свойствах?
Морфология.
Минералы со слоистой структурой кристаллы пластинчатого, уплощенного облика.
С цепочечной и ленточной структурой удлиненный облик. Это понятно.
Однако, какую будут иметь форму минералы со структурой I типа? Очевидно, скорее
всего изометричного облика для структур с ПКУ (ромб. или куб. сингонии) и кристаллы
призматические, но тоже большей частью изометричные для структур с ПГУ (триг. или
гекс. сингонии).
Минералы с островной и каркасной структурами тоже дают более-менее изометричные
кристаллы ромбической или кубической сингоний.
С типами структуры будут связаны и такие свойства как спайность и плотность. Это
очень наглядно для структур цепочечных, ленточных и слоистых спайность будет
проходить вдоль этих элементов структур. А с плотностью дело обстоит так если
сравнивать минералы, близкие по химическому составу, то более плотными окажутся те,
что имеют структуру I типа координационную, или наиболее близкую к нему
островную; наименее плотны минералы с каркасной структурой.
Пример: Альбит Na[Al
IV
Si
3
O
8
] каркасн., d=2.6 жадеит NaAl
VI
[Si
2
O
6
] цепочечн., d=3.3.
Далее, необходимо познакомиться (или вспомнить) еще несколько понятий,
необходимых для понимания курса и связанных со структурами и химизмом минералов.
8

1. Полиморфизм и политипия: полиморфизм способность веществ одного
химического состава кристаллизоваться с образованием разных кристаллических
структур, с различными полями устойчивости.
В чем могут проявляться различия структур?
1) В изменении КЧ одной и той же структурной единицы в зависимости от РТ условий
(см. пример с дистеномсиллиманитомандалузитом).
2) В изменении типа плотнейшей упаковки: при одном и том же КЧ сфалерит ПКУ и
вюртцит ПГУ.
3) Может меняться угол поворота некоторых структурных групп: кварц- Si-O-Si=160
o
,
кристобалит- Si-O-Si=180
o
.
Структурная перестройка может происходить при сохранении внешней формы
первоначальной модификации, в этом случае возникают параморфозы. Пример: тот же
кварц параморфоза тригонального -кварца по высокотемпературному гексагональному
-кварцу.
Говоря о полиморфизме, вспомним, что переходы или полиморфные превращения
могут быть энантиотропными, когда переход возможен в обе стороны при
соответствующем изменении температуры, и монотропными однонаправленными. Это
обычно связано с энергией решетки, потому что всякая перестройка решетки это
энергетические затраты. Такая перестройка тем легче, чем слабее связи в
перестраиваемой структуре. Здесь снова придется вспомнить про метастабильное
состояние, когда скорости перехода так малы, что вещество длительное время
сохраняется в прежней структуре в условиях, неравновесных для этой структуры.
И, наконец, с полиморфизмом тесно связано понятие «политипия». Что это такое, в
чем сущность? В некоторых случаях энергетические различия между структурами
оказываются так малы, что переход одной структуры в другую происходит не скачком, а
постепенно, и при одних и тех же Т и Р могут сосуществовать несколько структурных
разновидностей одного состава.
Такие явления наиболее типичны для минералов со слоистой структурой в них
различие будет выражаться лишь небольшим сдвигом слоев относительно друг друга.
Т.Е. у них два параметра ячейки будут одинаковы, а третий будет очень незначительно
отличаться. Мы уже сталкивались с этим явлением у графита два политипа:
1) с чередованием слоев типа АВ/АВ гексагональный тип 2H, чередование через слой,
период повторяемости 2;
2) с чередованием слоев типа АВС/АВС ромбоэдрический политип 3R, чередование,
когда лишь четвертый слой окажется под первым.
Следующее понятие уже будет касаться не столько структуры минералов, сколько их
химизма. Это понятие об изоморфизме.
2. Изоморфизм замещение ионами, атомами или молекулами друг друга в
кристаллической решетке с сохранением исходной кристаллической структуры. Это
понятие было введено в 1819г. Э. Митчерлихом.
В тех случаях, когда замена одного сорта частиц в структуре на другие частицы может
идти неограниченно, говорят о полном (совершенном) изоморфизме: наблюдается
полный переход от одного члена изоморфной смеси к другому. У нас уже был такой
пример золото и серебро. Они способны смешиваться в любых пропорциях, и это
отлично выражается графически непрерывной линией:
Au Ag
Промежуточное вещество с различным соотношением исходных членов называют
изоморфной смесью или твердым раствором. При этом разница ионных радиусов, как
правило, не должна превышать 15%.
9

Гораздо больше случаев, когда полный изоморфизм невозможен. Тогда говорят об
ограниченном (неполном, несовершенном) изоморфизме. Пример: изоморфное
вхождение Fe в сфалерит ZnS. Нет непрерывного ряда ZnS-FeS, лишь какое-то, и при том
незначительное, количество железа может безболезненно для структуры сфалерита
входить в него, а дальше нельзя, у исходных членов разная структура, и дальнейшее
вхождение Fe будет «ломать» структуру сфалерита. Если структуры различны, говорят о
направленности (полярности) изоморфизма. Так, железо в сфалерит входит, а загнать
цинк в структуру троилита или пирротина этого в природе не случается.
2. Изоморфизм замещение ионами, атомами или молекулами друг друга в
кристаллической решетке с сохранением исходной кристаллической структуры. Это
понятие было введено в 1819г. Э. Митчерлихом.
В тех случаях, когда замена одного сорта частиц в структуре на другие частицы может
идти неограниченно, говорят о полном (совершенном) изоморфизме: наблюдается
полный переход от одного члена изоморфной смеси к другому. У нас уже был такой
пример золото и серебро. Они способны смешиваться в любых пропорциях, и это
отлично выражается графически непрерывной линией:
Au Ag
Промежуточное вещество с различным соотношением исходных членов называют
изоморфной смесью или твердым раствором. При этом разница ионных радиусов, как
правило, не должна превышать 15%.
Гораздо больше случаев, когда полный изоморфизм невозможен. Тогда говорят об
ограниченном (неполном, несовершенном) изоморфизме. Пример: изоморфное
вхождение Fe в сфалерит ZnS. Нет непрерывного ряда ZnS-FeS, лишь какое-то, и при том
незначительное, количество железа может безболезненно для структуры сфалерита
входить в него, а дальше нельзя, у исходных членов разная структура, и дальнейшее
вхождение Fe будет «ломать» структуру сфалерита. Если структуры различны, говорят о
направленности (полярности) изоморфизма. Так, железо в сфалерит входит, а загнать
цинк в структуру троилита или пирротина этого в природе не случается.
Далее, различают изоморфизм изовалентный когда замещающие друг друга ионы
одинаковой валентности (те же Zn и Fe в сфалерите), и гетеровалентный когда
замещающие друг друга ионы различны по валентности. Вот тут появляются разные
возможности, чтобы сохранялась общая электронейтральность.
1) Парный изоморфизм. Замена одного иона другим ведет к параллельной замене
пары других ионов, с тем, что общий заряд сохраняется. Пример: ряд Ab-An (см. в ряду
Боуэна) Na[AlSi
3
O
8
] (Na
+
Si
+4
) Ca[Al
2
Si
2
O
8
] (Ca
+2
Al
+3
).
2) Твердые растворы вычитания. Возможна замена частиц не одна на одну, а в иной
пропорции. Пример: В галенит иногда входит Bi. Как идет замена? По схеме 2Bi
+3
3Pb
+2
т.е. вместо трех узлов решетки, занятых Pb
+2
, оказываются заняты лишь 2 узла решетки,
но трехвалентным Bi. Т.е. в структуре оказываются не все места заняты, не всё
пространство заполнено. Поэтому тв. р-ы вычитания (!).
3) Твердые растворы внедрения. Иногда при этом возможен другой расклад: чтобы
более высоковалентный ион, входящий в структуру вместо более низковалентного,
компенсировать по заряду, в структуру входят дополнительные частицы
противоположного знака. Получается прибавление, более плотное заселение
структурного пространства. Пример: флюорит CaF
2
. При вхождении Y
+3
Ca
+2
избыточный заряд компенсируется внедрением дополнительного F. А куда ему
внедряться-то? Дело в том, что в структуре CaF
2
крупными являются ионы Са, они
образуют структуру типа ПКУ, F находится в тетраэдрах, а при вхождении Y F занимает
и часть октаэдрических позиций.
10
