Коробкова О.И. Пособие по выполнению контрольных работ по физической химии
Подождите немного. Документ загружается.

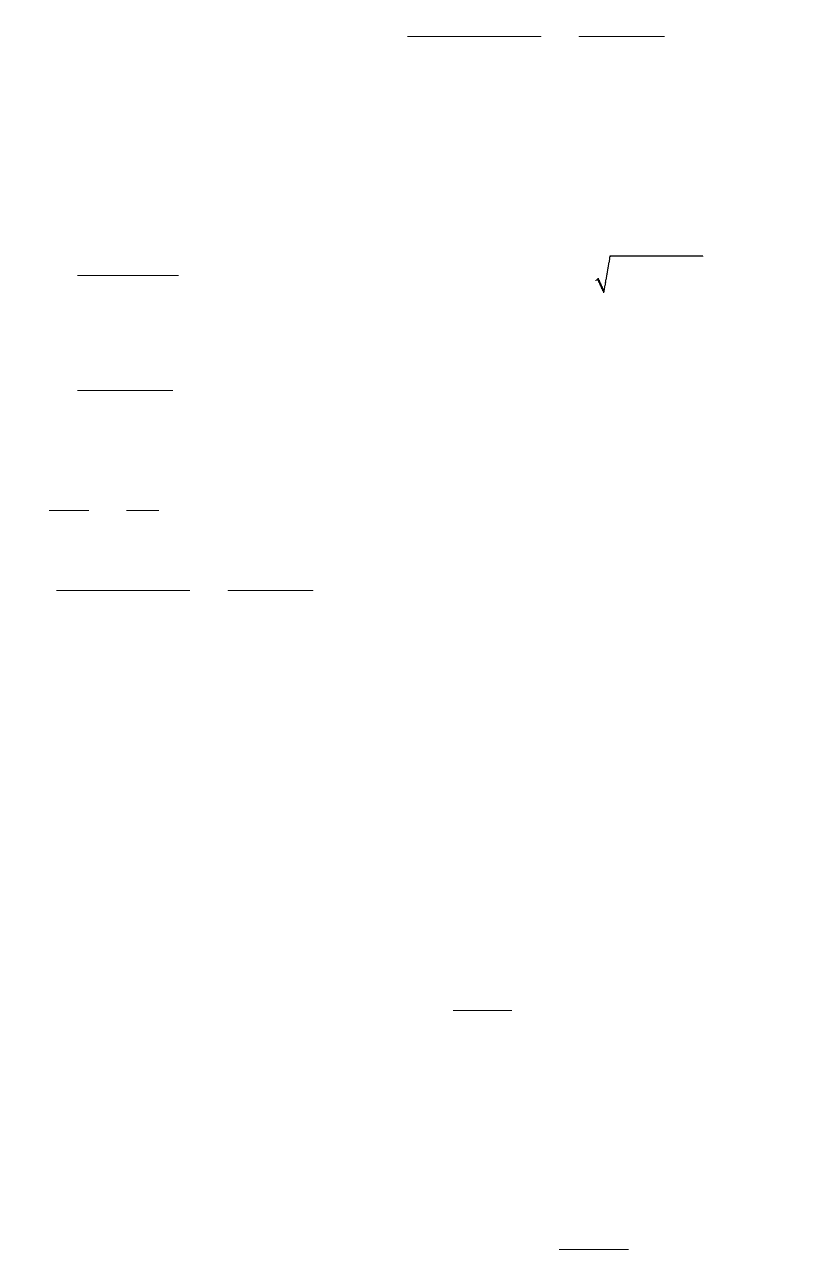
ПР
AgBr
= 2 1
-13
(моль/л)
2
E - ?
Решение:
ПР
AgCl
= 1 10
-10
(моль/л)
2
5
2
4 7
4,5 10
8,314 298 1 10
ln 7,967 10
1 9,648 10
E
ПР
AgBr
= 2 1
-13
(моль/л)
2
ПР
соли
= S
b
+
b
b
AgCl
Ag
+
+ Cl
-
b = 1 = 1
AgBr
Ag
+
+ Br
-
b = 1 = 1
S
b
+
=
ПР
AgCl
b
b
; S
2
(AgCl) = 110
-10
(моль/л)
2
;
10
1 10S
= 1 10
-5
моль/л
С (AgCl) = 1 10
-5
моль/л
S
b
+
=
AgBr
ПР
b
b
; S
2
(AgBr) = 2 1
-13
(моль/л)
2
; S = 4,5 10
-7
моль/л
C (AgBr) = 4,5 10
-7
моль/л
1
ln
2
a
RT
E
nF a
n = 1 Ag
+
+ e
Ag
5
2
4 7
4,5 10
8,314 298 1 10
ln 7,967 10
1 9,648 10
E
в
Ответ: Е = 7,9710
-2
в.
№ 167. Указания: см. задачу 154 выше.
№ 167. Определить константу равновесия реакции, протекающей при 25
о
С в
элементе Zn|Zn
2+
(а =1)||Cu
2+
(a=1)| Cu. Э.д.с. данного элемента равна 1,1 В.
Дано:
t=25
o
C = 298 K
E
цепи
= 1,1 В
Zn|Zn
2+
а =1
Cu |Cu
2+
a=1
К равновесия - ?
Решение: Решаем уравнение
lg
0,059
n E
K
при Т = 298 K
lg K = 2 1,1/0,059 = 37,288
K = 1,94.
Ответ: K = 1,94.
№ 168. Указания : Следует сначала вычислить концентрации ионов
водорода как в зад 151. По уравнению
2
1
C
K
D
можно найти , решив
квадратное уравнение:
2
С + К
D
- К
D
= 0 (только положительный корень
имеет смысл для данной задачи). Зная , можно вычислить концентрацию
51

водородных ионов [H
+
] и далее водородный показатель рН = - log [H
+
].
Концентрацию ионов водорода надо вычислить для обоих полуячеек. Затем
вычислить э.д.с. как в № 155.
Электродвижущую силу концентрационного элемента следует искать по
уравнению вида:
1
ln
2
a
RT
E
nF a
.
2
1
2
0,05
-4
1,77 10 =
1
-4 -4 2
1,77 10 1,77 10 0,05
2 -4 -4
0,05 +1,77 10 1,77 10 0
C
K
D
Для упрощения можно принять активности а
1
и а
2
равными концентрациям.
№ 168. Какова э.д.с. цепи:
Диффузионный потенциал не принимать во внимание. Константа
диссоциации муравьиной кислоты равна 1,77 10
-4
, а уксусной – 1,8 10
-5
.
Дано:
с
1
= 0,05 М
с
2 =
0,10 М
K
D
(HCOOH) = 1,77 10
-4
K
D
(CH
3
COOH) = 1,8 10
-5
E -?
Решение:
Применим формулу для расчёта ЭДС, составленную на основании уравнения
Нернста:
1
ln
2
c
RT
E
nF c
, где с
1
и с
2
– концентрации ионов водорода в
муравьиной и уксусной кислотах соответственно.
1. По уравнению
2
1
C
K
D
можно найти , решив квадратное уравнение:
2
С + К
D
- К
D
= 0 (только положительный корень имеет смысл для
данной задачи).
водородный
электрод
0,05 М
муравьиная
кислота
0,10 М
уксусная
кислота
водородный
электрод
52
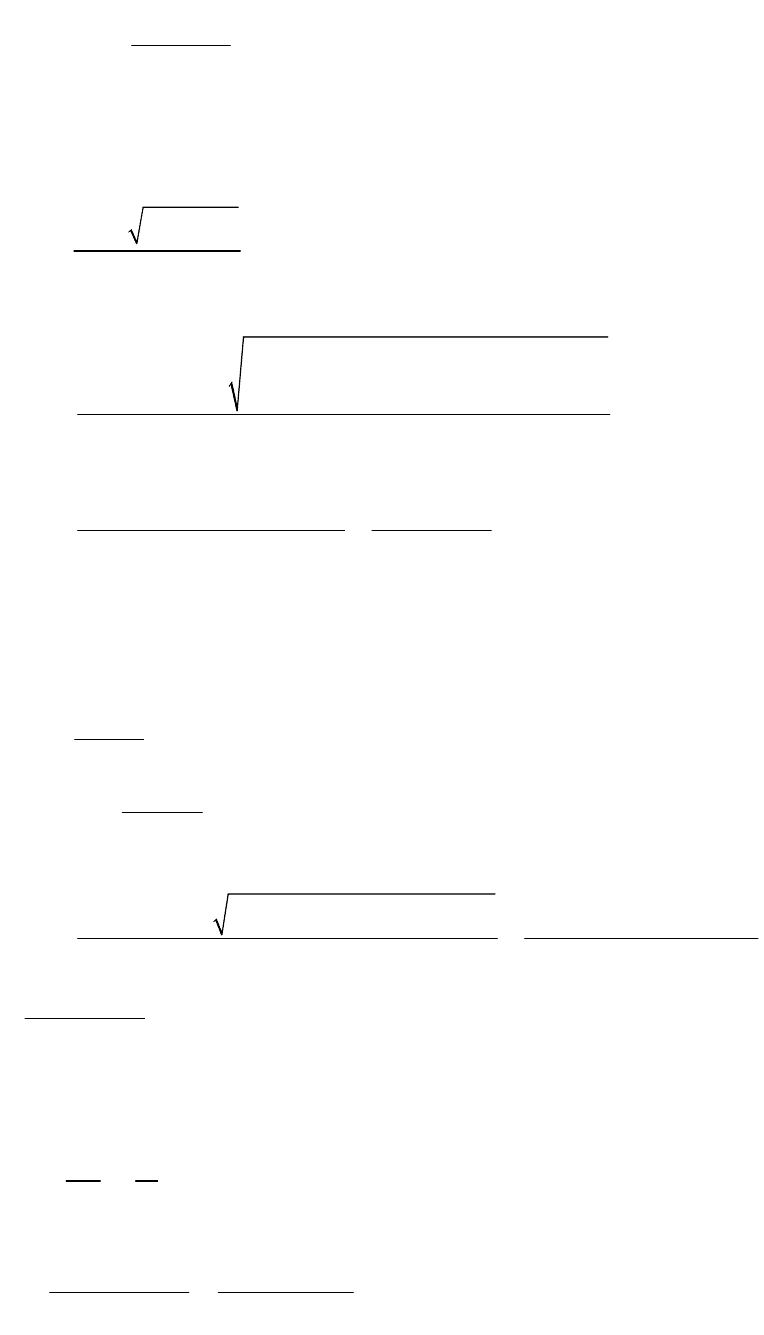
2
0,05
-4
1,77 10 =
1
-4 -4 2
1,77 10 1,77 10 0,05
2 -4 -4
0,05 +1,77 10 1,77 10 0
Полученное уравнение имеет вид: ах
2
+ вх + с = 0 и решается
2
4
1,2
2
2 -4 -4
0,05 +1,77 10 1,77 10 0
2
-4 -4 -4
1,77 10 1,77 10 4 0,05 1,77 10
1,2
2 0,05
-4 3 3
1,77 10 5,95 10 5,77 10
2
5,77 10
1,2
0,1 0,1
b b ac
х
a
1
= 5,77 10
-2
Отрицательное значение смысла не имеет.
Находим концентрацию ионов водорода в НСООН: С
ион
= С
С
1
= 0,05 5,77 10
-2
= 0,288510
-2
2. Находим концентрацию ионов водорода в СН
3
СООН:
2
1
C
K
D
2
0,1
-5
1,8 10
1
2 -5 -5
0,1 1,8 10 1,8 10 0
-5 10 -5
-5 3
1,8 10 3,24 10 0,72 10
-1,8 10 2,7 10
1,2
0,1 0,1
3
2,68 10
2
2,68 10
0,1
= 2,68 10
-2
С
ион
= С
С
ион
= 2,68 10
-2
0,1= 2,68 10
-3
3.
1
2
ln
cRT
E
nF c
, где с
1
и с
2
– концентрации ионов водорода в муравьиной и
уксусной кислотах соответственно.
2
8,314 298 0,289 10
3
ln 1,8 10
4 3
1 9,648 10 2,68 10
Е
в
Ответ: ЭДС элемента составит: 1,810
-3
в.
№№ 169 – 174. Указания: Вычисления проводятся по формулам:
53
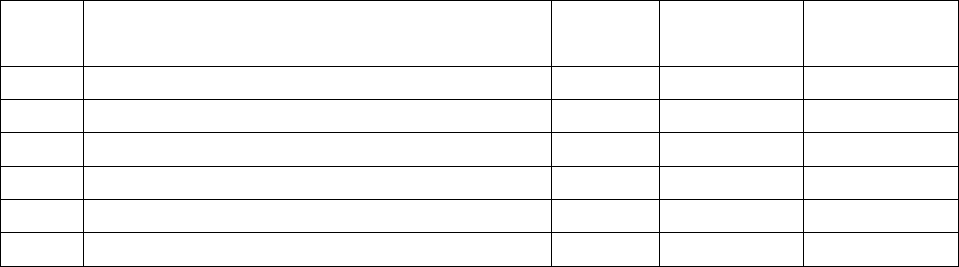
∆F = -nFE; ∆S = nF(dE/dT), ∆H = ∆F + T∆S
где ∆F - энергия Гельмгольца, F – число Фарадея, ∆S – энтропия, ∆H –
энтальпия, Т – температура термодинамическая.
Энергия Гельмгольца (энергия Гиббса) - это часть внутренней энергии,
которую система может отдать окружающей среде. Именно поэтому её
называют «свободной». Остальная часть внутренней энергии системы,
равная теплоте её нагрева от абсолютного нуля до Т
к
, остаётся в системе и не
может быть использована вне системы, в данном случае для передачи
теплоты из системы в окружающую среду. Оставшаяся часть энергии как бы
«заперта» в системе, поэтому её называют связанной энергией. Связанная
энергия контролируется энтропией системы.
№ 169 – 174. По данным таблицы рассчитать изменение термодинамических
функций ∆H, ∆F, ∆S в реакциях, протекающих в гальванических элементах.
№№ Реакция Т
о
С Э.д.с., В (dE/dT)р
В/град
169 Zn + 2AgCl = ZnCl
2
+ 2Ag 0,0 1,015 -4,0210
-4
170 Cd + PbCl
2
= CdCl
2
+Pb 25,0 0,1880 -4,810
-4
171 Ag +1/2Hg
2
Cl
2
= AgCl + Hg 25,0 0,0455 6,810
-4
172 Pb + PbO
2
+2H
2
SO
4
=PbSO
4
+2H
2
O 25,0 2,04 1,3610
-3
173 Zn + 2AgO = ZnO +Ag
2
O 25,0 1,83 5,710
-5
174 Zn + CuSO
4
= Cu + ZnSO
4
25,0 1,099 -4,310
-4
№ 172
Дано:
t
o
C = 25
o
C = 298K
E (эдс) = 2,04 в
dE/dT = 1,3610
-3
В/град
∆H - ? ∆F -?
∆S - ? ∆G - ?
Решение:
Pb + PbO
2
+2H
2
SO
4
=PbSO
4
+2H
2
O
Расчет ведём по уравнению Гиббса – Гельмгольца ∆F = -nFE, где n – число
электронов, участвующих в суммарных реакциях.
F – число Фарадея 96500 кл
Pb
o
– 2e = Pb
2+
∆F = -2 96500 2,04 = -393720 Дж/моль
∆S определим по формуле: ∆S = nF(dE/dT)
∆S = 2 96500 1.36 10
-3
= 262,48 Дж/мольК
∆H определим по формуле: ∆H = ∆F + T∆S
∆H = -393720 Дж/моль +262,48 Дж/мольК298 = -315500,96 Дж/моль
∆G = -315500,96 – 262,48 298= - 393720 Дж/моль
Ответ: ∆F = -393720 Дж/моль
54

∆G = -393720 Дж/моль
∆H = -315500,96 Дж/моль
∆S = 262,48 Дж/мольК
№ 175,176. Указания: Вычисления проводятся по формуле: W = nFE.
№ 175. Вычислить максимальную работу обратимой реакции, выразив её в
джоулях и калориях, протекающей в элементе:
Cu|Zn|1 н ZnSO
4
||1 н CuSO
4
|Cu. Стандартная э.д.с. равна 1,1 В.
Решение
Для решения задачи используем формулу: W = nFE.
W - полезная работа
n – число электронов, участвующих в реакции
F – 96500 Кл ( число Фарадея)
Zn + CuSO
4
= Cu + ZnSO
4
ЭДС элемента будет представлять собой разницу между потенциалами
электродов: E = E
o
Cu/Cu2+
- E
o
Zn/Zn2+
E = 0,337-(-0,763) = 1,1 В
n =2
W = 2 96500 1,1= 212300 Дж
1калория = 4,184 Дж
W= 212300/4,184 = 50740,917 кал = 50,74 ккал
Ответ: W= 50,74 ккал.
№ 177-181. Указания: Энергия активации Е вычисляется из уравнения
Аррениуса:
1 1
2
ln
1 2 1
k
E
k R T T
№ 177-181. Вычислить энергии активации химических реакций по данным о
константах скоростей, k, при разных температурах Т, указанных в таблице
№№ Уравнение реакции Т, К k
177 C
2
H
5
Br
C
2
H
4
+ HBr 750 4,53910
-
3
800 4,14010
-
2
178 N
2
O
4
2NO
2
300 3,28810
6
330 2,39810
7
179 H
2
+ I
2
2HI 520 0,243
10
-
3
560 5,610
10
-
2
180 2NO
2
2NO
+ O
2
350 1,11910
-
4
55

390 7,49910
-
3
181 CH
4
+ H
2
O
CO + 3H
2
1023 2,810
-3
1323 2,410
-2
№ 179
Энергия активации Е вычисляется из уравнения Аррениуса:
1 1
2
ln
1 2 1
k
E
k R T T
Отсюда
Е =
2
2,3 lg
1
1 1
1 2
k
R
k
T T
;
2
5,610 10
2,3 8,314 lg
3
0,243 10
1 1
520 560
Е
2 3
2,3 8,314 lg5,610 10 lg0,243 10
19,12 1,25 3,6)
327016,0 /
0,0001374 0,0001374
Е Дж моль
Ответ: Е = 327,016 кДж/моль
№ 182-188. Указания: Искомая концентрация прореагировавшего вещества
х находится решением уравнений:
1
ln
C
o
k
C x
o
, для реакций первого порядка
1
)
x
k
C C x
o o
для реакций второго порядка
№ 182-188. В таблицах представлены значения констант скоростей k ряда
реакций. Определить, сколько вещества прореагировало к моменту времени
при указанных начальных концентрациях С
о
. (Если реакция имеет вид А + В
продукты, то начальные концентрации А и В предполагаются
равными). Стехиометрические коэффициенты в уравнениях реакций
совпадают с порядками реакций по соответствующим реагирующим
веществам.
№№ Уравнение реакции k л/моль мин , мин С
о
, моль/л
182 H
2
+ Br
2
2HBr 8,5610
-2
60 0,03
183 H
2
+ I
2
2HI 1,4610
-3
28 2,83
184 2NO
N
2
+ O
2
47,059 45 2,83
185 CO + H
2
O
CO
2
+H
2
310
-4
90 3,75
№№ Уравнение реакции k мин
-1
, мин С
о
, моль/л
186 PH
3
1/2P
2
+ 3/2H
2
1,83 10
-2
80 0,87
56
187 SO
2
Cl
2
SO
2
+ Cl
2
610
-5
35 2,5
188 COCl
2
CO + Cl
2
5,310
-3
10 0,80
№182
Дано:
k = 8,5610
-2
л/мольмин
= 60 мин
С
о
= 0,03моль/л
n - ?
Решение
H
2
+ Br
2
2HBr - реакция 2-го порядка.
Искомая концентрация прореагировавшего вещества Х, находится
решением уравнений:
1
)
x
k
C C x
o o
.
x = k C
o
2
- k C
o
x
x + k C
o
x = k C
o
2
2 2
2
2
k C
o
1 k C
o
8,56 10 60 0,03
0,028
1 8,56 10 60 0,03
x
x
Ответ: через 60 минут прореагировало 0,028 моль вещества
№ 189-191. Указания: Как в № 177-181 и 182-188
Энергия активации Е вычисляется из уравнения Аррениуса:
2
1 2 1
1 1
ln
k E
k R T T
Искомая концентрация прореагировавшего вещества х находится решением
уравнений:
1
ln
C
o
k
C x
o
, для реакций первого порядка
1
)
x
k
C C x
o o
для реакций второго порядка
№ 189-191. Ниже приведены значения констант скоростей реакций k
1
и k
2
при температурах Т
1
и Т
2
. Вычислить константу скорости данной реакции
при температуре Т
3
и определить, сколько вещества прореагировало к
моменту времени при указанных начальных концентрациях С
о
и этой
температуре Т
3
. (Если реакция имеет вид 2А + В
продукты, то
начальные концентрации А и В предполагаются равными).
Стехиометрические коэффициенты в уравнениях реакций совпадают с
порядками реакций по соответствующим реагирующим веществам.
(задача 189) 2HI
H
2
+ I
2
; Со = 2,5 моль/м
3
; = 68 мин.
57
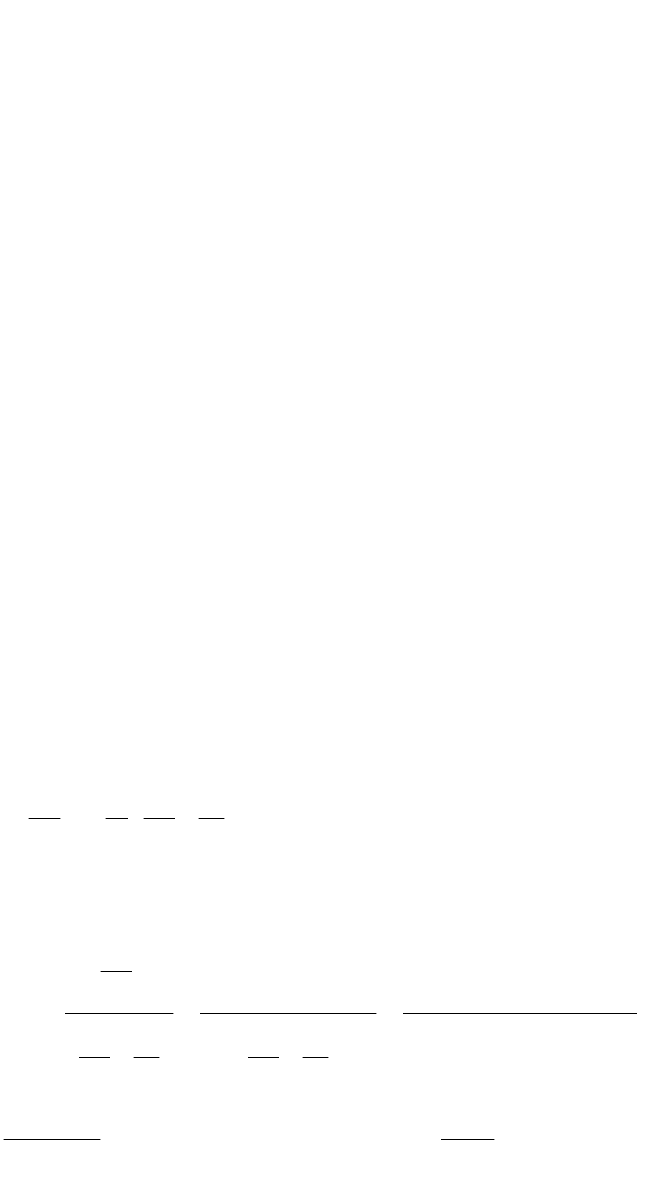
k
1
= 8,0910
-5
л/моль мин при Т
1
= 356
о
С; k
2
= 5,8810
-4
л/моль мин при Т
2
=
389
о
С
Т
3
= 374
о
С.
(задача 190)
2NO
+ O
2
2NО
2
Со = 1,5 моль/м
3
; = 40 мин.
k
1
= 3,6310
-3
л
2
/моль
2
мин при Т
1
= 0
о
С; k
2
= 1,1210
-2
л
2
/моль
2
мин при Т
2
=
86
о
С
Т
3
= 50
о
С.
(задача 191)
2NO
2
2NО
+
O
2;
Со = 2,0 моль/м
3
; = 60 мин.
k
1
= 83,0 л/моль мин при Т
1
= 600
о
С; k
2
= 107 л/моль мин при Т
2
= 640
о
С
Т
3
= 620
о
С
№ 190
Дано:
2NO
+ O
2
2NО
2
С
о
= 1,5 моль/м
3
;
= 40 мин.
k
1
= 3,6310
-3
л
2
/моль
2
мин
Т
1
= 0
о
С = 273 К
k
2
= 1,1210
-2
л
2
/моль
2
мин
Т
2
= 86
о
С = 359 К
Т
3
= 50
о
С = 323 К
k
3
- ? при Т
3
Решение:
Для решения используем уравнение Аррениуса:
1 1
2
ln
1 2 1
k
E
k R T T
где k
1
и k
2
константы скорости при температурах Т
1
и Т
2
. Из уравнения
Аррениуса определим энергию активации Е:
Дж
моль
2
ln
ln ln
4,49 5,62 8,314
2 1
1
0,0028 0,0037
1 1 1 1
2 1 2 1
9,39
10433,33; 10433,33
0,0009
k
R
k k R
k
E
T T T T
E
Найденное значение подставим в уравнение Аррениуса и определим при
Т=323 К.
58

1 1
3
ln
1 3 1
10433,33 1 1
3
ln ln3,63 10
3
8,314 323 273
10433,33 1 1
3
ln ln3,63 10
3
8,314 323 273
5,62 1254,91 ( 0,0006 5,62 0,75 4,87
ln 4,87
3
3
0,0077 7,7 10
3
k
E
k R T T
k
k
k
k
k
3
= 0,0017=7,710
-3
Искомая концентрация прореагировавшего вещества х находится решением
уравнения:
1
)
x
k
C C x
o o
для реакций второго порядка.
Реакция 2NO
+ O
2
2NО
2
- реакция второго порядка.
3 4
7,7 10 4,2 10
1,5 1,5
2
k C
o
1 k C
o
3 2
7,7 10 40 1,5 0,693
0,47
3
1,462
1 7,7 10 40 1,5
х
х
x
x
х = 0,47 моль
Ответ: k
3
=7,710
-3
. Через 40 мин. прореагировало 0,47 моль вещества
№ 192. Указания: Порядок реакции можно определить графически, методом
подбора. Следует построить графики (возможно более точные) в координатах
ln C = f(t) и 1/С = f(t), где С – концентрация, t – время. Если точки хорошо
«ложатся» на прямую на первом графике, то реакция имеет первый порядок,
если на втором – то второй порядок.
№ 192 Определить порядок реакции превращения цианата аммония в
мочевину по следующим данным:
Концентрация мочевины, кмоль/м
3
0,20 0,10 0,05
Время, часы 9,45 19,15 37,07
Решение: Если предположить, что реакция превращения цианата аммония в
мочевину протекает по типу реакции второго порядка, то для этой реакции
время полураспада
½
½
=
2
1 1
o
k c
, то есть произведение
½
С
о
должно быть постоянным.
Проверка: 9,45
.
0,2 19,15
.
0,1 37,07
.
0,05
Таким образом, эта реакция – реакция второго порядка.
59
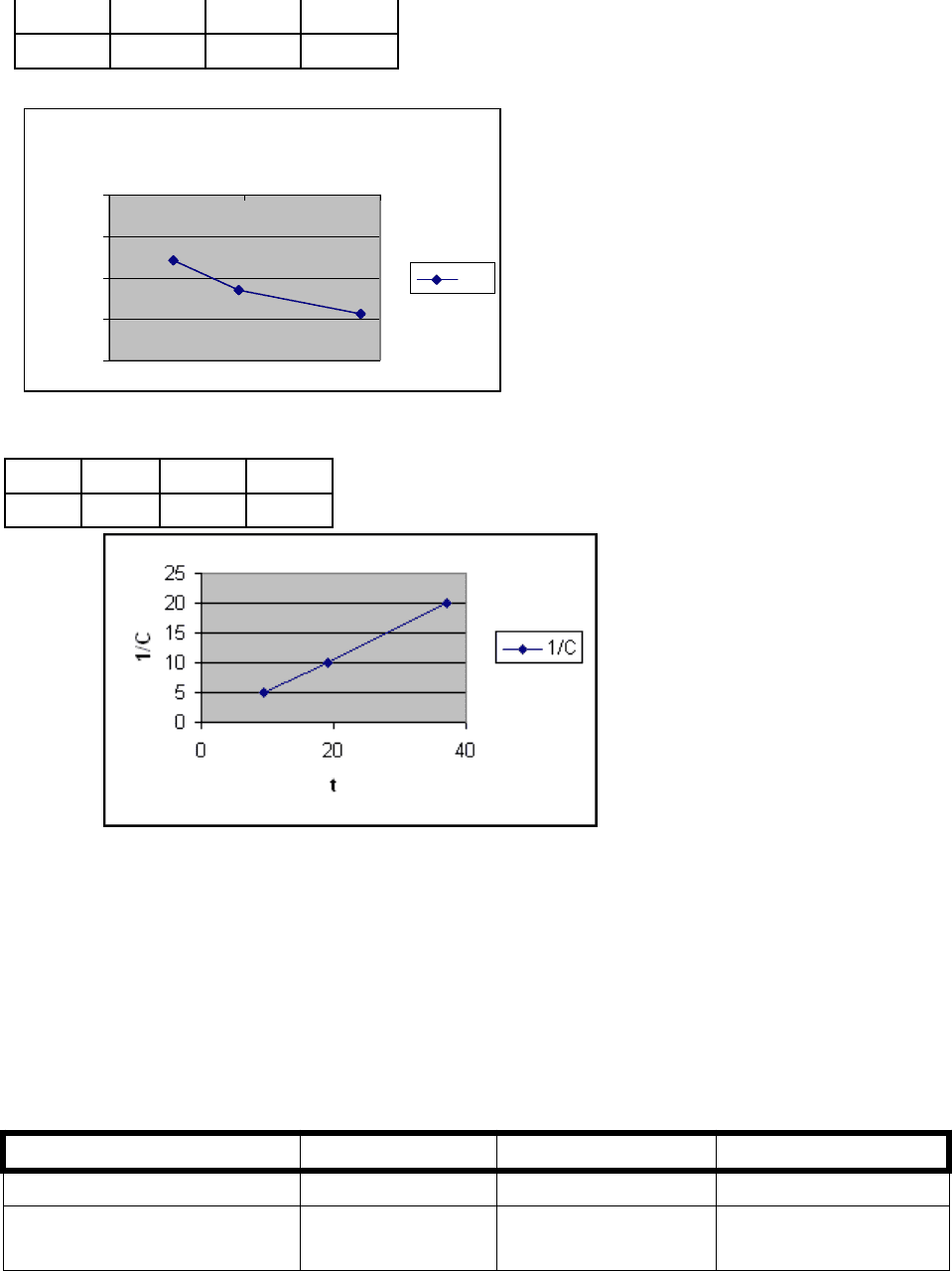
Порядок реакции можно определить графически методом подбора.
Следует построить графики (возможно более точные) в координатах ln C =
f(t) и 1/С = f(t)
Таблица 1
t 9,45 19,15 37,07
lnC -1,6 -2,3 -2,9
t
-4
-3
-2
-1
0
0 20 40
lnC
lnC
Таблица 2
t 9,45 19,15 37,07
1/С 5 10 20
Ответ: точки хорошо «ложатся» на прямую на втором графике,
следовательно, реакция имеет второй порядок.
Приложения
Таблица 1
Рефракция атомов и связей
Атом или связь R
a
, см
3
/моль Атом или связь R
a
, см
3
/моль
Азот: Йод 13,900
- в аммиаке
2,48
Кислород:
60
