Коробкова О.И. Пособие по выполнению контрольных работ по физической химии
Подождите немного. Документ загружается.

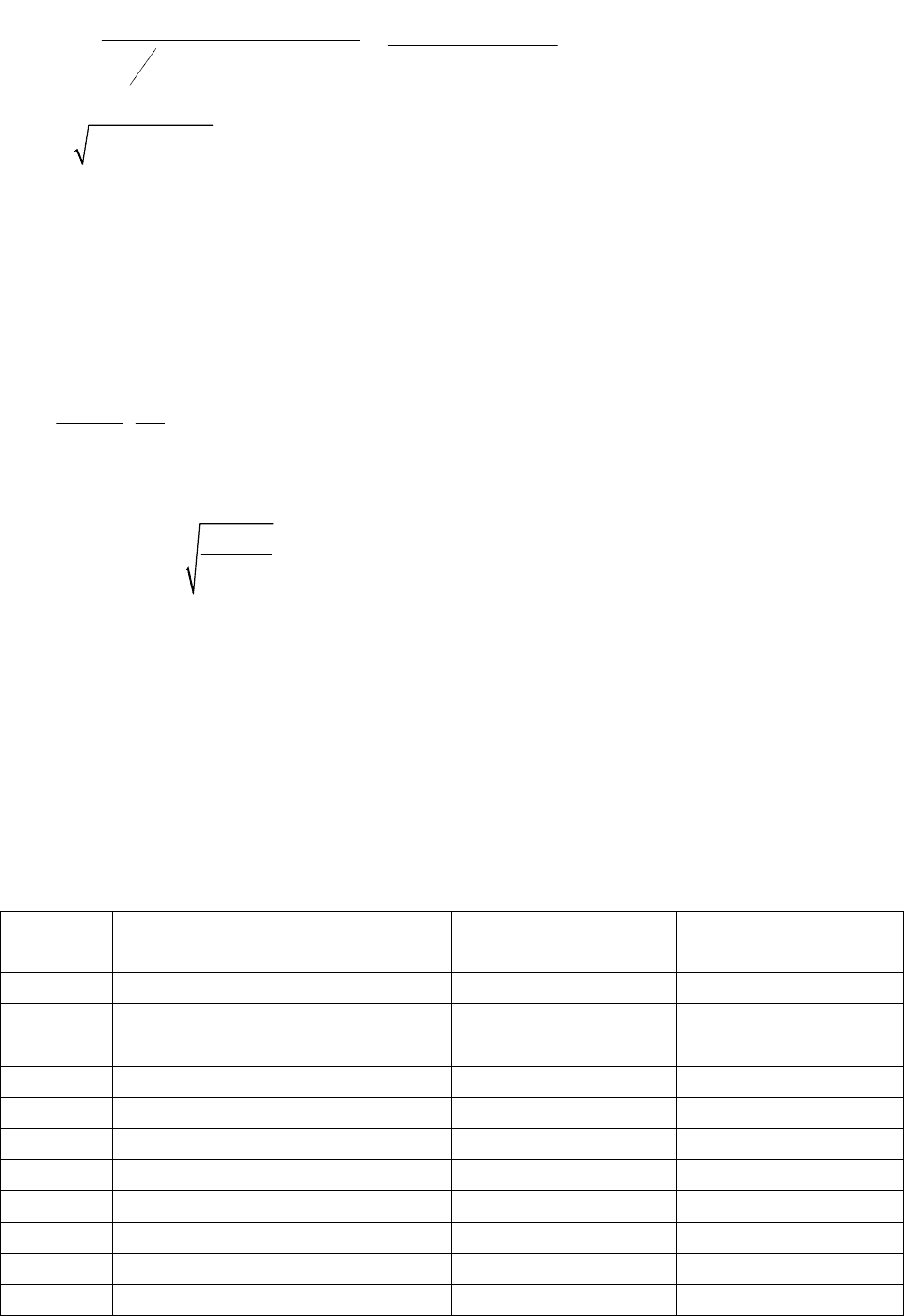
М
о
2
=
4
23
2,28 10 3 1,381 10
23
4
3,14 6,02 10
3
4
23
9,45 10 10
23
25,2 10
3,7510
-42
.
М
о
=
42
3,75 10
= 1,94 10
-21
Клм .
Ответ: величина электрического дипольного момента М
о
= 1,94 10
-21
Кл
.
м
4. Показатель преломления. Молярная рефракция
№№ 24-33. Указания: На основании данных о показателе преломления, n,
молярная рефракция вещества вычисляется по формуле:
2
1
2
2
n M
R
n
, где - плотность вещества при температуре измерения;
М - молекулярная масса.
Радиус молекулы может быть приблизительно оценен по формуле:
3
3
4
R
r
N
A
N
A
- число Авогадро
Рефракция молекулы вычисляется по правилу аддитивности атомных
рефракций:
R R R
атомов
связей
, где R
атомов
– рефракция атомов,
составляющих молекулу, R
связей
– рефракция двойных или тройных связей,
если они присутствуют в молекуле, и суммирование осуществляется по всем
составляющим молекулы (приложение 1).
24-33. Используя данные таблицы, вычислите молярную рефракцию через
коэффициенты преломления и сравните её с молярной рефракцией,
вычисленной по правилу аддитивности (см. таблицу приложения).
Вычислите радиус молекулы по величине найденной молярной рефракции.
№
задачи
Вещество 10
-3
, кг/м
3
n
24 С
6
Н
14
гексан 0,668 1,3802
25 С
4
Н
8
О
2
уксусноэтиловый
эфир
0,913 1,3798
26 С
4
Н
10
О бутанол 0,816 1,4030
27 С
3
Н
6
О ацетон 0,797 1,3616
28 С
3
Н
8
О пропанол-1 0,810 1,3886
29 С
7
Н
8
толуол 0,875 1,5026
30 С
2
Н
6
О этанол 0,7895 1,3614
31 С
4
Н
10
О диэтиловый эфир 0,7250 1,3555
32 С
6
Н
14
гексан 0,6680 1,3802
33 С
3
Н
6
О
2
уксуснометиловый 0,9460 1,3642
11
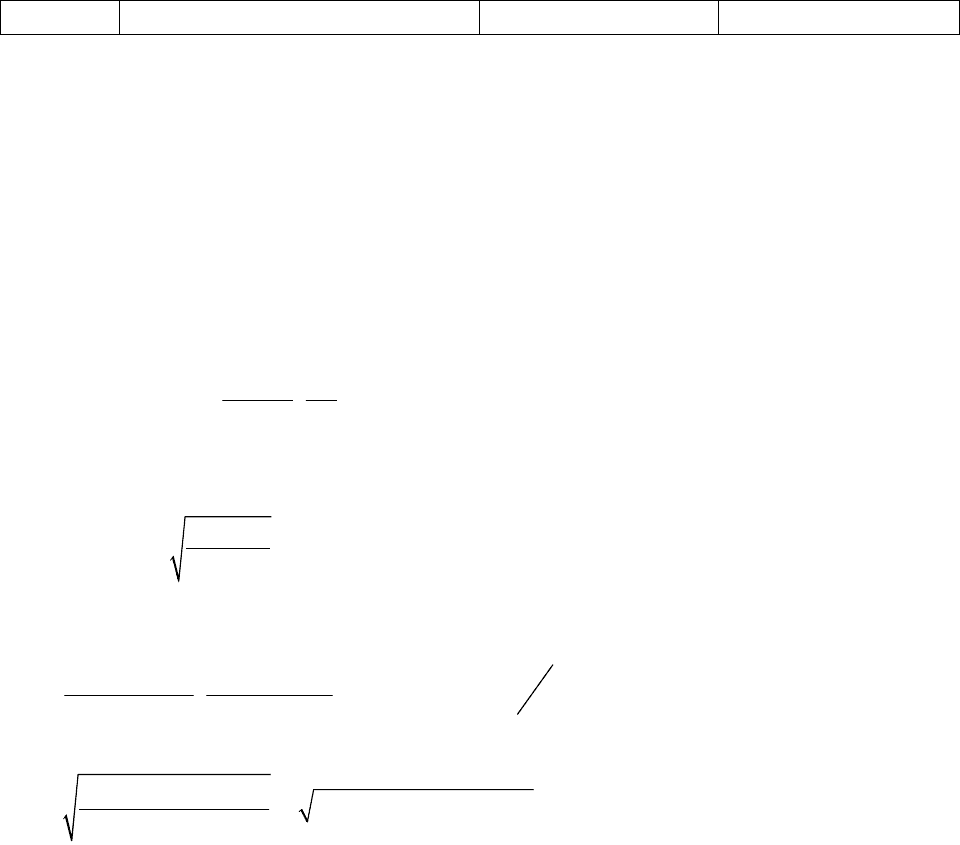
эфир
Для пересчёта атомных рефракций в м
3
/кг-атом надо табличные величины
умножить на 10
-3
.
№ 30.
Дано:
(С
2
Н
6
О) = 0,7895 10
-3
кг/м
3
n (С
2
Н
6
О) =1,3614
R - ? r молекулы - ?
Решение
Молярную рефракцию R для С
2
Н
5
ОН можно вычислить двумя способами
по формуле:
2
1
(1)
2
2
n M
R
n
и суммируя рефракции отдельных атомов в молекуле и связей:
R =
(2)
эт св
R R
Затем по рефракции рассчитываем радиус частицы по
формуле:
3
3
4
A
R
r
N
(3), если частица сферическая.
Берем данные из таблицы и подставляем в формулу:
R =
3
3
2
3
1,3614 1 0,046
0,0129 10
2
0,7895 10
1,3614 2
м
моль
Подставим значение R в формулу (3):
r =
3
4 3 23 8
23
10
3 0,0129 10
3
3
5,1183 10 10 7,999 10
4 3,14 6,02 10
м
Определим рефракцию по аддитивности:
R = 2R
C
+ 6R
H
+1R
O
+8R
(-)
R = 22,41810
-6
+61,110
-6
+1,52510
-6
= 12,96110
-6
=0,01296110
-3
м
3
/моль
Ответ: Молярные рефракции, вычисленные через коэффициенты
преломления и по правилу аддитивности, совпадают.
5. Энтальпия
Энтальпия является функцией состояния. Понятие об энтальпии: если
система окружена упругой средой (газом, жидкостью), дополнительно к
внутренней энергии она обладает ещё и определенным запасом
потенциальной энергии, которая равна произведению давления в системе на
её объём pV. Давление в системе противодействует окружающей среде – её
стремлению сжать систему. Полную энергию подобной системы называют
энтальпией и обозначают через ∆Н.
12
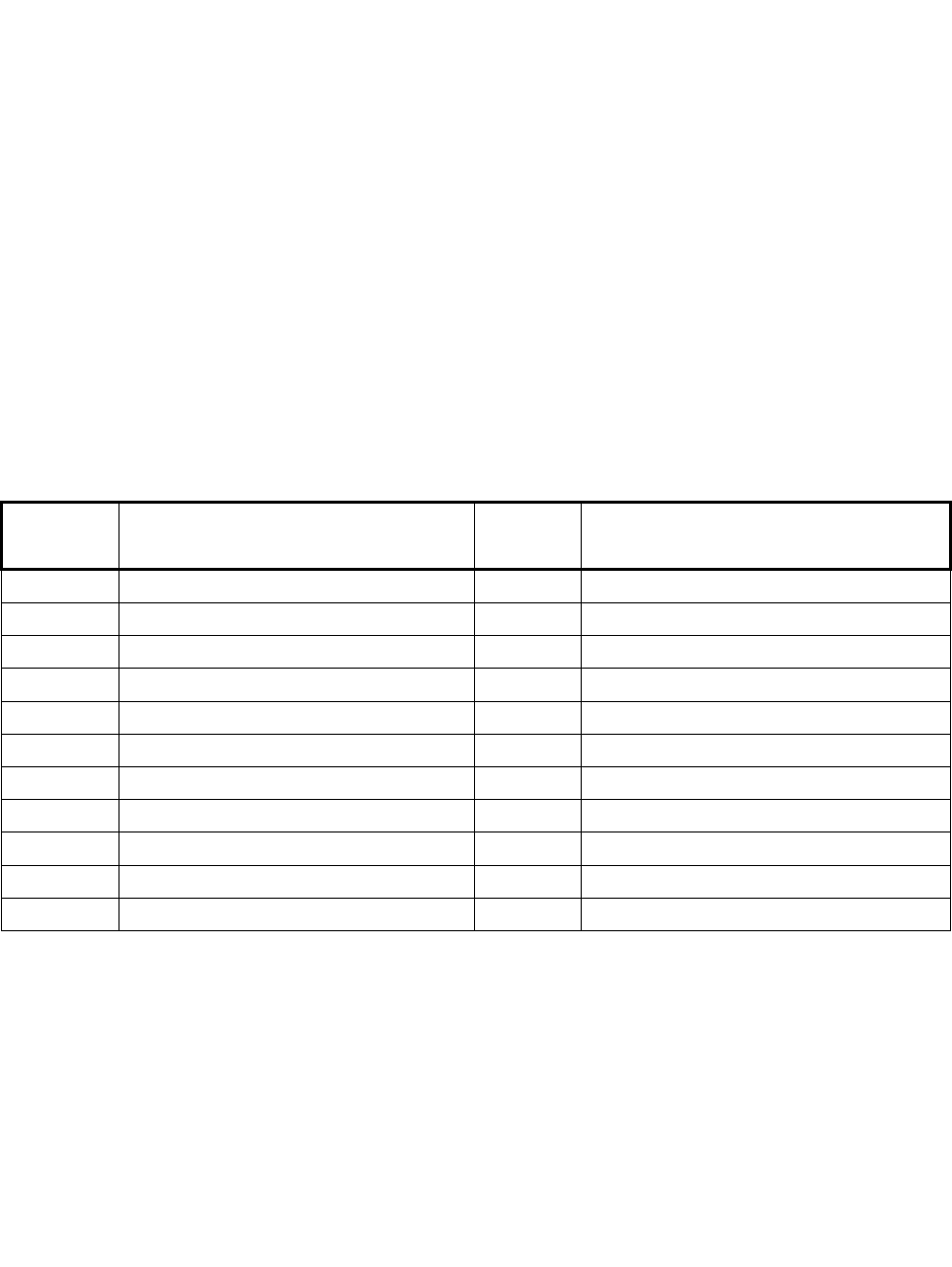
№№34-54. Указания: Согласно первому следствию закона Гесса,
стандартный тепловой эффект при постоянных Р и Т (стандартная
энтальпия) химической реакции вычисляется таким образом
∆Н
о
реакции
.
. . . . .
о о
Н Н
исх
прод обр прод обр исх
Где ν – стехиометрические коэффициенты продуктов реакции («прод.») и
исходных веществ (индекс «исх.»).
∆Н
о
обр
. – стандартные энтальпии образования продуктов или исходных
веществ.
Для решения задачи рассматриваем реакцию сгорания данного вещества,
принимая ∆Н
о
реакции
= ∆Н
о
сгор.,
где ∆Н
о
сгор,
энтальпия сгорания данного
вещества, берётся из приложения 2. Энтальпия образования СО
2
и Н
2
О (ж)
находится в приложении 3. Подставляя эти значения в уравнение для
∆Н
о
реакции,
вычисляем искомую энтальпию образования.
34-54.Вычислить стандартную энтальпию образования соединения при 298 К
и Р = 1,013310
5
Па, если известна его энтальпия сгорания (приложение 2).
Продукты сгорания: СО
2
, Н
2
, N
2
.
№
задачи
вещество №
задачи
вещество
34 С
6
Н
6
(ж) бензол 45 СН
4
О (ж) метанол
35 С
10
Н
8
(к) нафталин 46 С
2
Н
6
О (ж) этанол
36 СН
4
(г) метан 47 С
3
Н
8
О
3
(ж) глицерин
37 С
2
Н
2
(г) ацетилен 48 C
6
H
6
O (к) фенол
38 СН
4
ОN
2
(к) мочевина 49 С
3
Н
6
О (ж) ацетон
39 С
6
Н
7
N (ж) анилин 50 СН
2
О
2
(ж) муравьиная к-та
40 С
2
Н
4
(г) этилен 51 С
2
Н
4
О
2
(ж) уксусная к-та
41 С
2
Н
6
(г) этан 52 С
12
Н
22
О
11
(к) сахароза
42 С
3
Н
6
(г) пропилен 53 С
10
Н
16
О (к) камфара
43 С
7
Н
8
(ж) толуол 54 С
2
Н
6
О
2
(ж) этиленгликоль
44 С
3
Н
8
(г) пропан
№ 35.
Дано:
Т = 298 К
Р= 1,0133 10
5
Па
∆Н
о
сгор
= -5156,78 кДж/моль
∆Н
о
обр.
С
10
Н
8
(кр.) - ?
Решение
Для решения задачи используем первое следствие из закона Гесса:
∆Н
о
реакции
.
. . . . .
о о
Н Н
исх
прод обр прод обр исх
Запишем уравнение реакции:
C
10
Н
8
(кр.) + 12О
2
(г) = 10СО
2
(г) + 4Н
2
О (ж)
13
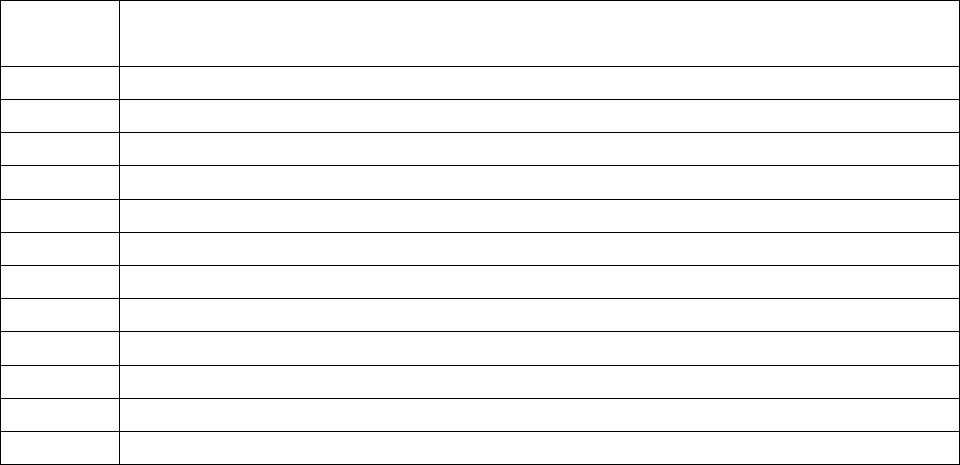
∆Н
о
сгор
(С
10
Н
8
(кр.) = [10 ∆Н
о
обр
(СО
2
(г) +4∆Н
о
обр
Н
2
0 (ж)] – [∆Н
о
обр
(С
10
Н
8
(кр.) + 12∆Н
о
обр
О
2
(г)], где
Н
о
обр.
- стандартные теплоты образования соответствующих веществ.
Значения Н
о
обр
берём из таблицы 3 приложения к Методическим указаниям:
Н
о
обр
СО
2
(г) = - 393,51 кДж/моль
Н
о
обр
Н
2
О (ж) = -285,84 кДж/моль
Н
о
обр
О
2
(г) = 0, т.к. О
2
простое вещество
Выразим стандартную энтальпию образования нафталина:
∆Н
о
обр.
С
10
Н
8
(кр.) = [10 ∆Н
о
обр
(СО
2
(г) +4∆Н
о
обр
Н
2
0 (ж)] – [∆Н
о
сг.
(С
10
Н
8
(кр.) +
12∆Н
о
обр
О
2
(г)]
∆Н
о
обр.
С
10
Н
8
(кр.) = [10(-393,51) + 4(-285,84)] – [-5156,78 +120] = 78,32
кДж/моль
Ответ: ∆Н
о
обр.
С
10
Н
8
(кр.) = 78,32 кДж/моль
№№ 55 -66. Указания:
Стандартную внутреннюю энергию (стандартный тепловой эффект при
постоянных V и Т) реакции находим из соотношения:
∆Н
о
реакции
= ∆U
о
реакции
+ ∆nRT,
где ∆n – изменение числа молей газообразных веществ при протекании
реакции (слева направо). Если все партнёры реакции находятся в
конденсированном состоянии (жидком или твёрдом), то можно принять, что
энтальпия и внутренняя энергия реакции приближённо равны.
№№ 55 -66. Вычислите тепловой эффект химической реакции при 298 К
(таблица) и определите, на сколько при этой температуре отличается ∆Н от
∆U. Необходимые данные взять из приложения 3.
Таблица
№
задачи
Уравнение реакции
55 SO
2
( г) + Cl
2
(г) = SO
2
Cl
2
(г)
56 C
6
H
6
(ж) +3H
2
( г ) = C
6
H
12
( г)
57 2SO
2
(г) +O
2
(г) = 2SO
3
(г)
58 Ca(OH)
2
() = CaO (к) + H
2
O (ж)
59 N
2
O
4
(г) = 2NO
2
(г)
60 2NO
2
(г) = 2NO (г) + O
2
(г)
61 4HCl (г) + O
2
(г) = 2H
2
O (ж) + 2Cl
2
(г)
62 2NH
4
Cl (к) +Ca(OH)
2
(к) = CaCl
2
(к) + 2NH
3
(г) +2H
2
O (г)
63 2NaOH (к) + CO
2
(г) = Na
2
CO
3
(к) + H
2
O (ж)
64 Al
2
O
3
(-модификация) +3SO
2
(г) = Al
2
(SO
4
)
3
(к)
65 CH
4
(г) + HNO
3
(ж) = CH
3
NO
2
(г) + H
2
O (ж)
66 2C
4
H
10
(ж) + 5O
2
(г) = 4CH
3
COOH (ж) +2H
2
O (ж)
№ 55
14

Дано:
∆Н
о
Cl2 (г)
= 0
∆Н
о
SO2
(г) = - 296,81
кДж
моль
∆Н
о
SO2Cl2 (г)
= -358,70
кДж
моль
∆Н
о
реакции
= ? ∆U
о
реакции
= ?
Решение
SO
2
( г) + Cl
2
(г) = SO
2
Cl
2
(г)
Для решения задачи используем первое следствие из закона Гесса:
∆Н
о
реакции
.
. . . . .
о о
Н Н
исх
прод обр прод обр исх
∆Н
о
реакции
= 1 (-358,70) – [1 (-296,81) + 10] = - 61,89 Дж\моль
∆n = 2-1 =1
∆U = ∆Н
о
реакции
- ∆nRT
∆U = -61,89 – 1 8,314 298 = 2539,46 Дж/моль
Ответ: ∆Н от ∆U отличается на: 2539,46 – (-61,89) = 2601,35 Дж/моль
№№ 67 - 80.Указания: Изменение энтропии вычисляется по формуле:
∆S
о
реакции
. .
. .
о о
S S
исх исх
прод прод
,
где S - стандартные энтропии участников реакции, ν – стехиометрические
коэффициенты.
Энергия Гиббса G и энергия Гельмгольца F вычисляются по формулам:
∆ G
о
= ∆Н
о
– Т ∆S
о
∆F
о
= ∆ G
о
+ ∆nRT,
где ∆n – изменение числа молей газообразных веществ при протекании
реакции (слева направо). Верхний индекс «
о
» указывает стандартные
состояния участников реакции. Если изменение энергии Гиббса или энергии
Гельмгольца меньше нуля, то реакция идёт в прямом направлении (слева
направо) при (р, Т) = const или (V,T) = const, соответственно.
№ 67 -80
Вычислить стандартную энтальпию химической реакции (∆Н
о
298
), изменение
энтропии (∆S
о
298
), энергию Гиббса (∆G
о
298
), энергию Гельмгольца (∆F
о
298
) и
определить, в каком направлении пойдёт химическая реакция (таблица)
Необходимые для вычислений данные взять из приложения 3.
№ задачи Уравнение реакции
67 СH
4
(г) + HNO
3
(ж) = CH
3
NO
2
(г) +H
2
O (ж)
68 2C
4
H
10
(ж) + O
2
(г) = CH
3
COOH (ж) + 2H
2
O (ж)
69 2C
4
H
10
(ж) + 3O
2
(г) = 2CH
3
COOC
2
H
5
(ж) +2H
2
O (ж)
15

70 CH
3
OH (г) + CH
3
COOH (г) = CH
3
COOCH
3
(ж) + H
2
O (ж)
71 CH
3
COOH (ж) + C
2
H
5
OH (ж) = CH
3
COOC
2
H
5
(ж) +H
2
O (ж)
72 H
2
(г) +F
2
(г) = 2HF(г)
73 2C
3
H
7
CHO (ж) + H
2
(г) = 2C
4
H
9
OH (ж)
74 CaC
2
(к) + 2H
2
O (ж) = C
2
H
2
(г) +Ca(OH)
2
(к)
75 2NO (г) + O
2
(г) =2NO
2
(г)
76 SO
2
(г) + Cl
2
(г) = SO
2
Cl
2
(ж)
77 2C
2
H
2
(г) = C
4
H
4
(г)
78 C
4
H
4
O (ж) + NH
3
(ж) = H
2
NCH
2
CH
2
OH (ж)
79 2C
4
H
10
(ж) +SO
2
(г) = 4CH
3
COOH (ж) + 2H
2
O (ж)
80 3C
2
H
2
(г)= C
6
H
6
(г)
№ 80
Дано:
3C
2
H
2
(г)= C
6
H
6
(г)
∆Н
о
298
C
2
H
2
(г) ацетилен = 226,75 кДж/моль
S
o
298
C
2
H
2
(г) ацетилен = 200,80 Дж/моль К
∆Н
о
298
C
6
H
6
(г) бензол = 82,93 кДж/моль
S
o
298
C
6
H
6
(г) бензол = 269,20 Дж/моль К
Решение :
1. Тепловой эффект химической реакции находится с помощью первого
следствия закона Гесса:
∆Н
о
реакции
.
. . . . .
о о
Н Н
исх
прод обр прод обр исх
∆Н
о
реакции
= 82,93 – (3 226,75) = 82,93 – 680,25 = -597,32 кДж/моль
2. Изменение энтропии вычисляется по формуле:
∆S
о
реакции
. .
. .
о о
S S
исх исх
прод прод
∆S
о
реакции
= 269,2 – (3 200,8) = -333,2 Дж/моль К
3. Энергия Гиббса G вычисляется по формуле:
∆ G
о
= ∆Н
о
– Т ∆S
о
∆G
о
=-597,320
кДж
моль
–(-333,2
Дж
моль
)298 =-597320 + 99293,6=-498026,4
Дж/моль
Энергия Гельмгольца F вычисляется по формуле:
∆F
о
= ∆ G
о
+ ∆nRT
∆n = 3-1 = 2
∆F
о
= - 498026,4 + 2 8,314 298 = -493071,256 Дж/моль
Ответ: Реакция идёт в прямом направлении (слева направо), т.к. ∆ G
о
< 0.
№№ 81, 82,84 Энтропия фазового перехода Указания:
Энтропия фазового перехода вычисляется по формуле:
16
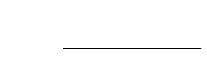
. .
H
фаз пер
S
Т
, где ∆Н
фаз.пер.
– энтальпия фазового перехода. Чтобы
от удельной энтальпии фазового перехода (то есть в расчёте на единицу
массу) перейти к молярной (в расчёте на один моль), надо удельную
энтальпию умножить на молекулярную массу.
№ 82. Удельная энтальпия плавления свинца составляет 24,6
.
10
6
Дж/кг,
температура плавления 327
о
С. Определить энтальпию плавления для 4 молей
свинца (молекула свинца состоит из одного атома).
Дано:
∆Н
о
плавл.
= 24,6
.
10
6
Дж/кг
t
o
плавл.
= 327
о
С
n = 4моль М(Pb) = 207,2г/моль
∆Н
плавл
- ?
Решение
Для того чтобы от удельной энтальпии фазового перехода (то есть в расчёте
на единицу массы) перейти к молярной (то есть в расчёте на один моль), надо
удельную энтальпию умножить на молекулярную массу.
∆Н
мол
= 24,6
.
10
6
0,2072 = 5,097
.
10
6
Дж/моль
По условию задачи необходимо рассчитать молярную энтальпию для 4
молей:
∆Н
пл
= 5,097
.
10
6.
4 = 20,388
.
10
6
Дж/моль
Ответ :∆Нпл. = 20,388
.
10
6
Дж/моль
№ 83
Энтропия сложной системы, будучи аддитивным свойством, равна сумме
энтропий её составляющих, поэтому надо определить энтропии данных
количеств веществ по отдельности, и затем их сложить. Энтропию вещества
определяем по формуле S
o
m/M,
m - масса вещества; М – молекулярная масса.
№ 83 В 0,3 кг жидкого ацетона поместили серебряную ложку массой 5,3 г.
Определить энтропию системы при 25
о
С. При этой температуре энтропия
жидкого ацетона равна 200,4 Дж/моль К, а серебра 42,55 Дж/моль К.
Дано:
m(ацетона) = 0,3 кг
m (серебра) = 5,3 г=5,310
-3
кг
S
1
(ацетона) = 200,4 Дж/моль К
S
2
(серебра) = 42,55 Дж/моль К
S (системы) - ?
Решение
M(C
3
H
6
O) = 58 г/моль = 0,058 кг/моль
M(Ag) = 108 г/моль = 0,108 кг/моль
17

1 0
m
S =S
M
1
0,3
0,058
S =200,4 1036,55 Дж/К
3
2
5,3 10
0,108
S =42,55 2,09 Дж/К
S = S
1+
S
2
S= 1036,55 + 2,09 = 1038,64 Дж/ К
Ответ: Энтропия системы при 25
о
С S = 1038,64 Дж/ К.
№№ 85-95. Указания: Необходимо использовать уравнение изотермы
химической реакции. Для химической реакции вида aA + bB = eE + rR:
' '
ln ln
,
' '
e r
C C
E R
F RT k
c
V T
a b
C C
B
A
Где Кс – константа равновесия:
e r
C C
E R
K
c
a b
C C
B
A
С’ – исходные (неравновесные) концентрации веществ;
C –равновесные концентрации;
,V T
F
- энергия Гельмгольца.
Уравнение рассматривается в условиях постоянства состава газовой смеси.
Это означает, что после того, как прореагировало число молей компонентов,
равное стехиометрическим коэффициентам в уравнении реакции, начальные
концентрации С остаются практически неизменными. Такое условие
достигается, если масса смеси газов велика. Если полученное значение
,V T
F
окажется меньше нуля, то реакция пойдёт в сторону образования конечных
продуктов реакции.
№ 85 -92
Константа равновесия реакции H
2
+ J
2
= 2HJ при 693 К равна 50. Образуется
ли йодид водорода, если исходные концентрации (моль/л) равны х Н
2
; у J
2
; z
HJ (x, y и z даны в таблице). Вещества в реакционный сосуд поступают из
бесконечно больших ёмкостей. Йодид водорода выводится из реакционного
сосуда в ёмкость бесконечно большого объёма.
№
задачи
х y z № задачи х y z
85 2 5 10 89 0,5 1,5 5
86 1,5 5 5 90 1,5 2 10
87 1,5 0,25 5 91 0,25 1,5 5
88 1 2 10 92 2 6 10
18

№ 92
Решение
Для химической реакции aA + bB = eE + rR
H
2
+ J
2
= 2HJ
ln
' '
ln
,
' '
C
K
e r
C C
E R
F RT
V T
a b
C C
B
A
;
e r
C C
E R
K
c
a b
C C
B
A
,
F
V T
= RT
2
ln ln50
2 2
C
HI
C C
H I
8,314 693 ln100 ln12 3,912
8,314 693 4,61 2,48 3,912 10267,17
Дж
моль К
Дж
моль
К
Ответ: Полученное значение
,V T
F
= -10267,17 Дж/моль, т.е. меньше
нуля. Реакция пойдёт в сторону образования конечных продуктов
реакции.
№ 93-95
Константа химического равновесия реакции С
2
Н
6
(г) = С
2
Н
4
(г) +Н
2
(г)
при 1500 К равна 38,4. Определить направление реакции, если в начале
реакции давления имеют следующие значения:
№
задачи
Парциальные давления, МПа
С
2
Н
6
С
2
Н
4
Н
2
93 0,07 0,02 0,02
94 0,05 0,01 0,02
95 0,03 0,02 0,01
№95
Дано:
Т = 1500 К
К
р
= 38,4
Р(С
6
Н
6
) = 0,03 МПа
Р(С
2
Н
4
) = 0,02 МПа
Р(Н
2
) = 0,01 МП
∆F - ?
Решение
С
2
Н
6
(г) = С
2
Н
4
(г) +Н
2
(г)
19

0,02 0,01
8,314 1500 (ln ln38,4)
0,03
12471 (ln 0,02 ln 0,01) ln 0,03 ln38,4
12471 3,91 4,61 3,51 3,65
107998,86 /
107,999 /
F
F
F
F Дж моль
F кДж моль
Ответ: реакция идёт в прямом направлении, т.к. ∆F < 0;
∆F = - 107,999 кДж/моль
№№ 96-99. Указания: Необходимо построить график зависимости lgKp
=f(1/T) и найти тангенс угла наклона (допустим, tg) полученной прямой к
оси абсцисс, как отношение противолежащего катета к прилежащему, взятых
в единицах измерения соответствующих осей координат. Тогда энтальпия
химической реакции вычисляется таким образом:
∆Н= 2,303 R tg.
№ 96 –99 Зависимость константы равновесия от температуры реакции 2СО
+ 2Н
2
= СН
4
+ СО
2
выражается уравнением:
11088
3
lg 2,85 10 18,539 3,113 lgKp T T
T
Найти графически энтальпию химической реакции при температуре (
о
С) 25
(задача 96); 50 (задача 97);70 (задача 98); 100(задача 99).
№97
Дано:
2СО + 2Н
2
= СН
4
+СО
2
lgK
p
= 11088/T – 2,8510
-3
T + 18.539 + 3113 lgT
t
o
C =50
T K = 323 K
∆H -?
Решение
Для решения построим график зависимости lgK
p
от 1/Т.
Решим уравнения, чтобы определить три значения lgK
p
Пусть Т
1
= 323 К; Т
2
= 333 К; Т
3
= 343 К;
lgK
p1
= 11088/323 – 2,8510
-3
323 + 18.539 + 3113 lg323 = 59,75
lgK
p2
= 11088/333 – 2,8510
-3
333 + 18.539 + 3113 lg333 = 58,75
lgK
p3
= 11088/343 – 2,8510
-3
343 + 18.539 + 3113 lg343 = 57,78
Находим 1/Т:
1/Т
1
= 1/323 =3,0959 10
-3
1/Т
2
= 1/333 =3,003 10
-3
1/Т
3
= 1/343 =2,9154 10
-3
Построим график и найдём значение углового коэффициента
20
