Коробкова О.И. Пособие по выполнению контрольных работ по физической химии
Подождите немного. Документ загружается.


Закон разбавления Оствальда характеризует зависимость степени
диссоциации от концентрации электролита (график 3). С уменьшением
концентрации электролита (ростом разбавления) степень диссоциации
увеличивается
№ 151. Указания:
Закон разбавления Оствальда характеризует зависимость степени
диссоциации от концентрации электролита. С уменьшением концентрации
электролита (ростом разбавления) степень диссоциации увеличивается.
Простой способ решения этой задачи основан на приближении, что
раствор 0,1 моль/л СН
3
СООН подчиняется законам разбавленных растворов.
Константа диссоциации в этом случае связана со степенью диссоциации .
По уравнению
2
1
C
K
D
можно найти , решив квадратное уравнение:
2
С + К
D
- К
D
= 0 (только положительный корень имеет смысл для
данной задачи). Зная , можно вычислить концентрацию водородных ионов
[H
+
] и далее водородный показатель рН = - log [H
+
].
№ 151. Константа кислотной диссоциации уксусной кислоты составляет
1,7510
-5
при 25
о
С. Вычислить концентрацию ионов водорода и рН её
водного раствора 0,1 моль/л при этой температуре.
Дано:
К
дисс
. = 1,75 10
-5
t = 25
о
С
См = 0,1 моль/л
С(Н
+
) = ? рН - ?
Решение:
СН
3
СООН
СН
3
СОО
-
+ Н
+
Уксусная кислота является слабым электролитом и подчиняется закону
разбавления Оствальда
Подставим значения в уравнение:
2
1
D
C
K
2
0,1
5
1,75 10
1
5 5 2
1,75 10 1,75 10 0,1
Решим квадратное уравнение:
41

5 2 10 1 5
1,75 10 1,75 10 4 10 1,75 10
1,2
1
2 10
5 10 6
1,75 10 3,0625 10 7 10
1,2
1
2 10
5
1,75 264,6 10
1
0,2
5
1,75 264,6 10
4
131,425 10
1
0,2
1
имеет отрицательное значение и для решения не подходит.
Определим С (Н
+
) в растворе СН
3
СООН
С(Н
+
) = С
м
(СН
3
СООН)
С(Н
+
) = 0,1 131,425 10
-4
= 0,00131 моль/л
рН = -lg С(Н
+
)
рН = -lg0,00131 =2,822
Ответ: С (Н
+
) = 0,00131 моль/л; рН = 2,822
№ 152. Указания: Произведение растворимости ПРсоли = S
b
+
b
b
,
где S –
растворимость соли (моль/л), b и - числа катионов и анионов, на которые
диссоциирует молекула электролита.
№ 152. Вычислить произведение растворимости Ag
2
CrO
4
, если его
растворимость в воде равна 8,0010
-5
моль/л при 25
о
С. Принять, что соль
диссоциирует в растворе полностью.
Дано:
S (Ag
2
CrO
4
) = 8,0010
-5
моль/л
ПР(Ag
2
CrO
4
)
- ?
Решение:
Ag
2
CrO
4
2Ag+ + CrO
4
2-
= 2; b = 1
ПР
(Ag
2
CrO
4
) = (8,0010
-5
)
2+1
1
1
2
2
= 512 10
-15
4 = 2,0510
-12
Ответ: ПР
(Ag
2
CrO
4
) = 2,0510
-12
.
7. ЭДС элемента
Гальванический элемент Якоби состоит из электродов Zn и Cu,
погруженных в растворы своих солей. Так как цинк является менее
благородным металлом, чем медь, то он будет посылать в раствор катионы
цинка. При этом цинковая пластинка заряжается отрицательно благодаря
накоплению на ней избытка электронов.
Если соединить цинковую пластинку проволочкой с медной, то
избыточные электроны с цинковой пластинки потекут на медную и
возникнет электрический ток.
42
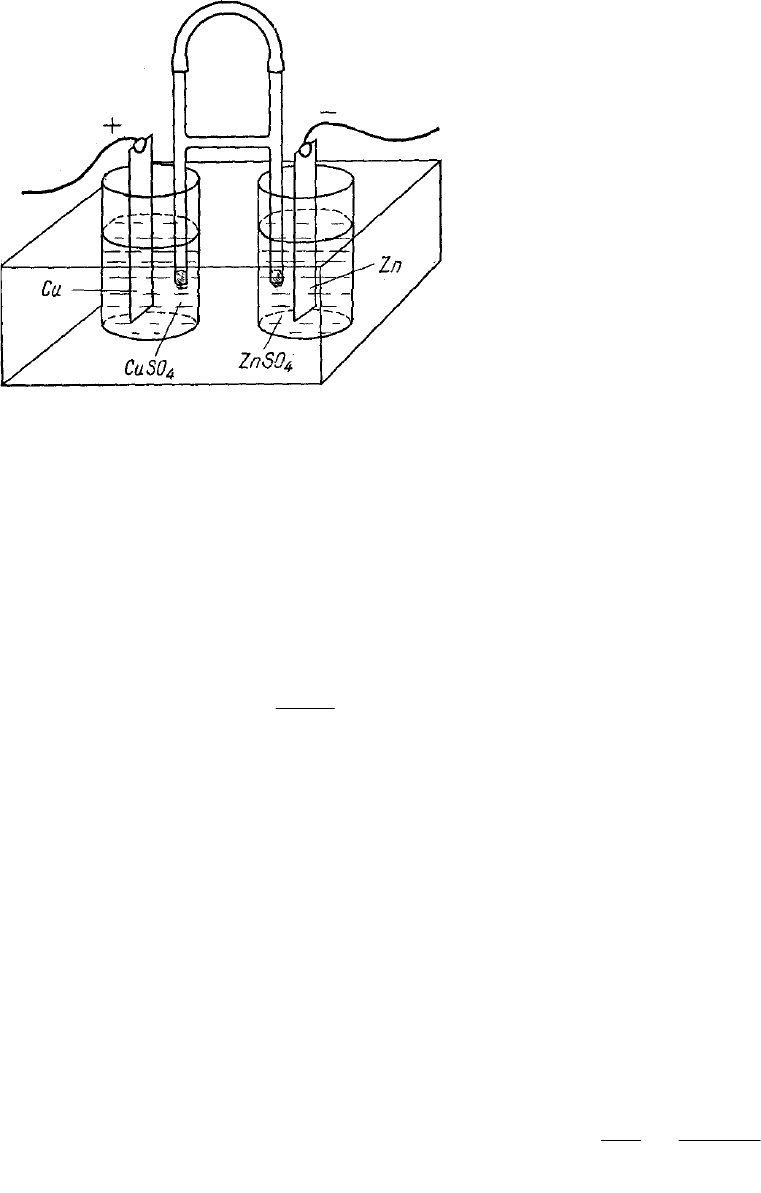
Перешедшие на медь электроны нейтрализуют катионы меди из
раствора CuSO
4
. Образующиеся при этом электронейтральные атомы меди
осаждаются на медной пластинке. Освобождающиеся из молекул CuSO
4
сульфат-ионы SO
4
2-
через пористую перегородку «mn» переходят в раствор
ZnSO
4
, где соединяются с ионами Zn
2+
и дают ZnSO
4
.
По мере удаления из цинковой пластинки
избытка электронов все новые количества Zn
2+
будут
переходить в раствор. Гальванический элемент будет
работать до тех пор, пока весь цинковый электрод не
растворится.
Схематически: + Cu | CuSO
4
|| ZnSO
4
| Zn -
ЭДС этой цепи будет Е = Е
Cu
- E
Zn
.
При работе гальванического элемента
происходит одновременный перенос электричества
по двум цепям: внешний (поток электронов по
проволочке) и внутренний (поток катионов в жидкой
фазе элементов).
Гальваническая цепь может быть составлена из
пар различных металлов, погруженных в растворы своих солей. При этом
растворяется более активный металл.
Обычно для измерения потенциала данного металла составляют
гальваническую цепь из исследуемого электрода и электрода сравнения,
потенциал которого точно известен. В качестве электрода сравнения
используют хлорсеребряный.
По величине нормальных потенциалов составлен ряд напряжений.
Потенциал любого металла рассчитывается по формуле Нернста:
Е = Е
о
+
0,059
lgC
n
, где
Е – электродный потенциал металла
Е
о
– нормальный потенциал металла (из таблицы)
n –валентность
С – концентрация в г-ион/л
Если оба электрода сделаны из одного и того же металла и погружены
в растворы с различной концентрацией ионов этого же металла, то такие
элементы называются концентрационными.
В гальванических элементах помимо электродных потенциалов,
возникающих на границе Me - раствор, наблюдается ещё появление
небольшого потенциала по месту соприкосновения двух растворов различной
концентрации. Это диффузионный потенциал.
153. Указания:
2
ln
2
2
а
RT
o o
Cu
E E E
Zn
Cu
F а
Zn
, где Е
о
– стандартный
потенциал, Е – электродвижущая сила, F – число Фарадея.
43

№153. Рассчитать э.д.с. элемента, составленного из полуэлементов: Zn|Zn
2+
(активность Zn
2+
равна 0,02) и Cu|Cu
2+
(активность Cu
2+
равна 0,3), если
Е
о
(Cu|Cu
2+
) = 0,373 В;
Е
о
(Zn|Zn
2+
) равна -0,673 В.
Дано:
Е
о
(Cu|Cu
2+
) = 0,373 В
Е
о
(Zn|Zn
2+
) = -0,673 В
a
Cu2+
= 0,3
a
Zn2+
= 0,02
Е - ?
Решение:
2
ln
2
2
a
RT Cu
o o
E E E
Zn
Cu
a
F
Zn
8,314 298 0,3
E =0,373 - (-0,673) + ln
4
0,02
2 9,648 10
1,046 0,0085 1,204 3,9 1,069 В
Ответ: э.д.с. элемента, составленного из полуэлементов: Zn|Zn
2+
и Cu|
Cu
2+
, равна 1,069 В.
№ 154. Указания:
lg
0,059
n E
K
№ 154. Рассчитать константу равновесия реакции: ZnSO
4
+ Cd = CdSO
4
+ Zn.
Стандартный потенциал Zn|Zn
2+
равен -0,762 В, а Сd|Cd
2+
= -0,40В .
Е
о
Zn|Zn
2+
= 0,762 в Е
о
Сd|Cd
2+
= -0,40 в
Стандартная эдс гальванического элемента Е
о
= Е
о
Сd|Cd
2+
- Е
о
Zn|Zn
2+
=
-0,40- (-0,762)=0,362
lg K =
2 0,362
12,27
0,059
K =1,8610
12
Ответ: K =1,8610
12
№ 155. Указания: Важнейшей характеристикой гальванического элемента
является электродвижущая сила (ЭДС), которая определяется как предельная
разность потенциалов, возникающая на границе раздела фаз в разомкнутой
цепи элемента.
Электродвижущую силу концентрационного элемента следует искать
по уравнению вида:
1
2
ln
a
RT
E
nF a
Для упрощения можно принять активности а
1
и а
2
равными концентрациям.
№ 155. Вычислить э.д.с. элемента:
44
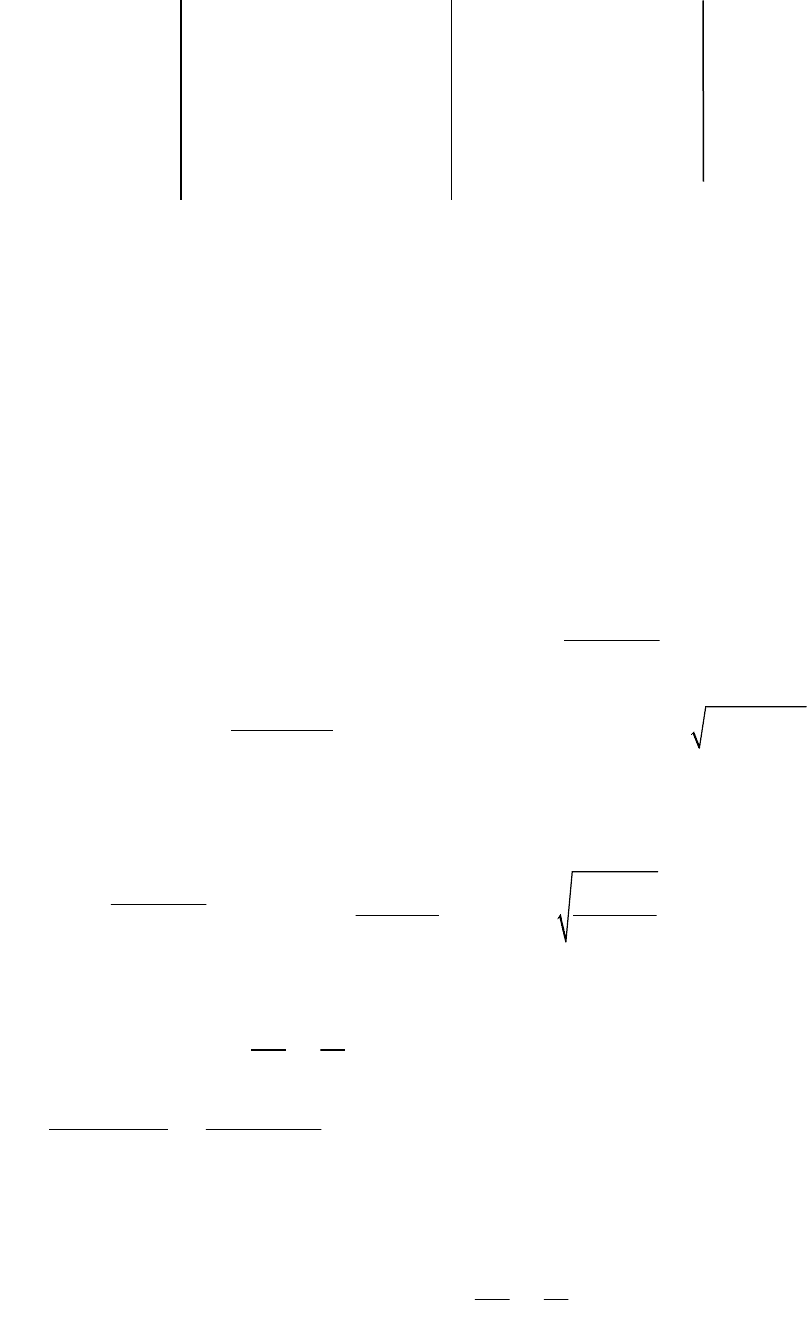
при 298 К, если произведение растворимости PbI
2
равно 810
-9
(моль/л),
произведение растворимости PbSO
4
равно 1,6 10
-8
(моль/л)
2
.
Дано:
ПР
PbI2
= 810
-9
(моль/л)
ПР
PbSO4
=1,6 10
-8
моль/л
T = 298 K
E -?
Решение
Используем формулу определения произведения растворимости
ПР
соли
= S
b
+
b
b
,
где S – растворимость соли (моль/л), b и - числа катионов
и анионов, на которые диссоциирует молекула электролита.
PbSO
4
Pb
2+
+ SO
4
2-
Из формулы ПР
соли
= S
b
+
b
b
S
b
+
=
ПР
соли
b
b
b = 1; =1 S
1+1
=
8
1,6 10
8
1,6 10
1 1
1 1
S
2
= 1,6
.
10
-8
; S =
8
1,6 10
= 1,2 10
-4
Концентрация насыщенного раствора равна растворимости (указания к №139).
С (PbSO
4
)= 1,2 10
-4
моль/л
PbJ
2
Pb
2+
+ 2J-
S
b
+
(PbJ2)
=
ПР
соли
b
b
9 9
8 10 8 10
3 3
3
; 1,25 10
2 1
4
2 1
2
S S
PbJ
C(PbJ
2
) = 1,25
.
10
-3
Электродвижущую силу концентрационного элемента следует искать по
уравнению вида:
1
2
ln
aRT
E
nF a
3
8,314 298 1,25 10
4
ln 5,2 10
4
2 96500
1,2 10
E
в
Ответ: Е = 5,2 10
-4
в.
№ 156-162. Указания:
Задача решается по формуле:
1
2
ln ,
o
a
RT
E E
nF a
где n – число электронов,
принимающих участие в окислительно-восстановительной реакции (в данном
случае n = 2), а – активность ионов цинка или меди. При концентрациях
Pb PbSO
4
насыщенный
раствор
PbI
2
насыщенный
раствор
Pb
45
более 0,01 моль/л нельзя принимать активность равной концентрации. Для
вычисления активности можно использовать следующие соотношения:
активность a = γ C, γ – коэффициент активности, С –концентрация.
2
0,509
lg
1
lg
10
z I
I
,
где z – заряд иона, I – ионная сила, вычисляемая по уравнению:
1
2
2
I z C
i i
,
где суммирование осуществляется по всем ионам, присутствующим в
растворе. (Следует иметь ввиду, что в элементе Даниэля-Якоби используются
растворы сульфатов цинка и меди).
№ 156-162
Электродвижущая сила элемента Даниэля-Якоби, в котором концентрация
Cu
2+
и Zn
2+
равны, при 18
о
С равна 1,1 В. Вычислить э.д.с. цепи, в которой
концентрация Cu
2+
и Zn
2+
составляют величины, указанные в таблице.
№ задачи 156 157 158 159 160 161 162
Концентрация
Cu
2+
, моль/л
0,0005 0,0003 0,002 0,001 0,04 0,05 0,03
Концентрация
Zn
2+
, моль/л
0,5 0,2 0,1 0,3 0,7 0,65 0,25
№ 156
Электродвижущая сила элемента Даниэля-Якоби, в котором концентрация
Cu
2+
и Zn
2+
равны, при 18
о
С равна 1,1 В. Вычислить э.д.с. цепи, в которой
концентрация Cu
2+
и Zn
2+
составляют величины указанные в таблице.
Концентрация
Cu
2+,
моль/л
0,0005
Концентрация
Zn
2+,
моль/л
0,5
Задача решается по формуле:
1
ln
2
a
RT
o
E E
nF a
где n – число электронов,
принимающих участие в окислительно-восстановительной реакции (в данном
случае n = 2)
Электродвижущая сила элемента Даниэля-Якоби, в котором концентрация
Cu
2+
и Zn
2+
равны, при 18
о
С равна 1,1 В. (по условию)
2
Cu
Cu
E
-
2
Zn
Zn
E
=
2
0
Cu
Cu
E
+
0,059
2
lgC(Cu
2+
)-
2
0
Zn
Zn
E
-
0,059
2
lgC(Zn
2+
)=
2
0
Cu
Cu
E
-
2
0
Zn
Zn
E
=0,337-(-0,763)=1,1 в.
46
Тогда Е = 1,1 +
2
0,059
lg
2
a
Cu
n a
Zn
При с > 0,01 моль/л нельзя принимать активность равной концентрации
a = γ C
Для вычисления активности используются также следующие соотношения:
2
0,509
lg
1
lg
10 ,
z I
I
где z – заряд иона, I – ионная сила, вычисляемая по уравнению:
1
2
2
I z C
i
i
,
где суммирование осуществляется по всем ионам, присутствующим в
растворе. (Следует иметь ввиду, что в элементе Даниэля-Якоби
используются растворы сульфатов цинка и меди).
С
Сu2+
= 0,0005. В этом случае а
1
= С
Сu2+
= 0,0005
Для а
2
¹С
Zn2+
а
2
= С
Zn2+
= 0,5
2
0,509 2
lg
1
I
I
2 2 2 2
1
2 0,5 2 0,5 2 0,0005 2 0,0005 2,002
2
I
(В растворе присутствуют Сu
2+
, Zn
2+
, SO
4
2-
(из CuSO
4
), SO
4
2-
(из ZnSO
4
)
0,509 4 2,002
lg 1,1929
1 2,002
lg
10
1,1929
10 15,5
а
2
= С
Zn2+
= 0,5=7,795
Е = 1,1 +
2
2
0,059
lg
Cu
Zn
a
n a
0,059 0,0005
E = 1,1 + lg 1,1 0,0295 lg0,0005 lg7,795
2 7,795
1,1 0,0295 4,19 1,1 0,124 0,976в
Ответ: Е = 0,976 в.
№ 163. Указания: Концентрации ионов следует найти из данных по
электропроводности таким образом: С
нон
= С раствора; = /
∞
№ 163. Вычислить э.д.с. цепи:
Ag | 0,1 M AgNO
3
| | 0,01 M AgNO
3
| Ag
при 25
о
С. Эквивалентная электропроводность раствора 0,1 М AgNO
3
равна
10,93, а раствора 0,01 М AgNO
3
равна 12,53 Cмм
2
моль
-1
.
47

№163
Дано:
Т = 25
о
С =298 К
R = 8,314 Дж/моль К
М1
(AgNO
3
) = 10,93Cмм
2
моль
-1
С
1
= 0,1 моль/л
М2
= 12,53 Cмм
2
моль
-1
С
2
= 0,01 моль/л
F = 9,648’10
4
Кл/моль
-
Е - ?
Решение:
Эквивалентная электропроводность
раствора при бесконечном разведении
∞
равна сумме подвижностей Cat и An = /
∞
;
∞
=
о
+
+
о
-
Для AgNO
3
, т.е. для Ag
+
+ NO
3
-
предельные подвижности берём из таблицы:
о
+
(Ag
+
) = 61,90
о
-
(NO
3
-
) = 71,46
n – число электронов, принимающих участие в реакции
1.
∞
= 61,90 + 71,46 = 133,36 Смм
2
моль
-1
10,93
= 0,082
1
133,36
а
12,53
а (AgNO )= =0,94
2 3
133,35
2. Находим концентрацию ионов по электропроводности:
С
1ион
= С = 0,082 0,1 = 0,0082 моль/л
С
2ион
= С = 0,094 0,01 = 0,00094 моль/л
3. Оба электрода сделаны из одного и того же металла и погружены в
растворы с различной концентрацией ионов этого же металла. Такие
элементы называют концентрационными.
Электродвижущую силу концентрационного элемента следует искать по
уравнению вида:
1
ln
2
a
RT
E
nF a
8,314 298 0,0082
ln 0,0257 4,80 6,97 0,056
4
0,00094
9,648 10
Е
Ответ: э.д.с. цепи Е = 5,610
-2
в.
№ 164. Указания: Потенциал стандартного водородного электрода, по
определению, равен нулю. Поэтому э.д.с. ячейки равна потенциалу
водородного электрода, погруженного в желудочный сок
48
ln ln
2
2
RT RT
E a P
H
H
F F
с обратным знаком. Поскольку Р
Н2
= 1 по условию
задачи, то активность ионов водорода вычисляется так:
EF
RT
a e
H
, тогда рН =
lga
H
№ 164
Э.д.с. цепи равно 0, 082 В при 298 К. Определить рН желудочного сока.
Решение:
Используем формулы:
EF
RT
a e
H
и рН =
lga
H
0,08296480
8,314 298 3,19
2,718 2,718 0,04117
EF
RT
a e
H
a
H
рН = -lg0,04117= 1,385
Ответ: рН желудочного сока составляет 1,385, то есть среда очень
кислая.
№ 165. Указания: Эту задачу следует решать в предположении, что
активности ионов, участвующих в электродных реакциях, равны их
концентрациям. Вычисления проводятся с использованием уравнения
Нернста (н-р, задача 153) с учётом того, что при разбавлении изменяется
потенциал только одного (цинкового) электрода, а потенциал другого
электрода остаётся неизменным.
2
2
ln
2
a
o o
Cu Zn
a
RT Cu
E E E
F Zn
где Е
о
– стандартный потенциал, Е –
электродвижущая сила, F – число Фарадея.
№ 165. Цинковый электрод погружён в 0,1 н раствор сульфата цинка.
Вычислить, насколько изменится потенциал цинка, если раствор разбавить в
10 раз. Предположить сначала, что кажущаяся степень диссоциации при
разбавлении не изменяется, а затем учесть, что в 0,1 н растворе составляет
0,40, а в 0,01 н растворе – 0,64.
Решение:
1. Предположим, что кажущаяся степень диссоциации при разбавлении не
изменяется
С(ZnSO
4
) = 0,1 н
стандартный
водородный
электрод
раствор HCl
насыщенный
желудочный
сок
водородный
электрод;
р(Н
2
)=1 атм
49

С
1
(Zn
2+
) = 0,1
1
= 0,4
C
2
(Zn
2+
) = 0,01
2
= 0,4
Е
Zn
= Е
o
(Zn) +
0.059
lga
n
Активности ионов, участвующих в электродных реакциях, равны их
концентрациям
С
1ион
= С
а
1
= С
1ион
= 0,40,1 =0,04моль/л
a
2
= С
2ион
= 0,4 0,01= 0,004 моль/л
Zn
2+
+ 2e =Zn Е
o
(Zn) = - 0,763
Е
1Zn
= -0,763 + 0,0295lg 0,04 = - 0,804
Е
2Zn
= -0,763 + 0,0295lg 0,004 = - 0,834
∆E = - 0,804 – (- 0,834) = 0,03 в
2. Кажущаяся степень диссоциации в 0,1 н растворе составляет 0,40, а в
0,01 н растворе – 0,64.
При С (ZnSO
4
) = 0,1 C (Zn
2+
) = C = 0,1 0,4 = 0,04;
Е
1Zn
=
0.059
0,763 lg 0,04 0,804
n
в
При С (ZnSO
4
) = 0,01 C (Zn
2+
) = 0,010,64= 0,064
Е
2Zn
=
0.059
0,763 lg 0,0064 0,828
n
в
∆Е = -0,804в – (-0,828в) = 0,024 в
Ответ: потенциал цинка изменится в первом случае на 0,03 в, а во
втором – на 0,024 в
№ 166. Указания: Сначала из значений произведения растворимости следует
определить концентрации, а затем э.д.с. вычислить по формуле для
концентрационного элемента.
Электродвижущую силу концентрационного элемента следует искать по
уравнению вида:
1
2
ln
a
RT
E
nF a
.
Для упрощения можно принять активности а
1
и а
2
равными концентрациям.
№ 166. Произведение растворимости хлорида серебра равно 1 10
-10
(моль/л)
2
, а бромида серебра - 2 10
-13
(моль/л)
2
. Вычислить э.д.с. цепи:
Дано:
ПР
AgCl
= 1 10
-10
(моль/л)
2
Ag AgCl
насыщенны
й водный
раствор
AgBr
насыщенны
й водный
раствор
Ag
50
