Ильясов С.Г. Процессы и аппараты упаковочного производства
Подождите немного. Документ загружается.


инженерной практике. На основе материального баланса определяют выход продукта
по сравнению с теоретически возможным (в %), а также количество (массу)
получаемых продуктов в единицу времени. Согласно закону сохранения, масса
(количество) поступающих на переработку веществ \Сд) должна быть равна массе
веществ, получаемых в результате роведения процесса (vga т.е.
В практических условиях при проведении технологического процесса происходят
необратимые потери вещества ]^бд (например, со точными водами или газовыми
выбросами, через неплотности ишаратуры и т.п.), поэтому материальный баланс в
общем случае принимает вид
Для нестационарных процессов материальный баланс имеет несколько иной вид, так
как потоки, направленные внутрь рассматриваемого объема (приход), и потоки,
направленные наружу ^расход), могут быть не равны (например, происходит
накопление массы), т.е.
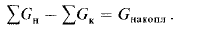
Приход — Расход = Накопление, или
Для стационарных процессов правая часть
выражения (1.5) равна нулю, и без учета потерь
оно приобретает вид уравнения (1.3).
Материальный и энергетический балансы в
макрообъемах (например, в аппарате) при
взаимодействии, например, двух фаз для гепло-
или массопереноса будут зависеть от их
относительного движения. Наиболее
распространенные виды такого относительного
движения потоков (или фаз) представлены на рис.
1-1. При рассмотрении конкретных процессов
тепло- и массопереноса будет показано, что
температуры (для теплопереноса) или
концентрации (для массопереноса) потоков на
выходе из аппаратов могут существенно
различаться, например, для прямоточного (рис. 1-
1, а) и про-швоточного (рис. 1-1,6) движения
потоков при одних и тех же их значениях
(начальных температур и концентраций) на входе
в аппараты. Проиллюстрируем это положение
следующим примером.
Рис. 1-1. Взаимное направление движения
потоков в аппаратах:
а прямоток; ^-противоток
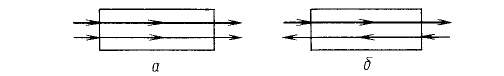
Рассмотрим установившийся процесс поглощения
газа жидкостью (абсорбцию), например
поглощение аммиака водой из аммиачно-
воздушной смеси (рис. 1-2) при условии
отсутствия перемешивания фаз по высоте
аппарата. Количество компонента (аммиака),
переходящего из газовой фазы в жидкую, из
выражения (1.1) определяется как
м == м, = G{y^ - v,) = L(^ - ^),
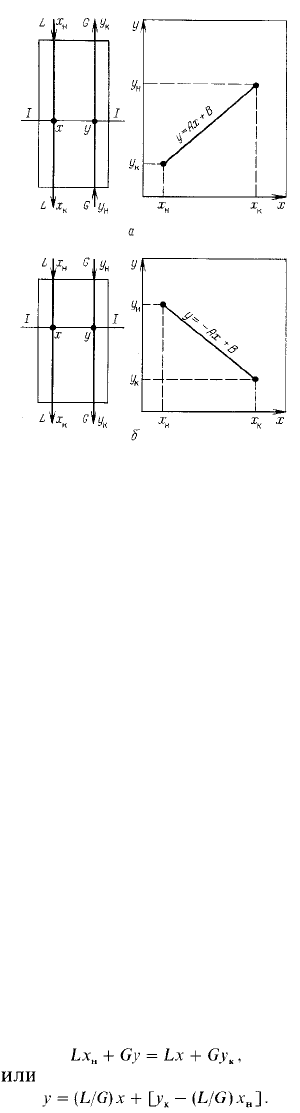
Рис. 1-2. К выводу уравнений материального
баланса и рабочей линии процесса (на примере
абсорбции):
а противоток; б - прямоток
где G и L-расходы соответственно инертного газа
и жидкости, кмоль/с; у^ и \\ - концентрации
компонентов газа на входе в аппарат и выходе из
него, кмоль/кмоль инертного газа; -v„, х^ -
концентрации компонента в жидкости на входе в
аппарат и выходе из него, кмоль/кмоль инертной
жидкости.
Для того чтобы получить связь между текущими
концентрациями в фазах, запишем материальный
баланс для верхней части аппаратов (сечение 1-1,
рис. 1-2, а):

Поскольку L/G == const, а второй член правой части уравнения (1.7) также является
постоянной величиной, получим
где А = L/G -тангенс угла наклона прямой линии; .о—отрезок, отсекаемый на оси
ординат прямой линией.
Уравнение (1.8) описывает связь рабочих концентраций компонента в потоках, обычно
его называют уравнением рабочей линии.
Для прямоточного движения потоков уравнение рабочей линии получают по аналогии
с предыдущим случаем:
Уравнение (1.9) отличается от (1.8) знаком перед коэффициентом А. На рис. 1-2,д и 1-
2,6 построены линии рабочих концентраций по уравнениям (1.8) и (1.9), которые в
дальнейшем, после рассмотрения условий равновесия систем (гл. 2), позволят подойти
к определению движущих сил процессов переноса массы.
1.2. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ
Из первого закона термодинамики может быть сформулировано выражение закона
сохранения энергии: внутренняя энергия U изолированной от внешней среды системы
постоянна, т. е. U = const.
22
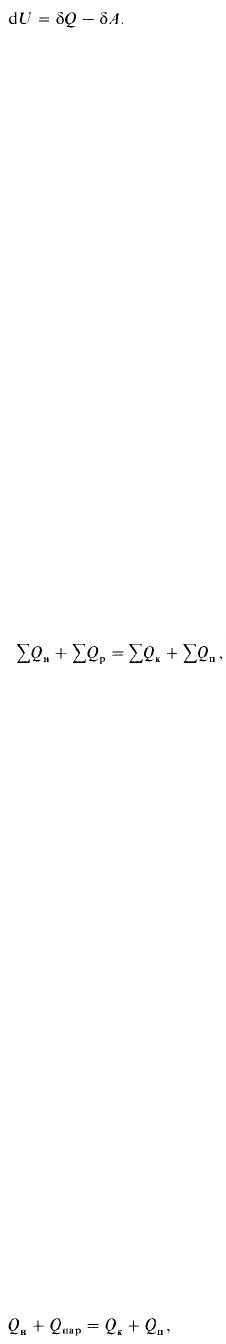
i огда
В уравнении (1.10) величины теплоты SQ и производимой рабо-i i»i 8 А характеризуют
не систему, а процессы ее взаимодействия i окружающей средой, поэтому они не
являются полными дифференциалами. Переход системы из одного энергетического
состояния ц другое характеризуется новым значением внутренней энергии I/, sbk как U
меняется на определенную величину независимо от пути перехода.
Уравнение (1.10) без большой ошибки может быть использовано н качестве закона
сохранения теплоты.
Энергетический баланс. При анализе и расчете химико-техно-югических процессов
часто необходимо определить расход энергии па его проведение, и в частности,
теплоты. Чтобы определить расход теплоты, составляют тепловой баланс как часть
общего щергетического баланса. Тепловой баланс составляют для многих процессов,
протекающих в реакторах, теплообменных аппаратах, массообменных аппаратах
(перегонка жидкостей, сушка и т.п.).
По аналогии с материальным балансом тепловой баланс в общем виде выражается
следующим образом:
; ic \Q^ теплота, вводимая в аппарат с исходными материалами; ^Qp тепловой >ффект
физических и химических превращений; ^бк теплота, выводимая из аппарата
продуктами; ^бп потери теплоты в окружающую среду.
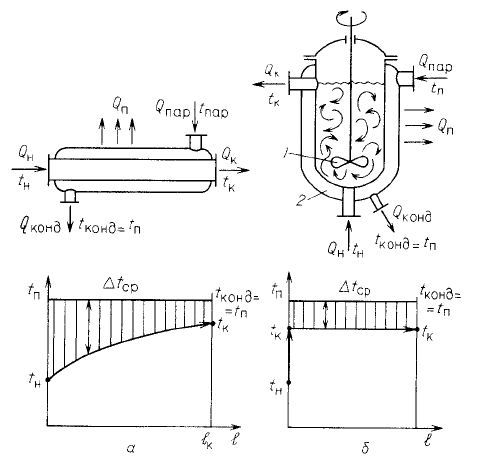
На рис. 1-3 приведены примеры нагревания жидкости в аппаратах идеального
вытеснения и идеального смешения. В аппарате идеального вытеснения температура
жидкости плавно изменяется по длине аппарата / от начальной ^ до конечной ^, так как
текущие н аппарате объемы жидкости вытесняют друг друга, не смешиваясь. 1^
аппарате идеального смешения поступающая жидкость прак-гически мгновенно
смешивается с находящейся в аппарате, поэтому начальная температура /ц жидкости в
таком аппарате мгновенно изменяется до конечной ^.
Средняя разность температур At^p при условии сохранения начальных температур
нагреваемой жидкости ^ и греющего пара t^ (средняя движущая сила процесса) в
аппарате идеального вытеснения выше, чем в аппарате идеального смешения.
Следовательно, н количество переданной при этом теплоты в аппарате идеального
вытеснения больше, т.е. бк.выт > бк.смеш-
Тепловой баланс для обоих случаев идентичен:
но значения величин, входящих в уравнение (1.12), различны. Поэтому при
составлении тепловых балансов часто приходится принимать модель, по которой
работает данный аппарат (идеальное вытеснение, идеальное смешение и т. д.-см. гл. 5),
что приводит
Рис. 1-3. Изменение температуры при нагревании жидкости в аппаратах идеального
вытеснения (а) и идеального смешения (о):
а-двухтрубный теплообменник; б -аппарат с мешалкой (7) и паровой рубашкой (2)
к определенной ошибке, так как работа реального аппарата может отличаться от
работы принятой модели.
Помимо расхода теплоты, энергетический баланс позволяет определить расходы
кинетической и потенциальной энергии на проведение процесса (перемещение
жидкостей, сжатие и транспортирование газов и др.).
1.3. ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА
Закон сохранения импульса (количества движения) является общим выражением
первого закона термодинамики [уравнение (1.10)] для контрольного объема (см. рис. 1-
1). Импульс по определению равен произведению массы выделенного элемента
жидкости т на вектор скорости его движения н
7
; следовательно, импульс mw-тоже век-
тор. Поэтому закон сохранения импульса можно представить и в векторной форме, и в
скалярной-в виде трех скалярных уравнений в направлениях осей координат х, у, z.
Баланс количества движения (или импульса) будет рассмотрен в гл. 3 при выводе
основных уравнений движения потока.
Подробнее балансы субстанций (массы, энергии и импульса) будут рассмотрены далее
при анализе и расчете конкретных процессов тепло- и массопереноса.
24
'РОСЫ ДЛЯ САМОКОНТРОЛЯ
выразите закон сохранения массы для системы, состоящей из ч)иого компонента, и для
многокомпонентной системы. Что понимают под плотностью конвективного потока?
Но каким признакам разделяют материальные балансы? Приведите выражения
материальных балансов для стационарных :( нестационарных процессов. Что
понимают под уравнением рабочей линии? Приведите выражение теплового баланса
аппарата.
ГЛАВА 2
ЗАКОНЫ РАВНОВЕСИЯ
(
'ионные положения закона термодинамического равновесия в системах
рассматриваются в курсах физической химии и термо-
..тамики. Поэтому в данном разделе основное внимание уделено ц; пменению этих
законов для решения инженерных задач-опре-
| гению направления и движущей силы процессов химической \пологий.
Обычно химико-технологические процессы осуществляются при шмо действии фаз.
Контакт между фазами может быть непосред-
. пенным (большинство процессов переноса массы) или через раз-'яющую стенку
(большинство процессов переноса энергии-и юты).
< )сновная задача химико-технологического процесса состоит поправленном
(заданном) изменении макроскопических свойств иствующих в этом процессе
веществ: состава, агрегатного со-ояпия, температуры, давления. Для этого на систему
воздейст-|о1 подачей или отводом теплоты, внешними силовыми полями ,);|
витационными, центробежными и др.), перемещением под исгвием силы давления и
т.п., что приводит к переносу субстан-
• .ш энергии, массы, импульса. Предельным состоянием системы , 1яется подвижное
равновесие, которое не приводит к изменению
' |кроскопических свойств участвующих в процессе веществ во
рсмени и пространстве. Таким образом, равновесным называют !кое состояние
системы, при котором перенос субстанций от-
!
ствует.
S УСЛОВИЯ ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ
. ювия равновесия в процессах переноса теплоты (теплового ишовесия) определяют
сравнительно простыми измерениями тем-' ратур соприкасающихся фаз (см.,
например, рис. 1-3). Механи-\ кое равновесие (при переносе импульса) обнаруживают
по равен-
25

ству непосредственно измеренных давлений в соприкасающихся фазах. Намного
сложнее определение условия равновесия системы в процессах переноса массы.
Поэтому здесь данному виду равновесия будет уделено основное внимание.
Процесс перехода массы из одной фазы в другую в изолированной замкнутой системе,
состоящей из двух или большего числа фаз, возникает самопроизвольно и протекает до
тех пор, пока между фазами при данных условиях (температуре и давлении)
установится подвижное фазовое равновесие. Оно характеризуется тем, что в единицу
времени из первой фазы во вторую переходит столько же молекул компонента,
сколько из второй в первую (т. е. преимущественного перехода вещества из одной
фазы в другую нет). Достигнув состояния равновесия, система может находиться в нем
без количественных и качественных изменений сколь угодно долго, пока какое-либо
внешнее воздействие не выведет ее из этого состояния. Таким образом, состояние
изолированной системы при равновесии определяется только внутренними условиями.
Поэтому градиенты интенсивных параметров и соответствующие им потоки должны
быть равны нулю:
где Т температура; Р давление; ц, химический потенциал i-го компонента.
Выражения (2.1)-(2.3) называют условиями соответственно термического,
механического и химического (материального) равновесия.
Все самопроизвольные процессы протекают в направлении достижения равновесия.
Чем в большей степени состояние системы отклоняется от равновесия, тем выше
скорость процесса переноса субстанций между фазами вследствие увеличения
движущей силы, обусловливающей этот процесс. Поэтому для осуществления про-
цессов переноса субстанций необходимо не допускать установления состояния
равновесия, для чего к системе подводят вещество или энергию. На практике в
открытых системах это условие обычно реализуется путем создания относительного
движения фаз в аппаратах с противоточной, прямоточной или другими схемами дви-
жения потоков.
Из второго закона термодинамики следует, что в самопроизвольных процессах
энтропия S системы возрастает и в условии равновесия достигает максимального
значения, т. е. в этом случае
Уравнение (2.4), а также уравнения (2.1)-(2.3) определяют условие равновесия
системы.
Химический потенциал в выражении (2.3) определяется как приращение внутренней
энергии U системы при добавлении к системе бесконечно малого количества молей г-
го компонента, отнесенное к этому количеству вещества, при постоянных объеме F,
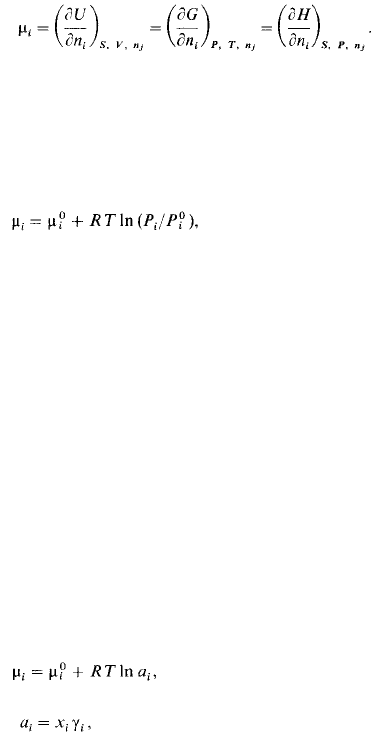
ропии S и количествах молей каждого из остальных компонен-' .^ (где п^= 1, 2, 3, ...).
\\ общем случае химический потенциал может быть определен к приращение любого
из термодинамических потенциалов систе-| при различных постоянных параметрах:
энергии Гиббса G -при '.чоянных давлении Р, температуре Г и п^ энтальпии Я-при ^
юянных S, Р и rij. 1 а ким образом,
Химический потенциал зависит не только от концентрации i итого компонента, но и от
вида и концентрации других компот-шов системы. Для смеси идеальных газов ц^.
зависит лишь от • чщентрации рассматриваемого компонента и температуры:
' р^' значение ц, при стандартном состоянии (обычно при Р, == 0,1 МПа), зависит ii>Ko
от температуры; /^.парциальное давление i-го компонента смеси; Р° -давле-| /1о
компонента в стандартном состоянии.
Химический потенциал характеризует способность рассматри-згмого компонента к
выходу из данной фазы (испарением, крис-| i шзацией и т.п.). В системе, состоящей из
двух и более фаз, ' |к'ход данного компонента может происходить самопроизвольно
"и*ко из фазы, в которой его химический потенциал больше, ф.пу с меньшим
химическим потенциалом. В условиях равновесия имический потенциал компонента в
обеих фазах одинаков.
В общем виде химический потенциал может быть записан юдующим образом:
