Гинберг А.M. и др. Технология важнейших отраслей промышленности
Подождите немного. Документ загружается.

221
хорошей жидкотекучестью, достаточно высокими механическими свойствами и
малой усадкой.
Лучшими литейными сплавами являются силумины
(нa основе алюминий ~
кремний), из которых изготовляют детали различных приборов и
радиоаппаратов,
корпуса турбонасосных aгрегaтов,и др. В литейные сплавы
иногда вводятся легирующие элементы — титан, марганец.
Иногда применяют спеченные сплавы стандартного состава, полученные из
порошков (САС), и сплавы из спеченной алюминиевой пудры (САЛ). К
порошковым сплавам относятся, в частности, сплавы марок Д16П,
АК4П.
Магний быстро окисляется на воздухе, имеет весьма низкие механические
свойства. Поэтому как конструкционный материал он не применяется, а
вводится
в качестве компонента в сплавы. Магниевые сплавы делятся на
деформируемые и литейные. Деформируемые магниевые сплавы:
MA1, МА2,
МА3 и т. д. — выпускаются
в виде прутков, листов н другого сортамента.
Магниевое литье (сплавы марок МЛ5, МЛ6) широко используется в
авиационной и приборостроительной технике для изготовления деталей
самолетов, двигателей, корпусов приборов. Широкое применение магниевого
литья объясняется, в частности, малой плотностью магния, что обеспечивает
получение деталей малой массы.
Tитан — малопрочный серебристо-серый металл,
в чистом виде в технике
не применяется. Технически чистый титан с малым количеством примесей
(железа, кремния, углерода и др.) выпускается двух марок BT1-00 и BTl-0.
Введение в титан различных компонентов позволяет получать требуемые
свойства сплавов. ГОСТ 19807 — 74 регламентирует выпуск 17 марок титана и
его сплавов (с алюминием, марганцем, молибденом, цирконием и др.), из
которых заготовки деталей получают обработкой давлением. Основными
марками титановых сплавов являются: BT5-I, ОТ4-1, ВТ14, ВТ22 и другие,
обладающие высокой прочностью, коррозионной стойкостью, в оIдельных
случаях жаропрочностью и термической стабильностью.
Применяют также литейные титановые сплавы (BT5Л, ВТ21Л и др.),
обеспечивающие высокую плотность отливок. Эти сплавы дают малую
линейную усадку, не подвержены образованию трещин в горячем состоянии,
что позволяет изготовлять отливки сложной формы.
Плавка и разливка титановых сплавов производится в защитой атмосфере и
вакууме.
Баббиты представляют собой сплавы на основе олова или свинца с
добавками меди, сурьмы и других элементов. По ГОСТ 1320 - 74 предусмотрен
выпуск оловянных и свинцовых баббитов, по ГОСТ 1209 — 78 — кальциевых.
Баббиты обладают высокими механическими свойствами при повышенных
температурах, хорошими антифрикционными и антикоррозионными
свойствами, хорошо прирабатываются. Лучшими сплавами, применяемыми для
222
заливки подшипников паровых турбин дизелей, турбокомпрессоров,
работающих при больших скоростях и нагрузках, являются Б83 и Б88.
Наиболее дешевые свинцовые баббиты используют для заливки
подшипников различных транспортных средств (железнодорожных вагонов,
трамваев и др.).
§ 16.6. Коррозия металлов
Коррозией металлов называют разрушение металлических материалов
вследствие их физико-химического взаимодействия с окружающей средой.
Коррозия металлов наносит большой ущерб народному хозяйству.
Разрушение металлических конструкций в атмосфере, коррозия корпусов
судов и различных морских и речных сооружений, коррозия металлических
трубопроводов различного назначения, коррозионное разрушение кабелей,
рельсов и др., по которым протекает электрический ток при их нахождении в
земле» разъедание химических аппаратов и установок, коррозия машин и
приборов, образование окалины на металле при его горячей обработке — все
это примеры коррозии.
В настоящее время не существует достаточно точных данных о
коррозионных потерях, однако, по общепринятому мнению, около
1/3
добываемого металла во всем мире выбывает из технического употребления в
результате коррозии. При этом считается, что около 2/3 некоррелированного
металла регенерируется в результате переплавки металлолома (скрапа) в
мартеновских печах, а остальная часть, составляющая около 10% от количества
выплавляемого металла, теряется в виде пыли.
Сделаны попытки подсчета коррозионных потерь исходя из металлического
фонда страны. Безвозвратные потери металла от коррозии по истечении срока
его службы, определяемого в 12-14 лет, могут быть оценены в 6—7%, а
абсолютный размер безвозвратных по- терь металла oт коррозии
соответственно массе металлофонда страны в 1975 г. — около 5,5 млн. т.
Однако по последним данным, приведенным академиком А. П. Александровым
на одной из сессий Академии наук СССР, ежегодные потери металла от
коррозии составляют 15 млн. т, что подтверждает большую достоверность
ранее приведенных расчетов.
С развитием промышленного потенциала во всех странах темп роста
коррозионных потерь стал превышать темп роста металлического фонда.
Следует при этом учитывать, что безвозвратные потери, в первую очередь
черных металлов, значительно ускоряют использование их природных
ресурсов. Однако основной вред от коррозии связан не столько с потерей
самого металла, сколько с выходом из строя металлических конструкций,
стоимость которых в большинстве случаев значительно превышает стоимость
металла, из которого они изготовлены.
Не меньшие убытки народному хозяйству наносят связанные с коррозией
аварии машин и сооружений, порча продукции заводов пищевой и химической
223
промышленности, происходящая вследствие загрязнения продуктами коррозии,
увеличение расхода металла, обусловленное завышенными допусками на
коррозию, а также простои оборудования, связанные с его ремонтом. Сюда же
относятся затраты на профилактику, ремонт и замену вышедших из строя
деталей. Весьма значительной статьей убытков является необходимость в
проведении комплексных мероприятий по борьбе с коррозией: замена обычных
сталей легированными, нанесение различных покрытий, смазок и ингибиторов.
В промышленно развитых странах убытки от коррозии составляют
примерно 5—10% от национального дохода. По последним данным, только
прямой ущерб, вызываемый коррозией изделий и сооружений из металла, к
середине 70-х годов в СССР достиг 13-14 млрд. руб. в год. В США общие
убытки, причиняемые коррозией металлов, превышают в настоящее время 70
млрд. долл. в год.
Все это указывает на большую важность изучения коррозионных процессов
и коррозионных потерь и проведения аффективной борьбы с коррозией
металлов путем разработки и внедрения соответствующих мер
противокоррозионной защиты. Наряду с этим важное значение имеет
общегосударственное планирование и координация проводимых научных
исследований по коррозии металлов и практических мероприятий по борьбе с
коррозией металлических конструкций, машин и механизмов.
Чрезвычайно важна работа в области экономики коррозии металлов и
противокоррозионной защиты и, в частности, разработка соответствующих
методик по сравнительно точному определению убытков от коррозии и
определение технико-экономической эффективности и мер антикоррозионной
защиты. Общегосударственный подход к проведению антикоррозионных
мероприятий предусматривает достаточную осведомленность широкого круга
экономистов, технологов, конструкторов и научных сотрудников в вопросах
коррозии для успешного решения задач, поставленных в этой области.
Классификация коррозионных процессов
По механизму протекания процесса различают два типа коррозии
металлов: химическую и электрохимическую.
Химическая коррозия — это коррозионный процесс, протекающий в
средах, не проводящих электрический ток. Электрохимическая коррозия
обычно сопровождается протеканием электрического тока.
Коррозия по условиям протекания бывает следующая:
Газовая — коррозия металла в газах при высоких температурах.
Коррозия в неэлектролитах (например, коррозия стали в бензине).
Атмосферная коррозия различных металлических конструкций на
воздухе.
Коррозия в электролитах — в проводящих электрический ток жидких
средах (например, коррозия в морской воде, в расплавленных солях и т.
д.).
224
Почвенная (например, коррозия подземных трубопроводов).
Коррозия внешним током или электрокоррозия (например, коррозия
подземной трубы блуждающими токами).
Контактная — электрохимическое разрушение металлов,
происходящее в результате контакта различных металлов в электролите
(например, коррозия деталей из алюминиевых сплавов,
соприкасающихся с деталями из меди).
Структурная — связанная со структурной неоднородностью металлов;
например, ускорение коррозионного процесса чугуна в растворе серной
кислоты в результате имеющихся в нем включении графита.
Коррозия под напряжением (статическим). изменяющимся по значению
и знаку, что часто вызывает коррозионную усталость — понижение
предела выносливости металла (например, коррозия рессор, с стальных
канатов и т. д.). Коррозия при трении: например, разрушение шейки
вала при вращении в морской воде.
Щелевая, протекающая в узких щелях и зазорах ме
жду отдельными
деталями.
Биокоррозия — коррозия металлов под воздействием продуктов,
выделяемых микроорганизмами и пота рук человека.
По характеру коррозионного разрушения коррозия бывает следующей.
Общая или сплошная коррозия, охватывающая всю поверхность металла. Этот
вид коррозии в свою очередь подразделяется на:
а) равномерную;
б) неравномерную, когда коррозионный процесс по скорости
неодинаков на различных участках.
в) местная, охватывающая лишь отдельные участки поверхности
металла.
Местная коррозия бывает: пятнами, язвами в виде отдельных точек
(питтинг), сквозная, подповерхностная, начинающаяся на поверхности, по
распространяющаяся преимущественно под поверхностью, межкристаллитная,
меняющая механические свойства металла и вызывающая коррозионное
растрескивание и т. п.
Химическая коррозия металла.
Этот тип коррозии наблюдается при действии на металлы сухих газов
(продуктов горения топлива и др.) и жидких неэлектролитов (нефти, бензина и
т. п.). Наиболее распространенным видом химической коррозии является
газовая коррозия, происходящая в газах при высокой температуре
(металлическая аппаратура нагревательных печей, двигателей внутреннего
сгорания, газовых турбин, аппаратов синтеза аммиака и др.), а также в ходе
различных технологических процессов (при термообработке, нагреве перед
прокаткой, ковкой, штамповкой и т. п.). В большинстве случаев продукты
газовой коррозии образуются и остаются на металле в виде пленки, характер
которой определяет ее защитные свойства.
225
Пленки на металлах по толщине мoгyт быть подразделены на три группы.
Тонкие (невидимые) с толщиной от единиц до 40,0 нм (400
А).
Средние (дающие цвета
побежалости), толщина которых колеблется от 40,0
до 500,0 нм (от 400 до 5000
А),
Толстые (видимые) толщиной свыше 500,0 нм (5000 А;
к этим пленкам относится также термическая окалина на стали). Защитными
свойствами могут обладать только пленки, покрывающие сплошным слоем всю
поверхность металла.
Характер пленки определяется условиями, сформулированными Пиллингом
и Бедвортсом следующим образом: если v
ок
/v
м
< 1, то пленка не может быть
сплошной; если v
ок
/v
м
> 1, то пленка может быть сплошной. Обобьем оксида;
v
ок
— объем металла, пошедшего на образование молекулы оксида). Для
щелочноземельных металлов (К, Na, Ca, Mg и др.) соотношение v
ок
:
v
м
находится в пределах 0,45 : 0,81. На этих металлах образуются рыхлые
пористые пленки. На таких металлах, как Cd, Al, Sn, Zn, Be, Си, Si, Fe и др., в
результате химической коррозии характерно образование сплошных или
малопористых пленок (v
ок
:
v
м
находится в пределах 1,21 : 2,14). По мере
утолщения таких пленок скорость коррозии металла тормозится. При
определенных толщинах образуются совершенно сплошные пленки,
обладающие значительными защитными свойствами
Электрохимическая коррозия металлов
Основное отличие электрохимического механизма коррозии металлов от
чисто химического заключается в том, что взаимодействие среды с металлом
разделяется на два в значительной степени самостоятельно протекающих
процесса: анодный и катодный. В большинстве случаев для электрохимической
коррозии характерна локализация анодного и катодного процессов на
различных участках, что является вторым существенным отличием
электрохимического механизма от чисто химического. Электрохимическая
коррозия аналогична реакции в гальваническом элементе, работа которого
кратко рассмотрена ниже.
Все металлы, погруженные в электролит, в большей или меньшей степени
стремятся перейти в раствор с образованием соответствующих ионов. Водные
растворы электролитов состоят из положительно заряженных (катионов) и
отрицательно заряженных (анионов) частиц, окруженных оболочкой из
молекул воды (гидра- тированных ионов). Молекулы воды имеют удлиненную
форму, причем положительные и отрицательные заряды расположены в разных
концах молекулы. Ион-атомы, находящиеся на поверхности металла,
притягиваются диполями воды, и если силы притяжения больше, чем силы
связи между ионами и электронами ов металле, то некоторое количество ионов-
атомов перейдет в раствор в виде гидратированных ионов-атомов. Эти ионы
вследствие электростатического притяжения электронами, находящимися в
металле, не могут удалиться от его поверхности. Образовавшийся двойной
226
электрический слой состоит из электронов, находящихся в металле, и
гидратированных ионов, находящихся в растворе. Двойной слой,
образующийся на границе между металлом и электролитом, определяет
электродный потенциал данного металла.
Для определения электродного потенциала металла измеряют разность
потенциалов между двумя электродами, при этом в качестве одного из
электродов обычно берется так называемый нормальный водородный электрод,
потенциал которого условно принят за нуль. Величина скачка потенциала на
поверхности металла при погружении его в электролит (потенциал металла)
зависит не только от характера двойного слоя, образовавшегося при
погружении металла в электролит, но и от процессов, установившихся на
электроде.
Так, между металлом и раствором, содержащим одноименные ионы
металла, постоянно происходит обмен ионами. Ион-атомы из металла
переходят в раствор, а ионы металла из раствора приобретают электроны и
осаждаются на металлической поверхности. Через некоторое время,- когда
скорости перехода ионов в раствор и осаждения атомов станут одинаковыми,
устанавливается динамическое (подвижное) равновесие. Электродные
потенциалы при этом являются равновесными. В случае если активная
концентрация ионов металла в растворе составляет 1 грамм-ион на литр, то
потенциал условно называется
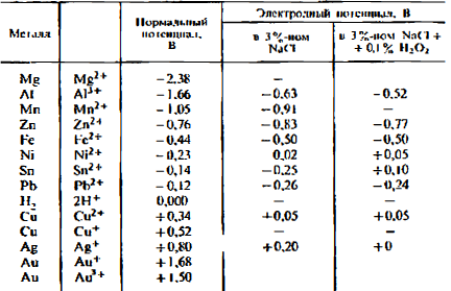
нормальным или стандартным. Ряд металлов,
расположенных по убывающим (или возрастающим) значениям нормальных
потенциалов, называется
рядом напряжений. Условно металлы, стоящие в
ряду напряжений выше водорода, называют электроотрицательными, а ниже —
электроположительными. Потенциал, который возникает при погружении
металла в электролит, не содержащий ионов данного металла, называется
электродным потенциалом металла. Нормальные и электродные потенциалы
некоторых металлов даны в табл.
16.1.
Таблица 16.1
Если два различных металла в электролите привести в соприкосновение, то
они образуют гальванический элемент, в котором металл с более
отрицательным потенциалом будет анодом, а с более положительным —
катодом.
227
В качестве примера возьмем железо и никель, помещенные в раствор
серной кислоты. Так как потенциал железа отрицательнее потенциала никеля,
железо станет анодом. Этой гальванической пары и будет растворяться,
посылая ионы в раствор, а освободившиеся при этом электроны будут
перетекать по соприкасающимся металлам к поверхности никеля, где будут
нейтрализовать притягивающиеся к катоду ионы водорода. Образующиеся
атомы водорода соединяются в молекулы и у катода выделяются пузырьки
газообразного водорода, отрывающиеся от поверхности металла и
удаляющиеся из раствора. Этот процесс может продолжаться до полного
растворения железа. Коррозию металлов можно рассматривать как результат
действия множества коррозионных микроэлементов, находящихся на
поверхности металла в соприкосновении с электролитом. Эти микроэлементы
возникают вследствие того, что технические металлы, как правило, содержат
примеси и включения в виде различных других металлов, их сплавов и
различных загрязнений, образующих анодные и катодные участки. Причиной
их образовании может быть и физическая неоднородность — различная
механическая обработка (например, нагартовка
) разных участков металлов, а
также неравномерное обтекание кислородом (аэрация и др. Разность
потенциалов может возникать также между ребром и гранью одного и того же
кристалла.
Известно, чтo разность потенциалов между замкнутыми электродами
гальванического элемента во время прохождения тока меньше, чем его
разность потенциалов в разомкнутом состоянии. Это уменьшение начальной
разности потенциалов электродов гальванического элемента (и в частном
случае, коррозионного элемента), возникающее при прохождении через него
тока, называется поляризацией гальванического элемента. Анодная
поляризация — смещение потенциала анода в положительную сторону при
прохождении анодного тока. Катодная поляризация — смещение потенциала
катода в отрицательную сторону при прохождении катодного тока.
Одной из основных причин изменения потенциалов электродов при
протекании тока является изменение концентрации ионов у анода и катода по
сравнению с концентрацией их во всем электролите. Поляризация тормозит
работу коррозионного элемента и уменьшает скорость электрохимической
коррозии Если бы не было явлений поляризации, то процессы
электрохимической коррозии шли бы с очень большими скоростями — в
десятки или сотни раз больше тех, которые обычно наблюдаются. Электродные
процессы, уменьшающие поляризацию на аноде и катоде, принято называть
процессами деполяризации (соответственно анодной или катодной). Вещества,
прибавление которых уменьшает процесс поляризаций, называют
деполяризаторами. Характер и скорость катодных реакций оказывает
значительное, часто решающее влияние на большинство коррозионных
процессов. При электрохимическом коррозионном процессе величина
коррозионных потерь металла, согласно закону Фарадея, пропорциональна
коррозионному току.
228
§ 16.7. Защита металлов от коррозии
Защита металлов от химической коррозии
Для защиты металлов от наиболее распространенного вида химической
коррозии — газовой коррозии, существуют следующие основные способы.
Жаростойкое легирование, т. е. введение в состав сплава компонентов,
повышающих жаростойкость, что особенно важно для деталей, работающих в
условиях высоких температур — мощных энергетических установках
реактивных двигателей, аппаратах химической промышленности,
высокопроизводительных печах и т. п. Основной компонент жаростойкого
легирования стали — хром. Более жаростойкими, чем хромистые стали,
являются сильхромы, содержащие 6—30% Cг, до 4% Si, до 1 % Mo. Eще более
жаростойкими становятся стали при одновременном введении 6% Cг, 1—2% Si
и 0,5—1% Al - сихромали. Сплавы меди, содержащие до 10% Al и до 2,5% Be,
применяют как жаростойкие и жаропрочные сплавы.
Другим практическим методом защиты металлов от газовой коррозии
является применение защитных атмосфер. позволяющих избежать
последующих трудоемких и вредных для людей операций очистки деталей от
окалины при различных видах термообработки. Даст большую экономию
металла (до 3,5%), снижает себестоимость и повышает качество продукции
(например, прочность и долговечность деталей повышается на 15 — 30%).
Инертные среды при термообработке стали — аргон, азот, водород, оксид
углерода.
Для защиты стали от газовой коррозии на ее поверхность можно наносить
алюминий, хром, кремнии и некоторые жаростойкие сплавы. Наиболее простым
и распространенным способом нанесения является нагрев изделий в
порошкообразных смесях (термодиффузионный метод). При этом детали,
очищенные от окалины, продукта коррозии и других загрязнений, помешают в
реактор (реторту или ящик), наполненный реакционной смесью, состоящей,
например, при алитировании (покрытии алюминием) из Al
2
O
3
, и NH
4
Cl (2—
5%), и выдерживают при температуре 900-950°C 6-10 ч.
Защиту плакированием применяют для изготовления биметаллических
листов и ленты. На заготовку накладывают с одной или с обеих сторон тонкие
листы защитного металла или сплава и полученный пакет подвергают либо
горячей прокатке, либо прессовке, либо нагреву под давлением. Так,
углеродистую или низколегированную сталь плакируют хромистой или
хромоникелевой жаростойкой сталью, медь — нихромом или никонелем (80%
Ni; 14% Cr; 6% Fe). Производство жаростойких биметаллов даст возможность
экономить около 60% высоколегированной стали и большое количество
дорогостоящих легирующих материалов.
Ниже приведены технико-экономические показатели биметалла с
плакирующим слоем из стали 12Х18Н9Т. Средняя отпускная цена 1 т листа
12XI8H9T толщиной 6—60 мм — 567 руб. Себестоимость 1 т того же листа -

229
553 руб. Средняя отпускная цена 1 т биметаллическою листа толщиной 6—60
мм с плакирующим слоем, равным 20% от общей толщины листа, - 353 руб.
Экономия на 1 т листа
Разница:
в отпускных ценах, руб. 214
в себестоимости, руб. 314
Экономия:
нержавеющей стали, кг . 700
никеля, кг. 63
хрома, кг 126
Из неметаллических покрытий чаще других применяются жаростойкие эмали,
полученные путем оплавления и представляющие собой керамические
покрытия, состоящие из неорганических оксидов. Покрытия из указанной эмали
служат для защиты от окисления в газовых средах при температуре 1000—
1450°С. К недостаткам эмалевых покрытий следует отнести малопластичность,
чувствительность к термоударам и склонность к механическим разрушениям.
Защита металлов oт электрохимической коррозии
Коррозионно-стойкие сплавы.
При эксплуатации металлических конструкций в жестких условиях
(например, при работе в агрессивных растворах, при повышенных
температурах и давлениях), в условиях, когда недопустимо загрязнение
продуктами коррозии рабочих сред (например, в пищевой промышленности),
наиболее эффективен метод повышения коррозионной устойчивости
непосредственно самого конструкционного материала за счет его легирования
другими металлами. Все это вызвало большое возрастание производства
специально легированных сталей и различных других сплавов.
Коррозионно-стойкие сплавы классифицируют по трем признакам: по
составу, по характеру устойчивости и структуре. По составу различают сплавы
на основе железа, медные, никелевые сплавы, легкие сплавы на основе
алюминия, магния и титана, сплавы благородных и редких металлов и
некоторые другие. Основными легирующими компонентами химически
стойких сплавов на железной основе являются хром, кремний, никель. Так, на-
пример, нержавеющая сталь для пружин, шарикоподшипников, режущего и
измерительного инструмента изготовляется на основе хрома 4X13 (ЭЖ-4); для
оборудования химических заводов, соприкасающегося с горячей азотной
кислотой и нитрозными газами, — хромоникелевая сталь Х17Н2 (ЭИ268).
Основной конструкционный материал для химической промышленности, а
также для деталей машин и приборов других Производств, работающих в
сильно агрессивных условиях, хромоникелевая сталь 1Х18Н9Т и некоторые
другие стали.
Обработка внешней среды. Сущность этого метода заключается в удалении
некоторых реагентов, присутствующих в окружающей среде и вызывающих
коррозию, или же в добавлении специальных веществ, замедляющих
230
коррозионные процессы. Такие вещества называются замедлителями
(ингибиторами). Так как электрохимическая коррозия является результатом
двух взаимно связанных процессов — анодного и катодного, то добавленные
вещества могут замедлить процесс коррозии, действуя на анодные или
катодные реакции, а также одновременно на обе. В качестве замедлителей,
например, используют нитрит натрия (анодный замедлитель), сульфит натрия
(катодный замедлитель), дихромат и хромат калия (смешанный замедлитель).
Нитрит натрия применяют как для кратковременной межоперационной защиты
стальных деталей, так и для более длительной зашиты при хранении и
транспортировке. Его используют в качестве замедлителей коррозии стали в
охлаждающе-смазывающих жидкостях, в воде паровозных котлов. Хроматы и
дихроматы применяют дли защиты от коррозии в воде или растворах солей.
Они замедляют коррозию практически всех важных металлов (Fe, Al, Cu, Zn).
Кислотные замедлители коррозии чаще всего применяют при удалении с
поверхности стали окалины или ржавчины в рacтворах кислот. Назначение
кислотных замедлителей коррозии заключается в том, чтобы предохранить
основной металл от растворения, значительно снизить водородную хрупкость, а
также расход кислоты при травлении. При травлении в серной кислоте
применяют присадку ЧМ, катанин. В растворы HCl при травлении добавляют
ПБ-5.
В последнее время широкое распространение получили так называемые
летучие или парофазные ингибиторы, позволяющие защищать от коррозии
стальные детали, а также детали из других металлов. Такими соединениями
являются летучие вещества, большей частью органические аминосоединения.
Ими, например, пропитывают оберточную бумагу, в которую заворачивают
стальные пилы, измерительный инструмент и т. п., а также используют для
защиты деталей при транспортировке и хранении. В СССР в качестве
ингибиторов для черных металлов применяются карбонат и бензоат
моноэтаноламина.
В растворах с высокой электропроводностью (например, в морской воде)
применяется электрохимическая защита от коррозии. Этот способ защиты
осуществляется присоединением к конструкции металла, имеющего более
отрицательный потенциал (протектора), или с помощью тока, приложенного
извне. Например, для за- щиты стали в контакте с металлической конструкцией
укрепляют цинковую пластинку. Для защиты приложенным извне током
необходимо иметь источник постоянного тока и дополнительный электрод,
который служит анодом. Защищаемое изделие присоединяется к минусу
источника тока и поляризуется катодно, а дополнительный электрод,
присоединенный к плюсу, поляризуется анодно. Защита протекторами и
внешним током применяется для предохранения от коррозии корпусов судов,
подземных металлических сооружений — трубопроводов, газопроводов,
резервуаров и т.п.
Наибольшее распространение в промышленности для защиты от коррозии, а
также для придания декоративных и специальных свойств изделиям получили
