Елинов Н.П. Основы биотехнологии
Подождите немного. Документ загружается.

понятна необходимость отдельных витаминов в питательных сре-
дах для биообъектов.
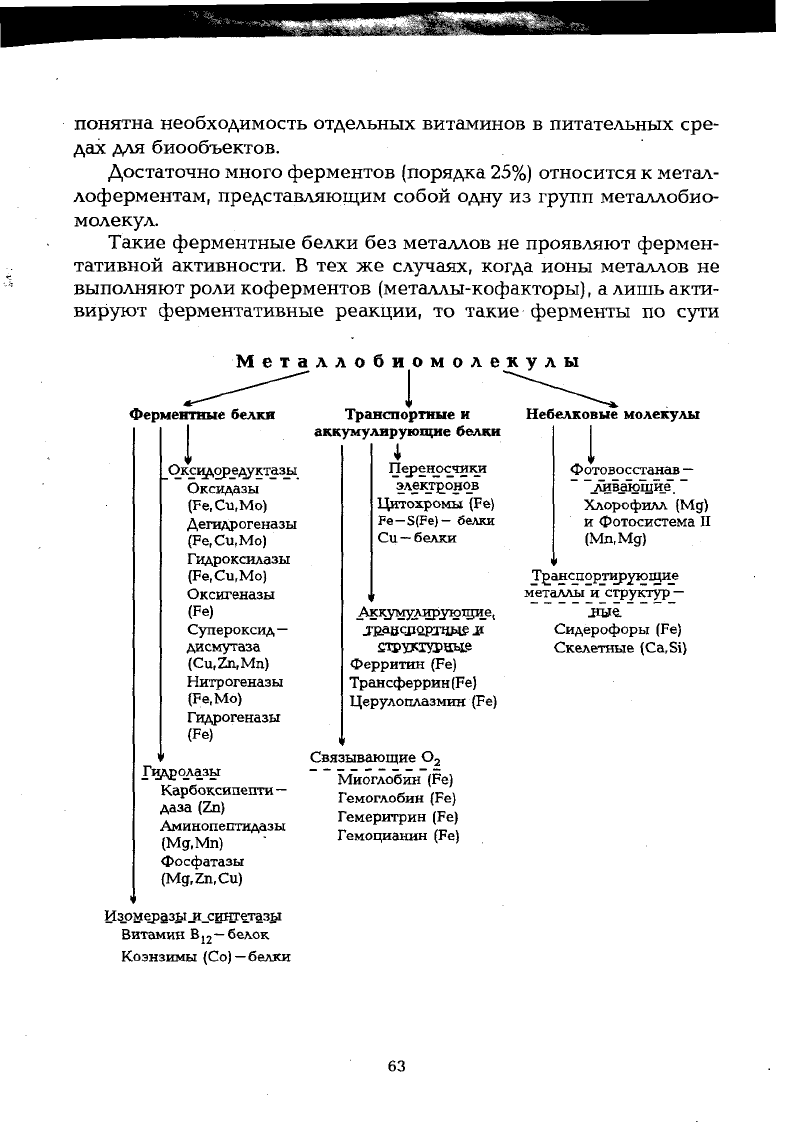
Достаточно много ферментов (порядка
25%)
относится к метал-
лоферментам, представляющим собой одну из групп металлобио-
молекул.
Такие ферментные белки без металлов не проявляют фермен-
тативной активности. В тех же случаях, когда ионы металлов не
выполняют роли коферментов (металлы-кофакторы), а лишь акти-
вируют ферментативные реакции, то такие ферменты по сути
Металлобиомол
Ферментные белки
Оксщ\оре^уктазы
Оксидазы
(Fe,Cu,Mo)
Дегидрогеназы
(Fe.Cu.Mo)
Гидроксилазы
(Fe,Cu,Mo)
Оксигеназы
(Fe)
Супероксид—
дисмутаза
(Cu,Zn,Mn)
Нитрогеназы
(Fe.Mo)
Гидрогеназы
(Fe)
Гидролазы
Карбоксипепти
—
даза
(Zn)
Аминопептидазы
(Mg.Mn)
Фосфатазы
(Mg,Zn,Cu)
Изрмер§зы^_сицтетазы
Транспортные и
аккумулирующие белки
i
Переносчики
электронов
Цитохромы (Fe)
Fe-S(Fe)- белки
Си —белки
^кущлнрующие,
JUaBcnQKraweii
£4>улурцые
Ферритин (Fe)
Трансферрин (Fe)
Церулоплазмин (Fe)
Связывающие 0
2
Миоглобин (Fe)
Гемоглобин (Fe)
Гемеритрин (Fe)
Гемоцианин (Fe)
Небелковые молекулы
Фотовосстанав -
_лив.ающие.
Хлорофилл (Мд)
и Фотосистема II
(Мп,Мд)
Транспортирующие
металлы и структур
—
Сидерофоры (Fe)
Скелетные (Ca.Si)
Коэнзимы (Со)
—
белки
63

своей не являются металлоферментами. Их следует называть ме-
таллоактивйрованными ферментами.
Можно утверждать, что в металлоферментах ионы металлов
выполняют и каталитическую и структурную роли, тогда как в
металлоактивированных ферментах — преимущественно катали-
тическую. Тем не менее металлы в качестве коферментов и
кофакторов в какой-то части сходны в своих функциональных
проявлениях. Для металлоактивированных ферментов возможны
4 схемы трехчленных комплексов, участниками которых являются
фермент (Ф), субстрат (С) и металл (М) в стехиометрическом
соотношении 1:1:1.
М
1) Ф—С—М, 2) Ф—М—С, 3) М—Ф—С, 4) Ф <^ [
С
В первой схеме мостиковое положение занимает субстрат, во
второй — металл, в третьей — фермент и в четвертой — металл в
циклическом комплексе. Металлоферменты, например, не форми-
руют комплекс Ф—С—М, так как при очистке они выявляются в
форме Ф—М.
Металлоферментами являются так называемые геминовые
ферменты (каталаза, пероксидаза, цитохромоксидаза), в составе
которых имеется простетическая железопорфириновая группи-
ровка, или гем; трансферазы, у которых коферментная форма
витамина Вп представлена 5'-дезоксиаденозилкобаламином.
Все ферменты с коферментом Bi2 катализируют реакции об-
мена водорода, связанного с углеродом, на какую-либо иную
64
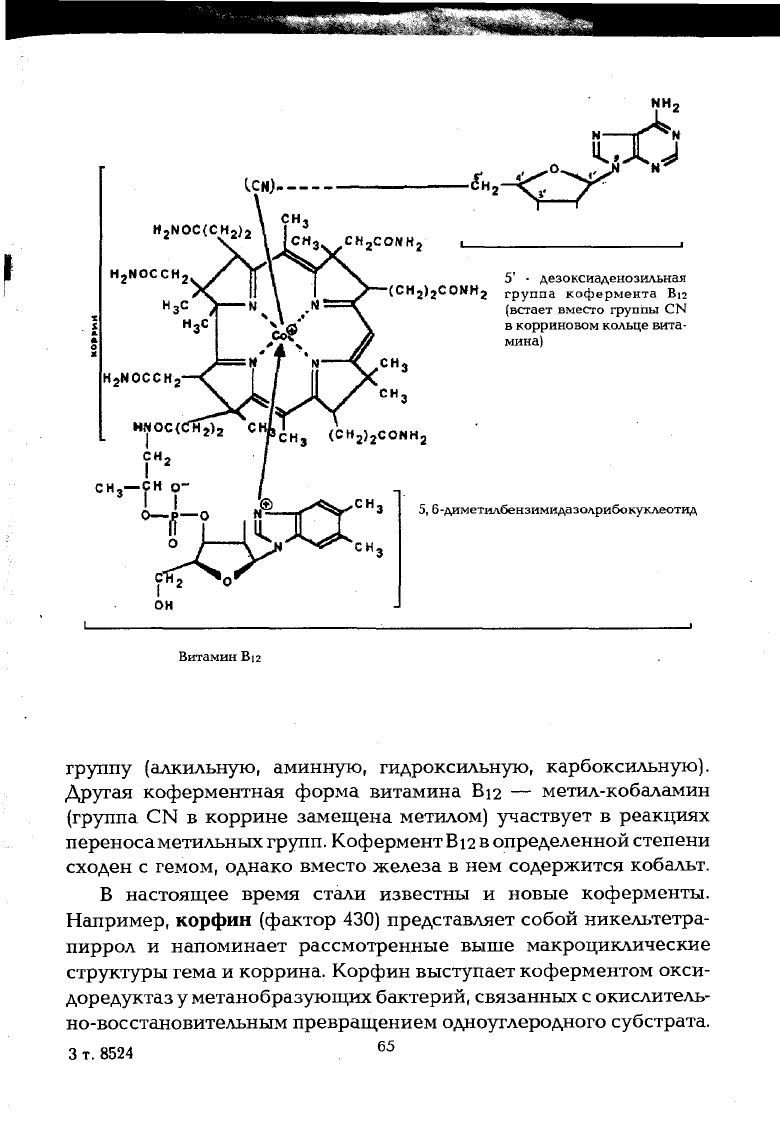
Витамин Bi2
группу (алкильную, аминную, гидроксильную, карбоксильную).
Другая коферментная форма витамина Bi2 — метил-кобаламин
(группа CN в коррине замещена метилом) участвует в реакциях
переноса метильных групп. Кофермент Bi2 в определенной степени
сходен с гемом, однако вместо железа в нем содержится кобальт.
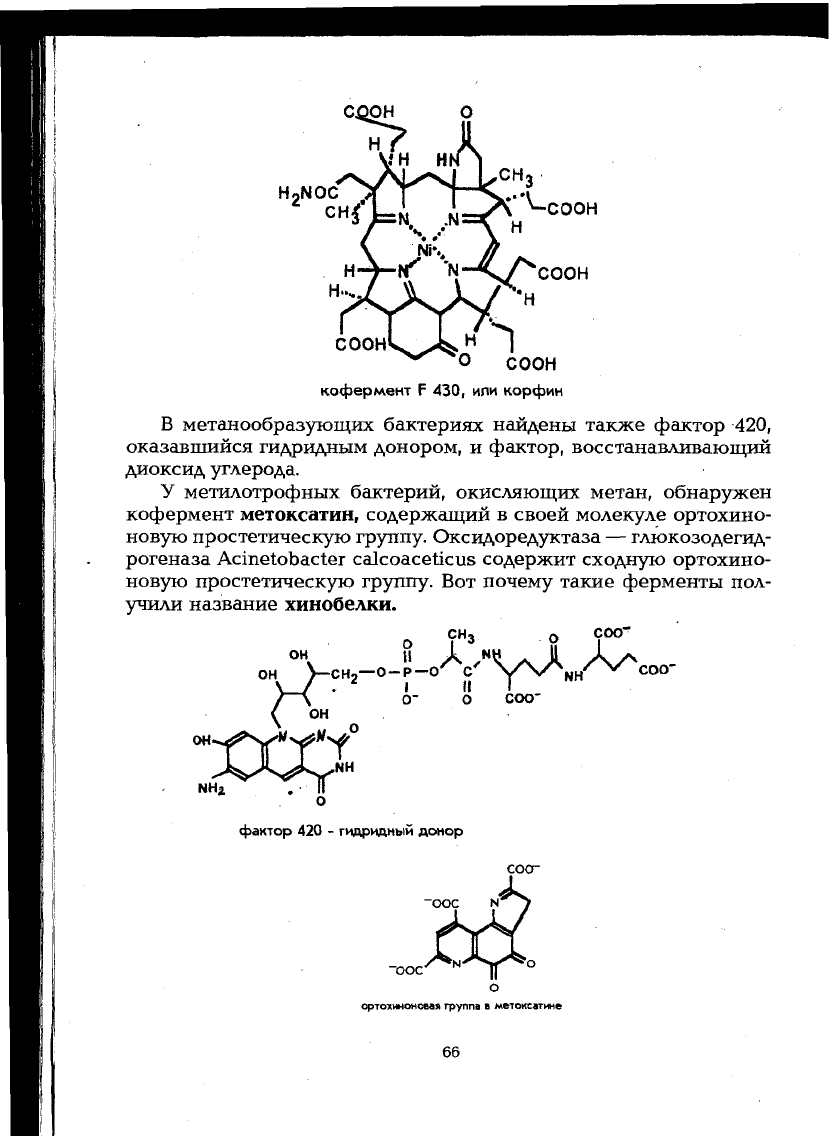
В настоящее время стали известны и новые коферменты.
Например, корфин (фактор 430) представляет собой никельтетра-
пиррол и напоминает рассмотренные выше макроциклические
структуры гема и коррина. Корфин выступает коферментом окси-
доредуктаз у метанобразующих бактерий, связанных с окислитель-
но-восстановительным превращением одноуглеродного субстрата.
3 т. 8524
65
С£ОЬ
н
снЛ-
н
"7~
H--J
соон
1
<
Ni
О
HN]
,.N=a
Ч
1н
^0
•
сн
з
\
н
чУ^сс
/ *н
S
соон
соон
кофермент F 430, ипи корфин
В метанообразующих бактериях найдены также фактор 420,
оказавшийся гидридным донором, и фактор, восстанавливающий
диоксид углерода.
У метилотрофных бактерий, окисляющих метан, обнаружен
кофермент метоксатин, содержащий в своей молекуле ортохино-
новую простетическую группу. Оксидоредуктаза — глюкозодегид-
рогеназа Acinetobacter calcoaceticus содержит сходную ортохино-
новую простетическую группу. Вот почему такие ферменты пол-
учили название хинобелки.
он
о
сн
3
о соо-
-
0
^-о'УуЛ
н
А/\
00
-
О" О СОСГ
фактор 420 - гидридный донор
СОСг
ортохиноновая группа в метокеатмне
66

фактор, восстанавливающий 0(¾
Механизм действия этих коферментов точно пока неизвестен.
Кофакторами в металлоактивированных ферментах часто вы-
ступают ионы магния, цинка, кальция, то есть металлы с постоян-
ной валентностью. Например цинк активирует алкогольдегидроге-
назу, щелочную фосфатазу; кальций - сс-амилазу; магний — АТФ-
азу, гексокиназу и многие другие ферменты; марганец (или магний)
— енолазу; калий — пируваткиназу, и т. д.
Из сказанного о металлоферментах и металлоактивированных
ферментах следует, что наличие определенных ионов в среде
культивирования биообъектов строго обязательно.
Кинетические характеристики биокатализаторов, определяю-
щие активность и длительность работы ферментов в различных
условиях, являются важными показателями и при промышленном
получении ферментов. Все эти данные подробно рассматриваются
в курсе биохимии. Здесь же мы останавливаемся лишь на важней-
ших параметрах, без которых биотехнология ферментов будет
недостаточно охарактеризованной.
В процессе биокатализа активность ферментов и, следователь-
но,
их каталитические функции снижаются. Кажущаяся структур-
ная громоздкость их в нативном виде (от лат. nature — природа) с
лихвой компенсируется эффективностью катализа, если сравни-
вать их с неорганическим ("простыми") катализаторами. Однако в
изолированном виде ферменты достаточно легко инактивируются,
что приобретает важное значение для практики. Отсюда возникает
проблема стабилизации активности ферментов в случаях их про-
мышленной эксплуатации. Следует заметить, что in vivo инактива-
ция и активация ферментов, равно как и синтез их de novo или
denuo (по-лат. — заново), регулируется самим организмом. К тому
же в организме (клетке, ткани) многие ферменты находятся в
связанном состоянии. Очевидно, что при этом их конформации
больше или меньше изменяются, что не безразлично для клетки с
67

функциональной точки зрения. Из практической работы известно
немало случаев, когда неполностью очищенные ферменты были
какое-то время активнее и стабильнее чистых образцов биоката-
лизаторов. На этом основании можно предполагать, что так назы-
ваемые примеси создавали благоприятное окружение ферменту и,
очевидно, выгодное потребителю. Стабилизация ферментов могла
быть обусловлена разными факторами, например, иммобилиза-
цией на мембранных структурах, соединением с высокополимер-
ными углеводами или гликоконъюгатами и пр. Подобная стабили-
зация сродни консервации белковой молекулы, так как здесь речь
идет о сохранении фермента какое-то (обычно более или менее
длительное) время со всеми присущими ему параметрами.
В любом случае при получении ферментов в производстве
необходимо опираться на воспроизводимые результаты, заложен-
ные в регламенте.
Активность и стабильность — как параметры важны и для вновь
внедряемых в производство ферментов, поскольку предполагаемая
их "выходная активность" приобретает существенное значение с
точки зрения выбора (или проектирования) конструкции реактора,
оснащении его необходимой контрольно-измерительной аппарату-
рой и т. д. (в частности, для исключения быстрой инактивации
фермента).
Активность биокатализаторов измеряют в международных еди-
ницах (ME) — 1 ME соответствует количеству фермента, превра-
щающему 1 микромоль (мк/моль; 10"
6
моль) субстрата в 1 мин. в
стандартных условиях. Единицы активности могут быть выражены
в мкЕ, нЕ и пЕ, то есть соответственно в микро-, нано- и пикоеди-
ницах с учетом превращения 10
е
, 10"
9
или 10"
12
моля субстрата в 1
мин. Удельную активность выражают в единицах на 1 мг белка. С
1973 г. введена единица ферментативной активности катал (кат.),
соответствующая количеству катализатора, способного превра-
щать 1 моль субстрата в продукт за 1 секунду. Тогда соотношения
катал и ME будут следующими: 1 кат=
1
моль субстрата •
С"
1
= 60
моль» мин"
1
=60*10
6
мкмоль» мин"' = 6«10
7
ME, 1 МЕ=1 мкмоль*
мин*'= 1/60 мкмоль*с"'= 1/60 мккат= 16,67 нкат= 16670 пкат. Все
это косвенно подтверждает факт трудности выделения ферментов
в чистом виде и на практике приходится чаще иметь дело с группой
белков в продукте — сырце или в исходном материале, или,
наконец, в других партиях материала, подлежащих разделению.
В лабораторных и производственных условиях нередко прихо-
68

дится иметь дело с денатурацией ферментов в зависимости от ряда
факторов, например, биологических — гидролиз целевого продукта
какой-либо пептид-гидролазой, находящейся в исходном сырье или
привнесенной случайно, например, при микробном загрязнении;
физических — неадекватное температурное, механическое, ради-
ационное воздействия; химических — рН, комплексообразовате-
лей, растворителей, ионогенных поверхностно-активных веществ,
тяжелых металлов и т. д.
Естественно, что от качества выделения и очистки фермента
зависит надежность анализа его структуры. Тем не менее, следует
помнить, что одинаковые ферменты, выделяемые из различных
источников, могут иметь разные аминокислотные последователь-
ности и, следовательно, они не тождественны — их каталитическая
активность и свойства будут различными. В качестве примера
можно назвать вид Вас. coagulans, образующий глюкозоизомеразу;
этот фермент активируется ионами Со
2+
, а такой же фермент,
продуцируемый мутантом данного вида при рН более 8, не нуж-
дается в ионах кобальта. Вот почему точность имеющейся инфор-
мации об источнике фермента, его технологии, паспортных данных
приобретает исключительную важность при сравнении фермента,
выпущенного разными фирмами-изготовителями.
М. Левитт и К. Чотиа в 1976 г. подразделили структурно
известные белки по наличию и расположению ос-спиралей и
Р-слоев на пять классов:
I — белки, состоящие только из а-спиралей, уложенных вместе
в глобулярную структуру;
II — белки, состоящие только из (3-слоев и формирующие
глобулу в форме бочонка;
III — белки, включающие ос-спирали и Р-слои (а + Р-белки), но
разобщенные в третичной структуре;
IV — белки сс/р, в которых а- и Р-структурные участки чере-
дуются в первичной структуре, формируя третичную структуру, в
центре которой находятся обычно параллельно уложенные Р-слои,
окаймленные с обеих сторон ос-спиралями;
V — обычно малые молекулы с многими -S—S-мостиками или
ассоциированные с крупным кофактором "неупорядоченные бел-
ки",
обладающие слабой вторичной структурой.
На рис. 13 представлены схемы Дж. Ричардсон (1981) для
различных белков, отнесенных к какому-либо одному из пяти
вышеназванных классов.
69

Рис. 13. Пять классов белков по Дж. Ричардсон
(1981):
А — миохемеритин (класс I),
1Я
Б — Си, Zn—супероксиддисмутаза (класс II),
В
—
лизоцим (а+р-структура, III класс),
Pi
Г
и Д
—
две ортогональные проекции НАД—свя-
зывающего домена лактатдегидрогеназы (IV
класс),
Е — тризофосфатизомераза
(ГУ
класс),
Ж Ж — нейраминидаза вируса гриппа (V класс).
Более или менее длинные цепи белков, как
правило,
формируют
домены, представляющие собой свернутую в пространстве струк-
туру, имитирующую маленькую белковую молекулу. Доменам
присущи функции связывания, и в ферментных белках активный
центр располагается преимущественно на границе между двумя
или большим числом
доменов.
К настоящему времени установлено,
что домены способны перемещаться друг относительно друга в
процессе функционирования содержащей их молекулы.
В
трипси-
ногене домен из неупорядоченного состояния переходит в упоря-
доченное в ходе активации зимогена.
70

Заметный прогресс в изучении структуры белков начался с
конца 70-х годов текущего столетия. Если до этого структуры их
выводили на основании метода диффракции нейтронов, карт
распределения электронных плотностей с введением в молекулы
белков тяжелых атомов, то в последующие годы были развиты
методы синхронной радиации, методы с использованием компью-
терной техники, что сослужило огромную службу кристаллогра-
фии данных биополимеров. В этой связи статичный метод рентге-
ноструктурного анализа одиночного кристалла способен дать ди-
намичную информацию. На основании указанных методов пока-
зано,
например, что фермент лизоцим имеет оболочку из 33—35
прочно связанных молекул воды и менее упорядоченную область
из 95—105 молекул воды, соединенных с белком лишь одной
водородной связью. Около 60—80% остальной воды распределено
в промежутках между кристаллами и не влияет на электронную
плотность белка.
Молекулы белков не являются жесткими структурами — они
подвижны л, следовательно, достаточная лабильность молекул
ферментов (молекулярная вибрация) играет важную роль в узна-
вании субстрата и стабилизации переходного состояния.
Чтобы увидеть ферменты в действии стали использовать метод
рентгеноструктурного анализа при низких температурах (криоэн-
зимология) — можно сделать "стоп-кадры" в кинетически значи-
мых точках катализируемой реакции.
Теперь хорошо известно, что ферменты, внедряемые в про-
мышленность выгодно отличаются от неорганических (или синте-
тических) катализаторов рядом преимуществ, существенным из
которых следует назвать низкую энергоемкость ферментативных
процессов, то есть сравнительно небольшие затраты внешней
энергии. На каталитические процессы в промышленности прихо-
дится 80—90% и доля их продолжает возрастать.
В
неорганическом
синтезе, например, получают контактным способом десятки мил-
лионов тонн серной кислоты в год. При контактном процессе
окисление SO2 в БОз протекает в присутствии катализатора V2O5
с добавлением К2О и других оксидов.
В органическом синтезе на никелевых катализаторах осущест-
вляют многие реакции гидрирования соединений, включающих
С = С, Са С, С =
О,
NO2 — группы. Для примера назовем алюмо-
молибденовые, алюмохромовые и алюмоплатиновые катализато-
ры,
применяемые для дегидрирования линейных и разветвленных
алканов в олефины. Так, катализаторы на основе оксида хрома,
применяемые в реакции превращения бутана в бутен, работают
при температуре около 600°С, а регенерация их протекает при
640—650°С. Оксидные катализаторы окисления С03О4, СГ2О3, NiO
71

эффективны также при температурах
250—600°С.
Лишь отдельные
катализаторы полимеризации (ВЁз) проявляют свое действие при
—80°—100°С, например, при получении полиизобутилена. Однако
чтобы добиться понижения температуры до —80° или —100° С,
также необходима затрата энергии.
Напротив, все биохимические реакции в живых системах
потекают при сравнительно низких температурах. Например, фер-
менты микроорганизмов
—
сапрофитов, живущих в почве средних
широт нашей страны, относятся к мезофилам, то есть их ферменты
эффективно действуют в пределах от +
10
до +50°С (с преимуще-
ственным интервалом от +
20 до
+
30°С).
Нечто аналогичное можно
сказать и о ферментах растений. Ферменты животных более
эффективны при нормальной температуре тела.
Тем не менее, следует помнить, что для каждого фермента есть
свои так называемые кардинальные точки температуры, рН и др.
(minimum, optimum, maximum).
Необходимо также отметить и тот факт, что скорости фермен-
тативных реакций при оптимальных условиях многократно превы-
шают скорости реакций, в которых используются неорганические
(синтетические) катализаторы.
Ферменты, с точки зрения энергетики, заметно снижают энер-
гию активации химических реакций. Под энергией активации
понимают количество энергии в Джоулях, необходимое для при-
ведения всех молекул 1 моля вещества при определенной темпе-
ратуре в состояние критического энергетического уровня (пере-
ходный уровень), при котором начинает происходить химическая
реакция. Если не все молекулы вещества достигают переходного
уровня, то скорость химической реакции снижается.
Основные пути повышения скоростей реакции — это либо
использование температурного фактора, либо катализаторов. В
случае применения неорганических или синтетических катализа-
торов необходимо использовать в большинстве случаев высокие
температуры. Как уже было
сказано,
биокатализаторы эффективно
работают при сравнительно низких температурах. Скорости реак-
ций зависят от концентраций субстратов. Когда фермент насыщен
субстратом, он не может функционировать быстрее — это и есть
максимальная скорость реакции (V
m
ax), то есть, когда доля свобод-
ного фермента оказывается предельно низкой.
Общая скорость ферментативной реакции должна быть про-
порциональной концентрации фермент-субстратного комплекса
ES (Е — энзим, S— субстрат). Зависимость скорости фермента-
тивной реакции от концентрации субстрата графически представ-
ляется гиперболической кривой (рис. 14). Км на рисунке представ-
ляет собой константу Михаэлиса—Ментен, то есть концентрацию
72
