Бунин К.П., Баранов А.А. Металлография
Подождите немного. Документ загружается.


ческом состоянии: в интервале АС
М
устойчив раствор а, в интер-
вале
С
М
С
Н
— смесь а + Р и в интервале С
Я
Б — раствор р.
Характер изменения термодинамического потенциала жидкого
и
твердых растворов может быть иным, что приводит к изменению
вида диаграмм состояния. На рис. 39, б—д для разных температур
показаны
кривые термодинамических потенциалов фаз, образую-
щихся при сплавлении компонентов с разным типом кристалли-
ческой решетки. Если ограниченная растворимость встречается
в
системах, в которых сплавление компонентов либо повышает,
либо понижает температуру ликвидуса, то получается диаграмма
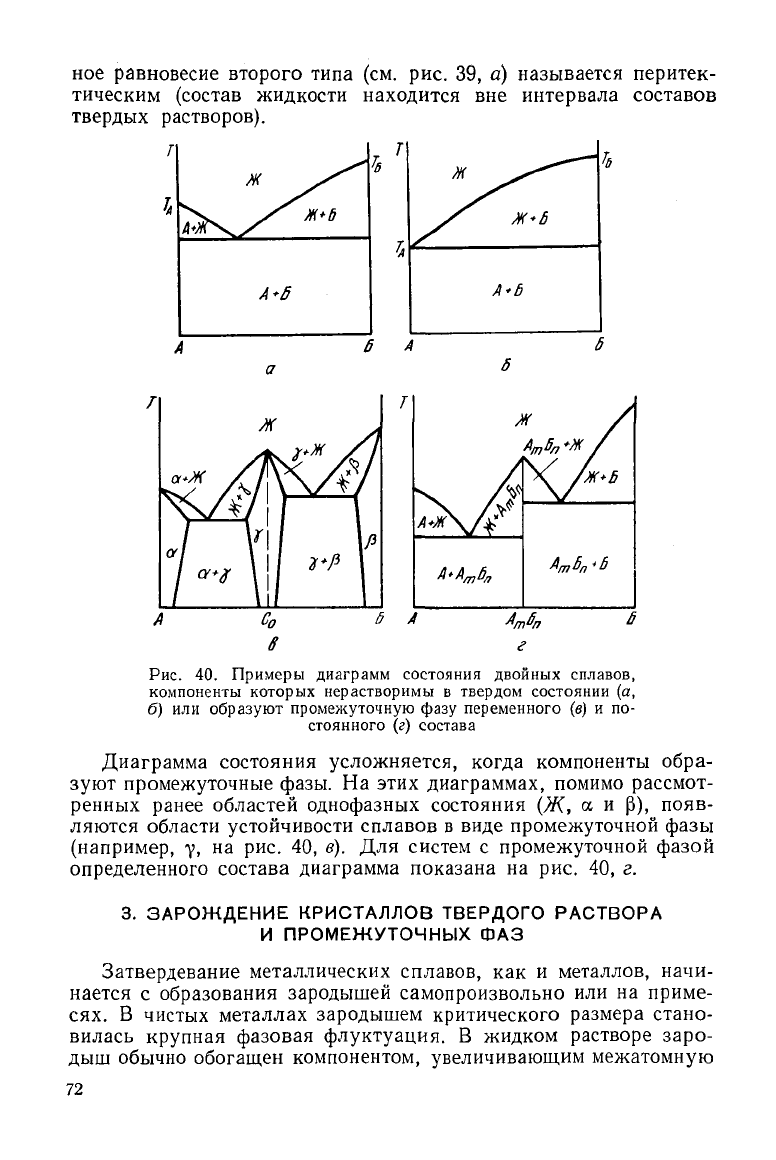
перитектического типа (рис. 39, а).
Такие
диаграммы характерны и для компонентов со сходной
решеткой, обладающих ограниченной растворимостью.
На
обеих диаграммах однофазные области существования а
и
р ограничены линиями насыщения компонентов
друг
в
друге
ИР
и ЛУ. ИР является линией растворимости Б в А, ЛУ —
линией
растворимости А в Б (рис. 38, а).
Чем меньше растворимость компонентов в твердом состоянии,
тем уже однофазные области существования растворов. В
случае
нерастворимости компонентов эти области выклиниваются и диа-
граммы приобретают вид, показанный на рис. 40, а, б. В реаль-
ных металлических сплавах полная нерастворимость компонентов
в
твердом состоянии невозможна. Даже в
случае
большого не-
сходства
атомов, исключающего возможность размещения одних
атомов в
узлах
или междоузлиях решетки
другого
компонента,
происходит хотя бы незначительное растворение, поскольку атомы
растворяемого элемента
могут
разместиться в децэектных участках
кристаллов растворителя (в скоплениях избыточных вакансий,
дислокациях, на границах зерен и блоков). Такого рода раство-
римость в основном связана с биографическими дефектами раство-
рителя: чем совершеннее его решетка, тем меньше растворимость,
и
в
случае
идеального монокристалла растворимость приближается
к
нулю. Поскольку все реальные металлы содержат дефекты,
растворимость указанного рода имеется всегда.
Кроме
однофазных и двухфазных состояний в двойных сплавах
возможно и трехфазное равновесие. При этом число степеней сво-
боды (С) в изобарических условиях равно нулю (С = К + 1 — Ф —
=
2+1 — 3 = 0, где К и Ф — соответственно число компонен-
тов и фаз), а равновесие
трех
фаз возможно при определенных
значениях температуры и состава
трех
фаз (жидкости и раство-
ров а и р). Для рассмотренных систем (см. рис. 38, а и 39, а)
трехфазное равновесие Ж + а + Р наблюдается при температу-
рах, соответствующих линиям ИКЛ или КИЛ, причем состав
жидкости определяется точкой К (С
к
), а составы растворов аир
соответственно И а Л (С
и
и С
л
). Трехфазное равновесие первого
типа (см. рис. 38, а) называется эвтектическим (состав жидкой
фазы
находится
между
составами кристаллических фаз). Трехфаз-
71
ное
равновесие второго типа (см. рис. 39, а) называется перитек-
тическим (состав жидкости находится вне интервала составов
твердых растворов).
Рис.
40. Примеры диаграмм состояния двойных сплавов,
компоненты
которых нерастворимы в твердом состоянии (а,
б) или образуют промежуточную фазу переменного (в) и по-
стоянного
(г) состава
Диаграмма состояния усложняется, когда компоненты обра-
зуют
промежуточные фазы. На этих диаграммах, помимо рассмот-
ренных ранее областей однофазных состояния (Ж, а и (3), появ-
ляются области устойчивости сплавов в виде промежуточной фазы
(например,
у, на рис. 40, в). Для систем с промежуточной фазой
определенного состава диаграмма показана на рис. 40, г.
3.
ЗАРОЖДЕНИЕ КРИСТАЛЛОВ ТВЕРДОГО РАСТВОРА
И
ПРОМЕЖУТОЧНЫХ ФАЗ
Затвердевание металлических сплавов, как и металлов, начи-
нается с образования зародышей самопроизвольно или на приме-
сях. В чистых металлах зародышем критического размера стано-
вилась крупная фазовая флуктуация. В жидком растворе заро-
дыш обычно обогащен компонентом, увеличивающим межатомную
72
связь.
Таким образом, зародышем становится фазовая флуктуа-
ция,
одновременно являющаяся и концентрационной. Достигнув
критической
величины, такая флуктуация способна к росту, ибо
присоединение
к ней атомов
ведет
к уменьшению термодинамиче-
ского потенциала сплава.
Воспользовавшись зависимостью термодинамического потен-
циала от концентрации и температуры, можно указать состав
и
величину зародыша критического размера.
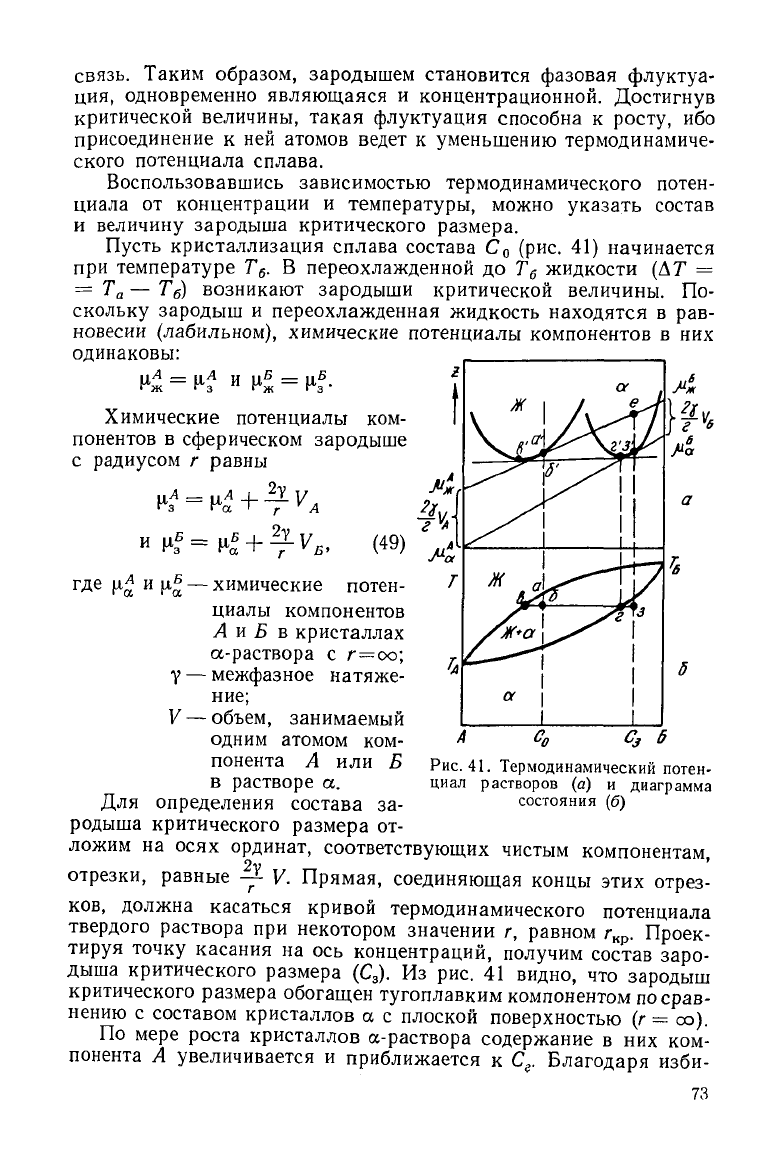
Пусть кристаллизация сплава состава С
о
(рис. 41) начинается
при
температуре Т
б
. В переохлажденной до Т
б
жидкости (AT =
=
Т
а
— Т
б
) возникают зародыши критической величины. По-
скольку зародыш и переохлажденная жидкость находятся в рав-
новесии
(лабильном), химические потенциалы компонентов в них
одинаковы:
Химические потенциалы ком-
понентов
в сферическом зародыше
с радиусом г равны
=
^+-
И
11? =
(49)
где
_ и [i° — химические потен-
циалы
компонентов
Л и £ в кристаллах
а-раствора с
г=оо;
Y — межфазное натяже-
ние;
V
— объем, занимаемый
одним атомом ком-
понента
А или Б
в
растворе а.
Для определения состава за-
родыша критического размера от-
ложим на осях ординат, соответствующих чистым компонентам,
отрезки,
равные -%- V. Прямая, соединяющая концы этих отрез-
кривой
термодинамического потенциала
С
3
6
Рис.41.
Термодинамический потен-
циал растворов (а) и диаграмма
состояния
(б)
ков,
должна касаться
твердого раствора при некотором значении г, равном г
кр
. Проек-
тируя точку касания на ось концентраций, получим состав заро-
дыша критического размера (С
3
). Из рис. 41 видно, что зародыш
критического размера обогащен тугоплавким компонентом по срав-
нению
с составом кристаллов а с плоской поверхностью (г = оо).
По
мере роста кристаллов а-раствора содержание в них ком-
понента
А увеличивается и приближается к С
е
. Благодаря изби-
73

рательной кристаллизации (выделению обогащенного тугоплав-
ким
компонентом ос-раствора) остающаяся жидкость приобретает
состав
С
в
и становится устойчивой.
В
результате
образования кристаллов
а
термодинамический
потенциал сплава, отнесенный к одному атому сплава, уменьшится
на
величину -п-
= а'б'.
Из
геометрического рассмотрения (рис. 41, а)
следует,
что из-
менение
термодинамического потенциала, отнесенное
к
одному
атому зародыша критического размера:
^
-
ty
A
)
С
3
=
3
(50)
где
п
3
— число атомов
в
зародыше;
С
3
— содержание
Б в
нем.
Если
кристалл
а
находится под давлением Р, термодинамиче-
ский
потенциал, приходящийся на один атом, повышен на вели-
чину
^
], (51)
где
V
A
и
У
Б
— атомные объемы компонентов
А и Б в
твердом
растворе.
В
случае
одного поверхностного давления
Р = —
получим
для зародыша критического размера (г
кр
)
-^•^[^(l-CJ
+ ViA]. (52)
Приравняв
левые части уравнений (50)
и
(52), определим
радиус зародыша критической величины:
_
_
2у1У
А
(1-С
3
)+У
Б
С
3
)
Гк
Р-
Д
М
(1С)+А|1ВС
"
Из
уравнения (53)
и
приведенного на рис. 41,
а
построения
следует,
что зародыш критического размера имеет минимальную
величину только при составе С
3
. Означает ли это, что кристалли-
зация
не может начаться на крупных фазовых флуктуациях иного,
чем С
3
, состава? По-видимому, нет. Фазовые флуктуации состава,
отличного от С
3
, но имеющие такие размеры, что удовлетворяются
условия ц^ s^ |л^
и
\i%
«g p,£, способны
к
росту, ибо присоедине-
ние
к
ним атомов компонентов
А и Б
приведет к снижению термо-
динамического потенциала сплава.
Аналогичным образом возникают зародыши химических соеди-
нений.
В
некоторых случаях образование зародышей твердых
растворов
и
химических соединений не сопровождается перерас-
пределением компонентов (зародыши имеют состав исходной жид-
74
кости).
Так происходит, например, при кристаллизации сплава
состава С
о
(см. рис. 36) и сплава, соответствующего соедине-
нию
А
т
Б
п
(см. рис. 40, г).
Активные и активированные примеси облегчают зарождение
кристаллов твердого раствора и промежуточных фаз. Как и в ме-
таллах,
увеличение переохлаждения уменьшает работу образова-
ния
зародышей и ускоряет зарождение. Как
следует
из диаграммы
(рис.
41, б), с увеличением переохлаждения уменьшается и различие
составов зародыша критического размера и исходной жидкости.
4.
РОСТ КРИСТАЛЛОВ ТВЕРДЫХ РАСТВОРОВ
И
ПРОМЕЖУТОЧНЫХ ФАЗ
Рост кристаллов твердого раствора и промежуточных фаз
также происходит вследствие перехода атомов жидкости к твердой
фазе и присоединения их к краям ступенек. Если переохлажде-
ние
велико, возможен и нормальный рост кристаллов. Особен-
ностью затвердевания сплавов является изменение состава жид-
кости
и твердой фазы во время
кристаллизации,
совершающей-
ся,
как правило, в интервале
температур.
а
Ж
1
1
1
а
с
I
1
1
1
г
0-
Л
Р Р П R
о
и о
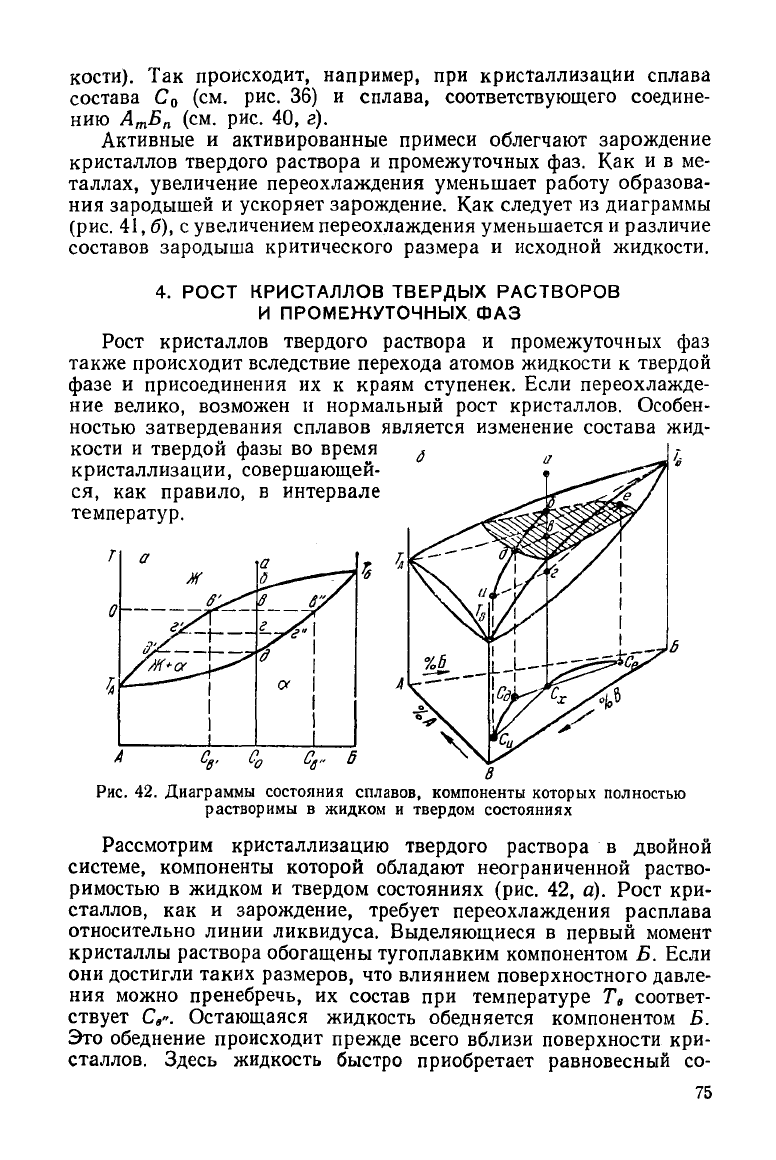
Рис.
42. Диаграммы
состояния
сплавов,
компоненты
которых полностью
растворимы
в жидком и твердом состояниях
Рассмотрим кристаллизацию твердого раствора в двойной
системе, компоненты которой обладают неограниченной раство-
римостью в жидком и твердом состояниях (рис. 42, а). Рост кри-
сталлов, как и зарождение,
требует
переохлаждения расплава
относительно линии ликвидуса. Выделяющиеся в первый момент
кристаллы раствора обогащены тугоплавким компонентом Б. Если
они
достигли таких размеров, что влиянием поверхностного давле-
ния
можно пренебречь, их состав при температуре Т
в
соответ-
ствует
С
в
». Остающаяся жидкость обедняется компонентом Б.
Это обеднение происходит прежде всего вблизи поверхности кри-
сталлов. Здесь жидкость быстро приобретает равновесный со-
75

став С' и оказывается химически неоднородной: вблизи кристал-
лов она обеднена компонентом Б, а вдали от них имеет исходный
состав, т. е. пересыщена компонентом Б (отрезок ев' указывает
пересыщение).
Из-за этой неоднородности в жидкости происходит
диффузионный
перенос атомов Б к фронту кристаллизации, а ато-
мов А от него.
Доставка атомов компонента Б к поверхности растущего кри-
сталла может происходить и в
результате
конвективного переме-
шивания
жидкости. Сначала выравнивание состава жидкости
обеспечивает дальнейший рост кристаллов. Однако постепенно
средний состав жидкости изменяется от Со к С
в
>. Когда вся
жидкость приобретает состав С
в
-, рост кристаллов прекратится
и
между
нею и твердым раствором состава С
в
" установится равно-
весие. Определим количественное соотношение фаз, находящихся
в
равновесии при температуре Т
в
. Пусть из общего количества
F граммов сплава х граммов находится в виде кристаллов, a F—х
граммов в виде жидкости. В сплаве содержится АС
0
= ов процен-
тов компонента Б. При температуре Т„ в равновесии находятся
жидкость состава С
в
- и кристаллы состава С
в
». В жидкости
(F—х) ов' граммов, в кристаллах х-ов" граммов компонента Б.
Поскольку
количество компонента Б в сплаве остается неиз-
менным,
то
F-ов = (F—x) ов' + х ов", (54)
откуда
-s- — —!jr или -=. = ——. (55)
F в в" F — х ев
v
'
Это соотношение называется правилом отрезков или правилом
рычага.
Сколь
угодно длительная выдержка сплава при Т
в
не приведет
к
образованию большего количества кристаллической фазы, чем
это
следует
из правила отрезков. Чтобы вызвать дальнейшую
кристаллизацию, необходимо охладить сплав ниже Т
в
, например
до Т
г
. При этом жидкость состава С
в
« переохлаждается и имею-
щиеся
кристаллы
растут.
При большом переохлаждении
могут
зарождаться и новые кристаллы.
Если
кристаллизация происходит в
результате
роста уже
имеющихся кристаллов, то новые слои твердого раствора также
содержат компонента Б больше, чем сохранившаяся жидкость.
Состав их близок к равновесному для данной температуры — С
г
".
Так
как ранее выделившиеся внутренние части имели состав С>,
т. е. были богаче компонентом Б, то кристалл оказывается хими-
чески неоднородным. Эту неоднородность называют внутрикри-
сталлической ликвацией. В таких кристаллах происходит диффу-
зионный
перенос атомов Б из внутренних участков к периферий-
ным,
а атомов компонента А из периферийных к внутренним.
Скорость диффузии в кристаллах на несколько порядков меньше,
чем в жидкости, и ликвация может сохраниться.
76

Достаточно длительная выдержка сплава при
Т
г
обеспечивает,
однако,
выравнивание состава кристалла
по
всему сечению.
Когда кристаллы приобретут однородный состав
С
г
«, а вся жид-
кость состав
С
г
',
рост прекратится
и
установится равновесие.
При
этом количественное соотношение
фаз
можно определить
по
•утг
If
правилу отрезков
— =
—г-.
Кристаллизация
оставшейся жидкости состава
С
г
>
продол-
жается
при
охлаждении ниже
Т
г
.
Охлаждение
до
температуры
слегка ниже
Т
д
и
выдержка приведет
к
затвердеванию всей жид-
кости,
причем последний остаток
ее
имеет состав
Сд'.
Картина
кристаллизации
не
изменится, если ступенчатое
охлаждение заменить медленным непрерывным.
И в
этом
случае
ее можно свести
к
большому числу отклонений
от
равновесия
(переохлаждения)
и
приближения
к
равновесию (выдержка). Если
скорость охлаждения мала
(или
выдержки
при
каждом переох-
лаждении длительны)
и
диффузия успевает выравнять состав твер-
дого раствора, затвердевший сплав состоит
из
химически однород-
ных кристаллов состава, соответствующего исходному
С
о
.
Аналогично кристаллизуются
и
тройные сплавы
в
системах
с полной растворимостью компонентов
в
жидком
и
твердом
со-
стояниях
(рис.
42, б).
При охлаждении тройного жидкого раствора
состава
С
х
кристаллизация становится возможной при температуре
ниже
Т
б
.
Появляющиеся кристаллы тройного раствора
а
обога-
щены
тугоплавким компонентом
Б. В
условиях равновесия
при
Т
в
состав кристаллов описывается точкой
е
(С
е
), находящейся
на
поверхности солидуса. Равновесный состав жидкого раствора
характеризуется точкой выхода коноды
на
поверхность ликвидуса
(точка
д).
Таким образом, рост кристаллов при
Т
в
влечет
за
собой
изменение
состава жидкости
от С
х
до С
д
.
Изменение
состава жидкости
в
условиях медленного охлажде-
ния
описывается линией бди (на поверхности ликвидуса),
а
измене-
ние
состава кристаллов твердого раствора— линией
ег
(на поверхно-
сти солидуса). Сплав полностью закристаллизуется при температу-
ре
Т
е
и
будет
состоять из кристаллов твердого раствора состава
С
х
.
Кристаллизация
сплавов
в
системах
с
ограниченной раство-
римостью компонентов
в
твердом состоянии происходит по-раз-
ному. Сплавы состава левее точки
И и
правее точки
Л
(рис.
38, а)
кристаллизуются
так
же, как сплавы
в
системах
с
неограниченной
растворимостью компонентов
в
твердом состоянии. После кристал-
лизации
в
условиях медленного охлаждения
они
состоят
из
кри-
сталлов
а или р\
Иначе
происходит затвердевание сплавов интервала
С
и
С
л
(см.
рис.
38, а) и С
К
С
Л
(рис.
39, а). В
сплавах интервала
С
и
С
к
(рис.
38, а)
кристаллизация начинается
с
образования
рас-
твора
а,
обогащенного компонентом
А. При
дальнейшем росте
кристаллов жидкость обогащается компонентом
Б. При
медлен-
77

ном
охлаждении сплава
до
эвтектической температуры изменение
состава кристаллов характеризуется линией
Т
А
И, а
жидкости
—
линией
Т
А
К.
При достижении эвтектической температуры
в
равно-
весии
будут
находиться кристаллы ос состава
С
и
и
жидкость эвтек-
тического состава
С
к
\
количественное соотношение
их
опреде-
ляется правилом отрезков.
В сплавах интервала
С
К
С
Л
вначале выделяются кристаллы
р,
а жидкость обогащается компонентом
А.
При эвтектической
тем-
пературе
Т
3
кристаллы
Р
приобретают состав
С
л
, а
жидкость
—
эвтектический состав
С
к
. Для
завершения затвердевания надо
охладить сплавы
до
температуры ниже эвтектической.
В
резуль-
тате
жидкость распадается
на две
твердые фазы
(Ж
—» ос
+ Р).
Этот процесс рассматривается дальше.
Затвердевание сплавов интервала
С
К
С
Д
(см.
рис.
39, а)
начи-
нается
с
образования раствора
р.
Выделение кристаллов
р и
обо-
гащение остающейся жидкости компонентом
А
происходят вплоть
до перитектической температуры
Г
2
.
Полностью закристаллизо-
ваться
эти
сплавы
могут
лишь
при
охлаждении ниже перитекти-
ческой температуры. При этом происходит перитектическая
кри-
сталлизация,
в
результате
которой сплавы правее
С
и
приобретут
а
+ р
состояние,
а
сплавы левее
С
и
—
двухфазное состояние
ос
+ Ж.
Затвердевание последних завершится лишь при охлажде-
нии
ниже линии солидуса
Т
А
И.
Жидкость состава
С
к
закристал-
лизуется
в
виде одного раствора ос. Перитектическая кристалли-
зация
рассмотрена ниже.
Кристаллизация
твердых растворов
в
тройных эвтектических
и
перитектических системах
с
ограниченной растворимостью ком-
понентов
в
твердом состоянии происходит,
в
принципе,
так же,
как
и в
двойных системах.
Промежуточные фазы переменного состава кристаллизуются
подобно твердым растворам.
В
некоторых случаях выделение
промежуточных
фаз при
медленном охлаждении может
и не со-
провождаться перераспределением компонентов
между
жидкостью
и
кристаллами (состав промежуточной фазы соответствует составу
исходного жидкого раствора).
Это
возможно
при тех
концентра-
циях, при которых
на
диаграммах состояния наблюдаются экстре-
мумы (сплавы состава
С
о
и
А
т
Б
п
на
рис.
40, г). Это
справедливо
и
для
сплавов состава
С„ (см.
рис.
36).
Описанные
здесь изменения, происходящие
в
сплавах
во
время
кристаллизации,
возможны после длительных выдержек
или мед-
ленного охлаждения
и
реализуются
на
практике
не
всегда. Вырав-
нивание
состава фаз происходит вследствие диффузии, требующей
времени.
При недостатке времени
в
сплавах обнаруживаются
раз-
личные отклонения
от
равновесия:
в
жидком растворе возникает
концентрационное
переохлаждение,
а в
твердом
—
внутрикри-
сталлическая ликвация.
При
полной задержке диффузии проис-
ходит
безызбирательная кристаллизация.
78

Б. КОНЦЕНТРАЦИОННОЕ ПЕРЕОХЛАЖДЕНИЕ
Кристаллизация жидкого раствора компонентов
А и Б
обычно
происходит
в
интервале температур. Добавки компонента
Б
могут
понижать
(рис. 43, а) и
повышать
(рис. 43, б)
этот интервал.
Для характеристики влияния второго компонента пользуются
понятием
о
коэффициенте распределения
(К
р
),
который равен
отношению концентраций компонента
Б в
твердой
и
жидкой фазах:
Если компонент Б понижает температуру кристаллизации
сплава, К
р
меньше единицы, а если повышает — К
р
больше
единицы.
Рассмотрим распределение компонента Б в жидком растворе
у фронта кристаллизации. Если диффузионные процессы вырав-
нивают состав жидкого и твердого растворов, распределение ком-
понента Б при Т = Т
1
для случая К
р
< 1
будет
таким, как пока-
зано на рис. 44. Жидкость и кристаллы имеют постоянный со-
став С
ж
и С
к
соответственно, а на границе
существует
скачок
концентраций.
Если твердая фаза содержит немного компонента Б, концен-
трация его в жидкости вблизи кристаллов увеличивается. Компо-
нент Б не успевает продиффундировать
вглубь
и накапливается
до тех пор, пока жидкость у кристалла не приобретает состав С
ж
(рис.
44). С удалением от кристалла содержание компонента Б
в жидкости уменьшается и на некотором расстоянии достигнет
исходного значения С
о
. Толщина обогащенного компонентом Б
слоя зависит от скорости роста кристаллов и подвижности атомов
в жидкости. С увеличением скорости роста толщина слоя умень-
шается. Обычно она составляет
10"
2
—10~
4
см.
Концентрация
компонента Б в жидком растворе на расстоя-
нии
х от. фронта кристаллизации
4
где D — коэффициент диффузии компонента Б в жидкости;
U
p
— скорость роста кристалла.
Выражение (56) применимо и в случае, когда К
р
> 1 (см.
рис.
44, б).
Неравномерное распределение компонента Б в жидкости
обусловливает и различие температур ликвидуса в разных ее
участках.
Если линия ликвидуса близка к прямой, температура
ликвидуса на расстоянии х от фронта кристаллизации
D
, (57)
где
т —
тангенс
угла
наклона линии ликвидуса.
79
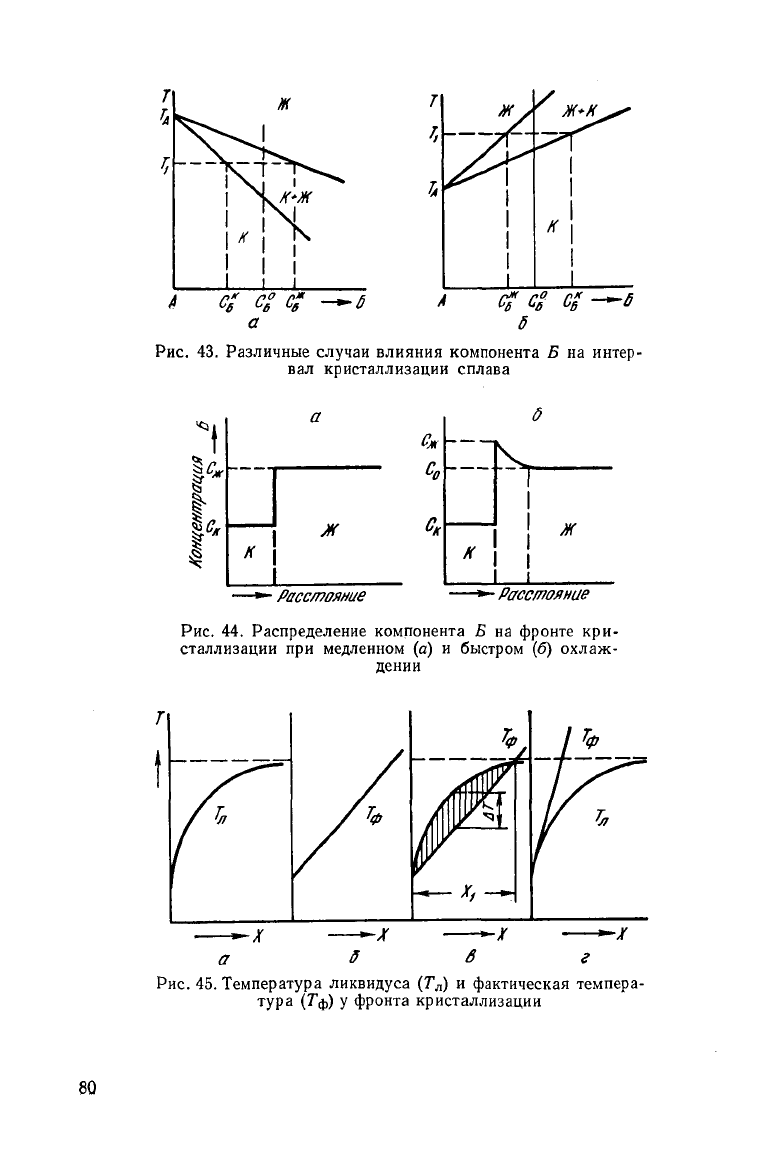
Рис.
43. Различные случаи влияния компонента Б на интер-
вал кристаллизации сплава
См
1
С„
1
I
г
Ж
I
6
1
|
ж
1
1
•
Расстояние
•Расстояние
Рис.
44. Распределение компонента Б на фронте кри-
сталлизации при медленном (а) и быстром (б) охлаж-
дении
Рис.
45. Температура ликвидуса (Т
л
) и фактическая темпера-
тура
(Тф) у фронта кристаллизации
80
