Бунин К.П., Баранов А.А. Металлография
Подождите немного. Документ загружается.

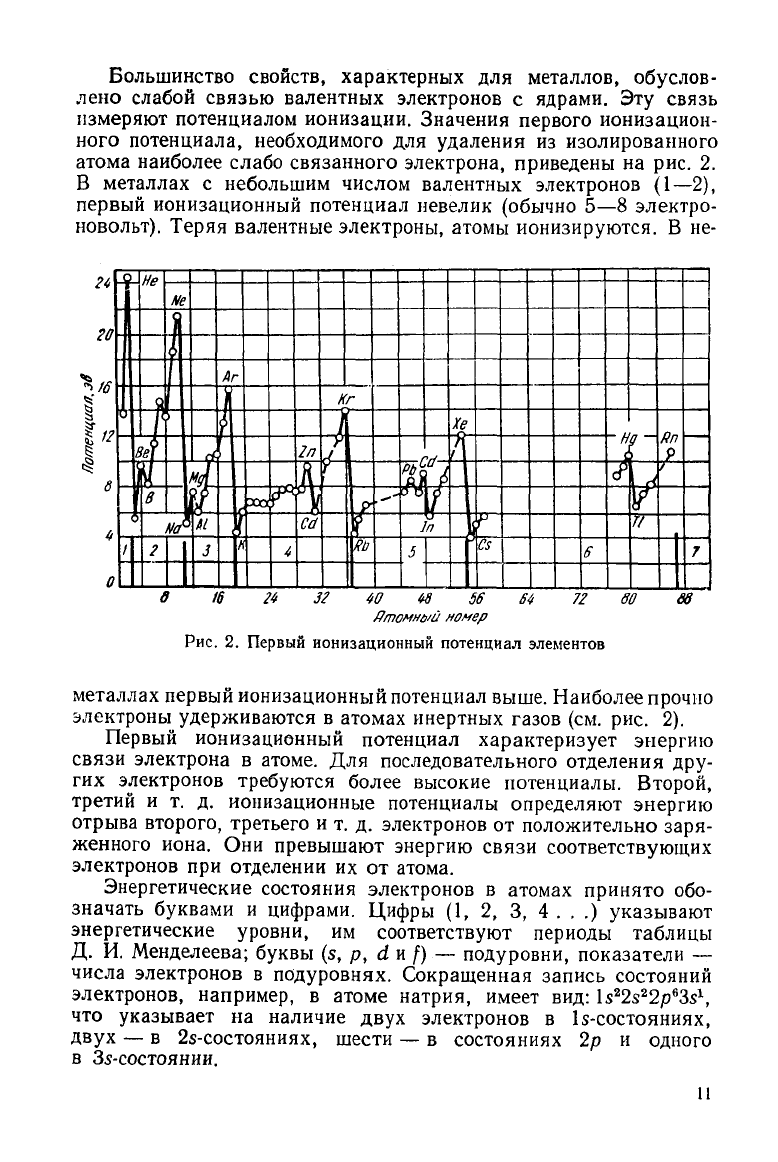
Большинство
свойств, характерных для металлов, обуслов-
лено слабой связью валентных электронов с ядрами. Эту связь
измеряют потенциалом ионизации. Значения первого ионизацион-
ного потенциала, необходимого для удаления из изолированного
атома наиболее слабо связанного электрона, приведены на рис. 2.
В металлах с небольшим числом валентных электронов (1—2),
первый ионизационный потенциал невелик (обычно 5—8 электро-
новольт).
Теряя валентные электроны, атомы ионизируются. В не-
24
20
I-
в
4
0
t
I
I
I
He
9
ft
ж
\\в
Ne
\
\
A
i
f
Щ
i
1
2
3
\
r
xot
1
r~
4
Zn
к
К
л/
Kr
\
J_
P"
{
Rb
.-*
V-
6
V
In
5
Xe
r
\v
Cs
6
- н
g-
Л
Y
ЙП
p
f
—
7
8
16 24 32 40 W 56 Si 72 80 SS
Рис.
2. Первый ионизационный потенциал элементов
металлах первый ионизационный потенциал выше. Наиболее прочно
электроны
удерживаются в атомах инертных газов (см. рис. 2).
Первый
ионизационный потенциал характеризует энергию
связи
электрона в атоме. Для последовательного отделения дру-
гих электронов требуются более высокие потенциалы. Второй,
третий и т. д. ионизационные потенциалы определяют энергию
отрыва второго, третьего и т. д. электронов от положительно заря-
женного иона. Они превышают энергию связи соответствующих
электронов
при отделении их от атома.
Энергетические состояния электронов в атомах принято обо-
значать буквами и цифрами. Цифры (1, 2, 3, 4 . . .) указывают
энергетические уровни, им соответствуют периоды таблицы
Д.
И. Менделеева; буквы (s, p, dnf) — подуровни, показатели —
числа электронов в подуровнях. Сокращенная запись состояний
электронов,
например, в атоме натрия, имеет вид:
Is
2
2s
2
2p
6
3s
1
,
что указывает на наличие
двух
электронов в ls-состояниях,
двух
— в 2з-состояниях, шести — в состояниях 2р и одного
в 3S-COCTOHHHH.
И
1H/s
2
.3
Li 2s
4
Re 2s
2
5
В 2s
2
2p
2s
z
2p
2
Zs
2
Zp
3
2s
2
2p
l>
2s
2
2p
s
6 С
7
N
8
О
9
F
Ne
Zs
2
zp
6
p
12
Mg 2p
s
3s
2
13
Al 3s
2
3p
14
Si Js^'
15
P 3s
2
3p
3
16 S ^*
17
Cl
18
ТАБЛИЦА
ЭНЕРГЕТИЧЕСКОЕ РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ
В
АТОМАХ
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
37
Rb 4p
6
5s
38
Sr4/»
e
55
39
У Ud 5s
!
40
Zr
41
Nb
42
MO
ЛЗ
Тс Ud
s
5s
44
Ru 4i/
7
J5
45
Rh
46 Pd
47
Ag 4d'"Ss
48 Cd
bd'°5s
2
49 In
55^5/7
50 Sn
5s
2
5p
2
51
SbJj'V^
52
Те 5s
2
5p*
53
3
J^
?
J/7
5
54
Xe 5s
2
5p
6
19 К /
'20
Ca 3p
6
4s
2
'21
Scu/4s*
22 Ti 3d*4s
2
23
V
Л^45
г
24
Cr 3d
5
4s
25
Mn3d
s
4s
2
26 Fe 3d4s
2
27
CO
28
Ni
29
Cu3d'4s
v
Zn
,31
Ga
32
Ge /
,33 As
is'ip
3
,34
Se
35
Вг
36 Кг
J5
CS
'56
Ba
5p'6s*
'Ы
La 5p
6
5d6s
!
58
Се "
59
Pr
60
Nd
61
Pm
62
63
Eu 4f
7
6s
2
64
Gd i,f
7
5d6s
2
65
Tb bf
s
5d6s*
66 Dy
67
HO
68 Er Uf
n
6s
2
69
70
Vb
\71
Lu Uf
n
5d6s
2
J2
Hf ^
73
Та
,74
W 5d*6s*
Re
V
OS
J7
Ir 5d
9
78
Pt 5^%
79
Au 5d'°6s
,80
Hg 5U"%^
,81
Tl 6s
2
6p
[82
Pb 6s
2
6p*
ф Bi
tfj^
a
V
84
PO 6s
2
6p*
$5
Ai 6s
2
6p5
86
Rn 6s
2
6p
s
87
Fr 6p4s
88 Ra ^«75'
89
Ac 6d7s
2
90
Th
(У^75'
gi Pa 5f
2
6d7s
2
92
U 5f
3
6d7s
2
93
Np
94
Pu
95
Am5f
7
7s
2
96 Cm5f
7
6d7s*
97
SK 5f
B
6d7s
2
98 Cf 5f
9
Bd7s
2
99
An 5f'°6d7s
2
100
Ct 5f"6d7s
2
101
r\d5f'*6d7s
2
102
No
103
Lv
104
Ku

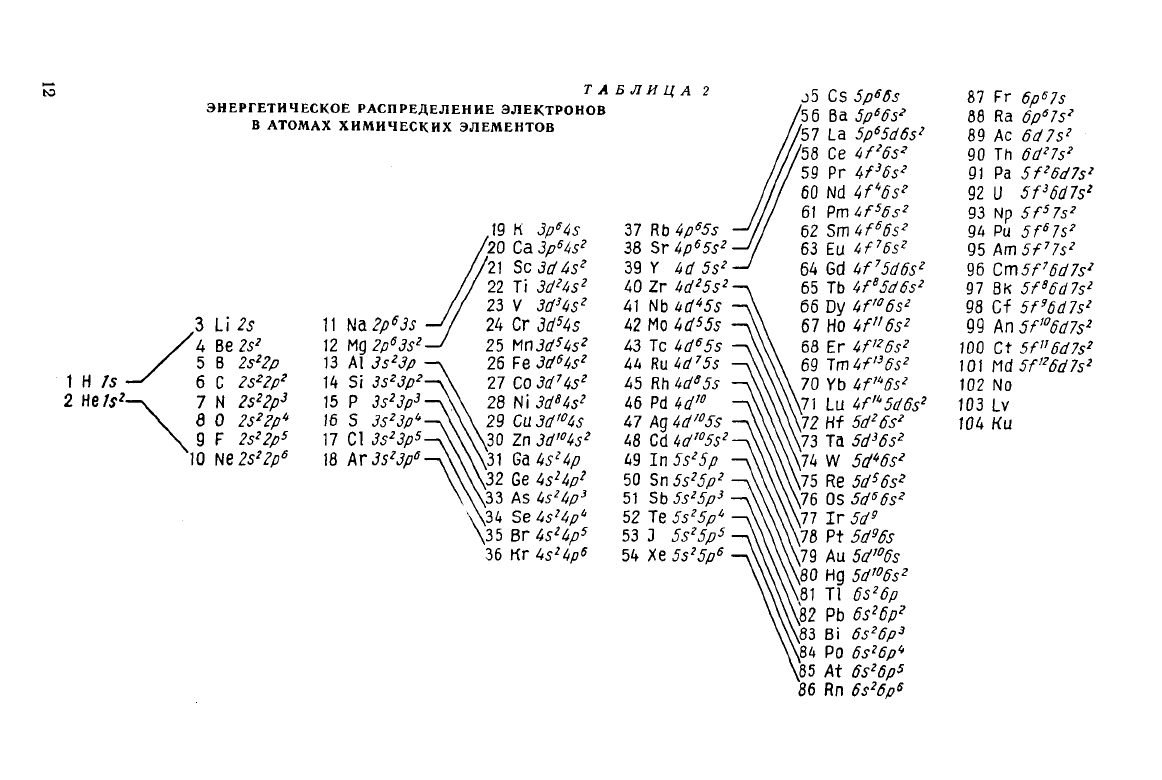
Энергетическое распределение электронов в атомах химических
элементов указано в табл. 2. На нижней ступени этого распреде-
ления
(Is)
могут
разместиться только 2 электрона с разными спи-
нами.
Она заполнена в атоме гелия и в атомах
всех
следующих
за ним элементов. С увеличением заряда ядра эти электроны при-
тягиваются к нему сильнее и отделение их
требует
большей
энергии.
Второй уровень возникает в атоме лития. В следующих за ним
элементах происходит последовательное заполнение второго
уровня (2s- и 2р-подуровни). Оно завершается у неона, имеющего
на
этом уровне 8 электронов. В атомах
всех
последующих эле-
ментов второй уровень заполнен 8 электронами.
Дальше последовательность заполнения уровней электронами
нарушается. На третьем уровне помимо s- и р-электронов
могут
находиться d-электроны. Их энергия может оказаться большей,
чем энергия s-электронов следующего четвертого уровня, и поэтому
девятнадцатый электрон, появляющийся у калия, находится
в
4s-, а не в З^-состоянии. Это имеется и в следующем элементе —
кальции,
у которого в состоянии 4s оказывается уже 2 электрона.
В элементах от скандия до меди происходит постепенное увеличе-
ние
числа электронов. Увеличение же числа электронов четвертого
уровня приостанавливается, поскольку их энергия в З^-состоя-
нии
меньше, чем в 4р-состоянии. У атомов меди третий уровень
заполняется
18 электронами. Энергия 3d- и 45-электронов близки
и
поэтому, в зависимости от условий, распределение электронов
между
3d- и 45-состояниями может меняться, что приводит к пере-
менной
валентности.
Аналогично заполняются уровни в пятом периоде(от иттрия
до палладия — подуровень Ad) и в шестом (от лантана до пла-
тины
— подуровень 4/ и bd). Металлы, в которых внутренние
подуровни частично заполнены электронами, называются пере-
ходными (в табл. 1 они заключены в рамку).
При
заполнении подуровней электроны, пока это возможно,
сохраняют спины параллельными и не образуют пар. Лишь по
исчерпании
таких возможностей образуются электронные пары
с противоположными спинами. Заполненные подуровни содержат
четное число электронов, что свидетельствует об их спаренности.
В азоте, например, имеется три р-электрона, и все они имеют па-
раллельные спины. В атоме следующего за азотом кислорода
на
один р-электрон больше, и он образует пару с одним из
трех
предыдущих электронов.
3.
ЭЛЕКТРОННАЯ СТРУКТУРА
КОНДЕНСИРОВАННЫХ
ШАЗ
Характерные для металлов физические свойства проявляются
в
конденсированном состоянии. Слабо связанные с ядрами валент-
ные
электроны перестают принадлежать каждому атому в отдель-
13
ности,
они коллективизируются, образуя единую для всего жид-
кого или
твердого
тела
квантованную электронную систему. В кон-
денсированном состоянии металл представляет совокупность по-
ложительно заряженных ионов,
удерживаемых
вместе двигаю-
щимися
между
ними коллективизированными электронами. Общая
энергия
связи определяется энергией притяжения
между
поло-
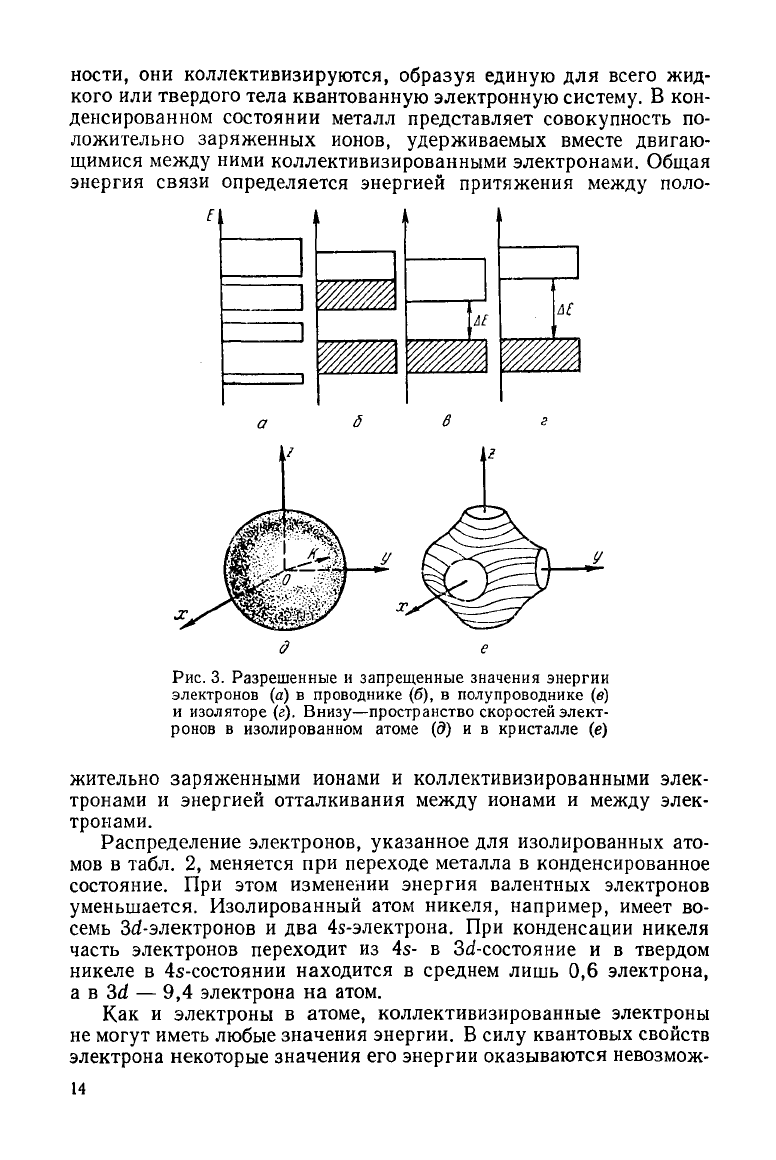
Рис.
3. Разрешенные и запрещенные значения энергии
электронов (а) в проводнике (б), в полупроводнике (в)
и
изоляторе (г). Внизу—пространство скоростей элект-
ронов в изолированном атоме (д) и в кристалле (е)
жительно заряженными ионами и коллективизированными элек-
тронами и энергией отталкивания
между
ионами и
между
элек-
тронами.
Распределение электронов, указанное для изолированных ато-
мов в табл. 2, меняется при
переходе
металла в конденсированное
состояние. При этом изменении энергия валентных электронов
уменьшается. Изолированный атом никеля, например, имеет во-
семь Зс(-электронов и два 4я-электрона. При конденсации никеля
часть электронов
переходит
из 4s- в Зс(-состояние и в твердом
никеле в 45-состоянии находится в среднем лишь 0,6 электрона,
а в 3d — 9,4 электрона на атом.
Как
и электроны в атоме, коллективизированные электроны
не
могут
иметь любые значения энергии. В силу квантовых свойств
электрона некоторые значения его энергии оказываются невозмож-
14

УДК
620.18(075.8)
Металлография. Бунин К. П., Баранов А. А
Изд-во
«Металлургия», 1970, 256 с.
В книге рассматривается формирование структуры
в
металлах и металлических сплавах. Основное внима-
ние
уделяется микроскопической картине кристаллиза-
ции
и структурных изменений в твердом состоянии. Из-
ложены основы металлографии железоуглеродистых
сплавов.
Рекомендуется студентам и аспирантам металлурги-
ческих и машиностроительных вузов в качестве учеб-
ного пособия по курсу «Металлография». Может быть
полезна также работникам металловедческих лаборато-
рий
и заводским инженерам термистам и литейщикам.
Илл.
140. Табл. 6, Библ. 45 назв.
3-11-1
79-70

Неметаллические кристаллы
смогут
проводить электрический
ток
в том
случае,
если электроны заполненных
зон
перепрыгнут
запрещенную область
и
окажутся
в
следующей
верхней зоне,
остававшейся
до
этого свободной. Здесь имеется много свободных
уровней
и
электроны
могут
получать ускорение. Теперь возможно
ускорение
и
электронов нижней зоны,
где
возникают свободные
уровни. Подобная проводимость появляется
при
нагревании,
когда некоторые электроны заполненной зоны, увеличивая
ско-
f
\
6
-е-
6
о
о
9
ч>
Ф
&
9 Ф
9
9 Ф Ф
о
Ф9
фф
фф
Фф
фф
ФФФ
ф
ф
ффф ффбф
ффф фф<;)фф
ффф
ф ф о ф q>
t
f
t
Ф
Ф
ф
Рис.
4. Ориентация магнитных моментов атомов:
в парамагнетике:
а—без
поля;
б—в
поле;
в—в ферромагнетике;
г—в
антиферромагнетике;
д
— в
ферримагнетике
рость, пересекают запрещенную область
и
переходят
в
свободную
зону.
В
зависимости
от
величины энергии, необходимой
для ука-
занного возбуждения электронов, неметаллические кристаллы
могут
быть либо полупроводниками
(рис. 3, б),
если запрещенная
область узка
« 4
эв), либо
(см. рис. 3, г)
непроводниками (изоля-
торами).
Вращение электронов создает магнитное поле. Если электроны
спарены, магнитные поля
их
противоположно направлены
и
ском-
пенсированы.
При
наличии неспаренных электронов атомы (ионы)
обладают
магнитным моментом.
В
отсутствие
внешнего магнит-
ного поля
эти
моменты обычно разориентированы,
и
намагничен-
ность металла
отсутствует
(рис. 4, а). Под
влиянием внешнего
поля магнитные моменты атомов ориентируются преимущественно
в одном направлении
и в
металле создается результирующая
на-
16

магниченность (рис. 4, б). Если магнитные моменты атомов (ионов)
ориентируются в направлении поля независимо
друг
от
друга,
металлы называют парамагнетиками. Усиливающееся с повыше-
нием
температуры тепловое движение атомов приводит к разупоря-
дочению магнитных моментов, и суммарная намагниченность
парамагнетиков уменьшается.
Под влиянием внешнего поля может происходить и изменение
энергии коллективизированных электронов. Объясняется это
взаимодействием его с магнитным полем, возникающим при дви-
жении электронов. Электроны, вращение которых вокруг соб-
ственной оси создает поле, совпадающее с направлением внешнего,
обладают
меньшей энергией, чем электроны с противоположным
спином.
Поэтому часть электронов меняет направление вращения
(спиновый
переход), и это приводит к уменьшению магнитной
энергии.
Щелочные и щелочноземельные металлы являются слабыми
парамагнетиками.
Ионы
этих металлов имеют полностью застроен-
ные электронные оболочки, и магнитный момент создается лишь
коллективизированными электронами. Инертные и многие дру-
гие газы не
могут
быть поэтому парамагнетиками, они являются
диамагнетиками.
Диамагнетизм проявляется во
всех
металлах
и неметаллах.
Под влиянием внешнего поля орбитальные электроны изменяют
свою скорость, что приводит к возникновению магнитного мо-
мента. Однако в отличие от парамагнетизма вектор намагничен-
ности в диамагнетиках направлен противоположно полю и они
отталкиваются от полюсов магнита. Сильными диамагнетиками
являются висмут,
сурьма,
бериллий, цирконий. Большинство
переходных металлов являются сильными парамагнетиками. В ато-
мах этих элементов 3d- и 4/-оболочки не прлностью заняты, и в них
имеются электроны с некомпенсированными спинами. Пара- и
диамагнетизм проявляются при наличии внешнего поля, и с его
удалением намагниченность устраняется.
Наряду с этим
существует
небольшая группа металлов, на-
магниченность которых проявляется и без внешнего поля (ферро-
магнетизм). Ферромагнетиками являются некоторые переходные
(Fe,
Co, Ni) и редкоземельные (Gd, Dy) металлы. В них также
имеются неспаренные электроны, и магнитные моменты атомов
принимают одну и ту же ориентировку. При этом взаимодействие
атомов настолько велико, что упорядоченное размещение магнит-
ных моментов, подобно указанному на рис. 4, б, происходит и без
внешнего поля и ферромагнетики намагничиваются спонтанно
(рис.
4, б).
Упорядоченным расположением магнитных моментов атомов
характеризуется и магнитная
структура
антиферромагнетиков
(Gr,
Mn) и некомпенсированных антиферромагнетиков (ферри-
магнетиков) (рис. 4, г, д).
17

При
конденсации газа коллективизация валентных электронов
может быть неполной. В этом
случае
электроны с противополож-
ными
спинами образуют пары, связывающие атомы
друг
с другом.
Наиболее ярко этот тип направленной (ковалентной) связи вы-
ражен в алмазе. Встречается она и в металлах, особенно в переход-
ных. В них, наряду с металлической связью имеется и ковалент-
ная,
что обусловлено незаполненностью 3d- и 4/ подуровней.
Благодаря этому переходные металлы имеют высокую темпера-
туру
плавления, они более тверды и менее пластичны, чем металлы
I
и II групп и субпериодов, у которых имеется чисто металличе-
ская
связь. Влияние направленной составляющей связи сильно
сказывается на свойствах, например, хрома, молибдена, вольфрама.
Между атомами
действуют
также и слабые поляризационные силы
притяжения.
4.
АТОМНОЕ СТРОЕНИЕ
КОНДЕНСИРОВАННЫХ
МЕТАЛЛОВ
В конденсированных фазах атомы (ионы) размещаются так,
что действующие
между
ними силы притяжения и отталкивания
уравновешиваются. При уменьшении межатомных расстояний
энергия
отталкивания превышает энергию притяжения и возра-
стает настолько сильно, что
даже
при больших давлениях не
удается
заметно сблизить атомы. С удалением их энергия отталки-
вания
убывает
быстрее энергии притяжения, и на расстоянии г
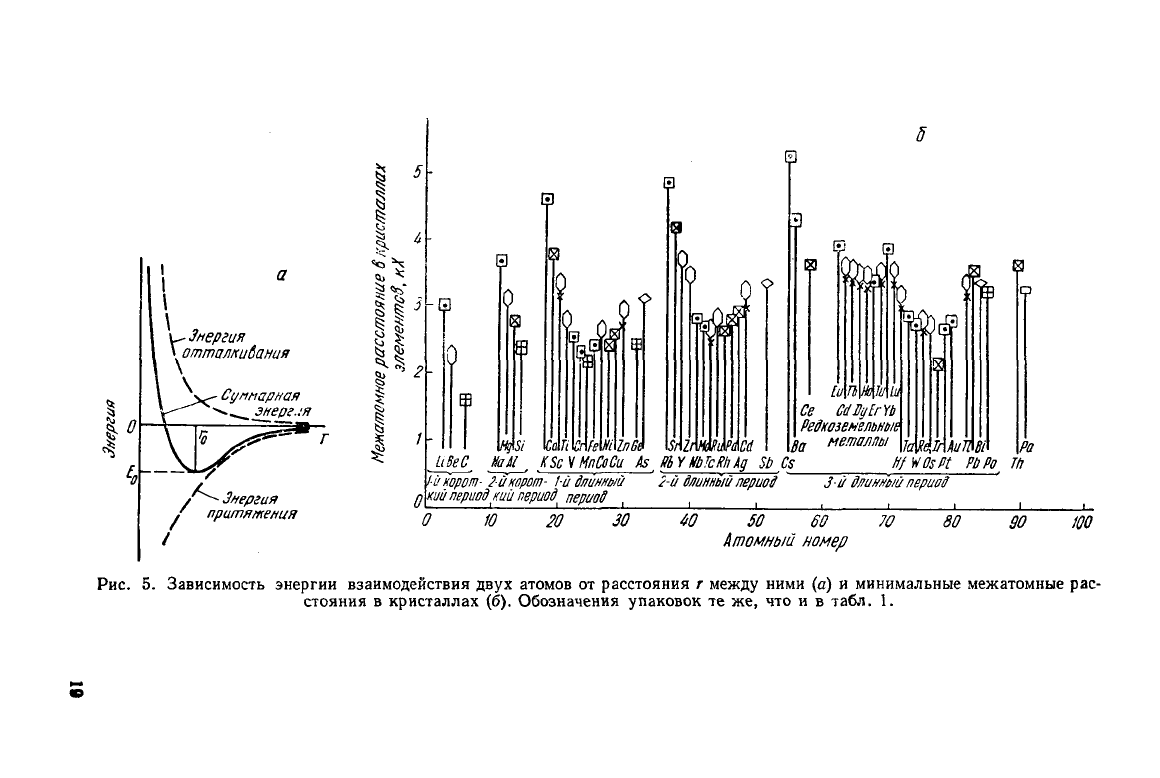
0
суммарная энергия становится минимальной (рис. 5, а). Это
мини-
мальное значение энергии Е
о
равно работе удаления атомов на
бесконечно большое расстояние
друг
от
друга
(энергия сублима-
ции).
Значения г
0
для различных элементов указаны на рис. 5, б.
Чтобы удалить атомы (вернее ионы) на расстояние, больше равно-
весного г,,, или сблизить на расстояния, меньшие г
0
, необходимо
затратить энергию.
При
формировании кристаллов атомы размещаются законо-
мерно.
Это правильное размещение обычно характеризуют про-
странственной решеткой. Узлы ее соответствуют равновесным
положениям атомов. Если известен характер размещения атомов
в кристалле и расстояние г
0
, то можно указать координаты любого
атома, как бы далеко он не был размещен от координатного центра.
В этом смысле можно говорить о дальнем порядке размещения
атомов в кристаллических
телах.
В металлических кристаллах большая плотность упаковки
атомов: каждый из них обычно окружен 12 или 8 ближайшими
равноудаленными соседями. Это число, называемое координацион-
ным
(к. ч.), характеризует ближний порядок размещения атомов
в пространстве. Известно 14 типов упаковки атомов. В металлах
наиболее часто встречаются три: гранецентрированная кубиче-
ская
— г. ц. к. (рис. 6, а), гексагональная плотная — г. п. (рис. 6, б)
и
объемноцентрированная кубическая — о. ц. к. (рис. 6, в).
18
I-
у- Энергия
\
отталкибания
•
Сулмарная
энергия
Энергия
притятения
1
§i'
s
п
р
п
0
О
OK?
Coff
О
SriZnWiiPiiCd
D
D
О
[и
лщщы
Ce
CdDyErib
Редкоземельнше
„
металлы
mt^
KScVMnCoCu AsJbYUbrclthig Sb Cs
id
трот-
2-й
трот-
1-й
длинный
' 2-й
длиншп
период
[)\кип
период
кий
периоду
период
Ра
fifWOsPt
PbPo
Th
3-й
длинный
период
'
О 10
20
30
50
60
Атомный
номер
70
80 90 100
Рис.
5. Зависимость энергии взаимодействия
двух
атомов от расстояния г между ними (а) и минимальные межатомные рас-
стояния
в кристаллах (б). Обозначения упаковок те же, что и в табл. 1.
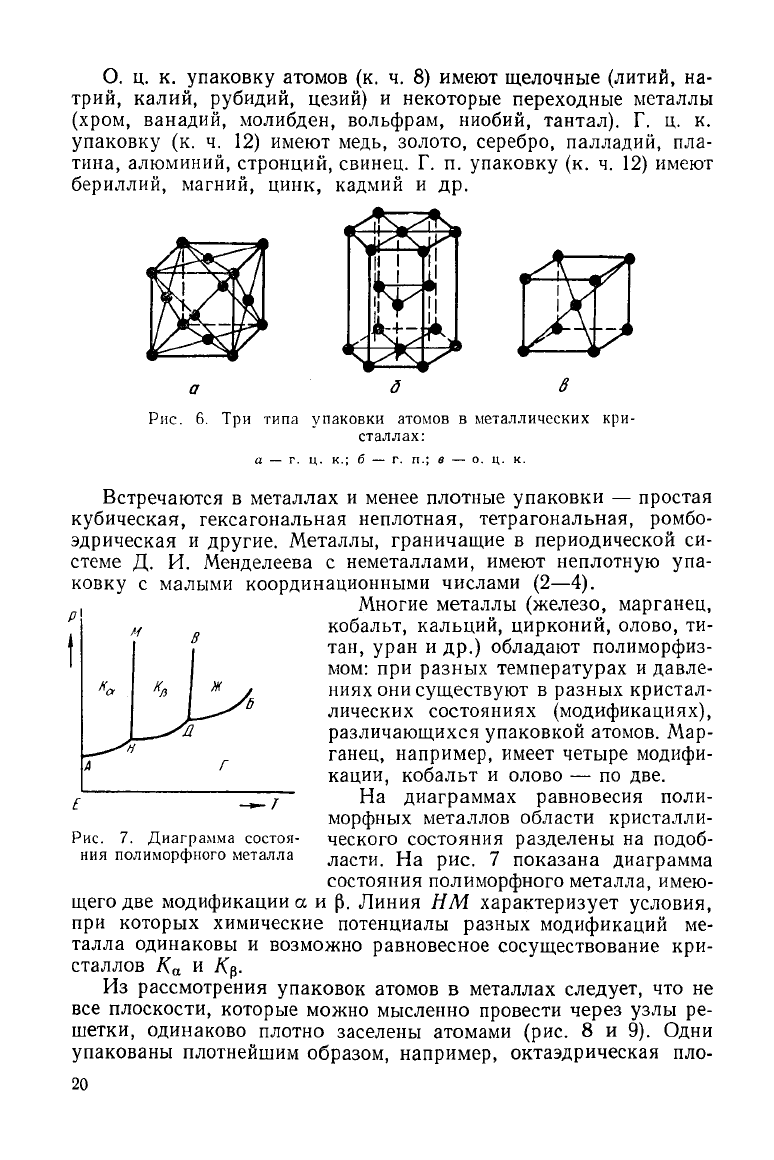
О. ц. к. упаковку атомов (к. ч. 8) имеют щелочные (литий, на-
трий,
калий, рубидий, цезий) и некоторые переходные металлы
(хром, ванадий, молибден, вольфрам, ниобий, тантал). Г. ц. к.
упаковку (к. ч. 12) имеют медь, золото, серебро, палладий, пла-
тина,
алюминий, стронций, свинец. Г. п. упаковку (к. ч. 12) имеют
бериллий, магний,
цинк,
кадмий и др.
Рис.
6. Три типа упаковки атомов в металлических кри-
сталлах:
а — г. ц. к.; б
г. п.; в — о. ц. к.
Р
Встречаются в металлах и менее плотные упаковки — простая
кубическая, гексагональная неплотная, тетрагональная, ромбо-
эдрическая и другие. Металлы, граничащие в периодической си-
стеме Д. И. Менделеева с неметаллами, имеют неплотную упа-
ковку с малыми координационными числами (2—4).
Многие
металлы (железо, марганец,
кобальт, кальций, цирконий, олово, ти-
тан,
уран и др.) обладают полиморфиз-
мом:
при разных температурах и давле-
ниях
они
существуют
в разных кристал-
лических состояниях (модификациях),
различающихся упаковкой атомов. Мар-
ганец,
например, имеет четыре модифи-
кации,
кобальт и олово — по две.
На
диаграммах равновесия поли-
морфных металлов области кристалли-
ческого состояния разделены на подоб-
ласти. На рис. 7 показана диаграмма
состояния
полиморфного металла, имею-
щего две модификации а и р\ Линия НМ характеризует условия,
при
которых химические потенциалы разных модификаций ме-
талла одинаковы и возможно равновесное сосуществование кри-
сталлов К
а
и Др.
Из
рассмотрения упаковок атомов в металлах
следует,
что не
все плоскости, которые можно мысленно провести через узлы ре-
шетки,
одинаково плотно заселены атомами (рис. 8 и 9). Одни
упакованы плотнейшим образом, например, октаэдрическая пло-
20
Рис.
7. Диаграмма состоя
ния
полиморфного металла
