Біотехнологія 2008 Том 1, №3
Подождите немного. Документ загружается.


Експериментальні статті
41
На відміну від антидДНК АТ, антигісто
нові АТ було виявлено у складі 12 препара
тів Ig молозива породіль (рис. 3). При цьому
у шести препаратах рівень їх був близьким
або перевищував рівень антигістонових АТ,
виявлених у препаратах IgG сироватки
крові хворих на розсіяний склероз. Найви
щим вмістом антигістонових АТ характери
зувався препарат № 4, де рівень антигістоно
вих АТ у 2,5 раза перевищував рівень їх
у препаратах IgG сироватки крові хворих на
розсіяний склероз. Варто зазначити, що, на
відміну від інших препаратів Ig, молозиво
породіллі №4 окрім антигістонових АТ міс
тило також антидДНК АТ. Присутність ав
тоАТ із різною специфічністю у молозиві
жінки дає підстави припустити, що в її орга
нізмі можуть відбуватися зміни в імунному
статусі, а отже в подальшому це може приз
водити до виникнення автоімунних або
алергічних захворювань.
Важливою характеристикою автоАТ
є їхня каталітична активність щодо автоАГ.
Встановлено, що ДНКгідролізуючі антиті
ла (ДНКзими) присутні у крові хворих на
автоімунні та деякі інші захворювання,
однак їх не виявлено у крові клінічно здоро
вих людей. ДНКзими було знайдено у сиро
ватці крові пацієнтів з автоімунними захво
рюваннями (системний червоний вівчак,
ревматоїдний артрит, автоімунний тирої
дит, розсіяний склероз та ін.), а також у хво
рих на СНІД, променеву хворобу та деякі
лімфопроліферативні захворювання (Влім
фолейкози) [8, 25]. ДНКгідролізуючі анти
тіла ізотипів sIgA та IgG було також виявле
но у молоці та молозиві клінічно здорових
породіль [17]. Частота, з якою ці абзими
трапляються у молозиві, та взаємозвязок їх
з автоімунними порушеннями у породіль за
лишаються малодослідженими.
Ми провели аналіз ДНКгідролізуючої
активності препаратів Ig молозива породіль.
Відомо, що ДНКзимам притаманна топоізо
меразна активність щодо надспіралізованої
ДНК плазміди [26]. ДНКзими, подібно до
топоізомераз, каталізують розриви в одній
із двох ниток ДНК, що призводить до утво
рення релаксованої форми ДНК плазміди.
Оскільки ці дві форми ДНК мають різну
електрофоретичну рухливість, їх можна
розділити електрофорезом у гелі агарози.
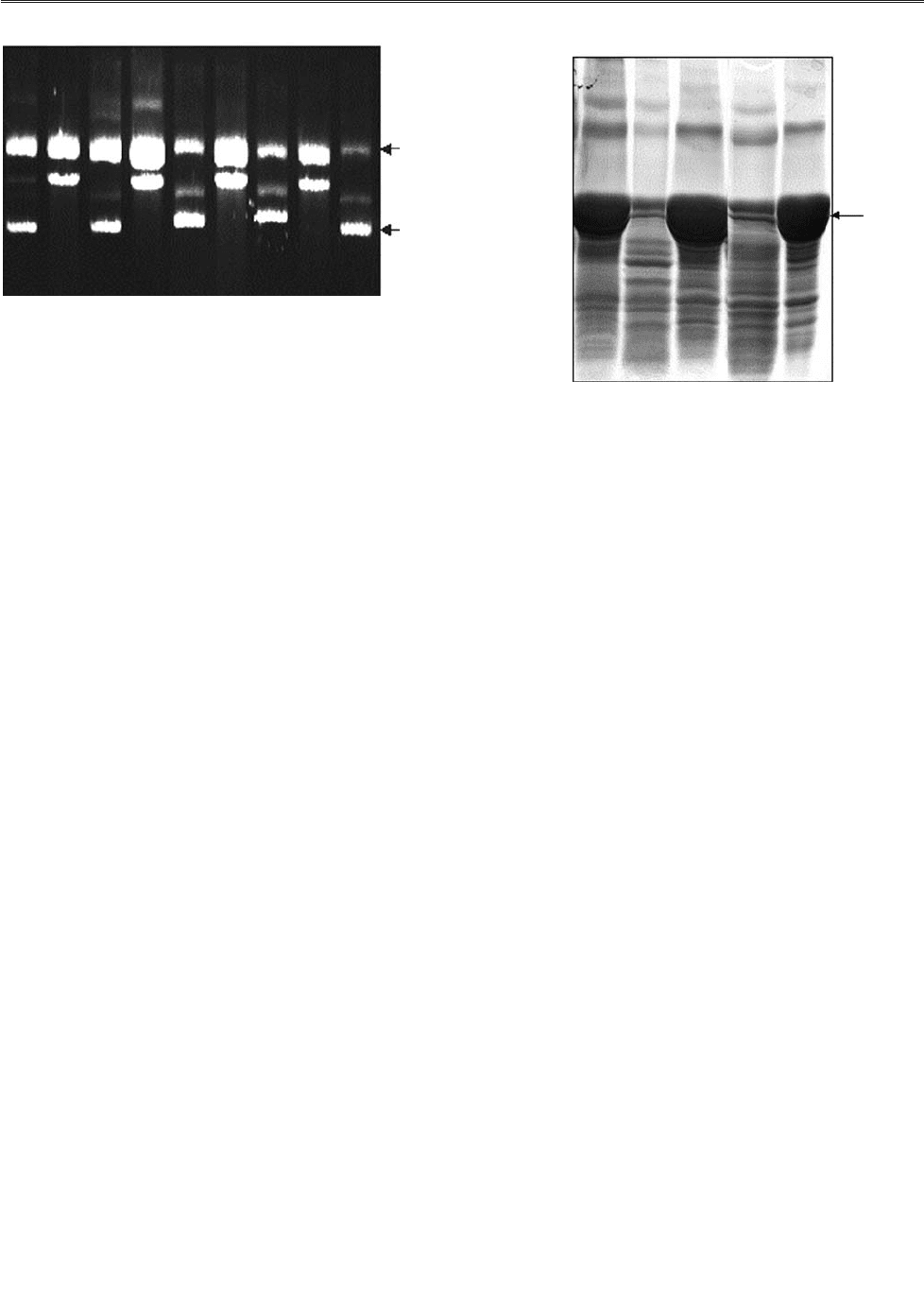
Було встановлено, що препарати Ig №4, 8,
18 та 21 гідролізують надспіралізовану плаз
мідну ДНК подібно до ДНКзимів, виділених
із сироватки крові пацієнтів з автоімунними
захворюваннями (рис. 4). В інших препаратах
Ig топоізомеразну активність не виявлено.
розсіяний склероз, а як негативний — пре
парати IgG сироватки крові клінічно здоро
вих донорів. Було встановлено, що вміст ан
тидДНК АТ в усіх препаратах Ig молозива
породіль, окрім препарату Ig №4, суттєво не
відрізнявся від вмісту антидДНК АТ у пре
паратах IgG, виділених із сироватки крові
здорових донорів (рис. 3). Вміст антидДНК
АТ у препараті № 4 був достовірно вищим,
ніж у інших препаратах АТ, хоча й був ниж
чим, ніж у препаратах IgG, виділених із си
роватки крові хворих на розсіяний склероз.
Рис. 2. Рівень виживання ТKклітин лінії Jurkat під
впливом препаратів Ig (1–25), очищених із молоK
зива породіль. К — контроль (за відсутності Ig)
Рис. 3. Імуноферментний аналіз (ІФА) відносного
вмісту автоKАТ зі спорідненістю до дволанцюгової
ДНК (антиKдДНК АТ) та гістонів (антигістонові
АТ) у препаратах Ig.
На діаграмі показано співвідношення вмісту авто
АТ у препаратах Ig, визначеного за величиною оп
тичного поглинання забарвлених продуктів перок
сидазної реакції: 1–25 — препарати Ig молозива
породіль; К1+, К2+ — препарати Ig сироватки
крові хворих на розсіяний склероз; К1–, К2– —
препарати Ig сироватки крові клінічно здорових до
норів
антигістонові АТ
антидДНК АТ
БІОТЕХНОЛОГІЯ, Т. 1, №3, 2008
42
не є вузькоспецифічними щодо субстратів
і крім ДНК вони можуть також гідролізува
ти синтетичні олігонуклеотиди та різні типи
РНК [7, 26]. Тому не виключено, що ДНК
зими каталітично активних препаратів Ig
№4, 8, 21 є автоАТ зі спорідненістю до одно
ланцюгової ДНК або РНК.
У табл. 1 подано узагальнені результати
дослідження антигенної специфічності, ци
тотоксичної та каталітичної активності пре
паратів Ig молозива породіль. Як випливає
із результатів цього аналізу, функціональна
активність Ig молозива двох породіль (№4
і №21) суттєво відрізняється від функціона
льної активності Ig інших породіль. Спіль
ною ознакою для породіль №4 і №6 є:
– високий вміст секреторних імуногло
булінів класу А;
– низька (або відсутня) цитотоксична ак
тивність щодо людських лейкемічних Т
клітин лінії Jurkat;
– наявність антигістонових АТ;
– топоізомеразна та протеолітична ак
тивність.
Наведена сукупність ознак свідчить про
те, що стан гуморального імунітету цих по
роділь відрізняється від стану інших поро
діль, і причиною цих змін можуть бути авто
імунні процеси, пов’язані з вагітністю та
пологами. В анамнезі цих породіль виявле
но суттєві відхилення від норми, зокрема
перебіг вагітності у них супроводжувався
загрозою переривання вагітності, токсико
зом, набряками кінцівок, що певною мірою
Іншим типом абзимів, присутність яких
в організмі свідчить про автоімунні порушен
ня, є протеїнгідролізувальні автоАТ (про
табзими). Протабзими класів sIgA і IgG, що
здатні гідролізувати бетаказеїн жіночого та
коров’ячого молока, було виявлено у молоці
клінічно здорових жінок і в сироватці крові
хворих на СНІД [27, 28]. Нами було встанов
лено, що високоочищені препарати sIgA,
виділені з молозива породіль, гідролізують
гістон Н1 [29]. Антитіла класу IgG із подіб
ною субстратною специфічністю також було
знайдено у сироватці крові хворих на розсія
ний склероз (дані не опубліковано). Одержа
ні результати вказують на те, що абзими, які
гідролізують гістон Н1, подібно до інших
протабзимів, можуть слугувати маркерами
автоімунних порушень в організмі людини.
У даній роботі встановлено, що препарати Ig
№ 4 та № 21 гідролізують гістон Н1 (рис. 5).
Іншим препаратам не притаманна каталі
тична активність щодо цього білка.
Враховуючи ту обставину, що препарати
Ig були недостатньо очищені від домішок
інших білків молозива, не можна виключи
ти, що каталітична активність деяких із цих
препаратів може бути наслідком дії домі
шок ензимів молока. Підвищений вміст ав
тоАТ зі спорідненістю до ДНК та гістонів
у складі каталітично активних препаратів
Ig №4 і №21 свідчить на користь присутнос
ті в них абзимів. Відсутність автоАТ зі спо
рідненістю до дволанцюгової ДНК у складі
препаратів Ig № 8, 18, 21 не виключає мож
ливості функціонування ДНКзимів. Відомо,
що, на відміну від протабзимів, ДНКзими
Рис. 4. Гідроліз плазмідної ДНК під впливом
препаратів Ig молозива породіль:
3, 7, 17, 20 — препарати Ig, у яких топоізомеразна
активність відсутня;
4, 8, 18, 21 — препарати Ig, яким притаманна топо
ізомеразна активність;
К — плазміда pBR322. Стрілками вказано положен
ня на гелі релаксованої (РП) та надспіралізованої
(СП) форм плазмідної ДНК
Рис. 5. Гідроліз гістону Н1 під впливом препаратів
Ig молозива породіль:
3, 22 — препарати Ig, у яких протеолітична актив
ність відсутня;
4, 21 — препарати Ig, здатні гідролізувати гістон
Н1; К — гістон Н1. Стрілкою вказано положення на
гелі гістону Н1
1
Н1
2221
К
4
3
СП
РП
К
2120
181787
4

Експериментальні статті
43
нуклеопротеїнів ядра можуть слугувати
діагностичними маркерами розвитку дея
ких автоімунних захворювань [6, 23]. Для
визначення положення ядер фіксовані
клітини лінії Jurkat фарбували флуоресцен
тним барвником DAPI. Встановлено, що
у препаратах Ig №4, 21 і 24 присутні авто
АТ класу IgA зі спорідненістю до біострук
тур Тклітин лінії Jurkat (рис. 6). У препа
раті Ig породіллі № 20 автоАТ класу sIgA
з подібною антигенною специфічністю не
виявлено. Накладання фазовоконтрастних
та флуоресцентних зображень клітин дозво
лило продемонструвати, що антигени авто
sIgA антитіл препаратів Ig №4 містяться
у ядрі клітин і, ймовірно, є компонентами
підтверджує припущення щодо розвитку ав
тоімунних порушень.
Важливою ознакою автоімунних пору
шень у людини є поява у сироватці крові ав
тоАТ до внутрішньоклітинних автоанти
генів [23]. Враховуючи ту обставину, що
sIgA є головним компонентом фракції Ig мо
лозива людини, було проведено досліджен
ня спорідненості sIgAантитіл препаратів Ig
до антигенів Тклітин лінії Jurkat. Викорис
тано препарати Ig породіль №4, 20, 21, 24,
у яких вміст sIgA, згідно з даними, наведе
ними на рис.1, був найвищим. Для виявлен
ня sIgA застосовували FITCмічені IgG кози,
моноспецифічні до Нланцюгів sIgA люди
ни. Відомо, що автоАТ зі спорідненістю до
Таблиця 1. Характеристика функціональної активності препаратів Ig,
виділених із молозива породіль
Донори
молозива
№ п/п
Цитотоксична
активність Ig
Мітогенна
aктивність
Ig
Вміст
антиДНК
АТ
Вміст анти
гістонових
АТ
Топоізоме
разна
активність
Ig
Протеолітич
на
активність Ig
щодо гістону
Н1
1 + + +
2 + +
3 + + + +
4 + + + ++ + + + +
5 + + +
6 + + +
7 + + +
8 + +
9 + + +
10 + +
11 + + +
12 + + + + +
13 + + + ++
14 + +
15 +
16 + +
17 + +
18 + + +
19 + +
20 + + + + +
21 + + + + + + + +
22 +
23 + + +
24 +
25 + + +
Примітка: «+» — низький, «++» — середній, «+++» — високий рівень прояву функціонального марке
ра у препаратах Ig.

БІОТЕХНОЛОГІЯ, Т. 1, №3, 2008
44
1. Полетаев А. Г. Иммунологический гомун
кулус (иммункулус) в норме и при патоло
гии // Биохимия. — 2002. — Т. 67, №5. —
С. 721–730.
2. Mackay I. R. Autoimmunity: Paradigms of
Burnet and complexities of today // Immun.
Cell. Biol. — 1992. — V. 70, N3. —
P. 159–171.
3. Avrameas S. Natural autoantibodies. From
horror autotoxicus to gnothi seauton //
Immunol. Today. — 1991. — V. 12, N5. —
P. 154–159.
4. Bouvet J/P., Dighitro G. From natural
polyreactive autoantibodies to a la Carte
monoreactive antibodies to infection agents:
is it a small world after all? // Infection and
Immunity. — 1998. — V. 66, N1. — C. 1–4.
5. Dawson K., Bell D. Production and patho
genic effect of antiDNA antibodies: rele
vance to antisense research // Antisense
Res. Devel. — 1991. — V. 1, N4. —
C. 351–360.
6. Kurien B. T., Scofield R. H. Autoantibody
determination in the diagnosis of systemic
lupus erythematosus // Scan. J. Immunol. —
2006. — V. 64, N3. — P. 227–235.
7. Невинский Г. А., Канышкова Т. Г., Бунева В. Н.
Природные каталитически активные ан
титела (абзимы) в норме и при патологии
// Биохимия. — 2002. — Т. 65, №11. —
С. 1473–1487.
8. Gabibov A., Ponomarenko N., Tretyak E. et al.
// Catalytic autoantibodies in clinical auto
immunity and modern medicine // Auto
imm. Rev. — 2006. — V. 5, N5. —
P. 324–330.
9. Сучков С. В. Сравнительное исследование
каталитических (ДНКгидролизирующих)
и цитотоксических свойств антиДНК ау
тоантител // Бюл. эксперим. биол. мед. —
2001. — Т. 131, №4. — С. 420–423.
10. Kozyr A. V., Sashchenko L. P., Kolesnikov A. V.
et al. AntiDNA autoantibodies reveal toxi
city to tumor cell lines // Immunol. Lett. —
2002. — V. 80, N1. — P. 41–47.
11. Gabibov A. Antibody catalysis: Biochemist
ry, immunology, pathology // Ibid. —
2006. — V. 103, N1. — P. 1–2.
12. Nevinsky G., Bunetva N. Catalytic antibodies
in healthy humans and patients with
autoimmune and viral diseases // J. Cell.
Mol. Med. — 2003. — V. 7, N3. —
P. 265–276.
13. Сervera R., Font J., Balasch J. Pregnancy
outcome in systemic lupus erythematosus:
хроматину. Водночас антигени автоsIgA
антитіл препаратів Ig № 21 і № 24 розміщені
головним чином у цитоплазмі та плазма
тичній мембрані Тклітин лінії Jurkat.
Аналіз результатів проведених дослі
джень дає підстави зробити висновок про те, що
функціональні властивості імуноглобулінів
молозива можуть відображати індивіду
альні особливості стану гуморального імуні
тету у породіль. Проте отримані результати
поки що не дозволяють однозначно стверд
жувати, які саме характеристики антитіл
молозива — цитотоксичність, спорідненість
до автоантигенів чи каталітична актив
ність — можуть слугувати маркерами у ран
ній діагностиці автоімунних порушень у по
роділь. Щоб відповісти на це запитання,
потрібно провести комплексне дослідження
стану здоров’я ширшої вибірки породіль,
яких за сумою виявлених нами ознак можна
віднести до групи ризику.
Автори висловлюють подяку д.б.н. М. Д. Лу
цику за надані ним препарати гістонів. Ро
боту виконано за фінансової підтримки
спільного проекту НАН України та Сибір
ського відділення Російської АН.
Рис. 6. Аналіз антигенної специфічності
секреторних IgA препаратів Ig молозива породіль
щодо лейкемічних ТKклітин лінії Jurkat:
К — клітини, не інкубовані з препаратами Ig (конт
роль);
4, 21 — клітини, інкубовані з Ig препаратів №4 та 21;
ФМК — фазовоконтрастна мікроскопія препаратів
клітин;
AIgA — флуоресцентна мікроскопія препаратів
клітин після оброблення їх FITCмічени
ми IgG кози, специфічними до Нланцюгів
IgA людини;
DAPI — флуоресцентна мікроскопія препаратів
клітин, зафарбованих DAPI
ЛІТЕРАТУРА

Експериментальні статті
45
Mol. Med. — 2003. — V. 7, N3. —
P. 265–276.
26. Nevinky G. A., Buneva V. N. Human cathalyt
ic RNA and DNAhydrolyzing antibodies //
J. Immunol. Methods. — 2002. — V. 269,
N1–3. — P. 235–249.
27. Odintsova E. S., Buneva V. N., Nevinsky G. A.
Caseinhydrolyzing activity of sIgA antibod
ies from human milk // J. Mol. Recognit. —
2005. — V. 18, N5. — P. 413–421.
28. Одинцова Е. С., Харитонова М. А., Барано/
вский А. Г. и др. Протеолитическая актив
ность IgG антител из крови больных синд
ромом приобретенного иммунодефицита
человека // Биохимия. — 2006. — Т. 71,
№3. — С. 320 — 332.
29. Кіт Ю. Я., Стойка Р. С. Каталітично ак
тивні антитіла (абзими) молока людини
і деякі механізми регуляції їх активності
// Матеріали IX Укр. біохім. з’їзду, 24–27
жовтня 2006 р., Харків. — Т. 1. — 20 с.
good news for the new millennium // Auto
immun. Rev. — 2002. — V. 1, N6. —
P. 354–359.
14. Канышкова Т. Г., Бунева В. А., Невинс/
кий Г. А. Биологические функции молока
человека и его компонентов // Успехи
совр. биологии. — 2002. — Т. 122, №3. —
С. 259–271.
15. Quan C. P., Berneman A., Pires R., Bouvet J. P.
Natural polyreactive secretory immuno
globulin A autoantibodies as a possible barri
er to infection in humans // Infect. Im
mun. — 1997. — V. 65, N10. —
Р. 3997–4004.
16. Кит Ю. Я., Семенов Д. В., Канышкова Т. Г.
и др. Секреторные иммуноглобулины А мо
лока человека обладают сродством к оли
гонуклеотидам и нуклеиновым кислотам
// Биохимия. — 1999. — Т. 64, №1. —
С. 52–59.
17. Кіт Ю. Я., Стойка Р. С. Каталiтично ак
тивні антитіла (абзими) молока людини //
Укр. біохім. журн. — 2007. — Т. 79,
№2. — С. 5–16.
18. Иммуноглобулины / Под ред. Г. Леитмена
и Р. Гуда. — М.: Мир, 1981. — C. 212–230.
19. Lowry O. H., Rosebrough N. J // Protein mea
surement with the folin phenol reagent // J.
Biol. Chem. — 1951. — V. 193, N1. —
P. 265–270.
20. Laemmly U. K. A cleavege of structugal pro
tein during the assambly of the head of bac
teriofage T4 // Nature. — 1970. — V. 227,
N5259. — P. 2244–2750.
21. Nevinsky G. A., Kanyshkova T. G., Semenov
D. V. et al. Secretory immunoglobulin A from
healthy human mothers’ milk catalyzes
nucleic acid hydrolysis // Appl. Biochem.
Biotechnol. — 2000. — V. 83, N1–3. —
P. 115–129.
22. Polosukhina D. I., Buneva V. N., Doronin B. M.
et al. Hydrolysis of myelin basic protein by
IgM and IgA antibodies the sera of patients
with multiple sclerosis // Med. Sci.
Monit. — 2005. — V. 11, N8. —
P. 266–272.
23. Herrington C. S., McGee J. O. D. Diagnostic
Molecular Pathology. — Oxford.: IRL Press,
1992. — 536 p.
24. Старикович М. А., Кит Ю. Я., Хавунка М. Я.
и др. Цитотоксическая активность имму
ноглобулинов плазмы крови клинически
здоровых людей и больных рассеянным
склерозом // Цитокины и воспаление. —
2006. — Т. 5, №4. — С. 26–31.
25. Nevinsky G. A, Buneva V. N. Catalytic anti
body in healthy humans and patients with
autoimmune and viral diseases // J. Cell

БІОТЕХНОЛОГІЯ, Т. 1, №3, 2008
46
IMMUNOGLOBULINS OF COLOSTRUM
AS NOVEL MOLECULAR MARKERS
OF PRECLINICAL DIAGNOSTICS
OF AUTOIMMUNE DISORDERS
IN PARTURIENT WOMEN
Yu. Ya. Kit
1
, M. O. Starykovych
1
,
R. O. Bilyy
1
, N. R. Skorohyd
1
,
L. B.Yanyv
2
, R. S. Stoika
1
1
Institute of Cell Biology of National
Academy of Sciences of Ukraine, Lviv
2
Lviv Regional Perinatal Center
E/mail: kit@cellbiol.lviv.ua
Analysis of antigen specificity, catalytic and
cytotoxic activity of colostrum immunoglobu
lins was carried out in order to detect novel mole
cular markers of autoimmune disorders.
Immunoglobulins were isolated from parturient
women colostrums by precipitation with 50%
ammonium sulfate. It was shown that prepara
tions of immunoglobulins possessed significant
ly different cytotoxic activity towards Jurkat
leukemia Tcells, various hydrolyzing ability
towards plasmid DNA and histone H1, and also
differed by content of autoantibodies to double
stranded DNA and histones. We concluded that
functional properties of colostrums immuno
globulins depended on individual peculiarities of
parturient women humoral immunity. These
properties can be used for complex detection of
early autoimmune disorders linked with preg
nancy and delivery.
Key words: colostrum of healthy women, immunoglo
bulins, cytotoxic activity, catalytic activity, level of
autoAB.
ИММУНОГЛОБУЛИНЫ МОЛОЗИВА
КАК МОЛЕКУЛЯРНЫЕ МАРКЕРЫ
ДОКЛИНИЧЕСКОЙ ДИАГНОСТИКИ
АУТОИМУННЫХ НАРУШЕНИЙ
У РОЖЕНИЦ
Ю. Я. Кит
1
, М. О. Старикович
1
,
Р. О. Билый
1
, Н. Р. Скорохид
1
,
Л. Б. Янив
2
, Р. С. Стойка
1
1
Институт биологии клетки
НАН Украины, Львов
2
Львовский областной перинатальный центр
E/mail: kit@сellbiol.lviv.ua
С целью выявления новых молекулярных
маркеров аутоимунных нарушений у рожениц
проведен анализ антигенной специфичности,
каталитической и цитотоксической активнос
ти иммуноглобулинов, полученных из молози
ва осаждением 50%м сульфатом аммония.
Установлено, что препараты иммуноглобули
нов существенно различаются по цитотокси
ческой активности относительно лейкемичес
ких Тклеток линии Jurkat, способности
гидролизовать плазмидную ДНК и гистон Н1,
а также по содержанию аутоАТ к двухцепоч
ной ДНК и гистонам. Сделан вывод о том, что
функциональные свойства иммуноглобулинов
молозива зависят от индивидуальных особен
ностей состояния гуморального иммунитета
рожениц. Эти свойства могут быть использова
ны для комплексного определения ранних ау
тоиммунных нарушений у женщин, связан
ных с беременностью и родами.
Ключевые слова: молозиво здоровых рожениц, им
муноглобулины, цитотоксическая активность, ка
талитическая активность, уровень аутоАТ.

Експериментальні статті
47
нози, Dглюкуронової і піровиноградної
кислот (3:2:1:1:1:1) та структурою повторю
ваної ланки вуглеводного ланцюга. Різниця
між цими ЕПС полягає в тому, що ацильова
ний полісахарид містить жирні кислоти
(С
12
–С
18
) [1].
Глюкуронова й піровиноградна кислоти
є бічними замісниками повторюваної ланки
вуглеводного ланцюга, з’єднаними із залиш
ками рамнози і манози, відповідно. Залежно
від умов культивування продуцента у складі
етаполану міститься 25–35% мінеральних
компонентів (одновалентних катіонів). На
явність мінеральних компонентів у складі
етаполану зумовлена структуруванням цьо
го ЕПС у процесі його біосинтезу катіонами,
що містяться в середовищі культивування
продуцента [1]. Реологічні властивості роз
чинів етаполану, що визначають його прак
тичну значущість (здатність до емульгуван
ня, підвищення в’язкості за присутності
одно і двовалентних катіонів у разі зниження
pH, за низьких швидкостей зсуву, у системі
Cu
2+
гліцин), залежить від співвідношення
у його складі ацильованих і неацильованих
компонентів, а також від співвідношення
жирних кислот в ацильованому полісаха
риді [1].
Слід зазначити, що сукупність таких рео
логічних властивостей не характерна для жод
ного з відомих мікробних полісахаридів.
Мікробні екзополісахариди (ЕПС) вик
ликають великий інтерес у дослідників зав
дяки унікальним фізикохімічним власти
востям цих полімерів, що визначають їх
використання у нафтодобувній, харчовій,
хімічній промисловості, сільському госпо
дарстві, медицині.
Acinetobacter sp. В7005 є продуцентом
комплексного екзополісахариду, названого
нами етаполаном [1]. На основі етаполану
розроблено спосіб ізоляції припливу пласто
вих вод, який дає змогу в разі застосування
1 т етаполану видобути додатково близько
240 т нафти та знизити її обводнення з 84 до
15%. З використанням етаполану як голов
ної складової частини розроблено технології
виготовлення косметичних кремів під за
гальною назвою «Екол», технічного мийно
го засобу БІМС1. Встановлено можливість
і доцільність застосування етаполану під
час виробництва хліба та хлібопродуктів.
Завдяки спроможності етаполану адсорбу
вати та виводити з організму солі важких
металів його рекомендовано для профілак
тичного харчування [1].
Етаполан складається з нейтрального
(мінорний компонент) і двох кислих поліса
харидів, один з яких є ацильованим. Ацильо
ваний і неацильований полісахариди іден
тичні за молярним співвідношенням
Dглюкози, Dманози, D/галактози, L/рам
УДК 579.841:577.15
УДОСКОНАЛЕННЯ БІОТЕХНОЛОГІЇ
УДОСКОНАЛЕННЯ БІОТЕХНОЛОГІЇ
МІКРОБНОГО ЕКЗОПОЛІСАХАРИДУ
МІКРОБНОГО ЕКЗОПОЛІСАХАРИДУ
ЕТАПОЛАНУ НА ЕТАНОЛІ
ЕТАПОЛАНУ НА ЕТАНОЛІ
Визначено особливості енергетичного й конструктивного метаболізму С
2
субстратів у Acinetobacter sp.
В7005 — продуцента екзополісахариду етаполану, виявлено сайти метаболічного лімітування і розроблено
підходи до їх усунення.
Показано, що «вузьким» місцем метаболізму етанолу в Acinetobacter sp. В7005 є асиміляція ацетату: ре
акція, що каталізується ацетилКоАсинтетазою, є швидкістьлімітувальною. Встановлено умови культивуван
ня бактерій, що дають змогу усунути лімітування С
2
метаболізму і підвищити у три рази активність ацетил
КоАсинтетази.
За таких умов синтезується високоацильований етаполан зі ступенем ацилювання 3–15%. Середня молеку
лярна маса полісахариду становить 1,5 млн. і не змінюється у процесі виділення й очищення препарату. Підви
щений вміст жирних кислот і висока молекулярна маса етаполану зумовлюють поліпшення реологічних влас
тивостей його розчинів, що визначають практичну значущість цього полісахариду.
Ключові слова: екзополісахариди, біосинтез, метаболізм етанолу, регуляція С
2
метаболізму, фізико
хімічні властивості.
Т. П. Пирог Інститут мікробіології і вірусології НАН України, Київ
Ю. В. Корж E/mail: tapirog@usuft.kiev.ua

БІОТЕХНОЛОГІЯ, Т. 1, №3, 2008
48
NH
4
NO
3
— 0,3; MgSO
4
⋅ 7H
2
O — 0,4; CaCl
2
·
2H
2
O — 0,1; FeSO
4
·7H
2
O — 0,01; середовиK
ще 4: KH
2
PO
4
— 3,4; КOH — 0,9; КCl — 4,4;
NH
4
NO
3
— 0,6; MgSO
4
·7H
2
O — 0,4; CaCl
2
⋅
2H
2
O — 0,1; FeSO
4
·7H
2
O — 0,01; середовиK
ще 5: KH
2
PO
4
— 1,7; КOH — 0,45; NH
4
NO
3
—
0,3; MgSO
4
·7H
2
O — 0,4; CaCl
2
·2H
2
O — 0,1;
FeSO
4
·7H
2
O — 0,01; середовище 6: KH
2
PO
4
—
2,0; КOH — 0,55; КCl — 5,6; NH
4
NO
3
— 0,6;
MgSO
4
·7H
2
O — 0,4; CaCl
2
·2H
2
O — 0,1;
FeSO
4
·7H
2
O — 0,01. Середовища різнилися
між собою молярністю фосфатного буфера,
загальною кількістю солей, наявністю Nа
+
,
концентрацією одновалентних катіонів.
Так, молярність буфера становила (М): сере
довища 1 і 2 — 0,05; 3 і 4 — 0,025; 5 і 6 —
0,0125. У середовища додатково вносили
0,5% (об’ємна частка) дріжджового автолі
зату та 0,006−0,009 % пантотенату кальцію
(вітамін В
5
). Штами В7005 і В7005 (1НГ)
є ауксотрофами за цим вітаміном [2,3],
який є попередником коензиму А. Джерелом
вуглецю та енергії слугував етанол у концент
рації 1% (об’ємна частка).
Як посівний матеріал використовували
культуру з експоненційної фази росту (16−
24 год), вирощену на мінеральних середови
щах 1÷6 із різними джерелами вуглецю.
Джерелом вуглецю та енергії у процесі одер
жання посівного матеріалу і біосинтезу ЕПС
були: а) 0,5 % етанолу (об’ємна частка); б)
1% етанолу (об’ємна частка) за наявності
або відсутності ацетату калію (0,1% або
0,01%); в) 1,6% ацетату калію. Кількість по
сівного матеріалу становила 5% від об’єму
середовища.
Ензиматичні аналізи. Визначення ак
тивності ферментів здійснювали в безклі
тинних екстрактах. Одержання безклітин
них екстрактів проводили як описано
в роботі [4].
Ключові ферменти С
2
/метаболізму та
гліоксилатного циклу. Активність алко
гольдегідрогенази (КФ 1.1.1.1), ацетальде
гіддегідрогенази (КФ 1.2.1.3 і КФ 1.2.1.4),
ацетилКоАсинтетази (КФ 6.2.1.1), ізоцит
ратліази (КФ 4.1.3.1) та малатсинтази (КФ
4.1.3.2) визначали як описано в роботі [4].
Ферменти циклу трикарбонових кис/
лот. Активність цитратсинтази (КФ 4.1.3.7)
аналізували за зниженням концентрації
ацетилфосфату у присутності коензиму А та
оксалоацетату, як описано в роботі [5]. Ак
тивність аконітатгідратази (КФ 4.2.1.3) [6]
встановлювали в присутності цисаконітату
за відновленням НАДФ
+
при 340 нм. Актив
ність ізоцитратдегідрогенази (КФ 1.1.1.41)
[7], малатдегідрогенази (КФ 1.1.1.37) [8]
Окрім того, для синтезу етаполану може бу
ти використаний широкий набір вуглецевих
субстратів (у тому числі й невуглеводних),
тимчасом як інші відомі полісахариди одер
жують тільки на основі вуглеводної сировини.
Здатність до синтезу ЕПС виявлено у ба
гатьох мікроорганізмів, проте рівень синте
зу цих полімерів коливається в широких ме
жах як для різних продуцентів ЕПС, так
і для одного продуцента в різних умовах його
культивування. Створення високоефектив
них технологій одержання практично важ
ливих метаболітів базується на цілеспрямо
ваній регуляції процесу біосинтезу, що у свою
чергу потребує глибоких знань фізіології,
біохімії та генетики продуцентів.
Відомо, що в послідовності метаболічних
реакцій, пов’язаних з утворенням ключо
вих інтермедіатів, існують лімітувальні ре
акції, швидкість яких нижча від інших або
які супроводжуються великою витратою
енергії чи втратою вуглецю субстрату. Вияв
лення таких сайтів метаболічного ліміту
вання та розроблення на основі знань прин
ципів регуляції метаболізму дасть змогу
реалізувати біотехнологічні процеси з най
вищою ефективністю.
Мета роботи полягала у визначенні шля
хів регуляції різних ланок метаболізму
у процесі вирощування штамів Acinetobac/
ter sp. В7005 і В7005 (1НГ) на С
2
субстра
тах для вдосконалення процесу біосинтезу
ЕПС етаполану.
Матеріали і методи
Об’єкти досліджень. О’єктом дослі
джень був штам Acinetobacter sp. — проду
цент комплексного екзополісахаридного
препарату етаполану [2], депонований у Де
позитарії Інституту мікробіології і вірусо
логії НАН України під номером В7005, а та
кож мутантний штам Acinetobacter sp.
В7005 (1НГ), що не утворює ЕПС, який бу
ло одержано з вихідного за допомогою нітро
зогуанідинового мутагенезу [3].
Культивування Acinetobacter sp. ВF7005.
Культивування бактерій здійснювали в кол
бах на качалці (220 об/хв) при 30 °С, рН
6,8−7,0, упродовж 16−120 год на рідких мі
неральних середовищах такого складу (г/л):
середовище 1: KH
2
PO
4
— 6,8; NaOH — 0,9;
NaCl — 1,05; NH
4
NO
3
— 0,6; MgSO
4
·7H
2
O —
0,4; CaCl
2
·2H
2
O — 0,1; FeSO
4
·7H
2
O — 0,01;
середовище 2: KH
2
PO
4
— 6,8; КOH — 1,8;
КCl — 1,4; NH
4
NO
3
— 0,6; MgSO
4
·7H
2
O —
0,4; CaCl
2
·2H
2
O — 0,1; FeSO
4
⋅7H
2
O — 0,01;
середовище 3: KH
2
PO
4
— 3,4; КOH — 0,9;

Експериментальні статті
49
лот — ваговим методом після дезацилюван
ня розчинів ЕПС [16]. Встановлення вмісту
мінеральних компонентів у складі етаполану
здійснювали, обробляючи його катіонітом
КУ28 (Н
+
). Вміст нейтральних моносаха
ридів визначали за допомогою вуглеводного
аналізатора Biotronik LC2000 [1], а молеку
лярномасовий склад ЕПС — методом
аналітичного градієнтного центрифугуван
ня в розчині хлористого натрію [20]. Як
стандарти молекулярних мас використову
вали декстрани фірми Fluka із молекуляр
ною масою 13,5; 20; 40; 70; 110; 500 тис.
і 2 млн. Вміст вуглеводнів в отриманих
після центрифугування фракціях (об’єм
1 мл) встановлювали за реакцією з фенолом
і сірчаною кислотою.
Вміст компонентів певної молекулярної
маси обчислювали, визначаючи кількість
вуглеводів у відповідних фракціях, і вира
жали в процентах до вихідної (загальної)
кількості вуглеводів. Знаючи процентний
вміст у складі ЕПС компонентів різної моле
кулярної маси, розраховували середню мо
лекулярну масу.
Властивості розчинів етаполану оціню
вали за відносною зміною їхньої в’язкості у
присутності 0,1 М КCl, рН 4−4,5 (за умови
переведення ЕПС в Н
+
форму), у системі
Cu
2+
гліцин. Відносну зміну в’язкості визна
чали за формулою:
де
η
1
— в’язкість розчину ЕПС у досліджува
них умовах;
η
2
— в’язкість розчину ЕПС
у дистильованій воді.
Результати та обговорення
Вивчення особливостей С
2
метаболізму
під час росту штамів Acinetobacter sp. В7005
та В7005 (1НГ) на етанолі показало, що
окиснення етанолу до ацетальдегіду каталі
зується НАД
+
залежною алкогольдегідроге
назою. Акцепторами електронів в ацетальде
гіддегідрогеназній реакції є НАД
+
і НАДФ
+
.
З’ясовано, що в Acinetobacter sp. ацетат
залучається до метаболізму за участю аце
тилКоАсинтетази; анаплеротичною послідов
ністю реакцій, що поповнюють пул С
4
дикарбо
нових кислот, є гліоксилатний цикл [21].
Подальші дослідження було спрямовано
на визначення активності ферментів циклу
трикарбонових кислот (ЦТК) та деяких
біосинтетичних шляхів [22]. У безклітинно
му екстракті Acinetobacter sp. В7005 і В7005
(1НГ) виявлено високу активність усіх
визначали за відновленням НАД
+
, а ізоцит
ратдегідрогенази (КФ 1.1.1.42) [5], малат
дегідрогенази (КФ 1.1.1.82) [9] — за віднов
ленням НАДФ
+
при 340 нм у присутності
ізоцитрату чи малату, відповідно. Актив
ність 2оксоглутаратдегідрогенази (КФ 1.2.4.2)
[10] встановлювали за відновленням НАД
+
при 340 нм у присутності 2оксоглутарату та
коензиму А, сукцинатдегідрогенази (КФ
1.3.99.1) [6] − за відновленням дихлорфе
ноліндофенолу в присутності феназинмета
сульфату при 600 нм, фумарази (КФ
4.2.1.2) — за утворенням фумарату з малату
при 250 нм [5].
Активність ключових ферментів глю/
конеогенезу та деяких біосинтетичних
шляхів. Активність фосфоенолпіруватсин
тетази (КФ 2.7.9.2) [11] аналізували колори
метрично за зниженням концентрації пірувату
в реакційній суміші (реакція з динітрофе
нілгідразином) при 445 нм [11], фосфо
енолпіруваткарбоксикінази (КФ 4.1.1.49)
[12], оксалоацетатдекарбоксилази (КФ
4.1.1.3) [6] — за утворенням фосфоенолпіру
вату (ФЕП) та пірувату при окисненні
НАДН, а глутаматдегідрогенази (КФ 1.4.1.4)
[13] — за утворенням глутамату при окис
ненні НАДФН і 340 нм. Активність глута
матдегідрогенази (КФ 1.4.1.2) [14] встанов
лювали за відновленням НАД
+
при 340 нм
у присутності 2оксоглутарату.
Активність ферментів у безклітинних
екстрактах визначали при температурі 28−
30
0
С, що є оптимальною для росту даних
бактерій, та виражали у нмоль
·
хв
–1
·
мг
–1
білка. Вміст білка в безклітинних екстрак
тах установлювали за Bradford [15].
Визначення швидкості окиснення суб
стратів (етанолу, ацетальдегіду й ацетату)
інтактними клітинами Acinetobacter sp. В7005
та В7005 (1НГ) проводили як описано в ро
боті [4].
Встановлення складу і фізикоFхімічF
них властивостей етаполану. Комплексний
полісахаридний препарат етаполан виділяли
з культуральної рідини осадженням ізопро
панолом після попереднього відокремлення
клітин продуцента та діалізу [1]. Розділення
етаполану на ацильований і неацильований
компоненти здійснювали за розробленим
раніше методом [16]. Для дезацилювання
проводили оброблення ЕПС NаОН у присут
ності NаВН
4
. Вміст вуглеводів в ЕПС визна
чали колориметричним методом за реакцією
з фенолом і сірчаною кислотою [17], пірови
ноградної кислоти — за реакцією з 2,4диніт
рофенілгідразином [18], уронових кислот —
за реакцією з карбазолом [19], жирних кис
−
⋅
10
0
100%,
ηη
η

БІОТЕХНОЛОГІЯ, Т. 1, №3, 2008
50
Аналіз активності ключових ферментів
метаболізму етанолу у процесі культивуван
ня Acinetobacter sp. В7005 на середовищах
1 і 2 показав, що активність ацетилКоА
синтетази в безклітинному екстракті була
в 2,7−5 разів нижчою, ніж активність алко
голь і ацетальдегіддегідрогеназ (табл. 2).
Досліджуючи швидкість окиснення С
2
суб
стратів інтактними клітинами Acinetobacter
sp. В7005 (1НГ), вирощеними на середови
щах 1 та 2, встановили, що після голодування
клітин упродовж 20 год швидкість дихання
за присутності етанолу й ацетальдегіду не
змінювалась і становила 152,6−157,8 та
153,5−159,4 нмоль О
2
·хв
–1
·мг
–1
клітин відпо
відно, а за присутності ацетату знижувалась
у 2 і 4 рази на середовищі 2 і середовищі 1,
відповідно, порівняно зі швидкістю окис
нення ацетату клітинами, що не голодували.
Отже, під час росту на етанолі в клітинах
Acinetobacter sp. В7005 і В7005 (1НГ) аце
тат утворюється з вищою швидкістю, ніж
залучається до метаболізму. Тому наші нас
тупні дослідження були спрямовані на по
шук чинників, що забезпечують однакову
швидкість утворення і подальшого мета
болізму ацетату в клітинах бактерій у про
цесі культивування на етанолі.
У результаті ензиматичних і полярогра
фічних досліджень встановлено, що інгібі
ферментів цього циклу (табл. 1). На нашу
думку, наявність обох ключових ферментів
гліоксилатного циклу, а також висока ак
тивність ізоцитратдегідрогенази, глутамат
дегідрогенази і низька активність 2оксо
глутаратдегідрогенази є підтвердженням
того, що ЦТК в Acinetobacter sp. В7005
і В7005 (1НГ) під час росту на етанолі вико
нує переважно біосинтетичну роль.
У процесі асиміляції мікроорганізмами
дво або тривуглецевих субстратів або суб
стратів, катаболізм яких здійснюється через
ацетилКоА чи інтермедіати ЦТК, виникає
необхідність синтезу молекул вуглеводів. Ці
перетворення відбуваються шляхом глюко
неогенезу. Ензиматичні дослідження пока
зали, що під час росту на етанолі в Acineto/
bacter sp. В7005 і В7005 (1НГ) піруват
утворюється з оксалоацетату в оксалоаце
татдекарбоксилазній реакції, а в утворенні
фосфоенолпірувату беруть участь обидва
ключові ферменти глюконеогенезу — ФЕП
карбоксикіназа і ФЕПсинтаза (табл. 1).
Таблиця 1. Активність ферментів
циклу трикарбонових кислот
та деяких біосинтетичних шляхів у
Acinetobacter sp. ВK7005 та ВK7005 (1НГ)
Фермент
Активність,
нмоль
·
хв
–1
·
мг
–1
білка
В7005
В7005
(1НГ)
Цитратсинтаза 421,3±25,1 405,6±21,6
Аконітаза 340,8±18,0 349,0±19,4
НАД
+
залежна ізоцит
ратдегідрогеназа
0 0
НАДФ
+
залежна ізоцит
ратдегідрогеназа
729,7±38,5 717,8±33,8
2Оксоглутаратдегідро
геназа
96,2±4,8 93,4±5,3
Сукцинатдегідрогеназа 183,4±13,9 197,5±15,8
Фумараза 192,1±9,6 186,8±9,9
НАД
+
залежна малат
дегідрогеназа
654,2±32,7 643,1±32,1
НАДФ
+
залежна малат
дегідрогеназа
81,9±5,1 79,8±4,3
НАД
+
залежна глута
матдегідрогеназа
653,9±33,5 642,6±31,8
НАДФ
+
залежна глута
матдегідрогеназа
247,3±15,6 257,2±16,3
Оксалоацетатдекар
боксилаза
457,3±28,6 446,6±23,3
Фосфоенолпіруваткар
боксикіназа
58,5±2,9 48,7±3,5
Фосфоенолпіруватсин
тетаза
584,4±32,9 487,0±35,4
Таблиця 2. Активність ключових ферментів
метаболізму етанолу в процесі культивування
Acinetobacter sp. ВK7005
Примітки: 1. Культивування бактерій здійсню
вали на середовищі 1 з 0,0006% В
5
.
2. Для визначення активності ацетилКоАсин
тетази, ізоцитратліази і малатсинтази бактерії
вирощували на середовищі 2 з 0,0009 % В
5
. У дуж
ках наведено дані культивування штаму на сере
довищі 1 з 0,0006 % В
5
.
Ферменти
Активність
(нмоль
·
хв
–1
·
мг
–1
білка)
під час культивування
бактерій
24 год 48 год
НАД
+
залежна алко
гольдегідрогеназа
365,7±19,6 289,5±17,5
НАД
+
залежна ацет
альдегіддегідрогеназа
119,5±7,6 93,7±6,5
НАДФ
+
залежна ацет
альдегіддегідрогеназа
253,7±15,7 197,3±11,3
АцетилКоАсинте
таза
135,7±8,7
(74,5±5,2)
134,1±8,7
Ізоцитратліаза
130,0±7,8
(50,5±2,9)
144,9±9,4
(7,4±0,4)
Малатсинтаза 58,2±3,7 67,4±3,7
