Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

длительного голодания, и в то же время отмечается интенсивный распад
белков в состоянии азотистого равновесия, причем распад белков в какой-
либо ткани часто сопровождается усиленным биосинтезом белков в других
тканях. Индуцированные активной или пассивной иммунизацией белки
антител – γ-глобулины – также подвергаются постоянному распаду и син-
тезу. Полупериод распада антител и ряда других белков крови человека
составляет примерно 2 нед. Для белков слизистой оболочки кишечника этот
период составляет несколько дней, для ряда гормонов исчисляется часами
и даже минутами (инсулин).
Высокая скорость обновления белков, доказанная при помощи меченых
атомов, свидетельствует о том, что в организме происходит постоянное
смешивание эндогенных белковых молекул и продуктов их гидролиза –
аминокислот с молекулами белков и их производных, синтезированных из
аминокислот белков пищи. Эта смесь эндогенного и экзогенного материала,
которая может в принципе служить источником анаболических и ка-
таболических реакций азотистого обмена, существует в качестве резервного
материала, называемого метаболическим пулом. С помощью изо-
топных методов установлено, что примерно
2
/
3
общего пула аминокис-
лот приходится на эндогенные источники и только
1
/
3
имеет своим
источником белки пищи. Эти данные указывают прежде всего на исключи-
тельную важность эндогенного источника аминокислот и, кроме того,
свидетельствуют о высокой скорости обновления белков тела.
Необходимо подчеркнуть, что белковый обмен тесно интегрирован
также с обменом углеводов, липидов и нуклеиновых кислот через амино-
кислоты или α-кетокислоты (α-кетоглутарат, оксалоацетат и пируват). Так,
аспарагиновая кислота или аланин путем трансаминирования обратимо
превращаются соответственно в оксалоацетат и пируват, которые не-
посредственно включаются в углеводный обмен. Эти данные, как и ре-
зультаты опытов с введением животным меченых аминокислот и α-кето-
кислот, свидетельствуют о том, что в организме млекопитающих не
существует вопреки классической теории М. Рубнера и К. Фойта обо-
собленного и независимого эндогенного и экзогенного обмена вообще
и белкового обмена в частности.
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ СОСТОЯНИЕ
БЕЛКОВОГО ОБМЕНА
Направление и интенсивность обмена белков в первую очередь опре-
деляются физиологическим состоянием организма и несомненно регули-
руются, как и все другие виды обмена, нейрогормональными факторами.
Более интенсивно обмен белков протекает в детском возрасте, при активной
мышечной работе, беременности и лактации, т.е. в случаях, когда резко
повышаются потребности в белках. Существенное влияние на белковый
обмен оказывает характер питания и, в частности, количественный и
качественный белковый состав пищи. При недостаточном поступлении
белков с пищей происходит распад собственных белков ряда тканей (печени,
плазмы крови, слизистой оболочки кишечника и др.) с образованием
свободных аминокислот, обеспечивающих синтез абсолютно необходимых
цитоплазматических белков, ферментов, гормонов и других биологически
активных соединений. Таким образом, «в жертву» приносятся некоторые
«строительные» белки тканей для обеспечения жизнедеятельности целост-
ного организма. Введение с пищей повышенных количеств белка, напротив,
не оказывает заметного влияния на состояние белкового обмена, поскольку
411
избыток белка не откладывается про запас, а в виде конечных продуктов
азотистого обмена выводится с мочой. Более существенное значение имеет,
однако, качественный белковый состав пищи, так как отсутствие или
недостаток хотя бы одной какой-либо незаменимой аминокислоты может
служить лимитирующим фактором биосинтеза всех белков в организме.
Синтез белка подчиняется закону «все или ничего» и осуществляется при
условии наличия в клетке полного набора всех 20 аминокислот. Даже при
поступлении всех аминокислот с пищей организм может испытывать
состояние белковой недостаточности, если всасывание какой-либо одной
аминокислоты в кишечнике замедлено или если она разрушается в большей
степени, чем в норме, под действием кишечной микрофлоры. В этих случаях
будет происходить ограниченный синтез белка или организм будет ком-
пенсировать недостаток аминокислоты для биосинтеза белка за счет рас-
пада собственных белков. Степень усвоения белков и аминокислот пищи
зависит также от количественного и качественного состава углеводов
и липидов, которые резко сокращают энергетические потребности ор-
ганизма за счет белков. Экспериментальный и клинический материал
свидетельствует, что диета с недостаточным содержанием жиров и низко-
калорийная пища способствуют повышению экскреции аминокислот и
продуктов их распада с мочой.
Имеются экспериментальные доказательства прямой и опосредованной
связи белкового обмена с обеспеченностью организма витаминами, в
частности В
1
, В
2
, В
6
, РР и др. Обмен белков регулируется, кроме того,
деятельностью желез внутренней секреции. Гормоны определяют в из-
вестной мере направление (в сторону синтеза или распада) и интенсивность
белкового обмена. Например, после введения АКТГ и гормонов щи-
товидной железы наблюдается интенсивный распад тканевых белков. Дру-
гие гормоны, в частности СТГ, андрогены и эстрогены, напротив, сти-
мулируют анаболические реакции и способствуют синтезу белка. Введение
некоторых гормонов коркового вещества надпочечников вызывает диспро-
теинемию и приводит к отрицательному азотистому балансу, что не-
которые авторы связывают со стимулированием глюконеогенеза из уг-
леродных скелетов аминокислот (после дезаминирования последних – см.
далее).
Таким образом, состояние белкового обмена определяется множеством
факторов, как экзогенных (окружающая среда, характер питания и др.), так
и эндогенных (физиологическое состояние организма, включающее нервно-
гормональный статус, ферментная оснащенность и др.). Любые отклонения
от нормального физиологического состояния организма отражаются на
азотистом обмене. Знание закономерностей изменений обмена белков при
данном конкретном патологическом процессе – необходимая предпосылка
для правильного выбора тактики терапевтических мероприятий по устра-
нению нарушенного процесса обмена.
НОРМЫ БЕЛКА В ПИТАНИИ
Изучение проблемы нормы белка в питании человека имеет, кроме ака-
демического интереса, большое социальное значение. Принятые в нашей
стране нормы белка для взрослого человека и для детей разного возраста
основаны на результатах многочисленных научных исследований отечест-
венных ученых, учитывают разные климатические условия, условия труда,
профессию, возраст и другие факторы. Эти нормы выводятся из оп-
тимального содержания белка в пищевом рационе. Так, взрослый человек,
412
занимающийся умственным трудом или подвергающийся средней физи-
ческой нагрузке (полностью механизированный труд), должен получать
100–120 г белка в сутки при трате общего количества энергии 12000 кДж.
При изменении условий труда (недостаточно механизированный труд)
и больших тратах энергии норма белка увеличивается на 10 г на каждые
2100 кДж. Рабочие, выполняющие тяжелую физическую работу, должны
получать 130–150 г белка в сутки.
Потребности в белках детей определяются в первую очередь возрастом
и массой тела. Дети даже раннего детского возраста нуждаются в 55–72 г
белка в сутки. С возрастом (от 12 до 15 лет) эта норма увеличивается до
суточной нормы взрослого человека. Суточные потребности в белке резко
возрастают при беременности и лактации, а также при некоторых па-
тологических состояниях, когда организм теряет белок с мочой или асцит-
ной жидкостью, экссудатами при нефритах, тяжелых инфекционных за-
болеваниях, ожогах, травмах и т.д.
БИОЛОГИЧЕСКАЯ ЦЕННОСТЬ БЕЛКОВ
Состояние белкового обмена целостного организма зависит не только от
количества принимаемого с пищей белка, но и от качественного состава его.
В опытах на животных было показано, что получение одинакового ко-
личества разных пищевых белков сопровождается в ряде случаев развитием
отрицательного азотистого баланса. Так, скармливание равного количества
казеина и желатина крысам приводило к положительному азотистому
балансу в первом случае и к отрицательному – во втором *. Имел значение
различный аминокислотный состав белков, что послужило основанием для
предположения о существовании в природе якобы «неполноценных» белков.
Оказалось, что из 20 аминокислот в желатине почти отсутствуют (или
содержатся в малых количествах) валин, тирозин, метионин и цистеин;
кроме того, желатин характеризуется другим, отличным от казеина про-
центным содержанием отдельных аминокислот. Этим можно объяснить тот
факт, что замена в питании крыс казеина на желатин приводит к развитию
отрицательного азотистого баланса. Приведенные данные свидетельствуют
о том, что различные белки обладают неодинаковой пищевой ценностью.
Поэтому для удовлетворения пластических потребностей организма тре-
буются достаточные количества разных белков пищи. По-видимому, спра-
ведливо положение, что, чем ближе аминокислотный состав принимаемого
пищевого белка к аминокислотному составу белков тела, тем выше его
биологическая ценность. Следует, однако, отметить, что степень усвоения
пищевого белка зависит также от эффективности его распада под влиянием
ферментов желудочно-кишечного тракта. Ряд белковых веществ (например,
белки шерсти, волос, перьев и др.), несмотря на их близкий амино-
кислотный состав к белкам тела человека, почти не используются в качестве
пищевого белка, поскольку они не гидролизуются протеиназами кишечника
человека и большинства животных.
С понятием биологической ценности белков тесно связан вопрос об
эссенциальных (незаменимых) аминокислотах. Живые организмы сущест-
венно различаются в зависимости от их способности синтезировать амино-
* Вопросы азотистого равновесия, положительного и отрицательного азотистого баланса
подробно рассматриваются в курсе физиологии.
413

кислоты или другие азотсодержащие соединения, которые они могут
использовать для биосинтеза аминокислот. Высшие растения, например,
могут синтезировать все необходимые для белкового синтеза амино-
кислоты, причем могут использовать для этого аммиак или нитраты
в качестве источника азота. Микроорганизмы обладают различной способ-
ностью синтезировать аминокислоты. В частности, если Е. coli синтезирует
все аминокислоты, используя нитриты и нитраты или аммиак, то мо-
лочно-кислые бактерии не обладают этой способностью и получают
аминокислоты в готовом виде из молока. Высшие позвоночные животные
не синтезируют все необходимые аминокислоты. В организме человека
и белых крыс синтезируются только 10 из 20 необходимых аминокислот – так
называемые заменимые аминокислоты. Они могут быть синтези-
рованы из продуктов обмена углеводов и липидов. Остальные 10 амино-
кислот не синтезируются в организме, поэтому они были названы жизненно
необходимыми, эссенциальными, или незаменимыми аминокисло-
тами (табл. 12.1).
Таблица 12.1. Заменимые и незаменимые аминокислоты
Заменимые
Аланин
Аспарагин
Аспарагиновая
кислота
Глицин
Глутамин
Незаменимые
Аргинин
1
Валин
Гистидин
1
Изолейцин
Лейцин
Заменимые
Глутаминовая
кислота
Пролин
Серин
Тирозин
Цистеин (цистин)
Незаменимые
Лизин
Метионин
Треонин
Триптофан
Фенилаланин
1
Частично заменимые аминокислоты.
Незаменимость аминокислот для роста и развития организма животных
и человека объясняется отсутствием способности клеток синтезировать
углеродные скелеты незаменимых аминокислот, поскольку процесс ами-
нирования соответствующих кетопроизводных осуществляется сравнитель-
но легко посредством реакций трансаминирования (см. далее). Следо-
вательно, для обеспечения нормальной жизнедеятельности человека и
животных все эти 10 аминокислот должны поступать с пищей.
Следует отметить, что для взрослого человека аргинин и гистидин
оказались частично заменимыми. Г. Роуз наблюдал людей, получавших
искусственную пищу, в которой белок был полностью заменен смесью 20
аминокислот. Он установил, что для сохранения нормальной массы тела
и работоспособности имеют значение не только определенное количество
каждой аминокислоты и соотношение незаменимых аминокислот в по-
добной диете, но и содержание в последней общего азота (табл. 12.2).
Исключение какой-либо незаменимой аминокислоты из пищевой смеси
сопровождается развитием отрицательного азотистого баланса, истоще-
нием, остановкой роста, нарушениями функции нервной системы и др.
В опытах на крысах были установлены следующие величины незаменимых
аминокислот, необходимых для оптимального роста, относительно три-
птофана, принятого за единицу: лизина 5; лейцина 4; валина 3,5; фенил-
аланина 3,5; метионина 3; изолейцина 2,5; треонина 2,5; гистидина 2;
414
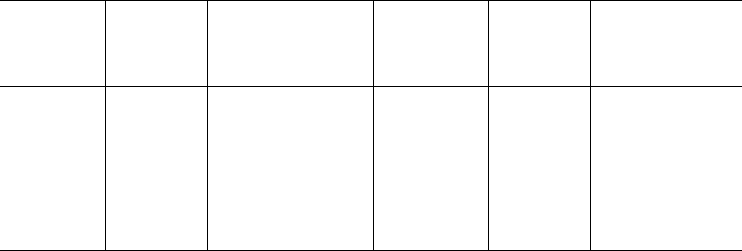
Таблица 12.2. Минимальная суточная потребность организма человека в неза-
менимых аминокислотах (рекомендации ФАО и ВОЗ)
Амино-
кислота
Арг
Гис
Иле
Лей
Лиз
Потреб-
ность инди-
видуума,
г/сут
1,8
0,9
0,7
1,1
0,8
Потребность в
расчете на массу
тела, мг/кг
Взрослый орга-
низм не нужда-
ется
10
14
12
Амино-
кислота
Мет
(Цис)
1
Фен (Тир)
2
Тре
Трп
Вал
Потреб-
ность инди-
видуума,
г/сут
1,1
1,1
0,5
0,25
0,80
Потребность в
расчете на массу
тела, мг/кг
13
14
7
3,5
10
1
Цистеин снижает потребность в метионине на 80%.
2
Тирозин снижает потребность в фенилаланине на 70%.
аргинина 1. Имеются доказательства, что примерно такое же соотношение
незаменимых аминокислот требуется для человека.
Последствия недостаточного содержания какой-либо незаменимой
аминокислоты в пище более подробно изучены на животных. Отсутствие
или недостаток, например, валина и лизина приводит к остановке роста
и развитию тяжелой клинической картины, напоминающей авитаминоз
у животных.
Следует особо подчеркнуть, что недостаток в пище одной незаменимой
аминокислоты ведет к неполному усвоению других аминокислот. Вместе
с тем в опытах на животных было показано, что потребности в не-
заменимом фенилаланине могут быть частично компенсированы заме-
нимой аминокислотой тирозином, потребности в метионине – гомоцисте-
ином с добавлением необходимого количества доноров метильных групп.
Глутаминовая кислота снижает потребности в аргинине. Необходимо
учитывать и видовые различия при определении незаменимости отдельных
аминокислот. Для цыплят, например, глицин оказался незаменимым фак-
тором роста.
Для оценки биологической ценности пищевого белка важное значение
имеет знание его аминокислотного состава. Так, скармливание крысам
казеина (белок молока) и выделенного из кукурузы белка зеина, который не
содержит лизина и практически триптофана, показало, что при получении
с пищей казеина рост животных не нарушался. Замена казеина зеином
приводила к постепенному отставанию в росте и снижению массы тела
животных. Добавление к зеину только триптофана предотвращало сни-
жение массы тела, но не увеличивало рост; при добавлении к рациону еще
и лизина масса тела прогрессивно нарастала.
Таким образом, скармливание выделенного из кукурузного зерна белка
зеина, не содержащего двух незаменимых аминокислот, приводит к ос-
тановке роста, уменьшению массы тела животных и развитию отрица-
тельного азотистого баланса.
Человек и животные питаются не искусственно выделенными, а на-
туральными белками, входящими в состав смешанной пищи, в которой
обычно содержится весь набор незаменимых аминокислот. Так, цельное
кукурузное зерно содержит 2,5% лизина, 0,7% триптофана, в то время как
415

зеин не содержит лизина вообще, а триптофана в нем всего 0,1%. Этот
пример лишний раз свидетельствует о том, что в природе неполноценных
белков почти не существует и что следует, очевидно, лишь различать
биологически более ценные и менее ценные (в питательном отношении)
белки (табл. 12.3).
Таблица 12.3. Содержание незаменимых аминокислот в белках различного проис-
хождения
Аминокислота
Apг
Гис
Иле
Лей
Лиз
Мет
Фен
Тре
Трп
Вал
Содержание аминокислоты в продуктах, в процентах от сухой массы
пшеничная
мука
4,2
2,2
4,2
7,0
1,9
1,5
5,5
2,7
0,8
4,1
соевая
мука
4,7
2,4
5,4
7,7
6,5
1,4
5,1
4,0
1,5
5,0
рыбная
мука
5,0
2,3
4,6
7,8
7,5
2,6
4,0
4,2
1,2
5,2
говядина
7,7
3,3
6,0
8,0
10,0
3,2
5,0
5,0
1,4
5,5
коровье
молоко
4,1
2,6
7,8
11,0
8,7
0,8
5,5
4,7
1,5
7,1
кормовые
дрожжи
8,0
1,7
5,5
7,6
6,8
1,2
3,9
5,4
1,6
6,0
Биологическая ценность пищевого белка целиком зависит от степени его
усвоения организмом, что в свою очередь определяется соответствием
между аминокислотным составом потребляемого белка и аминокислотным
составом белков организма. Такой пищевой белок лучше используется
организмом для синтеза белков тканей. Для человека, например, белки
мяса, молока, яиц биологически более ценны, поскольку их аминокислот-
ный состав ближе к аминокислотному составу органов и тканей человека.
Однако это не исключает приема растительных белков, в которых со-
держится необходимый набор аминокислот, но в другом соотношении.
Поэтому для обеспечения биосинтеза необходимого количества эндогенных
белков человеку потребуется значительно больше растительных белков, чем
животных.
Таким образом, для нормального роста и гармоничного развития
организма человека исключительно большое значение имеют составление
и подбор пищевых продуктов, содержащих оптимальный аминокислотный
состав и обеспечивающих физиологически полноценное питание для разных
групп населения с учетом не только возраста и пола, но и различных
климатических условий, характера труда, сезона года и т.д.
РЕЗЕРВНЫЕ БЕЛКИ
Под термином «резервные белки» понимают не особые отложения белков,
а легкомобилизуемые при необходимости тканевые белки, которые после
гидролиза под действием специфических протеиназ служат поставщиками
аминокислот, необходимых для синтеза ферментов, гормонов и др. Опыты
на животных показали, что при голодании наблюдается неравномерное
изменение массы отдельных органов и тканей; в значительно большей
416
степени снижается масса печени. Многочисленные наблюдения больных
в клиниках также свидетельствуют, что при голодании и тяжелых ин-
фекционных заболеваниях, когда наблюдается интенсивный распад ор-
ганов, в первую очередь снижается масса печени и мышц и существенно не
изменяется масса мозга и сердца. Организм за счет распада белков печени
и мышц обеспечивает нормальную деятельность жизненно важных органов.
На основании этих данных принято считать, что белки плазмы крови,
печени и мышц могут служить в качестве «резервных», хотя эти резервы по
своему существу резко отличаются от резервов углеводов (отложение
гликогена в печени и мышцах) и липидов (отложение триацилглицеролов
в жировых депо).
Следует, однако, подчеркнуть, что существование в организме ме-
ханизма срочной мобилизации белковых ресурсов в экстремальных ус-
ловиях (голодание, тяжелая интоксикация, потеря крови и др.), несомненно,
имеет важное физиологическое значение.
ПАРЕНТЕРАЛЬНОЕ БЕЛКОВОЕ ПИТАНИЕ
Важной для клинической практики является проблема парентерального
белкового питания. Как известно, белки пищи могут быть использованы
организмом человека только после предварительного переваривания и
расщепления их в пищеварительном тракте до свободных аминокислот.
Введение белков парентерально, т.е. минуя кишечный тракт, приводит
к развитию сенсибилизации (повышенная чувствительность организма к
чужеродному белку), а повторное введение белков может вызвать ана-
филаксию – шоковое состояние. Между тем такой метод введения белка
иногда вынуждены использовать, в частности, в хирургической практике
при непроходимости пищевода в результате ожогов и отравлений, при
тяжелых раковых поражениях пищевода и желудка, после операций на
желудке и кишечнике и др. Для предотвращения тяжелых осложнений,
возникающих после парентерального введения белковых растворов, в
настоящее время для белкового питания используют гидролизаты белков
(смесь аминокислот). Введение аминокислотной смеси не вызывает ал-
лергических реакций, поскольку свободные аминокислоты не обладают
в отличие от белков ни видовой, ни тканевой специфичностью. Длительные
наблюдения больных в клинических условиях свидетельствуют, что потреб-
ности организма в белках могут быть полностью компенсированы вве-
дением смеси аминокислот. Нельзя не отметить, однако, ряд побочных
отрицательных реакций организма в ответ на введение гидролизатов
белков, в частности возможность нарушения нормальной психической
деятельности.
ПЕРЕВАРИВАНИЕ БЕЛКОВ
Главными источниками белков для человека являются пищевые продукты
животного и растительного происхождения. В табл. 12.4 представлены
средние данные о содержании белка в основных пищевых продуктах.
Главным образом животные (мясо, рыба, сыр) и только некоторые расти-
тельные (горох, соя) продукты богаты белками, в то время как наиболее
распространенные растительные пищевые продукты содержат небольшие
количества его.
417
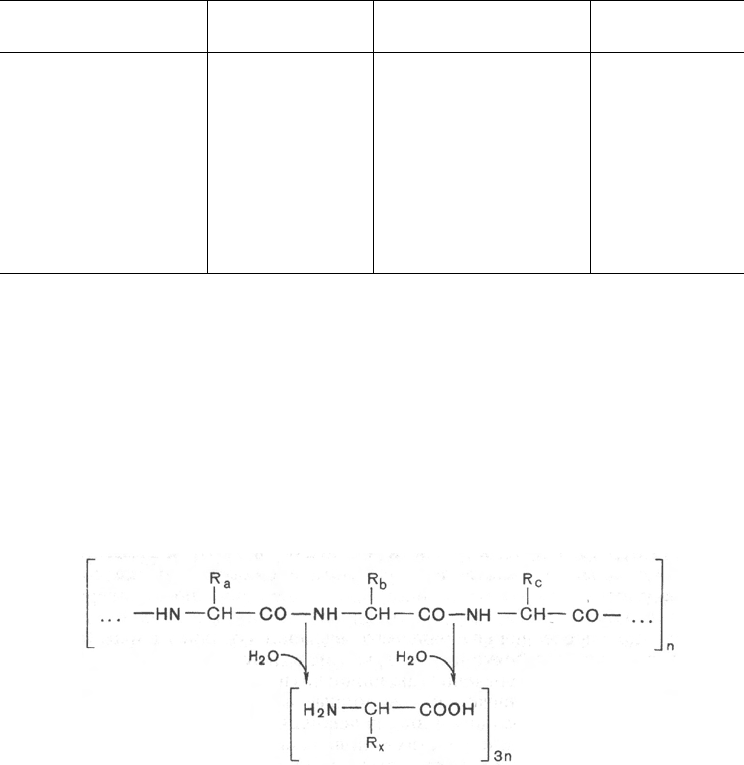
Таблица 12.4. Содержание белка в некоторых пищевых продуктах
Продукт
Мясо
Рыба
Сыр
Яйца
Молоко
Хлеб ржаной
Рис
Горох
Соя
Макароны
Содержание
белка, %
18-22
17-22
20-36
13
3,5
7,8
8
26
35
9-13
Продукт
Гречневая крупа
Пшено
Орехи лесные
» кедровые
Картофель
Капуста
Морковь
Свекла
Яблоки
Вишня
Содержание
белка, %
11
10
12
4
1,5-2
1,1-1,6
0,8-1,6
1,6
0,3-0,4
1-1,1
Весь сложный процесс переваривания пищевых белков в пищевари-
тельном тракте «настроен» таким образом, чтобы путем последовательного
действия протеолитических ферментов лишить белки пищи видовой и
тканевой специфичности и придать продуктам распада способность вса-
сываться в кровь через стенку кишечника. Примерно 95–97% белков пищи
всасывается в виде свободных аминокислот. Следовательно, ферментный
аппарат пищеварительного тракта осуществляет поэтапное, строго из-
бирательное расщепление пептидных связей белковой молекулы вплоть до
конечных продуктов гидролиза белков – свободных аминокислот. Гидролиз
заключается в разрыве пептидных связей —СО—NH— белковой мо-
лекулы.
Протеолитические ферменты (протеиназы) обладают широкой специ-
фичностью действия, определяемой как размером полипептида, так и
структурой радикалов аминокислот, участвующих в образовании пептид-
ной связи. Основные ферменты, катализирующие гидролитический распад
пищевых белков и пептидов, приведены в табл. 12.5.
Следует подчеркнуть, что с пищей человек получает огромное разно-
образие белков, однако все они подвергаются воздействию ограниченного
числа протеиназ. Эти ферменты относятся к классу гидролаз (см. главу 4)
и часто называются также пептидазами. Известны две группы пептидаз:
экзопептидазы, катализирующие разрыв концевой пептидной связи с
освобождением одной какой-либо концевой аминокислоты, и эндопеп-
тидазы, преимущественно гидролизующие пептидные связи внутри поли-
пептидной цепи. Эндопептидазы обладают разной субстратной специфич-
418

Таблица 12.5. Протеолитические ферменты пищеварительного тракта
Источник
Желудочный сок
» »
» »
Панкреатический сок
» »
» »
» »
» »
Кишечный сок
» »
» »
» »
» »
» »
» »
» »
Фермент
Пепсин
Реннин
Гастриксин
Трипсин
Химотрипсин
Коллагеназа
Карбоксипептидаза
Эластаза
Аминопептидаза
Лейцинаминопептидаза
Аланинаминопептидаза
Энтеропептидаза
Трипептидазы
Дипептидазы
Пролил-дипептидаза
Пролин-дипептидаза
Примечание
Протеиназа (найден также
в желудочном соке птиц,
рептилий и рыб)
Вызывает свертывание мо-
лока
Пепсиноподобный фермент
Протеиназа
»
»
Пептидаза
»
»
»
»
Гликопротеин
Пептидазы
»
»
»
ностью действия, всецело определяемой природой радикалов аминокислот
по соседству с разрываемой пептидной связью, поэтому белковая молекула
распадается под действием разных эндопептидаз на строго определенное
число пептидов, сравнительно легко идентифицируемых методами хро-
матографии и электрофореза (метод отпечатков пальцев). Это свойство
эндопептидаз нашло широкое применение в исследовательской работе при
выяснении первичной структуры индивидуальных белков.
Эндопептидазы
Пепсин. Одним из хорошо изученных и основных протеолитических фер-
ментов пищеварительного тракта является пепсин. Его наличие в желудке
было установлено еще в 1783 г. Л. Спалланцани, хотя в кристаллическом
виде он был получен только в 1930 г. (см. главу 1). Пепсин вырабатывается
в главных клетках слизистой оболочки желудка в неактивной форме – в виде
пепсиногена. Превращение пепсиногена в активный пепсин происходит в
желудочном содержимом, однако молекулярный механизм этого превра-
щения в деталях еще не выяснен. Наиболее вероятным считается пред-
положение, что этот процесс является последовательным и протекает
в несколько этапов в присутствии соляной кислоты по механизму
419
аутокаталитического действия самого пепсина. Молекулярная масса пеп-
синогена составляет приблизительно 40400, а пепсина – 32700, поэтому
превращение первого во второй связано с отщеплением пептидных фраг-
ментов. Оба фермента можно сравнительно легко получить в кристал-
лическом виде. Следует отметить, что в отличие от других протеиназ
пепсин отличается высокой устойчивостью в сильнокислой среде и ха-
рактеризуется низким значением изоэлектрической точки (рI < 1). Такие
условия обычно создаются в желудочном содержимом, куда поступает
секретируемая париетальными клетками слизистой оболочки соляная кис-
лота *; рН чистого желудочного сока колеблется от 1,0 до 2,0. Эта среда
является оптимальной для каталитического действия пепсина. Имеются
доказательства, что в желудке человека из пепсиногена, вероятно, об-
разуется не только активный пепсин, а несколько близких по строению
пепсинов, включая пепсиноподобный фермент гастриксин, который
имеет отличный от пепсина оптимум рН действия, равный 3,0.
Реннин. Фермент реннин выделен из сока четвертого отдела желудка
телят в кристаллическом виде. Он есть также в желудочном соке детей
грудного возраста. По механизму и специфичности действия реннин сильно
отличается от пепсина, тогда как по структуре близок к нему: так же
состоит из одной полипептидной цепи с мол. массой 40000. Изоэлектри-
ческая точка реннина равна 4,5.
Три другие важные эндопептидазы: трипсин, химотрипсин и эластаза,
а также одна экзопептидаза – карбоксипептидаза, участвующие в даль-
нейшем после действия пепсина в переваривании белков, синтезируются
в поджелудочной железе. Все они вырабатываются в неактивной форме,
в виде проферментов, и их превращение в активные ферменты происходит
в тонкой кишке, куда они поступают с панкреатическим соком.
Трипсин. Трипсиноген и трипсин получены в кристаллическом виде,
полностью расшифрована их первичная структура и известен молекулярный
механизм превращения профермента в активный фермент. В опытах in vitro
превращение трипсиногена в трипсин катализируют не только энтеро-
пептидаза и сам трипсин, но и другие протеиназы и ионы Са
2+
.
Активирование трипсиногена химически выражается в отщеплении с
N-конца полипептидной цепи 6 аминокислотных остатков (Вал–Асп–
Асп–Асп–Асп–Лиз) и соответственно в укорочении полипептидной цепи
(рис. 12.1).
Следует подчеркнуть, что в этом небольшом, казалось бы, химическом
процессе – отщепление гексапептида от предшественника – заключено важ-
ное биологическое значение, поскольку при этом происходят формирование
активного центра и образование трехмерной структуры трипсина, а известно
(см. главы 1 и 4), что и белки биологически активны только в своей
нативной трехмерной конформации. В том, что трипсин, как и другие
протеиназы, вырабатывается в поджелудочной железе в неактивной форме,
также имеется определенный физиологический смысл, поскольку в про-
тивном случае трипсин мог бы оказывать разрушающее протеолитическое
действие не только на клетки самой железы, но и на другие ферменты,
синтезируемые в ней (амилаза, липаза и др.). В то же время поджелудочная
железа защищает себя еще одним механизмом – синтезом специфического
белка ингибитора панкреатического трипсина. Этот ингибитор оказался
* Поступление пищевого белка в желудок стимулирует секрецию гормона гастрина,
который в свою очередь стимулирует секрецию НСl и пепсиногена в клетках слизистой
оболочки.
420
