Авдеенко А.П. Сборник задач по химии для студентов нехимических специальностей
Подождите немного. Документ загружается.


9. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ. ПРОИЗВЕДЕНИЕ
РАСТВОРИМОСТИ. ГИДРОЛИЗ СОЛЕЙ
9.1. Типовые задачи с решениями
Задача № 1. Расчеты по водородному показателю рН.
Пример 1. Каково значение рН раствора, концентрация ионов ОНЇ которого
равна 10
-9
моль/л ?
Решение.
],OH[]H[K
O
2
H
−+
=
откуда
;л/моль10
10
10
]OH[
K
]H[
5
9
14
O
2
H
−
−
−
−
+
===
рН = -lg[H
+
] = -lg(10
-5
) = 5,
или рОН = -lg OHЇ = - lg(10
-9
) = 9;
pH + pOH = 14 ⇒ pH = 14 – pOH = 14 – 9 = 5.
Пример 2. Какова концентрация ионов водорода и ионов гидроксила раствора,
рН которого равен 10,3 ?
Решение.
рН = -lg[H
+
].
lg[H
+
] = -рН = -10,3 = 11,7.
По таблицам логарифмов находим: [H
+
] = 5,01·10
-11
моль/л. Так как
[H
+
] [OHЇ] = 10
-14
, определяем [OHЇ] :
.л/моль102
1001,5
10
]H[
K
]OH[
4
11
14
O
2
H
−
−
−
+
−
⋅=
⋅
==
Пример 3. Определить рН растворов сильных электролитов:
а) 0,1 молярного раствора HNO
3
(α = 0,92; f = 0,79);
б) 0,01 молярного раствора КОН (α = 0,93; f = 0,90).
Решение. 1) Для 0,1 молярного раствора
HNO
3
находим:
,
]HNO[
H
3
][
α
+
=
где α – степень диссоциации;

[H
+
] = α [HNO
3
] = 0,92·0,1 = 0,092 моль/л.
Затем определяем
а = f c,
где а – активность, т.е. проявляющаяся концентрация ионов;
с – реальная концентрация;
f – коэффициент активности, для очень разбавленных растворов f
→ 1, тогда а ≈ с.
Активность ионов водорода находим по формуле
моль/л.0727,0092,079,0]H[fa =⋅==
+
+
H
Определяем рН раствора, причем вместо реальной концентрации
используем активность:
.14,10727,0lgalgpH
=
−
=
−
=
+
H
2) Для 0,01 молярного раствора КОН
;
]KOH[
Ї]OH[
α =
[OHЇ ]= 0,01·0,93 = 0,0093 моль/л;
;077,200837,0lgalgpOH
;л/моль00837,00093,090,0]OH[fa
=−==
=⋅==
−
−
-
OH
OH
-
рН = 14 – рОН = 14 – 2,077 = 11,927
.
Пример 4. Определить рН 0,6 молярного раствора HСlO (К
д
= 3,2·10
-8
).
Решение. Для слабого электролита расчет рН производится по величине
константы дисоциации
К
д
. И так как величины концентраций очень
малы, активность
а → с.
HClO ⇄ H
+
+ ClOЇ ;
],ClO[]H[;
HClO
]ClO][H[
K
−+
−
+
==
HClOд,
тогда

,
]HClO[
]H[
K
2
HClOд,
+
=
где [HClO] – равновесная концентрация, однако в связи со слабой
диссоциацией принимают ее равной общей концентрации молекул кислоты, как
диссоциированных, так и недиссоциированных,
[HClO] = 0,6 моль/л;
;л/моль1039,16,0102,3[HClO]K]H[
48
HClOд,
−−+
⋅=⋅⋅==
pH =
-lg H
+
= -lg 1,39·10
-4
= 3,857.
Задача № 2. Рассчитать произведение растворимости.
Пример 1. Рассчитать произведение растворимости Mg(OH)
2
, если его
растворимость равна 6,4·10
-3
г/л.
Решение. Для выражения растворимости малорастворимых веществ чаще всего
используются два способа ее выражения.
1. Растворимость в граммах на литр раствора
,
V
1000m
R
ра-p
ва-в
m
⋅
=
где
R
m
– растворимость вещества, г/л;
m
в-ва
– масса растворенного вещества, г;
V
р-ра
– объем раствора, мл.
Тогда концентрация какого-либо иона растворенного вещества
определяется по формуле:
,
M
iR
C
m
=
где М – молярная масса иона;
i – индекс иона в формуле.
2. Растворимость в молях молекул растворенного вещества на литр
раствора
,
VM
1000m
R
ра-p
вав
M
⋅
=
−

где R
M
– растворимость, моль/л.
Тогда концентрация какого-либо иона растворенного вещества
определяется по формуле:
С = R
M
i.
В настоящей задаче растворимость Mg(OH)
2
выражена в граммах
на литр. Вычислим концентрацию ионов
Mg
2+
и ионов ОНЇ в
насыщенном растворе
Mg(OH)
2
:
.л/моль102,2
58
2104,6
M
iR
OH
;л/моль101,1
58
1104,6
M
iR
]Mg[
4
3
2
Mg(OH)
m
-
4
3
2
Mg(OH)
m
2
][
−
−
−
−
+
⋅=
⋅⋅
==
⋅=
⋅⋅
==
Найдем произведение растворимости Mg(OH)
2
:
Mg(OH)
2
⇄ Mg
2+
+ 2OHЇ ;
.103,5)102,2(101,1ПР
;]OH[]Mg[ПР
12244
2
Mg(OH)
22
2
Mg(OH)
−−−
−+
⋅=⋅⋅=
=
Пример 2. Определить концентрацию ионов Ag
+
и растворимость Ag
2
CrO
4
,
выраженную в граммах на литр насыщенного раствора Ag
2
CrO
4
( = 9·10
4
CrO
2
Ag
ПР
-12
).
Решение. Ag
2
CrO
4
⇄ 2Ar
+
+ CrO
4
-2
;
].CrO[]Ag[ПР
2
4
2
4
CrO
2
Ag
−
+
=
Примем концентрацию [CrO
4
-2
] равной Х, тогда [Ag
+
] = 2X, так как
диссоциация одной молекулы Ag
2
CrO
4
дает один ион CrO
4
-2
и два
иона Ag
+
.

моль/л;1031,1
4
109
X
;109X4;109ПР
;X4)X2(XПР
4
3
12
12312
4
CrO
2
Ag
32
4
CrO
2
Ag
−
−
−−
⋅=
⋅
=
⋅=⋅=
==
=
−
]CrO[
2
4
1,31·10
-4
моль/л; [Ag
+
] = 2,62·10
-4
моль/л.
Определим растворимость соли в граммах на литр:
,
i
MC
R
4
CrO
2
Ag
4
CrO
2
Agm,
⋅
=
где С – концентрация какого-либо иона;
i – его индекс.
.л/г0435,0
2
3321062,2
2
M]Ag[
R
=
⋅⋅
==
−
+
4
4
CrO
2
Ag
CrO4
2
Agm,
Пример 3. В каком направлении смещено равновесие следующих
ионообменных реакций:
CaCO
3
+ Na
2
SO
4
⇄ CaSO
4
↓ + Na
2
CO
3
;
AgCl + KI
⇄ AgI↓ + KCl ?
Решение. Рассмотрим смещение равновесия на примере последней реакции.
Равновесие ионообменных реакций с участием малорастворимых
веществ смещено в сторону образования вещества с меньшим
произведением растворимости:
ПР
AgCl
= 1,56·10
-10
; ПР
AgI
= 1,5·10
-16
.
Равновесие данной реакции смещено в сторону образования AgI, так
как AgI посылает в раствор меньшее число ионов
Ag
+
, чем AgCl:
AgCl + KI AgI + KCl.
Задача № 3. Написать молекулярные и ионные уравнения гидролиза
следующих солей: CH
3
COONa, NaCN, K
3
PO
4
, NH
4
Cl, Al
2
(SO
4
)
3
,
NH
4
NO
4
, Na
2
CO
3
, Al
2
S
3
, KCl, FeSO
4
. Указать характер среды водных
растворов этих солей.

Примеры решений. Вначале определяется природа соли.
Соли, образованные слабым основанием и сильной кислотой и,
наоборот, - сильным основанием и слабой кислотой, подвергаются частичному
гидролизу, в большинстве случаев преимущественно по I ступени, при этом в
уравнении гидролиза ставятся две стрелки в противоположных направлениях (
⇄ ), указывающие на незначительное протекание гидролиза.
Соль, образованная сильным основанием и сильной кислотой, гидролизу
не подвергается.
Для написания ионного уравнения гидролиза применяют те же правила,
что и при написании ионных уравнений любых ионообменных реакций:
малодиссоциируемые молекулы или ионы записывают в неизменном виде,
тогда как молекулы сильных электролитов записывают в виде ионов.
1. NaCN – соль, образованная сильным основанием и слабой
кислотой:
NaCN + H
2
O ⇄ NaOH + HCN;
Na
+
+ CNЇ + H
2
О ⇄ Na
+
+ OHЇ + HCN;
CNЇ + H
2
O ⇄ HCN + OHЇ; pH > 7, среда щелочная.
2. Na
2
CO
3
– соль, образованная сильным основанием и слабой
двухосновной кислотой.
Гидролиз протекает преимущественно по I ступени:
Na
2
CO
3
+ H
2
O ⇄ NaHCO
3
+ NaOH;
2Na
+
+ CO
3
2-
+ H
2
O ⇄ Na
+
+ HCO
3
Ї + Na
+
+ OHЇ;
CO
3
2-
+ H
2
O ⇄ HCO
3
Ї + OHЇ;
pH > 7, среда щелочная.
По II ступени гидролиз практически не протекает, равновесие сильно
смещено влево:
NaHCO
3
+ H
2
O NaOH + H
2
CO
3
;
Na
+
+ HCO
3
Ї Na
+
+ OHЇ + H
2
CO
3
;
HCO
3
Ї + H
2
O OHЇ + H
2
CO
3
;
pH > 7, среда слабо щелочная.
3. NH
4
NO
3
– соль, образованная сильной кислотой и слабым
основанием:
NH
4
NO
3
+ H
2
O ⇄ NH
4
OH + HNO
3
;
NH
4
+
+ NO
3
Ї + H
2
O ⇄ NH
4
OH + H
+
+ HNO
3
Ї;
NH
4
+
+ H
2
O ⇄ NH
4
OH + H
+
; pH < 7, среда кислая.
4. FeSO
4
– соль, образованная сильной кислотой и слабым
двухкислотным основанием.
Гидролиз протекает преимущественно по I ступени:
2FeSO
4
+ 2H
2
O ⇄ (FeOH)
2
SO
4
+ H
2
SO
4
;
2Fe
2+
+ 2SO
4
-2
+ 2H
2
O ⇄ 2FeOH
+
+ SO
4
-2
+ 2H
+
+ SO
4
2-
;
Fe
2+
+ H
2
O ⇄ FeOH
+
+ H
+
; pH < 7, среда кислая.
По II ступени гидролиз практически не протекает, равновесие сильно
смещено влево:
(FeOH)
2
SO
4
+ 2H
2
O 2Fe(OH)
2
+ H
2
SO
4
;
2FeOH
+
+ SO
4
-2
+ 2H
2
O 2Fe(OH)
2
+ 2H
+
+ SO
4
2-
;
FeOH
+
+ H
2
O Fe(OH)
2
+ H
+
; pH < 7, среда слабо кислая.
5.
Al
2
S
3
– соль, образованная слабым основанием и слабой кислотой.
Подвергается полному гидролизу:
Al
2
S
3
+ 6H
2
O → 2Al(OH)
3
+ 3H
2
S↑ ;
2Al
3+
+ 3S
2-
+ 6H
2
O → 2Al(OH)
3
↓ + 3H
2
S↑ ;
pH ≈ 7, среда близкая к нейтральной.
6. NaCl – соль, образованная сильной кислотой и сильным
основанием:
NaCl + H
2
O ↛; рН = 7, среда нейтральная.
Задача № 4. Рассчитать константу гидролиза и рН водных растворов
следующих солей:
а) 0,2 М раствор CH
3
COONa;
б) 0,05 М раствор NH
4
Cl.
Решение. 1) Для соли, образованной слабой кислотой и сильным основанием,
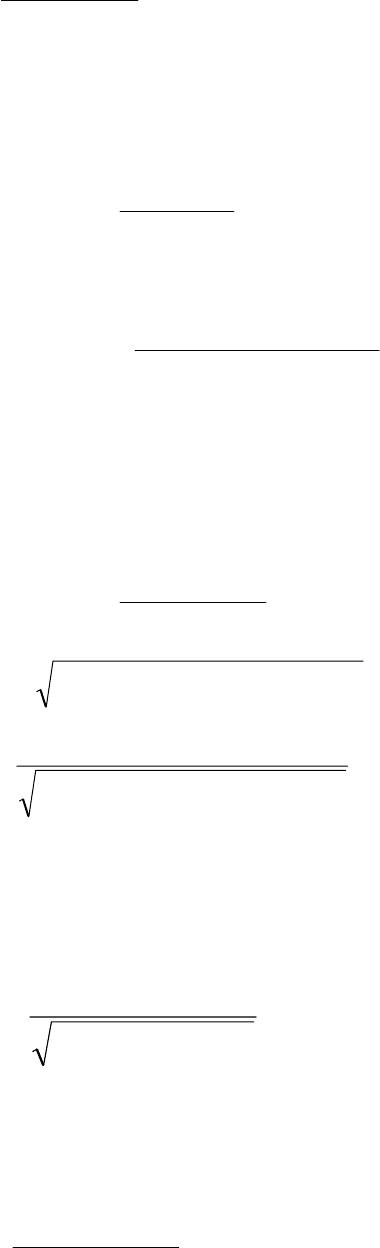
.
K
K
K
кислотыд,
O
2
H
h
=
Находим в справочнике:
;1075,1K
5
COOH
3
CHд,
−
⋅=
.1071,5
1075,1
10
K
10
5
14
COONa
3
CHh,
−
−
−
⋅=
⋅
=
Выражение константы гидролиза:
.
]COOCH[
]OH][COOHCH[
K
−
−
=
3
3
COONa
3
CHh,
CH
3
COONa + H
2
O ⇄ CH
3
COOH + NaOH;
CH
3
COOЇ + H
2
O ⇄ CH
3
COOH + OHЇ.
Так как [CH
3
COOH] = [OHЇ], то
;
]COOCH[
]OH[
K
−
−
=
3
2
COONa
3
CHh,
;]COOCH[K]OH[
−−
=
3COONa
3
CHh,
.
]COOCH[K
10
]H[
−
−
+
=
3COONa
3
CHh,
14
Предположив, что соль CH
3
COONa диссоциирует полностью,
вместо [CH
3
COOЇ] подставляем [CH
3
COONa]:
[CH
3
COONa] = 0,2 моль/л;
;л/моль1093,0
2,01071,5
10
]H[
9
10
14
−
−
−
+
⋅=
⋅⋅
=
рН = -lg [H
+
] = -lg 9,3·10
-10
= 9,03.
2) Для соли, образованной сильной кислотой и слабым основанием,
.
K
K
K
основанияд,
O
2
H
h
=
Находим в справочнике:

;1079,1K
5
OH
4
NHд,
−
⋅=
;1059,5
K
K
10
OH
4
NHд,
O
2
H
Cl
4
NHh,
K
−
⋅==
NH
4
Cl + H
2
O ⇄ NH
4
OH + HCl;
NH
4
+
+ H
2
O ⇄ NH
4
OH + H
+
.
Выражение константы гидролиза имеет вид
.
NH
]H][OHNH[
K
][
4
4
Cl
4
NHh,
+
+
=
Так как [NH
4
OH] = [H
+
], то
.]NH[K]H[;
]NH[
]H[
K
4Cl
4
NH,h
4
2
Cl
4
NH,h
++
+
+
==
Предположив, что соль NH
4
Cl диссоциирует полностью, вместо
[NH
4
+
] подставляем [NH
4
Cl]:
NH
4
Cl = 0,05 моль/л;
;л/моль1029,505,01059,5]H[
610 −−+
⋅=⋅⋅=
pH = -lg [H+] = -lg 5,29·10-6 = 5,28.
Задача № 5. Написать уравнение совместного гидролиза двух солей: Al
2
(SO
4
)
3
и
Na
2
CO
3
.
Решение. Так как данные соли противоположного типа –
Al
2
(SO
4
)
3
образованы слабым основанием и сильной кислотой, а
Na
2
CO
3
образована сильным основанием и слабой кислотой, то при
растворении в воде они дают разную реакцию растворов
:
I Al
3+
+ H
2
O ⇄ AlOH
2+
+ H
+
, pH < 7;
I CO
3
2-
+ H
2
O ⇄ HCO
3
Ї + OHЇ , pH > 7.
При сливании растворов происходит взаимная нейтрализация:
Н
+
+ OHЇ → H
2
O. Это смещает оба равновесия вправо и становятся
возможными следующие стадии гидролиза:
II AlOH
2+
+ H
2
O ⇄ Al(OH)
2
+
+ H
+
;
II HCO
3
Ї + H
2
O ⇄ H
2
CO
3
+ OHЇ;
III Al(OH)
2
+
+ H
2
O ⇄ Al(OH)
3
+ H
+
.
В итоге происходит полный гидролиз:
2Al
3+
+ 3SO
4
2-
+ 6Na
+
+ 3CO
3
2-
+ 3H
2
O →
→ 2Al(OH)
3
+ 3H
2
CO
3
+ 6Na
+
+ 3SO
4
2-
;
2Al
3+
+ 3CO
3
2-
+ 3H
2
O → 2Al(OH)
3
+ 3H
2
CO
3
, рН ≈ 7.
9.2. Задачи для самостоятельного решения
86. Раствор щелочи в воде содержит гидроксид-ион в концентрации 2,5·10
-5
моль/л. Найти концентрацию водородных ионов в растворе и рН его.
87. Чему равен рН 0,01 М раствора соляной кислоты?
88. рН раствора 4,4. Определить концентрацию ионов водорода.
89. Какова концентрация гидроксид-ионов в растворе, рН которого равен 10,8 ?
90. Вычислить рН 0,01 н раствора уксусной кислоты, степень диссоциации
которого в растворе равна 4,2 %.
91. Вычислить ПР для
AgCl, если известно, что 1 л насыщенного раствора при
20
о
С содержит 0,0016 г AgCl.
92. ПР PbI
2
при комнатной температуре равно 1,4·10
-8
. Рассчитать
растворимость соли при этой температуре и концентрацию каждого из ее
ионов в насыщенном растворе.
93. В каком направлении смещено равновесие в следующих ионообменных
реакциях:
CaCO
3
↓ + 2KF ⇄ CaF
2
+ K
2
CO
3
;
PbCl
2
+ Na
2
SO
4
⇄ PbSO
4
↓ + 2NaCl ?
94. Написать молекулярные и ионные уравнения гидролиза следующих солей:
NaNO
3
, Zn(NO
3
)
2
, Li
3
PO
4
, Cr
2
S
3
, Al
2
(SO
3
)
3
, Fe
2
(SO
4
)
3
, NH
4
Cl.
95. Рассчитать константу гидролиза и рН водных растворов следующих солей:
а) 0,1 М раствор KCN (
= 4,7·10
HCNд,
K
-10
);
