Анненков Ю.М. и др. Основы электротехнологий: практикум
Подождите немного. Документ загружается.

каф. ЭИКТ ЭЛТИ ТПУ
71
растворённого вещества, приводящая к уменьшению концентрации ио-
нов, участвующих в электролизе.
При этом на электродах выделяются газы в виде пузырьков.
В процессе электролиза водных растворов электролитов (кислых,
щелочных, нейтральных) происходит одновременно ряд различных ре-
акций, среди которых наибольшее значение имеют следующие:
1) диссоциация молекул воды и соли:
Н
2
О → ОН
-
+ Н
+
NaCl ↔ Na
+
+ Cl
-
2) переход металла электрода из металлического состояния (Ме
0
) в
ионное состояние: Ме
0
± nе → Ме
n+
,
где n – число единичных зарядов,
е – единичный отрицательный заряд (электрон).
3) образование различных металлических соединений, состав кото-
рых определяется химическим составом электролита или продуктов
электролиза:
- в кислых растворах: Ме
n+
+ nR
-
→ Me(R)
n
,
где R – кислотный остаток (анион), например Cl
-
,
−2
4
SO ,
−3
4
PO
- в нейтральных и щелочных растворах:
Ме
n+
+ nOH
-
→ Me (OH)
n
↓ (гидрат окиси металла - нерастворим)
Ме
n+
+ nO
2-
→ Me
n
O
n
(нерастворим)
4) переход иона металла электролита в металлическое состояние
(Ме
0
) в результате его взаимодействия с металлом катода (процесс ка-
тодного восстановления): Na
+
+ e
-
→ Na
0
5) продуктами электролиза воды являются газы (кислород и водо-
род), непрерывно удаляющиеся из сферы реакции.
на аноде: 4ОН
-
- 4е
-
→ 2Н
2
О + О
2
↑ (газ)
на катоде: 2Н
2
О + 2е
-
→ 2ОН
-
+ Н
2
↑ (газ).
Течение катодных и анодных реакций при электролизе, при условии,
что на электроде протекает только один электрохимический процесс,
определяется двумя законами Фарадея:
1.
Масса вещества (m), выделившегося при электролизе на катоде
или перешедшего с анода в электролит, пропорциональна количеству
электричества (Q=It при постоянном токе) прошедшего через электро-
лит
t
IQ
m
⋅
⋅
=
⋅
=
α
α
, (1)
где α- электрохимический эквивалент вещества, г/Кл (кг/А⋅с)
I – сила тока
t- время прохождения тока

каф. ЭИКТ ЭЛТИ ТПУ
72
2.
Электрохимические эквиваленты элементов прямо пропорцио-
нальны их химическим эквивалентам, т.е. прямо пропорциональны
атомной массе вещества (А) и обратно пропорциональны его валентно-
сти (n)
nF
A
⋅
=
α
, (2)
где F = 96480 – число Фарадея [Кл⋅моль
-1
].
Число Фарадея означает, что при растворении 1 грамма эквивален-
та любого металла, требуется одно и то же количество электричества,
равное 96500 Кулонов, или равное 26,8 А
.
час.
Таким образом, электрохимический эквивалент вещества пред-
ставляет собой массу вещества в граммах, выделяемую единицей коли-
чества электричества, проходящего через электролит. Для меди А =
63.54, n=2, α= 0.000329 г/Кл, для никеля α= 0.000304 г/Кл, для цинка α=
0.00034 г/Кл.
Электрохимический эквивалент любого сплава можно найти че-
рез эквиваленты входящих в него
элементов (k
1
, k
2
,....k
n
) и через массо-
вое содержание в процентах (р
1
, р
2
....р
n
) элемента в сплаве:
1.2. Анодное растворение
Электрохимическая обработка материалов нашла широкое приме-
нение в различных областях техники для нанесения на изделия защит-
ных покрытий из никеля и хрома, создания копий инструмента, изго-
товления отверстий в твердотельных сплавах, шлифования деталей,
электрохимического травления (очистки) алюминиевой и медной фоль-
ги, формирования оксидно-полупроводниковых конденсаторов и т.д.
В
большинстве современных методов используется преимущест-
венно процесс анодного растворения, т.е. перехода металла, помещён-
ного в электролитическую ванну в качестве анода, из металлического
состояния в различные неметаллические соединения (соли, гидроокиси,
окислы). В этом случае, материал анода как бы растворяется, а продук-
ты растворения уносятся электролитом. При этом катод, который слу-
жит
инструментом, не изнашивается, что является положительной осо-
бенностью ЭХО.
Под действием тока в электролите материал анода растворяется и
выносится электролитом из промежутка в виде продуктов обработки:
1)
Адсорбция аниона на поверхности анода (А):
Cl
-
э
+ А → Cl
-
адс
2)
перезарядка аниона:
Cl
-
адс
– e
-
→ Cl
0
адс

каф. ЭИКТ ЭЛТИ ТПУ
73
3)
перезарядка атомного остова ионов металла анода:
Cu
2+
тв
+e
-
→ Cu
+1
тв
4)
химическое взаимодействие адсорбированного атома хлора с ио-
нами меди с образованием адсорбированного комплекса:
Cu
+
тв
+ Cl
0
адс
→ (CuCl)
+
адс
5)
растворение комплекса
(CuCl)
+
адс
→ (CuCl)
+
э
6)
взаимодействие ионов хлора с комплексом в электролите
(CuCl)
+
э
+ Cl
-
э
→ Cu
2+
э
+ 2Cl
-
э
7) образование продуктов электролиза:
Cu
2+
э
+ 2OH
-
→ Cu (OH)
2
↓
Cu
2+
э
+ 2O → CuО
2
4ОН
-
- 4е
-
→ 2Н
2
О + О
2
↑ (газ)
2Н
2
О – 4e
-
→ 4Н
+
+ О
2
↑ (газ)
Таким образом, анодное растворение в нейтральных электролитах
сопровождается образованием газов, гидратов окиси металла, которые
являются практически нерастворимыми в электролите и забивающие
межэлектродный зазор, и образованием оксидной плёнки на аноде. В
результате этого возникает явление пассивации – образование на по-
верхности оксидной плёнки, обладающей большим сопротивлением. С
увеличением напряжения растёт толщина
плёнки. Предотвратить или
удалить пассивацию можно с помощью введения в электролит активных
ионов или подведения ультразвуковых колебаний к электроду или в
электролит.
На практике важно знать линейную скорость растворения металла,
которую можно определить из уравнения
δ
σ
η
⋅
⋅
⋅
=
d
Uk
V , (3 )
где σ - удельная проводимость электролита;
δ - зазор между катодом и анодом;
η - коэффициент, учитывающий химическое растворение металла;
d - плотность электролита;
U - внешнее напряжение.
Скорость анодного растворения зависит от силы тока через электро-
лит, состава электролита, его концентрации и температуры, металла
анода и др.
Одним из видов электрохимической обработки
металлов является
острение металлических зондов, которые широко используются в лабо-
раторных исследованиях. В этом случае с помощью специального при-
способления в раствор электролита погружается металлическая прово-
каф. ЭИКТ ЭЛТИ ТПУ
74
лока или игла, из которых изготовляется зонд. Эта игла служит анодом,
а электролит или ванна - катодом. При погружении иглы в электролит с
её кончика металл переходит в электролит. Производя периодическое
поднятие и погружение иглы в раствор электролита, добиваются нужно-
го радиуса иглы. Поскольку большее время в электролите находится
кончик
иглы, то и количество металла, уносимого в электролит, будет
для него больше, а соответственно и меньше радиус. Можно сказать,
что количество металла, переносимого через электролит, будет пропор-
ционально количеству прошедшего электричества, т.е. времени нахож-
дения различных частей иглы в электролите. Обычно для изготовления
металлических зондов используются электролиты на основе водного
раствора NаCl, КОН и др.
1.3. Катодное восстановление (гальванотехника).
Гальванотехника – способ осаждения металлов на поверхности ме-
таллических и неметаллических изделий при помощи электролиза. По-
сле осаждения поверхность изделия приобретает большую стойкость
против коррозии, красивый вид (декоративное покрытие), большую
твёрдость и стойкость против истирания. Если изделие покрывается
тонким слоем (5-30 мкм) металла, то процесс называется гальваностеги-
ей (омеднение, никелирование, хромирование, серебрение, золочение
,
кадмирование и т.д.). Медь используется, главным образом, как проме-
жуточный слой ( хорошее сцепление с материалом изделия) на покры-
ваемых никелем или хромом стальных изделиях.
Как правило, в процессах гальваностегии применяют растворимые
аноды в виде полос или прутков из металла, осаждаемого на катоде. В
этом случае осуществляется перенос металла с
анода на катод. Приме-
няются и аноды из металла, нерастворимого в данном электролите
(хромирование). В этом случае металл выделяется на изделиях за счёт
электролита. Основной частью электролита являются соли осаждающе-
гося металла. Кроме того, для улучшения проводимости электролита в
него часто вводят кислоты или щёлочи.
Например, в соответствии с рядом
напряжений металлов, железо бо-
лее склонно к образованию химического соединения с кислородом, чем
водород. Поэтому, попадая в воду, железо окисляется (ржавеет), образуя
окись Fe
2
O
3
, и вытесняет из нее водород. Другим примером такого ме-
ханизма является взаимодействие железа с раствором сульфата меди.
Согласно ряду напряжения более активное железо вытесняет медь из
раствора, причем железо растворяется, образуя сульфат железа, в виде
ионов, а медь выделяется в виде металла и оседает на поверхность же-

каф. ЭИКТ ЭЛТИ ТПУ
75
леза. Как только медь покроет всю поверхность железа, этот процесс
прекратится.
Аналогичный процесс будет наблюдаться, если пластинку железа
поместить в раствор сульфата никеля и борной кислоты. В этом случае
более активное железо вытесняет из раствора никель, который будет
выделяться в виде металла и покрывать поверхность железа.
Рассмотренные выше химические
реакции являются типичным при-
мером химического осаждения (восстановления) металла. Если этот
процесс провести в электрическом поле, т.е. приложить к металлам со-
ответствующий потенциал, то интенсивность этого процесса увеличит-
ся. Следует отметить, что скорость таких реакций или количество выде-
ляющегося вещества сильно зависит от температуры, времени, состава и
концентрации раствора электролита
и величины протекающего через
него тока.
В случае восстановительной реакции ионы металла электролита при-
тягивают электроны катода и осаждаются на нём в виде атомов (Me
адс
):
Ме
n+
+ ne
-
→ Me
адс
Кроме того, на катоде происходит выделение водорода в результате
окисления молекул воды и гидроксид-анионов.
Кроме этих процессов в зависимости от материала электродов, типа и
состава электролита, в процессе электролиза будут протекать и другие
химические реакции.
Для нанесения никелевого покрытия обычно используются электро-
литы на основе сернокислого никеля с добавлением сернокислого
ам-
мония и борной кислоты с величиной рН ≈ 3,7 ÷ 6,0. Эти добавки необ-
ходимы для связывания образующегося водорода (чтобы избежать газо-
выделения на катоде) и повышения качества никелевого покрытия.
Осаждение никеля на катод происходит в результате следующих хи-
мических реакций:
NiSO
4
↔ Ni
2+
+SO
4
2-
Н
2
О ↔
Н
+
+ ОН
-
Анод Катод
SO
4
2-
- 2е
-
→ SO
4
Ni
2+
+ 2e
-
→ Ni
адс
Молекула SO
4
нестойкая. 2Н
+
+ 2е
-
= Н
2
↑
Она распадается, выделяя 2Н
2
О + 2е
-
→ 2ОН
-
+ Н
2
↑ (газ)
атомарный кислород:
SO
4
→ SO
3
+ О↑
4ОН
-
- 4е
-
→ 2Н
2
О + О
2
↑ (газ)
каф. ЭИКТ ЭЛТИ ТПУ
76
1.4. Электролитическое рафинирование (электрофорез)
Значительный практический интерес представляет электролиз рас-
творов солей металлов (МеSO
4
) с электродами из этих металлов. В этом
случае на аноде окисляются и переходят в раствор в виде положитель-
ных ионов атомы Ме, а на катоде те же ионы восстанавливаются и в
виде металла осаждаются на электроде. Такая «перегонка» Ме с анода
на катод не бессмысленна. Часто выплавляемая из руды медь
содержит
примеси. Если из этой меди сделать аноды и «перегнать» их элекрохи-
мически (через раствор CuSO
4
) на катод, то произойдёт очистка метал-
ла. Высокочистая медь необходима, например, для изготовления про-
водов. В промышленности применяют и другие растворимые аноды.
Так, анодным растворением сплава железа и марганца можно получить
перманганат калия.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Электрохимическое анодное растворение.
2.1.1. Цель и задачи работы.
- Изучение метода анодного растворения металлических пластин.
- Получение металлических зондов методом электрохимического
травления металлических игл.
2.1.2. Описание экспериментальной установки
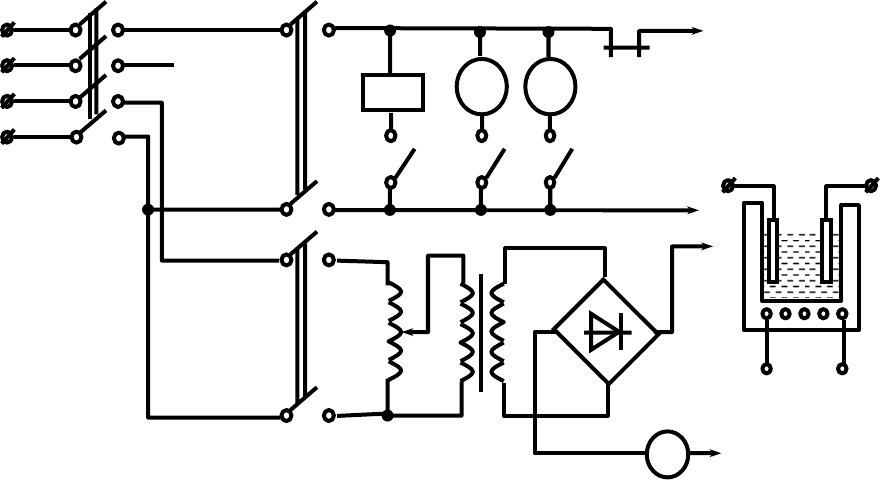
Установка (рис. 3) состоит из электролитической ванны с подогревом
электролита нагревателем Н1. Температура раствора контролируется
контактным термометром К1, который включен в цепь питания катушки
реле Р1.
При включении установки пакетным выключателем ПВ включение
нагрева ванны производится выключателем В1. В этом случае напряже-
ние сети через нормально замкнутые контакты реле Р1 подводится к
на-
гревателю Н1, что фиксируется загоранием лампы Л1 (меньше) на пуль-
те управления.
При достижении заданной температуры раствора происходит замы-
кание контактов контактного термометра К1, что обеспечивает подачу
напряжения на обмотку реле Р1, которое размыкает свои нормально
замкнутые контакты Р1, и, тем самым, снимается напряжение с нагрева-
теля Н1. На
пульте управления загорается соответственно сигнальная
лампа Л2 (больше), сигнализирующая о превышении температуры рас-
твора. Подача постоянного напряжения величиной 6В на электроды
ванны осуществляется от выпрямителя, подключенного к разделитель-
каф. ЭИКТ ЭЛТИ ТПУ
77
ному трансформатору ТР. Регулировка величины тока осуществляется
автотрансформатором - АТ. Для включения напряжения на электроды в
схеме управления предусмотрен выключатель В2.
Рис.3. Принципиальная электрическая схема установки:
ПВ-пакетный выключатель сети, Н1-нагреватель ванны, В1-выключатель нагрева
ванны, В2-выключатель напряжения ванны, Р1-обмотка и контакты реле, К1-
контактный термометр, АТ-автотрансформатор, ТР-понижающий трансфор-
матор, Л1, Л2-лампы сигнализации.
2.1.3. Порядок работы
Подготовить образцы и установить их в электродное устройство.
Подготовить раствор электролита и залить в ванну.
Включить установку в сеть пакетным выключателем ПВ. На ПУ за-
горается сигнальная лампа «Сеть».
Подать напряжение на электроды выключателем В2 и с помощью ав-
тотрансформатора установить по амперметру рабочий ток в пределах 5 -
50 А (величина тока
задается преподавателем).
В процессе электрохимического травления через определенные про-
межутки времени производить контроль массы образца (таб. 1) или ра-
диуса иглы (таб. 2).
Выключить установку пакетным выключателем ПВ.
Произвести согласно формулам 1 и 2 расчет массы растворенного
металла и сравнить экспериментальные и теоретические результаты.
ПВ В
1
Р
1
В
а
н-
+
-
Н1
+
-
к Н1
Р
1
Р
1
Р
1
К
1
В
2
АТ Т
р
А
Л
1
Л
2

каф. ЭИКТ ЭЛТИ ТПУ
78
Таблица 1
Влияние силы тока и времени травления на массу металла
Масса образца, гр Ток
I, А
Время
травления
τ, мин
экспериментальная
m
экс
расчётная
m
Ф
0
5
10
…
0
5
10
…
Таблица 2
Зависимость радиуса иглы от времени травления
Радиус иглы R, мкм Время травления
τ, мин
ток I = 1 А ток I = 10 А
0
5
10
….
Произвести необходимые расчёты и построить графики, соответст-
вующие заданию (m
экс
= f(I), m
экс
= f(τ), m
Ф
= f(I), m
Ф
= f(I) или R
иглы
=
f(t)).
2.1.4. Контрольные вопросы
1. Что представляет собой электрохимическая обработка материалов
и для каких целей она применяется?
2. Что такое анодное растворение металлов?
3. В чем заключается физическая сущность процесса анодного рас-
творения металлов?
4. От каких факторов зависит скорость электрохимической обработки
материалов?
2.2. Электрохимическое катодное восстановление.
2.2.1. Цель и задачи работы
- Изучение гальваностегии.
- Получение никелевого покрытия методом электрохимического вос-
становления металла
каф. ЭИКТ ЭЛТИ ТПУ
79
2.2.2. Описание экспериментальной установки
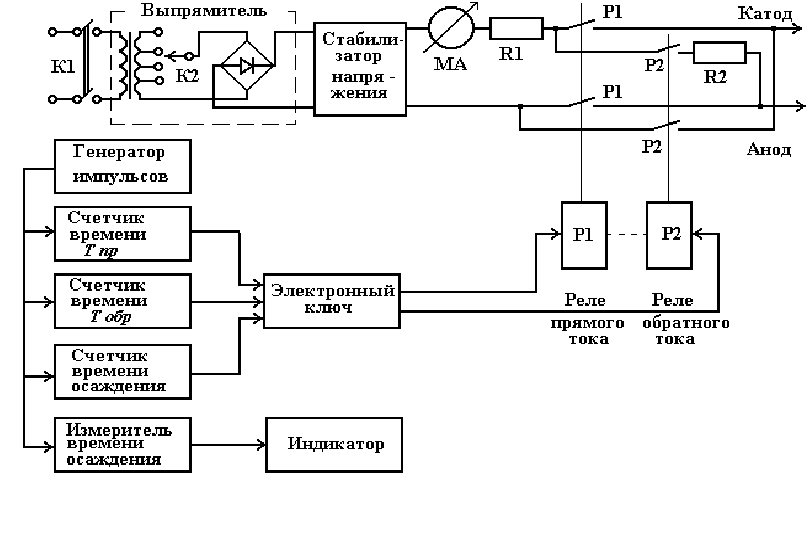
Установка (рис.4) состоит из электролитической ванны и реверсив-
ного блока питания. Реверсивный блок питания состоит из стабилизато-
ра напряжения, измерителя и регулятора тока, регулятора режима рабо-
ты и счетчика времени.
Структурная блок-схема установки содержит регулируемый стабили-
затор напряжения, являющийся источником тока осаждения. Ток осаж-
дения контролируется измерителем тока мА. Реверсирование тока осу-
ществляется поочередным включением кнопок Р
1
, Р
2
реле прямого и об-
ратного тока. Управление реле осуществляет электронный ключ. Счет-
чик времени Т
пр
и Т
обр
поочередно считают импульсы, поступающие с
генератора импульсов и в конце каждого счета по истечении заданного
времени переключают электронный ключ. Для ограничения прямого
тока служит сопротивление R1, а для ограничения обратного тока – до-
полнительно сопротивление R2.
Счетчик времени осаждения по истечении заданного времени отклю-
чает электронный ключ и, тем самым, отключает ток.
Измеритель
времени осаждения совместно с индикатором фиксирует
время осаждения с начала процесса. По окончании заданного интервала
времени осаждения включается звуковой сигнал.
Рис.4. Блок –схема установки
каф. ЭИКТ ЭЛТИ ТПУ
80
2.2.3. Порядок работы
Залить в ванну электролит, соблюдая меры безопасности.
Подготовить образец для никелирования, взвесить его на весах, уста-
новить в зажим и опустить в ванну.
Установить рукоятки регистров «Грубо», «Точно» в крайнее положе-
ние против часовой стрелки.
Задать режим работы (длительность действия прямого и обратного
тока в цикле).
Задать время осаждения.
Включить
установку тумблером «Сеть». При этом должна загореться
сигнальная лампа «Сеть».
Включить тумблер «Сеть» реверсивного блока и нажать кнопку
«Сброс» для сброса показаний счетчика времени осаждения и выключе-
ния звукового сигнала.
Нажать кнопку «Пуск» реверсивного блока и рукоятками резисторов
«Грубо» и «Точно» установить величину прямого тока (100 мА) по за-
данию преподавателя
.
По окончании заданного времени осаждения нажать кнопку «Сброс»
и отключить звуковой сигнал.
Вынуть образец из зажима, промыть его в воде, просушить и изме-
рить его вес после нанесения.
Повторить процесс нанесения.
Результаты измерений внести в таблицу 3.
Произвести по формулам 1 и 2 расчет массы осажденного металла
(m
Ф
) и сравнить экспериментальные и теоретические результаты.
Построить график изменения веса (массы) образца от времени осаж-
дения.
Объяснить полученные результаты.
Таблица 3.
Влияние силы тока и времени нанесения покрытия
на массу электрода
Масса образца, гр Ток
I, А
Время
травления
τ, мин
экспериментальная
m
экс
расчётная
m
Ф
0
5
10
0
5
10
