Ахметов А. Технология и оборудование процессов переработки нефти и газа
Подождите немного. Документ загружается.

561
ние давления способствует реакциям синтеза, идущим с уменьшением
объема. Наоборот, для реакций крекинга, идущих с увеличением объ
-
ема, благоприятны низкие давления. Для реакций, протекающих без
изменения объема, таких как изомеризация или замещение, давление
не оказывает влияния на их равновесие.
Для прогнозирования вероятности образования того или иного
продукта реакций в термодинамике пользуются данными по энергиям
связи в химических веществах.
Энергией связи называется количество энергии, необходимое для раз
-
рыва или образования определенного типа связи между атомами в моле
-
кулах. При возникновении связи происходит переход химической систе
-
мы в более устойчивое состояние, сопровождающееся выделением тепла.
Следовательно, энергия образования связи положительна. При распаде
молекул тепло поглощается, и энергия разрыва связи отрицательна.
Из сопоставительного анализа данных, приведенных в табл. 5.2, мож
-
но сформулировать некоторые качественные выводы о влиянии струк
-
туры и массы молекул углеводородов на величину энергий разрыва свя
-
зей между атомами углерода, углерода с водородом и углерода с серой.
1. В молекулах алканов энергия разрыва связи между крайним ато
-
мом углерода и водородом наибольшая в метане
(431 кДж/моль),
и она снижается по мере увеличения числа углеродных атомов до
четырех и затем становится постоянной (на уровне 394
кДж/моль).
2. В нормальных алканах энергия разрыва связи между атомами водо-
рода и находящегося внутри цепи углерода постепенно уменьшает
-
ся в направлении к середине цепи (до
360 кДж/моль). Например,
в молекуле нормального октана она составляет: 394; 373; 364; 360;
360; 364; 373; 394 кДж/моль.
3. Энергия отрыва атома водорода от вторичного и особенно от тре
-
тичного атома углерода несколько меньше, чем от первичного.
4. В молекуле алкенов энергия отрыва атома водорода от углеродного
атома с двойной связью значительно больше, а от атома углерода
,
находящегося в сопряжении с двойной связью, — значительно ни
-
же,чем энергия С–Н-связи в алканах.
5. В нафтеновых кольцах прочность связи С–Н такая же, как в связях
вторичного атома углерода с водородом в молекулах алканов.
6. В молекулах бензола и алкилароматических углеводородов энергия
связи между атомом углерода в кольце и водородом сопоставима
с прочностью С–Н-связи в метане, а энергия отрыва водорода от
углерода, сопряженного с ароматическим кольцом, значительно
ниже, чемэнергия С–Н-связи в алканах.
562
Таблица 5.2 — Энергия разрыва связей в некоторых углеводородах
и гетероорганических соединениях
Соединение, связь
Энергия
разрыва,
кДж/моль
Соединение, связь
Энергия
разрыва,
кДж/моль
Н–Н 435 СН
3
–СН
3
360
СН
3
–Н 431 С
2
Н
5
–СН
3
348
C
2
H
5
–H 410 C
3
H
7
–CH
3
339
C
3
H
7
–H 398 C
4
H
9
–CH
3
335
C
4
H
9
–H 394 С
2
Н
5
–С
2
Н
5
335
и-C
4
H
9
–H 390 C
3
H
7
–C
3
H
7
318
т-C
4
H
9
–H 373 и-C
3
H
7
–и-C
3
H
7
320
СН
2
=СН–Н 435 C
4
H
3
–и-C
3
H
7
318
СН
2
=СНСН
2
–Н 301 С
4
Н
9
–С
4
Н
9
310
ц-С
6
Н
11
–Н 389 m-С
4
Н
9
–m-С
4
Н
9
264
ц-С
5
Н
9
–Н 389 СН
2
=СН
2
502
С
6
Н
5
–Н 427 СН
2
СН–СН
3
394
С
6
Н
5
СН
2
–Н 348 СН
2
СНСН
2
–СН
3
260
С
6
Н
5
СН
2
СН
2
–Н 394 СН
2
С(СН
з
)–С
2
Н
5
268
(С
6
Н
5
)
2
СН–Н 310 310
423 293
Η
406 364
CH
3
–SH 293 С
6
Н
5
–СН
3
381
С
2
Н
5
СН
2
–SH 289 C
6
H
5
–C
2
H
5
368
C
6
H
5
–SH 222 C
6
H
5
–C
3
H
7
360
CH
3
–SCH
3
301 С
6
Н
5
СН
2
–СН
3
264
С
2
Н
5
–SC
2
H
5
289 С
6
Н
5
–С
6
Н
5
414
CH
3
S–SCH
3
293 С
6
Н
5
СН
2
–СН
2
С
6
Н
5
197
C
2
H
5
S–SC
2
H
5
293 (С
6
Н
5
)
2
СН–СН(С
6
Н
5
)
2
159
Примечание. Сокращения: и — изо; т — третичный; ц — циклический.
563
7. Энергия разрыва углерод-углеродной связи в молекулах всех клас-
сов углеводородов всегда ниже энергии С–Н-связи (примерно на
50 кДж/моль).
8. В молекулах алканов длина, строение цепи и местоположение раз
-
рываемой связи оказывают влияние на энергию разрыва углерод-
углеродной связи качественно аналогично влиянию их на прочность
С–Н-связи. Так, связь между крайними углеродными атомами
ослабляется по мере увеличения числа углеродных атомов (от
360
для этана до 335
кДж/моль для пентана и выше), а связь между внут-
ренними углеродными атомами — по мере приближения к середине
цепи (до
310 кДж/моль). Например, энергия разрыва связи С–С
в молекуле
н-октана в зависимости от ее местоположения изменяет-
ся следующим образом: 335; 322; 314; 310; 314; 322; 335
кДж/ моль.
9. Связи между первичными атомами углерода всегда прочнее, чем
С–С-связи в комбинациях с первичным, вторичным (С
вт
) и третич-
ным (С
ТР
) атомами углерода. Энергия разрыва углерод-углеродной
связи (DС–С) уменьшается в следующей последовательности:
D
C–C
> D
C–C
ВТ
> D
C– C
TP
>D
C
BT
–C
BT
> D
C
BT
–C
TP
> D
C
TP
–C
TP
10. В алкенах углерод-углеродные двойные связи значительно проч
-
нее (но менее чем в 2 раза), чем С–С-связи в алканах. Так, энер
-
гия разрыва С=С-связи в этилене составляет
500 кДж/моль. Од-
нако С–С-связи, сопряженные с двойной (т. е. находящиеся к ней
в 3-положении), значительно слабее С–С-связи в алканах.
11. Энергия разрыва углерод-углеродной связи в кольце циклопентана
(293
кДж/моль) и циклогексана (310 кДж/моль) несколько меньше
С–С-связи в середине цепи нормального гексана (318
кДж/ моль).
12. В алкилароматических углеводородах углерод-углеродная связь,
сопряженная с ароматическим кольцом (С–С
АР
), менее прочна,-
чем связь С–С в алканах. Сопряжение с ароматическим кольцом
снижает прочность углерод-углеродной связи приблизительно
в такой жестепени, как и сопряжение с двойной связью. Сопря
-
жение с несколькими бензольными кольцами снижает прочность
С–С-связи еще больше.
13. Энергия разрыва атомов водорода в молекуле водорода (диссоциа
-
ции) несколько выше С–Н-связи в наиболее термостойком метане
и составляет 435 кДж/моль.
14. По прочности связь в меркаптанах и связь S–S в дисульфидах со
-
поставима со связью С–С в алканах.

564
Очевидно, что при термолизе углеводородного сырья будут разры-
ваться в первую очередь наиболее слабые связи и образовываться про
-
дукты преимущественно с меньшей свободной энергией образования.
Таким образом, термодинамический анализ позволяет прогнозировать
компонентный состав и подсчитать равновесные концентрации ком
-
понентов в продуктах реакций в зависимости от условий проведения
термических, а также каталитических процессов. Однако компонент
-
ный состав и концентрации продуктов химических реакций в реальных
промышленных процессах не всегда совпадают с результатами термо
-
динамических расчетов.
При проектировании, математическом моделировании, оптими
-
зации, научных исследованиях и решении проблем интенсификации
химико-технологических процессов принято пользоваться кинетичес-
кими закономерностями химических реакций.
Не следует противопоставлять химическую кинетику и химическую
термодинамику. На основе термодинамических закономерностей про
-
ектировщик, инженер или исследователь устанавливает в целом наибо
-
лее благоприятную, с точки зрения выхода целевого продукта, область
протекания химических реакций. Химическая же кинетика позволяет
в термодинамически разрешенной области рассчитать концентрации
(не равновесные, а кинетические) продуктов реакций, материальный
баланс, геометрические размеры реакционных аппаратов и оптимизи
-
ровать технологические параметры процессов.
5.2.2. Основные положения механизма термических реакций
нефтяного сырья
На основании многочисленных исследований, проведенных в нашей
стране и за рубежом почти за столетний период, в настоящее время
общепризнано, что:
— в основе процессов термолиза нефтяного сырья лежат реакции кре
-
кинга (распада) и поликонденсации (синтеза), протекающие через
ряд промежуточных стадий по радикально-цепному механизму;
— в реакциях крекинга ведущими являются короткоживущие радика
-
лы алкильного типа, а поликонденсации — долгоживущие бензиль
-
ные или фенильные радикалы.
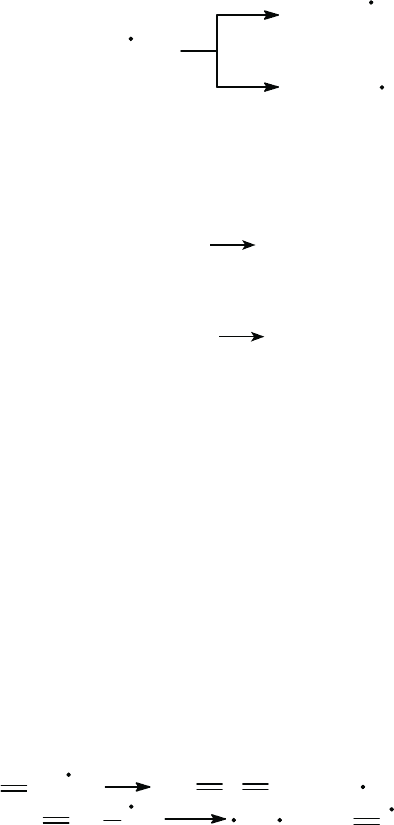
Свойства и реакции радикалов
. Радикалы, имеющие неспаренные
(свободные) электроны, образуются при гомолитическом распаде угле
-
водородов преимущественно путем разрыва менее прочной С–С-связи:
C
2
H
6
2CH
3
, а также С–Н-связи:
C
2
H
6
H + C
2
H
5
.
565
Гомолитический распад молекул энергетически значительно выгод-
нее, чем гетеролитический с образованием заряженных ионов.
Радикалы, являясь химически ненасыщенными частицами, облада
-
ют исключительно высокой реакционной способностью и мгновенно
вступают в различные реакции.
Радикалы высокой молекулярной массы термически малостабильны
и распадаются с образованием низкомолекулярного более устойчивого
радикала, в том числе водородного:
C
5
H
11
C
4
H
8
+ CH
3
C
5
H
10
+ H
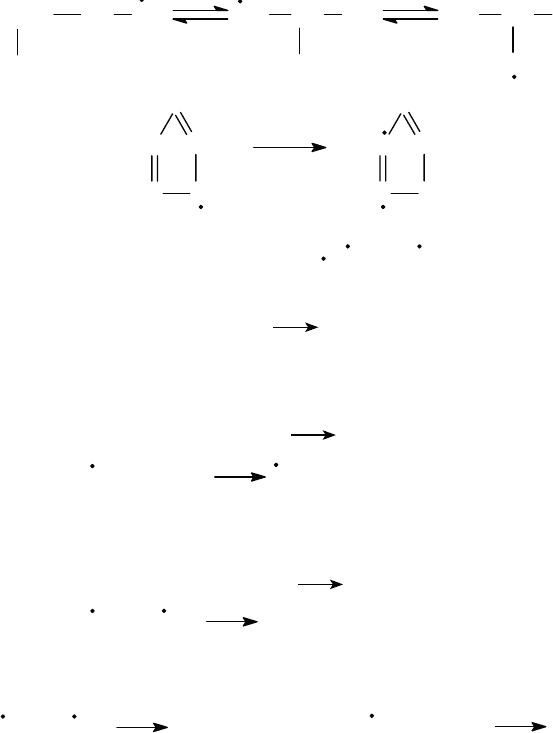
При термолизе протекают следующие типы реакций радикалов.
Мономолекулярные реакции распада могут быть двух типов с об
-
разованием:
1) монорадикала и молекулы с двойной связью
R• A + R•' ;
2) бирадикала:
R• •R•'' .
Из двух типов реакций энергетически более выгоден распад 1-го
типа. Бирадикалы при дальнейшем распаде образуют только молекулы
с двойной связью и далее не участвуют в цепных реакциях термолиза.
Распад радикалов с образованием водородного радикала энергети
-
чески менее выгоден, чем образование алкильного радикала.
Если распад радикала возможен по двум путям с образованием
в обоих случаях олефина и алкильного радикала, то энергетически бо
-
лее выгоден распад с образованием большего радикала. С перемещени
-
ем свободной валентности ближе к центру радикала возрастает энергия,
необходимая для его распада.
Наиболее вероятные направления радикалов – требующие наимень
-
шей энергии активации. Легче всего происходит распад С–С-связи
в β-положении к углероду, имеющему неспаренный электрон.
При распаде алкильных радикалов энергетически значительно вы
-
годнее образование алкадиенов и водородного радикала
CH
2
CHCH
2
CH
2
C
CH
2
+ H
, чем образование бира-
дикала
CH
2
CH CH
2
CH
2
+
CH
CH
2
.
566
Распад нафтенового радикала с наибольшей скоростью проходит
с раскрытием кольца, а не с отрывом водорода с кольца.
Бензильные радикалы малоактивны в реакциях распада, они склон
-
ны главным образом к реакциям рекомбинации и поликонденсации.
Реакции изомеризации
. В процессах термолиза углеводородов мо-
гут происходить, кроме распада, и реакции структурной и скелетной
изомеризации радикалов:
CH
3
CH CH
2
CH
2
CH CH
3
CH
3
CH CH
3
CH
3
CH
3
CH
2
CH
2
H
2
C
CH
HC
CH
CH
HC
CH
HC
CH
2
Реакции замещения представляют собой по существу обмен ато-
мом водорода между радикалом (
H
, CH
3
и С
2
H
5
) (присоединяет)
и молекулой углеводорода (отдает):
R• + R'H RH + R•'.
Реакции присоединения имеют место при взаимодействии радикала
с молекулой, имеющей двойную (т. е.
π) связь:
R• + CH
2
= CH–R' R–CH
2
–CH–R'
(например,
C
2
H
5
+ C
2
H
4
C
4
H
9
).
Реакция рекомбинации обратна реакции мономолекулярного рас
-
пада молекулы на радикалы:
R• + R•' RR'
(например,
CH
3
+ C
2
H
5
CH
8
).
Реакция диспропорционирования радикалов является обратной
(обратимой) по отношению к реакции бимолекулярного их образования:
CH
3
+ C
2
H
5
CH
4
+ C
2
H
4
, или
C
2
H
5
+ C
2
H
4
C
2
H
6
2
.
Цепные реакции
. Первичной реакцией термолиза нефтяного сы-
рья является образование первичного радикала в результате мономо
-
лекулярного распада или бимолекулярного взаимодействия молекул
углеводородов.

567
Концентрация радикалов в реакционной системе обычно невелика,
и вероятность их столкновения между собой ничтожно мала. При термо
-
лизе более значительно преобладают взаимодействия между радикалом
и молекулами исходного сырья. Поскольку радикал имеет свободный
неспаренный электрон, то его реакция с молекулами, все электроны ко
-
торых спарены, должна в силу принципа неуничтожимости свободной
валентности привести к образованию нового вторичного радикала. Если
последний не является малоактивным, то он, в свою очередь, вступит
в реакцию с новой молекулой сырья и т. д.
Так как число радикалов, могущих образоваться при термолизе, ве
-
лико, на некоторой стадии образуется радикал, принимавший участие
в одной из предыдущих стадий, и возникает регулярное чередование
двух или более последовательно параллельных элементарных реакций
с образованием конечных продуктов. Этот процесс продолжится до
тех пор, пока радикал не «погибнет» в результате реакций рекомбина
-
ции или диспропорционирования. Реакции такого типа называются
цепными
.
Первичная элементарная реакция с образованием первичного ра
-
дикала из молекул сырья называется реакцией инициирования цепи
.
Реакции превращения одних радикалов в другие, при которых рас
-
ходуется сырье, называются реакциями продолжения цепи. Реакции,
при которых радикалы гибнут, превращаясь в стабильные молекулы
в результате рекомбинации, диспропорционирования или образования
малоактивного радикала, называются реакциями обрыва цепи.
Обрыв цепи может произойти также при добавлении или в при
-
сутствии в сырье веществ —
ингибиторов, которые приводят к замене
активных радикалов на малоактивные, не способные к продолжению
цепи.
Совокупность элементарных реакций продолжения цепи, повторе
-
ние которых дает цепной процесс, называют звеном цепи. В результа
-
те реакций обрыва цепи на каждый радикал, инициирующий цепной
процесс, приходится некоторое конечное число звеньев, называемое
длиной цепи.
Рассмотрим в качестве иллюстрации термический распад нормаль
-
ного пентана.
Инициирование цепи:
C
5
H
12
CH
3
+ C
4
H
9
C
2
H
5
+ C
3
H
7
H + C
5
H
11
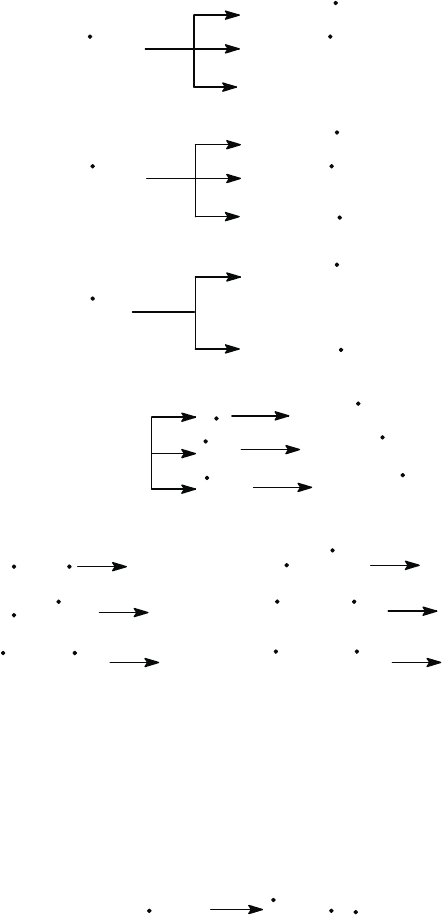
568
Распад высокомолекулярных алкильных радикалов:
C
5
H
11
C
3
H
6
+ C
2
H
5
C
2
H
4
+ C
3
H
7
H + C
5
H
11
C
4
H
9
C
3
H
6
+ CH
3
C
2
H
4
+ C
2
H
5
C
4
H
8
+ H
C
3
H
7
C
2
H
4
+ CH
3
C
3
H
6
+ H
C
5
H
12
CH
3
+ C
4
H
9
C
2
H
5
+ C
3
H
7
C
4
H
8
+ CH
3
Продолжение цепи:
C
5
H
12
H
C
2
H
5
C
2
H
6
+ C
5
H
11
H
2
+ C
5
H
11
CH
4
+ C
5
H
11
CH
3
+
Обрыв цепи:
H + H H
2
H + C
2
H
5
C
2
H
6
CH
3
+ C
2
H
5
C
3
H
8
H + CH
3
CH
4
CH
3
+ CH
3
C
2
H
6
C
2
H
5
+ C
2
H
5
C
4
H
10
В процессе термолиза пентана протекают также реакции изомери-
зации, циклизации и далее поликонденсации с образованием высоко
-
молекулярных ароматизированных продуктов.
Разветвленные цепные реакции — разновидность цепных реакций,
в которых превращение активных промежуточных продуктов приво
-
дит к увеличению числа свободных радикалов. Например, одной из
элементарных стадий окисления водорода является реакция
H + O
2
OH + O
В этой реакции вместо одной свободной валентности у атома водо-
рода образуются три новые свободные валентности — одна у гидрок
-
сила и две (т. е. бирадикал) у атома кислорода. Последующая реакция
569
бирадикала кислорода с молекулой водорода приводит к образованию
двух новых свободных монорадикалов:
O + H
2
OH + H
Таким образом, одна цепь как бы разветвляется на три, откуда
и происходит термин «разветвление». Примером такого механизма раз
-
ветвления цепей являются кроме горения водорода реакции с участием
перекисей углеводородов, например детонационное горение автобен
-
зинов.
5.2.3. Химизм газофазного термолиза нефтяного сырья
Термолиз алканов приводит преимущественно к образованию бо
-
лее термостойких низкомолекулярных алкенов и алканов. Из алканов
наибольшей термостабильностью обладает метан. Его термическая де
-
струкция термодинамически возможна при температуре выше
560 °С.
С заметной скоростью распад метана протекает при температуре выше
1000 °С. Высокая термостабильность метана объясняется тем, что в его
молекуле отсутствуют связи С–С, энергия разрыва которых меньше,
чем для связей С–Н. При высокотемпературном пиролизе метана кроме
водорода (и пироуглерода) образуются этилен, этан, ацетилен и арены.
Синтез этих продуктов можно выразить следующей схемой:
2CH
4
H
2
+ 2CH
3
2H
2
+ CH
2
3H
2
+ 2CH 4H
2
+ 2
C
C
2
H
6
C
2
H
2
C
2
H
4
Ароматические углеводороды образуются в результате вторичных
реакций синтеза из ацетилена и этилена.
Этан менее устойчив, чем метан: его деструкция начинается при тем
-
пературе –500 °С
. При пиролизе этана образуются преимущественно
этилен и водород, а также метан и жидкие продукты, богатые аренами
и алкенами.
Пропан и бутан термически менее устойчивы, чем этан. Пропан на
-
чинает разлагаться при 460 °С, а н-бутан и изобутан — около 435 °С.
Основные направления пиролиза пропана:
C
3
H
8
C
2
H
4
+ CH
4
C
3
H
6
+ H
2
1/2CH
4
+ 1/2C
2
H
6
+ 1/2C
3
H
6

570
Все другие продукты пиролиза пропана (бутадиен, ацетилен, аро-
матические углеводороды и др.) являются, несомненно, продуктами
вторичного происхождения.
Начиная с бутана, при термолизе алканов преобладающим становится
распад по связи С–С. Относительная скорость их термолиза возрастает
с увеличением молекулярной массы, что обусловливается уменьшени
-
ем энергии разрыва С–С-связей по мере приближения к середине цепи
и увеличения степени разветвленности молекул.
В процессе пиролиза
н-бутана преобладают следующие две реакции
его распада:
C
4
H
10
C
2
H
4
+ C
2
H
6
C
3
H
6
+ CH
4
Характерно, что чем выше температура пиролиза бутана, тем больше
отодвигается место его распада по С–С-связи к краю молекулы. На это
указывает непрерывное возрастание содержания метана в газообразных
продуктах реакции вплоть до 900 °С. Аналогичные реакции распада ха
-
рактерны для термолиза более высокомолекулярных алканов. Для них
при умеренных температурах (400
…500 °С) наблюдается симметричный
разрыв молекулы с образованием олефина и парафина приблизитель
-
но одинаковой молекулярной массы. При более высоких температурах
в продуктах их термолиза обнаруживаются низшие алканы и высокомо
-
лекулярные алкены и арены, вероятно, как результат вторичных реакций.
Алкены характеризуются ввиду наличия двойной связи высокой ре
-
акционной способностью в реакциях присоединения, но повышенной,
по сравнению с алканами, термостойкостью в отношении реакций рас
-
пада. Этилен из алкенов наиболее устойчивый. Он всегда содержится
в продуктах термолиза нефтяного сырья как первичный и вторичный
продукт их превращений. По термической стабильности он занимает
промежуточное положение между метаном и этаном. Термический рас
-
пад этилена заметно начинается при температуре 660 °С. При 400
…600 °С
в основном протекает его полимеризация:
2C
2
H
4
C
4
H
8
В тех же условиях в продуктах пиролиза этилена содержатся высоко-
молекулярные олефины — продукт сополимеризации бутиленов с эти
-
леном. При температурах 600 °С и выше в продуктах термолиза этилена
появляются бутадиен и водород в результате дегидрирования бутена-1.
