Журнал - Проблемы криобиологии 2009 №3
Подождите немного. Документ загружается.

251
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
их объёмом [6]. Установлено, что действие детер-
гентов обусловлено способностью связываться
гидрофобными связями с белковыми компонен-
тами мембраны [4]. За счет такого встраивания
детергентов разрушается связь между компонен-
тами мембраны и, в конечном итоге – биомембра-
ны солюбилизируются. Осмотическое действие
как фактор, способный резко повышать устойчи-
вость эритроцитов к охлаждению и переносу в ги-
пертонические растворы, связан с усилением гид-
рофобных связей в мембране [6]. Поэтому осмоти-
ческое действие препятствует возникновению пов-
реждений, вызванных детергентами, в среде, со-
держащей 0,5 М сахарозы, 0,15 М NaCl (рис. 2) [6].
Кривые гемолиза с Тритон Х-100 и Твин-20 (см.
рис. 1, б, г) имеют более сглаженный вид по срав-
нению с данными лизиса в присутствии ДСН и
ЦТАБ (см. рис. 1, а, в). Это свидетельствует о том,
что ДСН и ЦТАБ оказывают более значительное
действие на мембраны эритроцитов, чем Тритон
Х-100 и Твин-20. Различная интенсивность пов-
реждающего действия обусловлена характером
действия на мембрану ионных и неионных детер-
гентов. Неионные детергенты (Твин-20,Тритон Х-
100) приводят к разрыву белково-липидных связей,
не повреждая белковые компоненты мембраны
[15]. Ионные детергенты действуют не только на
границе белок-липид, но и вызывают денатурацию
самих белков [15].
Осмотический лизис сопровождается модифи-
кациями в мембране, связанными с изменениями
структуры белка полосы 3 [16]. В нашей работе
был использован ДИДС – модификатор белка по-
лосы 3 [17].
Связывание ДИДС с мембраной приводит к на-
рушению связей цитоскелета с белком полосы 3
[16], что снижает защитный эффект осмотического
действия на предварительных этапах инкубации
клеток. Известно, что при связывании ДИДС с
белком полосы 3 увеличивается площадь контак-
тов данного белка с липидными компонентами
мембраны. Это является причиной увеличения ко-
личества поврежденных клеток при воздействии
на детергентный лизис модификатора ДИДС [17].
При связывании с мембранами эритроцитов
ДИДС вызывает диссоциацию тетрамеров белка
полосы 3 на димеры [17], что способствует ослаб-
лению взаимодействия цитоскелета с мембраной.
Такое влияние приводит к усилению действия
ионных детергентов (как в случае с ЦТАБ и ДСН),
которые солюбилизируют мембранные белки [14].
Однако при увеличении площади контактов белок-
липид [14] действие неионных детергентов (Твин-
20, Тритон Х-100) на мембрану ослабляется.
Поэтому влияние ДИДС на лизис с ЦТАБ и ДСН
(рис. 2, а, в) проявляется в большей степени, чем
into dimers [17], contributing to the weakening of
cytoskeletal interaction with membrane. Such an effect
results in strengthening of ion detergent effect (as in
case with CTAB and SDS), which solubilise membrane
proteins [14]. However when increasing the area of
protein-lipid contacts [14] the effect of non-ionic deter-
gents (Tween 20, Triton X-100) on membrane is
weakened. Therefore the DIDS effect on lysis with
CTAB and SDS (Fig. 2, a, c) is manifested in a greater
extent, than on a detergent one, caused by Tween 20
and Triton X-100 (Fig. 2, b, d).
The results obtained enable suggesting an osmotic
factor at preliminary stages before different detergents
effect as contributing to an increase in erythrocyte
resistance, by strengthening the interaction of cyto-
skeleton with band 3 protein. This proves the correct-
ness of the approach to search the way for cell resis-
tance increase by modifying their states at preliminary
incubation stages.
Conclusions
The medium, containing 0.15 M NaCl; 0.5 M suc-
rose protectively affects erythrocytes under detergent
lysis, caused by both ionic and non-ionic detergents.
DIDS presence in the medium results in a rise of
cell sensitivity to detergent effect and reduces the
erythrocyte integrity under osmotic effect.
Modifier DIDS is capable in a different extent to
strengthen the erythrocyte sensitivity to ionic and non-
ionic detergents.
References
Belous A.M., Grischenko V.I. Cryobiology.– Kiev: Naukova
dumka, 1994.– 331 p.
Bogatov V.V. DNA and RNA isolation for pharmacy. Methods
for DNA and RNA isolations, envisaged in terms of industrial
pharmacy // Bull. Eksp. Biol. Med.– 1983.– Vol. 50, N4.– P. 41–47.
Bondarenko V.A., Bondarenko T.P., Rudenko S.V. Dehydration
effects in controlling the cold and osmotic sensitivity of cells //
Problems of Cryobiology.– 1992.– N4.– P. 14–25.
Introduction into biomembranology: Manual / Ed. by A.A. Bol-
dyrev.– Moscow: Publishing House of Moscow State Univer-
sity, 1990.– P. 87–98.
Idiyatullin Z.Sh., Arkhipov V.P., Babkina Ya.A., Ryzhkina I.S.
Study of aggregation behaviour of aminomethylated phenols
and calix(4)resorcinarenes in DMFA-CTAB medium by NMR
FT PMFG method // Chemistry and Computational Stimulation.
Butlerov Communications.– 2002.– N6, suppl.– [web site]
http://chem.kstu.ru/butlerov_comm/vol2/cd-a3/data/
jchem&cs/russian/n6/appl6/yal2001/1sdms97/1sdms97.htm
(15.09.2008).
Pozdnyakov V.V., Bondarenko V.A. Volume shift as the factor,
controlling erythrocyte osmotic resistance in solutions of low
molecular cryoprotectants // Physico-chemical and biological
effect of cryoprotectants.– Kiev: Naukova dumka, 1990.–
P. 115–123.
Ramazanov V.V., Bondarenko V.A. Cryoprotectant effect on
erythrocyte resistance to detergents under band 3 protein
aggregate state modification stress // Problems of Cryo-
biology.– 2007.– Vol. 17, N4.– P. 335–345.
1.
2.
3.
4.
5.
6.
7.
252
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
на детергентный лизис, вызванный Твин-20 и
Тритон Х-100 (рис. 2, б, г).
Полученные результаты позволяют предпо-
ложить, что осмотический фактор на предвари-
тельных этапах перед действием различных видов
детергентов способствует повышению устойчи-
вости эритроцитов, усиливая взаимодействия
цитоскелета с белком полосы 3. Это доказывает
правильность подхода к поиску пути повышения
устойчивости клеток посредством модификации их
состояний на предварительных этапах инкубации.
Выводы
Среда, содержащая 0,15М NaCl; 0,5М сахарозы,
оказывает защитное действие на эритроциты при
детергентном лизисе, вызванном как ионными, так
и неионными детергентами.
Присутствие в среде ДИДС приводит к повыше-
нию чувствительности клеток к действию детер-
гентов и уменьшает сохранность эритроцитов при
осмотическом воздействии.
Модификатор ДИДС в разной мере способен
усиливать чувствительность эритроцитов к ионным
и неионным детергентам.
Ramazanov V.V. Effect of osmotic stress and cytoskeletal
modifiers on development of cold and hypertonic stress of
erythrocytes: Thesis of candidate of biol. sciences.– Kharkov,
1993.– P. 100.
Chernitsky E.A., Vorobey A.B. Structure and function of
erythrocyte membranes.– Minsk: Nauka i tekhnika, 1981.–
216 p.
Kragh-Hansen U., le Maire M., Moller J.V. The mechanism of
detergent solubilization of liposomes and protein-containing
membranes // Biophys. J.– 1998. –Vol. 75, N6.– Р. 2932–2946.
le Maire M., Champeil P., Moller J.V. Interaction of membrane
proteins and lipids with solubilizing detergents // Biochim.
Biophys. Acta.– 2000.– Vol. 1508, N1–2.– P. 86–111.
le Maire M., Kwee S., Andersen J.P., Moller J.V. Mode of
interaction of polyoxyethyleneglycol detergents with mem-
brane proteins // Eur. J. Biochem.– 1983.– Vol. 129, N3.–
P. 525–532.
Lukacovic M.F., Feinstein M.B., Shaafi R.I., Perrie S.
Purification of stabilized band 3 protein of the human erythro-
cyte membrane and its reconstitution into liposomes // Bioche-
mistry.–1981.– Vol. 20, N11.– P. 3145–3151.
Macarulla J.M., Alonso A., Arrondo J.L. et al. Membrane
solubilization by the non-ionic detergent triton X-100. A
comparative study including model and cell membranes //
Rev. Esp. Fisiol.– 1989.– Vol. 45.– P. 1–8.
Matson R.S., Goheen S.C. Use of high-performance size
exclusion chromatography to determine the extent of deter-
gent solubilization of human erythrocyte ghosts // J. Chro-
matogr.– 1986.– Vol. 359.– P. 285–295.
Sato Y., Yamakose H., Suzuki Y. Participation of band 3 in hy-
potonic hemolysis of human erythrocytes // Biol. Pharm. Bull.–
1993.– Vol. 16, N2.– P. 188–194.
Van Dort H.M., Knowless D.W., Chasis J.A. et al. Analysis
of integral membrane protein contributions to the deformability
and stability of the human erythrocyte membrane // J. Biol.
Chem. Chem.– 2001.– Vol. 276, N50.– P. 46968–46974.
Van Dort H.M., Moriyama R., Low P.S. Effect of band 3
subunit equilibrium on the kinetics and affinity of ankyrin
binding to erythrocyte membrane vesicles // J. Biol. Chem.–
1998.–Vol. 273, N24.– P. 14819–14826.
Walter A., Kuehl G., Barnes K., Van der Waerdt G. The
vesicle to micelle transition of phosphatildylcholine vesicle
induced by nonionic detergents: effects of sodium chloride,
sucrose and urea // Biochim. Biophys. Acta.– 2000.– Vol.
1508, N1–2.– P. 20–33.
Womack M.D., Kendal D.A., Macdonald R.C. Detergent
effects on enzyme activity and solubilization of lipid bilayer
membranes // Biochim. Biophys. Acta.– 1983.– Vol. 733, N2.–
P. 210–215.
Yegutkin G.G. Effects of increasing concentration of nonionic
detergent triton X-100 on solubilization and structure of rat
liver and adipose plasma membranes // Membr. Cell. Biol.–
1997.– Vol. 10, N5.– P. 515–520.
Accepted in 18.11.2008
Литература
Белоус А.М., Грищенко В.И. Криобиология.– Киев: Наук.
думка, 1994.– 431 с.
Богатов В.В. Выделение ДНК та РНК для фармации //
Труды Одес. политехн. ун-та.– 1998.– №1(5).– С. 41-47.
Бондаренко В.А., Бондаренко Т.П., Руденко С.В. Эффекты
дегидратации в контроле холодовой и осмотической
чувствительности клеток // Пробл. криобиологии.–
1992.– №4.– С. 14–25.
Введение в биомембранологию: Учеб. пособие / Под ред.
А.А. Болдырева.– М.: Изд-во МГУ, 1990. – С.87–98.
Идиятуллин З.Ш., Архипов В.П., Бабкина Я.А., Рыжкина И.С.
Исследование агрегационного поведения аминометили-
рованных фенолов и каликс(4)резорциноренов в среде
вода-ДМФА-ЦТАБ методом ЯМР ФП ИГМП [Электронный
ресурс] // Химия и компьютерное моделирование.
Бутлеровские сообщения.– 2002.– №6, приложение.–
[web-сайт] http://chem.kstu.ru/butlerov_comm/vol2/cd-a3/
data/jchem&cs/russian/n6/appl6/yal2001/1sdms97/
1sdms97.htm (15.09.2008).
Поздняков В.В., Бондаренко В.А. Объёмный сдвиг как
фактор, контролирующий осмотическую устойчивость
эритроцитов в растворах низкомолекулярных криопро-
текторов // Физико-химическое и биологическое
действие криопротекторов: Сб. науч. трудов.– Киев:
Наук. думка, 1990.– С. 115–123.
Рамазанов В.В., Бондаренко В.А. Влияние криопротек-
торов на устойчивость эритроцитов к детергентам при
модификации агрегатного состояния белка полосы 3 //
Пробл. криобиологии.– 2007.– Т. 17, №4.– С. 335–345.
Рамазанов В.В. Влияние осмотического стресса и
модификаторов цитоскелета на развитие холодового и
гипертонического шока эритроцитов: Дис. ... канд. биол.
наук.– Харьков, 1993.– 138 с.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
1.
2.
3.
4.
5.
6.
7.
8.
253
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
Черницкий Е.А., Воробей А.Б. Структура и функция
эритроцитарных мембран.– Минск: Наука и техника,
1981.– 216 c.
Kragh-Hansen U., le Maire M., Moller J.V. The mechanism of
detergent solubilization of liposomes and protein-containing
membranes // Biophys. J.– 1998. –Vol. 75, N6.– Р. 2932–2946.
le Maire M., Champeil P., Moller J.V. Interaction of membrane
proteins and lipids with solubilizing detergents // Biochim.
Biophys. Acta.– 2000.– Vol. 1508, N1–2.– P. 86–111.
le Maire M., Kwee S., Andersen J.P., Moller J.V. Mode of
interaction of polyoxyethyleneglycol detergents with mem-
brane proteins // Eur. J. Biochem.– 1983.– Vol. 129, N3.–
P. 525–532.
Lukacovic M.F., Feinstein M.B., Shaafi R.I., Perrie S.
Purification of stabilized band 3 protein of the human erythro-
cyte membrane and its reconstitution into liposomes // Bioche-
mistry.–1981.– Vol. 20, N11.– P. 3145–3151.
Macarulla J.M., Alonso A., Arrondo J.L. et al. Membrane
solubilization by the non-ionic detergent triton X-100. A
comparative study including model and cell membranes //
Rev. Esp. Fisiol.– 1989.– Vol. 45.– P. 1–8.
Matson R.S., Goheen S.C. Use of high-performance size
exclusion chromatography to determine the extent of deter-
gent solubilization of human erythrocyte ghosts // J. Chro-
matogr.– 1986.– Vol. 359.– P. 285–295.
Sato Y., Yamakose H., Suzuki Y. Participation of band 3 in hy-
potonic hemolysis of human erythrocytes // Biol. Pharm. Bull.–
1993.– Vol. 16, N2.– P. 188–194.
Van Dort H.M., Knowless D.W., Chasis J.A. et al. Analysis
of integral membrane protein contributions to the deformability
and stability of the human erythrocyte membrane // J. Biol.
Chem. Chem.– 2001.– Vol. 276, N50.– P. 46968–46974.
Van Dort H.M., Moriyama R., Low P.S. Effect of band 3
subunit equilibrium on the kinetics and affinity of ankyrin
binding to erythrocyte membrane vesicles // J. Biol. Chem.–
1998.–Vol. 273, N24.– P. 14819–14826.
Walter A., Kuehl G., Barnes K., Van der Waerdt G. The
vesicle to micelle transition of phosphatildylcholine vesicle
induced by nonionic detergents: effects of sodium chloride,
sucrose and urea // Biochim. Biophys. Acta.– 2000.– Vol.
1508, N1–2.– P. 20–33.
Womack M.D., Kendal D.A., Macdonald R.C. Detergent
effects on enzyme activity and solubilization of lipid bilayer
membranes // Biochim. Biophys. Acta.– 1983.– Vol. 733, N2.–
P. 210–215.
Yegutkin G.G. Effects of increasing concentration of nonionic
detergent triton X-100 on solubilization and structure of rat
liver and adipose plasma membranes // Membr. Cell. Biol.–
1997.– Vol. 10, N5.– P. 515–520.
Поступила 18.11.2008
Рецензент О.И. Гордиенко
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.

254
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
* Автор, которому необходимо направлять корреспонденцию:
ул. Гаджиева, 43а, г. Махачкала, Республика Дагестан,
Российская Федерация, 367001; тел.: +7-88722-67-59-15
электронная почта: klich-khan@mail.ru
* To whom correspondence should be addressed: 43a, Gadgiyev
str., Makhachkala, Republic of Dagestan, Russian Federation,
367027; tel.: +7 88722 67 5915; e-mail: klich-khan@mail.ru
Dagestan State University, Makhachkala, RussiaДагестанский государственный университет, г. Махачкала
УДК 591.111.05
М.Д. АСТАЕВА, В.Р. АБДУЛЛАЕВ, Н.К. КЛИчХАНОВ*
Влияние гипотермии на интенсивность окислительной модификации
белков плазмы крови сусликов
UDC 591.111.05
M.D. ASTAEVA, V.P. ABDULLAEV, N.K. KLICHKHANOV*
Influence of Hypotermia on Intensity of Oxidative Modification of
Ground Squirrels’ Blood Plasma Proteins
Исследовали влияние искусственной гипотермии разной глубины на интенсивность окислительной модификации белков
плазмы и активность антиокислительной системы крови сусликов в активный летний период. Показано, что гипотермия при 20
и 10°С по-разному влияет на интенсивность окислительной модификации белков плазмы. При гипотермии, независимо от ее
глубины, выявлено повышение устойчивости белков плазмы крови к оксидантам. При низких температурах тела обнаружено
существенное повышение активности гидрофильных антиоксидантов в плазме крови, что может играть важную роль в защите
белков от окислительного повреждения.
Ключевые слова: белки плазмы крови, окислительная модификация, антиокислительная активность, кровь, суслики.
Досліджували вплив штучної гіпотермії різної глибини на інтенсивність окислювальної модифікації білків плазми та
активність антиокислювальної системи крові ховрашків в активний літній період. Показано, що гіпотермія при 20 і 10°С по-
різному впливає на інтенсивність окислювальної модифікації білків плазми. При гіпотермії, незалежно від її глибини, виявлено
підвищення стійкості білків плазми крові до оксидантів. При низьких температурах виявлено істотне підвищення активності
гідрофільних антиоксидантів в плазмі крові, що може відігравати важливу роль у захисті білків від окислювального
пошкодження.
Ключові слова: білки плазми крові, окислювальна модифікація, антиокислювальна активність, кров, ховрашки.
The effect of artificial hypothermia of various depths on intensity of oxidative modification of plasma proteins and activity of
antioxidant system of ground squirrel blood during active summer time were studied. It has been shown that hypothermia at 20 and
10°C differently affects the intensity of oxidative modification of plasma proteins. Under hypothermia independently of its depth the
increase of protein resistance of blood plasma to oxidants has been revealed. At low temperatures of body the significant increase of
hydrophil antioxidants’ activity in blood plasma is found that may play an important role in protection of proteins from oxidative
damage.
Key-words: proteins of blood plasma, oxidative modification, antioxidative activity, blood, ground squirrels.
Стрессорные и экстремальные состояния у мле-
копитающих стимулируют образование активных
форм кислорода (АФК) в тканях, что приводит к
окислительному повреждению клеток, перекисно-
му окислению липидов, окислительной модифика-
ции белков и других макромолекул [6]. Белки,
вследствие особенностей их структуры и разнооб-
разия аминокислотных радикалов, особенно чувст-
вительны к повреждающему действию АФК [4].
Зимняя спячка (гибернация) – это закрепленная
в ходе эволюции уникальная способность к миними-
зации жизненных функций организма, позволяющая
ряду видов млекопитающих в течение многих
месяцев переживать холод, бескормицу, сокраще-
ние светлого периода суток [7]. Важным аспектом
спячки мелких грызунов является ее прерывис-
тость. Спячка мелких грызунов, например сус-
ликов, состоит из баутов (торпидное состояние),
которые могут длиться от нескольких дней до двух
недель [13]. Полагают, что в связи с резким изме-
Stress and extreme states in mammals stimulate
the formation of reactive oxygen species (ROS) in tis-
sues which result in oxidative damage of cells, lipid
peroxidation, oxidative modification of proteins and
other macromolecules [6]. Proteins due to peculiarities
of their structure and variety of aminoacid radicals, are
especially sensitive to damaging action of ROS [4].
Hibernation is a fixed during evolution unique ability
to minimize living functions of an organism, enabling
variety of mammalian species to survive against cold,
lack of fodder and reduction of day light time during
many months [7]. The important aspect of small
rodents’ hibernation is its discontinuity. Hibernation of
small rodents, for example ground squirrel, consists of
bauts (torpid state), which may last from several days
up to two weeks. There is a suggestion that due to a
sharp change of perfusion rate the hibernators’ tissues
are exposed to a risk of ischemic damage and oxidative
stress during entering and leaving the torpid state [15].
During entering into a torpid state the heart rate and
255
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
нением скорости перфузии ткани гибернаторов
подвергаются риску ишемического повреждения
и окислительного стресса при входе и выходе из
торпидного состояния [15]. При входе в торпидное
состояние частота сердечных сокращений и сер-
дечный выброс падают до того, как значительно
снизится температура тела. Это приводит к сниже-
нию перфузии тканей в тех областях, где скорости
биохимических процессов остаются на эутермном
уровне. Способность переносить резкие перепады
энергетического обмена и интенсивности свобод-
норадикальных процессов (СРП) в динамике зим-
ней спячки является одним из главных элементов
зимней спячки как адаптации [14]. Вместе с тем
неизвестно, адаптированы ли гибернаторы к изме-
нению интенсивности метаболизма вне периода
зимней спячки.
Цель работы – исследовать содержание окисли-
тельно-модифицированных белков и активность
антиокислительной системы крови сусликов при
искусственной гипотермии различной глубины в пе-
риод их летнего бодрствования.
Материалы и методы
Исследования проводили на малых сусликах
Spermophilus pygmaeus Pall. с массой тела 250–
300 г. До опытов животные находились в условиях
вивария на стандартном пищевом рационе. Для
изучения влияния гипотермии сусликов подвергали
охлаждению в специальных холодовых камерах, в
рубашках которых циркулировала холодная вода
(3–4°С). Температуру тела сусликов снижали рав-
номерно, так что за 55–60 мин она достигала 20°С,
а за 90–100 мин – 10°С. Контролем служили бодр-
ствующие летом животные.
Степень окислительной модификации белков
(ОМБ) плазмы крови определяли по количеству
карбонильных групп, реагирующих с 2,4-динитро-
фенилгидразином [19]. При этом определяли исход-
ный уровень карбонильных групп, а также их
накопление в модельной системе в течение 15 мин
при 37°С в присутствии 10
-3
М Fe
2+
, 10
–3
М ЭДТА и
3×10
–4
М Н
2
О
2
. Содержание карбонильных групп,
измеренное при длине волны 370 нм, рассчитывали
с использованием коэффициента молярной экстинк-
ции (22000 л
⋅⋅
⋅⋅
⋅М
–1
⋅⋅
⋅⋅
⋅см
–1
для алифатических динит-
рофенилгидразинов) и выражали в нмолях на 1 мг
белка [19]. Количественное содержание белка в
плазме крови определяли биуретовым методом
[11]. Активность супероксиддисмутазы (СОД) и
каталазы определяли в гемолизатах. Об актив-
ности СОД судили по ее способности ингибировать
процесс восстановления тетразолиевого нитроси-
него и феназинметосульфата в условиях генерации
супероксидного анион-радикала [3]. Активность
каталазы определяли по скорости убыли перекиси
водорода в среде инкубации, концентрацию переки-
cardiac output go down before the body temperature
is significantly reduced. This results in decrease of
tissue perfusion in those areas, where the rates of
biochemical processes remain at eutermic level. Ability
to undergo sharp differences of energy exchange and
intensity of free radical processes (FRP) in hibernation
dynamics is one of its main adaptation elements [14].
At the same time it is unknown if the hibernators are
adapted to metabolism intensity change beyond hiber-
nation period.
The research aim was to study the content of oxida-
tive-modified proteins and activity of antioxidative sys-
tem of ground squirrel blood under artificial hypothermia
of various depths during their summer active period.
Materials and methods
The researches were carried out in small ground
squirrels Spermophilus pygmaeus Pall.of 250–300 g.
Prior to experiments the animals were under vivarium
conditions on a standard diet. For studying the effect
of hypothermia the ground squirrels were exposed to
cooling in special cold chambers, in the jackets of which
cold water circulated (3–4°C). Temperature of ground
squirrel’s body was decreased evenly with reaching
20°C for 55–60 min, and 10°C for 90–100 min. Summer
active animals considered as the control.
Rate of protein oxidative modification (POM) of
blood plasma was determined by the content of carbo-
nyl groups, reacting with dinitrophenyl hydrazine [19].
Herewith the initial level of carbonyl groups and their
accumulation in model system for 15 min at 37°C at
the presence of 10
–3
M Fe
2+
, 10
–3
M EDTA and 3×10
–4
M
H
2
O
2
were determined. The content of carbonyl groups
was measured at 370 nm wave length using coefficient
of molar extinction (22.000 l
⋅⋅
⋅⋅
⋅M
-1
⋅⋅
⋅⋅
⋅cm
-1
for aliphatic di-
nitrophenyl hydrazine) and expressed in nM per 1 mg
of protein [19]. Quantitative content of protein in blood
plasma was determined by biuret method [11]. Activity
of superoxide dismutase (SOD) and catalase was de-
termined in hemolysates. SOD activity was estimated
by its ability to inhibit the reduction process of tetrazo-
lium nitroblue and phenazine methosulfate under
conditions of superoxide anion radical generation [3].
Catalase activity was determined by the rate of decrea-
se of hydrogen peroxide content in incubation medium,
concentration of hydrogen peroxide was assayed in
the reaction with ammonium molybdate [8]. The
content of hemoglobin was determined by ammonium
method [9]. Antioxidative activity of hydrophilic
components was estimated by oxidation kinetics of
reduced form of 2,6-dichlorphenol indophenol by
oxygen [10]. Sta-tistical processing of the results were
carried out with Statistica software program.
Results and discussion
As Table 1 shows under hypothermia only the
insignificant decrease of protein content in blood plasma
256
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
си водорода – по реакции с молибдатом аммония
[8]. Содержание гемоглобина определяли аммиач-
ным методом [9]. Об антиокислительной актив-
ности гидрофильных компонентов судили по кине-
тике окисления восстановленной формы 2,6-ди-
хлорфенолиндофенола кислородом [10]. Статисти-
ческую обработку результатов проводили с исполь-
зованием программы Statistica.
Результаты и обсуждение
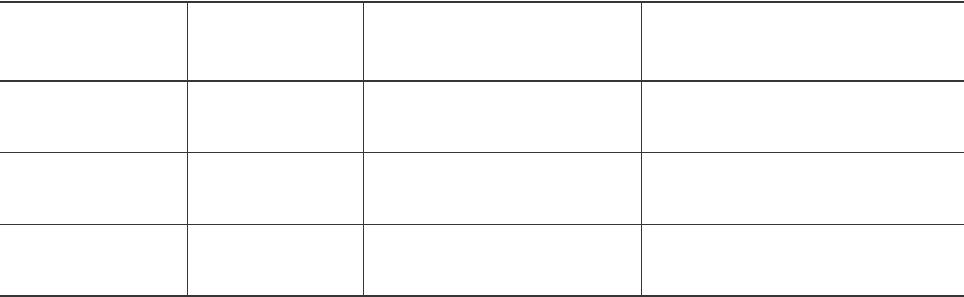
Как видно из табл. 1, при гипотермии наблю-
дается лишь тенденция к снижению содержания
белков в плазме крови. Снижение уровня плазмен-
ных белков может быть связано с выходом части
мелкодисперсных белков из сосудистого русла и/
или с интенсификацией процессов окислительной
модификации плазменных белков и их захватом
клетками ретикулоэндотелиальной системы.
Анализ одного из маркеров ОМБ [15]: содержа-
ния карбонильных групп – показал, что при гипотер-
мии 20°С этот показатель в плазменных белках
снижается на 17% по отношению к контролю. Од-
нако при дальнейшем снижении температуры тела
(10°С) обнаружено повышение содержания карбо-
нильных групп в белках на 26,8%. Чем же обуслов-
лена интенсификация процессов ОМБ при глубокой
гипотермии?
Можно предположить, что повышение содер-
жания окислительно-модифицированных белков в
плазме отражает повышение уровня АФК в крови.
АФК могут поступать в плазму из тканей, митохонд-
рий эндотелиальных клеток, а также в процессе
функционирования СОД эритроцитов и плазмы [17].
Недавно на артериях хвоста мышей установлено,
что умеренное холодовое воздействие (28°C), в
отличие от условий 37°C, приводит к увеличению
образования АФК в митохондриях гладкомышеч-
ных клеток [12]. Образующиеся при этом АФК
способствуют вазоконстрикции сосудов. При глу-
бокой гипотермии вряд ли следует ожидать увели-
чения образования АФК митохондриями гладко-
мышечных клеток, поскольку при этом, с одной
стороны, резко снижается потребление кислорода,
с другой – происходит сдвиг кривой диссоциации
оксигемоглобина влево [26], что затрудняет отдачу
кислорода тканям.
Возможно, при глубокой гипотермии окисли-
тельно-модифицированные белки поступают в
плазму крови из тканей. Это предположение подт-
верждают результаты исследования окисляемости
плазменных белков в условиях in vitro при гене-
рации АФК средой Фентона. Как оказалось, при
гипотермии разной глубины индукция процессов
ОМБ внесением в среду инкубации ионов железа
и пероксида водорода приводит к снижению содер-
жания в них карбонильных групп в среднем на 17%
is observed. Decrease of plasma protein level may be
associated with partial release of low-molecular-weight
proteins from bloodstream and/or with intensification
of oxidative modification processes of plasma proteins
and their capture by the cells of reticuloendothelial sys-
tem.
Analysis of one of POM markers, the carbonyl
groups’ content, showed that under hypothermia of
20°C this index measured in plasma proteins decreased
down to 17% comparing to the control [15]. However
during further decrease of body temperature (10°C)
the increase of carbonyl group content in proteins up
to 26.8% is observed. What the intensification of POM
processes under deep hypothermia is stipulated with?
One may suggest that increase of oxidative-modi-
fied proteins in plasma shows the increase of ROS
level in blood. ROS may enter into plasma from tissues,
mitochondria of endothelial cells and during SOD
functioning in erythrocytes and plasma [17]. Recently
it was established that in the mice caudal arteries the
moderate cold effect (28°C) in contrast to normal
temperature of 37°C leads to the increase of ROS
formation in mitochondria of smooth muscle cells [12].
ROS forming thereby contributes to vasoconstriction
of vessels. Under deep hypothermia the intesification
of ROS formation in mitochondria of smooth muscle
cell is hardly expected, because on the one hand the
oxygen consumption sharply reduces, and on another
there is a left shift of oxyhemoglobin dissociation curve
[26], reflecting the decrease in oxygen output to tissues.
Perhaps, under deep hypothermia the oxidative-
modified proteins enter into blood plasma from tissues.
The results of in vitro investigation of plasma proteins
oxidation during ROS generation with Fenton’s medium
confirm this suggestion. Under different hypothermia
depth the POM processes induction with introduction
of iron ion and hydrogen peroxide ion into incubation
medium was shown to result in decreasing of carbonyl
groups’ content by 17% comparing to the control
(Table 1). These results testify to an increase of protein
resistance of ground squirrels’ blood plasma to oxidants
under decrease of body temperature.
It should be noted that low inducibility of POM
processes of blood plasma has been observed by us in
ground squirrels both under deep hibernation and during
induced arousal of animals [5]. Thus, independently of
season the decrease of ground squirrel body tempera-
ture is accompanied by an increase of blood plasma
protein resistance to oxidants.
It has been established that metal-catalyzed oxida-
tion of proteins is a site-specific process, involving
H
2
O
2
and Fe
2+
in the area of metal-binding surface of
protein [23]. Iron ions are linked to metal-binding
surface of protein. Fe
2+
-
protein complex reacts with
H
2
O
2
and generates in situ OH
•
radical, inducing
oxidative modification of aminoacid residue in the area
257
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
относительно контроля (табл. 1). Эти результаты
свидетельствуют о повышении устойчивости бел-
ков плазмы крови сусликов к оксидантам при
снижении температуры тела.
Следует отметить, что низкая индуцибельность
процессов ОМБ плазмы крови обнаружена нами у
сусликов и при глубокой зимней спячке, и в ходе
индуцированного пробуждения животных [5]. Та-
ким образом, вне зависимости от сезона года при
снижении температуры тела сусликов происходит
повышение устойчивости белков плазмы крови к
оксидантам.
Установлено, что металл-катализируемое окис-
ление белков – это сайт-специфический процесс, в
который вовлекаются Н
2
О
2
и Fe
2+
в области ме-
таллсвязывающей поверхности белка [23]. Ионы
железа фиксируются на металлсвязывающей
поверхности белка. Комплекс Fe
2+
-белок реагирует
с Н
2
О
2
и генерирует in situ радикал OH˙, который
вызывает окислительную модификацию аминокис-
лотного остатка в области металлсвязывающего
участка белка. Это приводит к дезаминированию
отдельных аминокислотных остатков, превраще-
нию их в карбонилпроизводные, потере белком
функциональной активности и увеличению чувст-
вительности к протеолитической деградации. Кар-
бонильные производные образуются в результате
металл-катализируемого окисления пролиновых,
аргининовых, лизиновых, гистидиновых остатков
аминокислот [19]. Ароматические аминокислоты
реже входят в состав металлсвязывающей поверх-
ности белков, поэтому они меньше подвергаются
воздействию металл-катализируемого окисления
[24]. Отсюда следует, что в ходе снижения тем-
пературы тела сусликов меняется либо спектр,
либо структура присутствующих в плазме белков,
Таблица 1. Содержание белка и карбонильных групп в белках плазмы крови
сусликов при гипотермии (M ± m, n = 4–5)
Table 1. Content of protein and carbonyl groups in proteins of ground squirrels’ blood plasma
under hypothermia (M ± m, n = 4–5)
Примечание: p – различия достоверны по отношению к контролю.
Notes: p – differences are significant in respect to the control.
of metal-binding site of protein. This results in deami-
nation of several aminoacid residues, their transforma-
tion in carbonyl derivatives, loss of protein functional
activity and increase of sensitivity to proteolytic degra-
dation. Carbonyl derivatives are formed in reaction of
metal-catalyzed oxidation of proline, arginine, lysine
and hystidine residues of aminoacids [19]. Aromatic
aminoacids are seldom included as a compound of me-
tal-binding surface of proteins, therefore they are less
affected by metal-catalyzed oxidation [24]. Therefore
during decrease of ground squirrel body temperature
either spectrum, or structure of plasma proteins are
changed, that results in loss of binding sites for Fe
2+
and EDTA-Fe
2+
complex, used for ROS generation.
FRP intensity is known to depend both on rate of
ROS generation, and on activity of antioxidative system,
involved of enzymatic and non-enzymatic components
[25].
The results of study of various links of blood antioxi-
dant protection were shown in Table 2. It was shown
that independing on hypothermia depth the antioxidative
activity of plasma, provided by hydrophilic antioxidants
increased up to 131% comparing to the control. During
hibernation in ground squirrel tissues the content of
low-molecular antioxidants is also increased [16,21].
Herewith in ground squirrel blood plasma the content
of ascorbic acid is significantly increased (in 2–4 times),
that on authors’ opinion provides protection for cells
of endothelium, surrounding tissues and blood from
oxidants (O
2
•–
, OH
•
), formed in endothelial cells during
arousal and further sleep of animal [16]. Probably,
under hypothermia an antioxidative protection is also
connected with increasing of ascorbate content in blood
plasma.
Among high-molecular-weight antioxidants the
leading place in preserving of antioxidant status of
огонтовижеиняотсоС
etatslaminA
л/г,колеБ
l/g,nietorP
хыньлинобракьневоруйындохсИ
аклебгм/ьломн,хаклебвппург
nipuorglynobracfolevellaitinI
nietorpfogm/lomn,snietorp
азхаклебвппургхыньлинобрактсорирП
eFиивтстусирпвним51
+2
-Н
2
О
2
rofsnietorpnispuorglynobracfonoitamroF
eFfoecneserpehttanim51
+2
-H
2
O
2
ьлортноК
lortnoC
0,3±5,7991,0±67,25,1±8,84
С°02яимретопиГ
aimrehtopyhC°02
3,3±7,3921,0±92,2
0,2±4,04
20,0<p
С°01яимретопиГ
aimrehtopyhC°01
7,2±4,29
22,0±05,3
50,0<p
0,3±8,04
20,0<p
258
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
в результате чего уменьшается
количество мест связывания для
Fe
2+
и комплекса ЭДТА-Fe
2+
, ис-
пользуемых для генерирования
АФК.
Как известно, интенсивность
СРП зависит не только от ско-
рости генерации АФК, но и актив-
ности антиокислительной систе-
мы, представленной фермента-
тивным и неферментативным
звеньями [25].
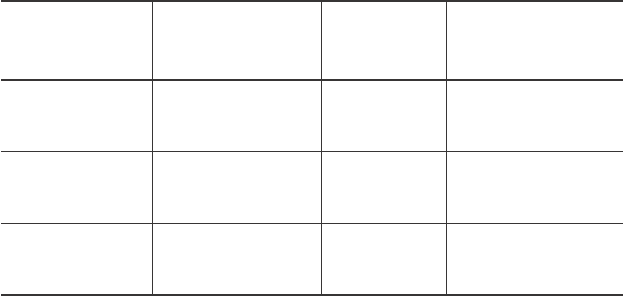
Результаты исследования раз-
личных звеньев антиоксидантной
защиты крови приведены в табл. 2.
Видно, что независимо от глуби-
ны гипотермии антиокислитель-
ная активность плазмы, обеспе-
ченная гидрофильными антиокси-
дантами, возрастает на 131% от-
носительно контроля. При зимней
спячке в тканях сусликов также
еиняотсоС
огонтовиж
etatslaminA
хыньлифордигАОА
%,вотненопмок
lihpordyhfoAOA
%,stnenopmoc
,ДОС
bHгм/де.лсу
bHgm/u,DOS
ьломкм,азалатаК
H
2
O
2
ним/bHгм/
,esalataC µ Hlom
2
O
2
/
nim/bHgm
ьлортноК
lortnoC
07,0±00,31460,0±85,242,0±43,73
С°02яимретопиГ
aimrehtopyhC°02
08,0±30,03
10,0<p
240,0±80,3
50,0<p
74,0±49,43
50,0<p
С°01яимретопиГ
aimrehtopyhC°01
69,2±60,03
10,0<p
550,0±21,2
50,0<p
57,0±81,03
50,0<p
Таблица 2. Активность компонентов антиоксидантной защиты
эритроцитов и плазмы крови сусликов при искусственной
гипотермии (M ± m, n = 6)
Table 2. Activity of components of antioxidant protection
of erythrocytes and ground squirrels’ blood plasma under artificial
hypothermia (M ± m, n = 6)
Примечание: p – различия достоверны по отношению к контролю; АОА –
антиоксидантная активность.
Notes: p – differences are significant in respect to the control; AOA – antioxidant
activity.
увеличивается содержание низкомолекулярных
антиоксидантов [16, 21]. При этом в плазме крови
сусликов существенно (в 2–4 раза) повышается
содержание аскорбиновой кислоты [16], что, как
считают авторы, обеспечивает защиту эндоте-
лиальных клеток, клеток окружающих тканей и
крови от оксидантов (О
2
•–
, ОН
•
), образующихся в
эндотелиальных клетках, в процессе пробуждения
и последующего засыпания животного [16]. Воз-
можно, что и при гипотермии антиоксидантная
защита также связана с повышением содержания
аскорбата в плазме крови.
Среди высокомолекулярных антиоксидантов
ведущую роль в поддержании антиоксидантного
статуса эритроцитов и плазмы крови принадлежит
СОД, которая осуществляет антирадикальную
защиту, а также каталазе, расщепляющей продукт
дисмутации супероксидного анион-радикала –
H
2
O
2
[17]. Исследование СОД эритроцитов пока-
зало, что ее активность зависит от температуры
тела животного (табл. 2). Снижение температуры
тела суслика до 20°С повышает активность фер-
мента на 19,4% относительно контроля. Глубокая
же гипотермия (10°С) приводит к снижению актив-
ности СОД на 17,8%. В отличие от СОД активность
каталазы снижается по мере падения температуры
тела животного. При температуре тела 20°С ее ак-
тивность падает на 6,4%, а при 10°С – на 19,2%
относительно контроля.
Активность антиоксидантных ферментов свя-
зана с интенсивностью СРП. Показано, что акти-
вация антиокислительных ферментов эритроцитов
является первой реакцией организма на увеличение
erythrocytes and blood plasma belongs to SOD, imple-
menting antiradical protection, as well as to catalase,
deconjugating dismutation product of superoxide anion-
radical, H
2
O
2
[17]. Study of erythrocyte SOD has shown
that its activity depends on animal body temperature
(Table 2). Reduction of ground squirrel’s body tempe-
rature down to 20°C increases the enzyme activity to
19.4% in respect to the control. But deep hypothermia
(10°C) results in SOD activity decrease down to
17.8%. In contrast to SOD, the catalase activity is
reduced with the decrease of animal body temperature.
At body temperature of 20°C its activity decreases
down to 6.4%, and at 10°C – down to 19.2% in respect
to control.
Activity of antioxidant enzymes is associated with
FRP intensity. It has been shown, that activation of
antioxidant enzymes of erythrocytes is the first respon-
se of organism to an increase of intensity of ROS for-
mation [1]. SOD is unique antiradical enzyme. There-
fore, one may suggest that increase of its activity under
20°C hypothermia reflects intensification, and a de-
crease does an inhibition of ROS formation processes.
Data about glutathione, cysteine and other SH-contai-
ning substances significantly increase the activation
of SOD are of interest [18].
Moreover, it is known that accumulation of ROS
and toxic peroxidation products (peroxides of fatty
acids, aldehydes, ketones and other products) leads to
an inactivation of SOD and catalase [20]. Exposure
of erythrocytes in the medium with H
2
O
2
inhibits SOD
activity in concentration dependent mode [22]. Adding
the reduced glutathione and unitiol to homogenates of
hypothermal (20°C) rat brain significantly increased
259
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
SOD activity [2]. Until now it has been difficult to say
if decrease of erythrocyte SOD and catalase activity
under deep hypothermia is associated with their oxida-
tive modification or whethe it is a result of down-regu-
lation of enzymes.
Conclusions
Thus, our finding suggest, that in ground squirrels
in active summer time the blood plasma proteins
manifest the resistance to oxidative modification during
a decrease in body temperature. An important role in
their protection under 20°C hypothermia is played by
both hydrophylic antioxidants of plasma, and antioxida-
tive enzymes of erythrocytes, and under 10°C hypo-
thermia these are mainly plasma antioxidants.
интенсивности образования АФК [1]. СОД явля-
ется единственным антирадикальным ферментом.
Поэтому можно предположить, что повышение ее
активности при гипотермии 20°С отражает интен-
сификацию, а понижение – ингибирование процес-
сов образования АФК. Представляют интерес дан-
ные о том, что глутатион, цистеин и другие SH-
содержащие соединения значительно повышают
активность СОД [18].
Вместе с тем известно, что накопление АФК и
токсических перекисных продуктов (перекисей
жирных кислот, альдегидов, кетонов и прочих
продуктов) вызывает подавление активности СОД
и каталазы [20]. Экспозиция эритроцитов в среде
с H
2
O
2
концентрационнозависимо инактивирует
СОД [22]. Добавление восстановленного глута-
тиона и унитиола к гомогенатам мозга гипотер-
мированных (20°С) крыс существенно повышало
активность СОД [2]. Связано ли снижение актив-
ности СОД и каталазы эритроцитов при глубокой
гипотермии с их окислительной модификацией или
это есть результат понижающей регуляции фермен-
тов пока сказать сложно.
Выводы
Полученные нами данные свидетельствуют о
том, что у активных в летний период сусликов в
ходе снижения температуры тела белки плазмы
крови проявляют устойчивость к окислительной
модификации. В их защите при гипотермии 20°С
важную роль играют как гидрофильные антиокси-
данты плазмы, так и антиоксидантные ферменты
эритроцитов, при гипотермии 10°С – в основном
гидрофильные антиоксиданты плазмы.
References
Verbolovich V.P., Podgornyy Yu.K., Podgornaya L.M. Indices
of resistance of human erythrocytes to oxidative process//
Voprosy Med. Khimii.– 1989.– Vol. 35, N5.– P. 35–39.
Gasangazhieva A.G. Antioxidative activity of adapted to cold
rats’ tissues under hypothermia and spontaneous heating:
Thesis of Doctor of Biol. Sci.– Makhachkala, 1999.– 145 p.
Dubinina E.E. Activity and properties of superoxide dismutase
of human blood erythrocytes and plasma in ontogenesis//
Ukr. Biokhim. Zhurn.– 1988.– Vol. 66, N3.– P. 20–24.
Dubinina E.E. Products of oxygen metabolism in functional
activity of cells. Life and death, creation and destruction.–
St. Petersburg, 2006.– 400 p.
Dubrovskaya M.D., Klichkhanov N.K. Induced waking of
ground squirrels from hibernation and intensity of oxidative
modification of plasma proteins// Ros. Fiziol. Zhurnl.– 2004.–
Vol. 90, N8.– P. 190.
Zenkov N.K., Lankin V.Z., Menshikova E.B. Oxidative stress:
Biochemical and pathophysiological aspects.- Moscow:
Nauka, Interperiodika, 2001.– 340 p.
Kalabukhov N.I. Hibernation of mammals.– Moscow: Nauka,
1985.– 264 p.
Korolyuk M.A., Ivanova L.N., Mayorova I.G., Tokarev V.E.
Method of catalase activity determining// Lab. Delo.– 1988.–
N1.– P. 16–19.
Lopatina N.I., Geronimus A.L., Tremestova E.P. Determining
of fetal hemoglobin in blood with PhEC// Lab. Delo.– 1976.–
N6.– P. 328–331.
Semenov V.L., Yarosh A.M. Determining method of antioxi-
dative activity of biological material // Ukr. Biokhim. Zhurn.–
1985.– Vol. 57, N3.– P. 50–52.
Skoups P. Methods of protein purification.– Moscow: Mir,
1985.– 358 p.
Bailey S.R., Mitra S., Flavahan S., Flavahan N.A. Reactive
oxygen species from smooth muscle mitochondria initiate cold-
induced constriction of cutaneous arteries // Am. J. Physiol.
Heart Circ. Physiol.– 2005.– Vol. 289.– P. H243–H250.
Buck C.L., Barnes B.M. Effects of ambient temperature on
metabolic rate, respiratory quotient, and torpor in an arctic
hibernation // Am. J. Physiol., Regul. Integr. Comp. Physiol.–
2000.– Vol. 279.– P. R255–R262.
Carey H.V., Andrews M.T., Martin S.L. Mammalian hibernation:
cellular and molecular responses to depressed metabolism
and low temperature // Physiol. Rev.– 2003.– Vol. 83.–
P. 1153–1181.
Dalle-Donne I., Ross R., Guistarini D. et al. Protein carbonyl
groups as biomarkers of oxidative stress // Clinica Chimica
Acta.– 2003.– Vol. 329.– P. 23–38.
Литература
Верболович В.П., Подгорный Ю.К., Подгорная Л.М. Пока-
затели резистентности эритроцитов человека к окис-
лительному стрессу // Вопросы мед. химии.– 1989.–
Т. 35, №5. – С. 35–39.
Гасангаджиева А.Г. Антиоксидантная активность тканей
адаптированных к холоду крыс при гипотермии и само-
согревании: Дис. ... канд. биол. наук. – Махачкала, 1999.–
145 с.
Дубинина Е.Е. Активность и свойства супероксиддисму-
тазы эритроцитов и плазмы крови человека в онтоге-
незе // Укр. биохим. журн.– 1988.– Т. 66, №3.– С. 20–24.
Дубинина Е.Е. Продукты метаболизма кислорода в
функциональной активности клеток. Жизнь и смерть,
созидание и разрушение.– СПб, 2006.– 400 c.
Дубровская М.Д., Кличханов Н.К. Индуцированное про-
буждение сусликов от зимней спячки и интенсивность
окислительной модификации плазменных белков // Рос.
физиол. журн.– 2004.– Т. 90, №8.– С. 190.
Зенков Н.К., Ланкин В.З., Меньшикова Е.Б. Окисли-
тельный стресс: Биохимический и патофизиологические
аспекты.– М.: Наука. Интерпериодика, 2001.– 340 с.
Калабухов Н.И. Спячка млекопитающих.– М.: Наука,
1985.– 264 с.
1.
2.
3.
4.
5.
6.
7.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
260
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹3
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹3
Королюк М.А., Иванова Л.Н., Майорова И.Г., Токарев В.Е.
Метод определения активности каталазы // Лаб. дело.–
1988.– №1.– С. 16–19.
Лопатина Н.И., Геронимус А.Л., Треместова Е.П. Опре-
деление фетального гемоглобина в крови с помощью
ФЭКа // Лаб. дело.– 1976.– №6.– С. 328–331.
Семенов В.Л., Ярош А.М. Метод определения антиокис-
лительной активности биологического материала // Укр.
биохим. журн.– 1985.– Т. 57, №3.– С.50–52.
Скоупс Р. Методы очистки белков.– М.: Мир, 1985.– 358 с.
Bailey S.R., Mitra S., Flavahan S., Flavahan N.A. Reactive
oxygen species from smooth muscle mitochondria initiate cold-
induced constriction of cutaneous arteries // Am. J. Physiol.
Heart Circ. Physiol.– 2005.– Vol. 289.– P. H243–H250.
Buck C.L., Barnes B.M. Effects of ambient temperature on
metabolic rate, respiratory quotient, and torpor in an arctic
hibernation // Am. J. Physiol., Regul. Integr. Comp. Physiol.–
2000.– Vol. 279.– P. R255–R262.
Carey H.V., Andrews M.T., Martin S.L. Mammalian hibernation:
cellular and molecular responses to depressed metabolism
and low temperature // Physiol. Rev.– 2003.– Vol. 83.–
P. 1153–1181.
Dalle-Donne I., Ross R., Guistarini D. et al. Protein carbonyl
groups as biomarkers of oxidative stress // Clinica Chimica
Acta.– 2003.– Vol. 329.– P. 23–38.
Drew K.L., Osborne P.A., Frerichs K.U. et al. Ascorbate and
glutathione regulation in hibernating ground squirrels // Brain
Research.– 1999.– Vol. 851.– P. 1–8.
Halliwell B., Clement M.V., Long L.H. Hydrogen peroxide in
the human body // FEBS Letters.– 2000.– Vol. 486.– P. 10–13.
Hoshino T., Ohta V., Joshigino J. The effect of sulfhydryl
compounds on the catalytic activity of Cu, Zn-superoxide
dismutase purified from rat liver // Experientia.– 1985.–
Vol. 41, N11.– P. 1416–1419.
Levine R.L., Garland D., Oliver C.N. et al. Determination of
carbonyl content in oxidatively modified proteins // Methods
in Enzymol.– 1990.– Vol. 186.– P. 464–478.
Lievre V., Becuwe P., Bianchi A. et al. Intracellular generation
of free radicals and modifications of detoxifying enzymes in
cultured neurons from the developing rat forebrain in respon-
se to transient hypoxia // Neuroscience.– 2001.– Vol. 105, N2.–
P. 287–297.
Okamoto I., Kayano T., Hanaya T. et al. Up-regulation of an
extracellular superoxide dismutase-like activity in hibernating
hamsters subjected to oxidative stress in mid- to late arousal
from torpor // Comp. Biochem. Physiol.– 2006.– Part C 144.–
P. 47–56.
Salo D.C., Pacifici R.E., Lin S.W., Giulivi C., Davies K.J.A.
Superoxide dismutase undergoes proteolysis and fragmen-
tation following oxidative modification and inactivation // J.
Biol. Chem.– 1990.– Vol. 265, N20.– P. 11919–11927.
Stadtman E.R. Metal ion – catalyzed oxidation of proteins:
biochemical mechanism and biological consequences // Free
Radic. Biol. Med.– 1990.– Vol. 9.– P. 315–325.
Stadtman E.R. Role of oxidized amino acids in protein break-
down and stability // Methods Enzymol.– 1995.– Vol. 258.–
P. 379–393.
Young I.S., Woodside J.V. Antioxidants in health and disease //
J. Clin. Pathol.– 2001.– Vol. 54.– P. 178–186.
Zinchuk V.V., Dorokhina L.V., Maltsev A.N. Prooxidant-
antioxidant balance in rats under hypothermia combined with
modified hemoglobin-oxygen affinity // J. Thermal Biol.– 2002.–
Vol. 27.– P. 345–352.
Поступила 25.03.2009
Рецензент В.С. Марченко
Drew K.L., Osborne P.A., Frerichs K.U. et al. Ascorbate and
glutathione regulation in hibernating ground squirrels // Brain
Research.– 1999.– Vol. 851.– P. 1–8.
Halliwell B., Clement M.V., Long L.H. Hydrogen peroxide in
the human body // FEBS Letters.– 2000.– Vol. 486.– P. 10–13.
Hoshino T., Ohta V., Joshigino J. The effect of sulfhydryl
compounds on the catalytic activity of Cu, Zn-superoxide
dismutase purified from rat liver // Experientia.– 1985.–
Vol. 41, N11.– P. 1416–1419.
Levine R.L., Garland D., Oliver C.N. et al. Determination of
carbonyl content in oxidatively modified proteins // Methods
in Enzymol.– 1990.– Vol. 186.– P. 464–478.
Lievre V., Becuwe P., Bianchi A. et al. Intracellular generation
of free radicals and modifications of detoxifying enzymes in
cultured neurons from the developing rat forebrain in respon-
se to transient hypoxia // Neuroscience.– 2001.– Vol. 105, N2.–
P. 287–297.
Okamoto I., Kayano T., Hanaya T. et al. Up-regulation of an
extracellular superoxide dismutase-like activity in hibernating
hamsters subjected to oxidative stress in mid- to late arousal
from torpor // Comp. Biochem. Physiol.– 2006.– Part C 144.–
P. 47–56.
Salo D.C., Pacifici R.E., Lin S.W., Giulivi C., Davies K.J.A.
Superoxide dismutase undergoes proteolysis and fragmen-
tation following oxidative modification and inactivation // J.
Biol. Chem.– 1990.– Vol. 265, N20.– P. 11919–11927.
Stadtman E.R. Metal ion – catalyzed oxidation of proteins:
biochemical mechanism and biological consequences // Free
Radic. Biol. Med.– 1990.– Vol. 9.– P. 315–325.
Stadtman E.R. Role of oxidized amino acids in protein break-
down and stability // Methods Enzymol.– 1995.– Vol. 258.–
P. 379–393.
Young I.S., Woodside J.V. Antioxidants in health and disease //
J. Clin. Pathol.– 2001.– Vol. 54.– P. 178–186.
Zinchuk V.V., Dorokhina L.V., Maltsev A.N. Prooxidant-
antioxidant balance in rats under hypothermia combined with
modified hemoglobin-oxygen affinity // J. Thermal Biol.– 2002.–
Vol. 27.– P. 345–352.
Accepted in 25.03.2009
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
