Яглов В.Н. (ред.) Задачи предлабораторного контроля по химии
Подождите немного. Документ загружается.

разбавленный
раствор
А1
2
(8О
4
)
1
- сильный электролит.
Следовательно, а =
1.
По уравнению диссоциации
А1
2
(ЗС>4)з:
т
,
Л —
число ионов
А1
3+
,
образующихся при диссоциации одной
молекулы
А1
2
(ЗО
4
)
3
равно 2.
Следовательно,
п
д/я+
-1
Тогда
С
Л
,,
+
=
5-1(ГМ-2
=
10~
3
моль/л
Рассчитываем электродный потенциал алюминиевого
электрода по уравнению
(1)
Ответ:
р
д
,,
+
м;
=-1,73
В.
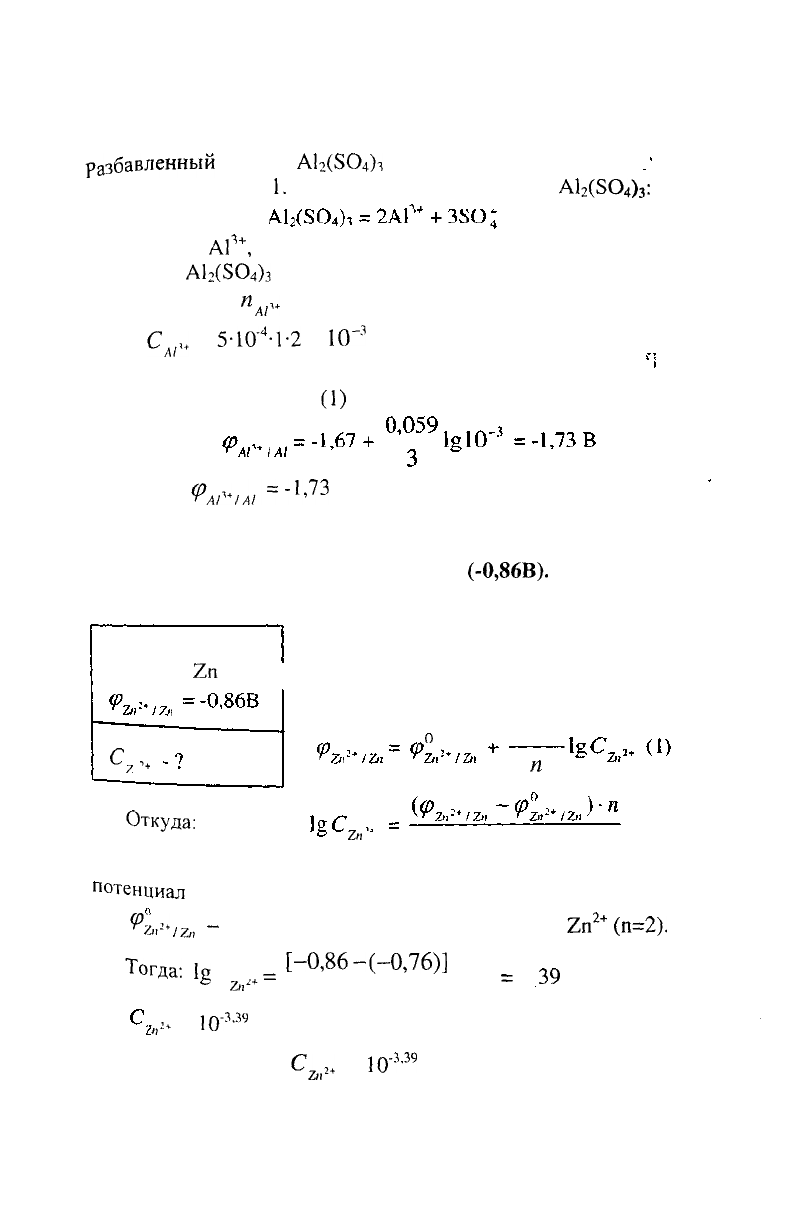
б) Потенциал цинкового электрода, погруженного в
раствор своей соли, равен
(-0,86В).
Вычислить
концентрацию ионов цинка в растворе.
РЕШЕНИЕ:
Дано:
С
7
,
+
7л
Электродный потенциал цинка
Металл -
2п
рассчитываем по уравнению
Нернста:
0
0,059
п
Откуда-
2
"
0,059
По таблице П7[1] определяем стандартный электродный
потенциал
цинка
^йг*
/г,,
~
-0,76 В, п - равно заряду иона цинка
2п
2+
(п=2).
Тогда:
1
8
С
=
[-0.86-
(-0,76)]
• 2
=
39
2
"'
+
0,059
п>*
=
Ю-
3
'
39
моль/л.
Ответ:
С
&2+
=
1
0"
3
'
39
моль/л.
81

2. Составить две схемы гальванических элементов
(ГЭ), в одной из которых олово служило бы анодом,
в
другой - катодом. Для одной из них написать
уравнения электродных процессов и суммарной
токообразующей
реакции. Вычислить значение
стандартного напряжения ГЭ.
РЕШЕНИЕ:
В гальваническом элементе анодом является более активный
металл с меньшим алгебраическим значением электродного
потенциала, катодом - менее активный металл с большим
значением электродного потенциала.
По
таблице
П7[1]
находим
<р^^
п
=
-0,14В
а) Олово является анодом ГЭ.
В качестве катода можно выбрать любой металл с
тме"*
I
Ме
т
5
„1+1
5п
Выбираем медь
<р^
н
г*-
/Си
= + 0,34 В. В паре 5п- Си - олово
будет являться анодом ГЭ, медь - катодом. Составим схему
ГЭ:
А(-) 5п |
5п
2+
| |
Си
2+
|
Си(+)К
или
А(-)
5п
|
5п5О
4
|
|
Си8О
4
\ Си(+)К
Уравнения электродных процессов:
На А(-) 5п - 2ё = 5п
2+
На
К(+)
Си
2+
+ 2ё = Си
1
- окисление
- восстановление
5п +
Си
2
"
1
"
=
5п
2+
+ Си -
суммарное ионное уравнение
Зп +
Си5О
4
=
5п5О
4
+ Си - суммарное молекулярное
уравнение токообразующей реакции.
Рассчитываем стандартное напряжение ГЭ:
=$
-<?"
=
9^
1СЯ
-
<^
/Л
=^34-(-ОЛ4)
=
0,48
б) Олово является катодом ГЭ.
82
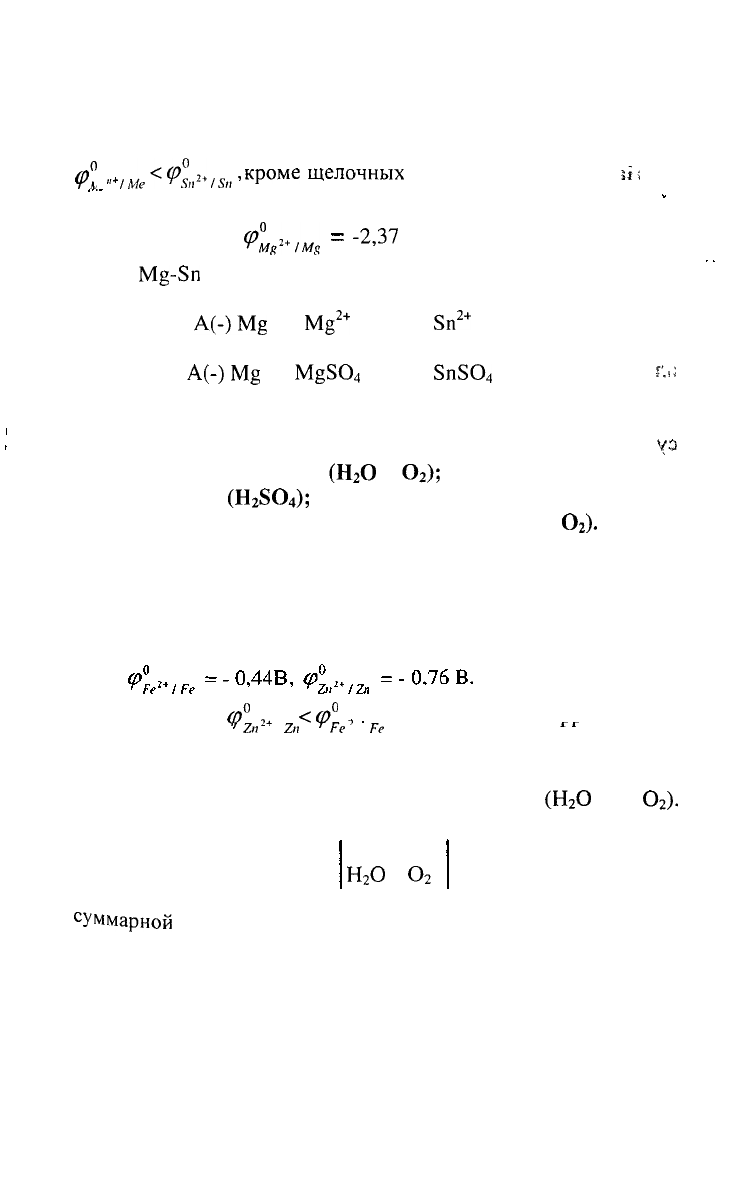
В качестве анода ГЭ можно выбрать любой металл с
^°
«*
/ме
<(
Р^п
2
*
15,,'
к
Р
оме
Щелочных
и
щелочноземельных
ш
металлов, так как они реагируют с водой.
Выбираем магний
<Р°
м/;
2+
/М!
,
=
-2,37
В
В паре
М§-5п
- магний является анодом, олово - катодом.
Составляем схему ГЭ:
А(-)М
ё
|
М§
2+
| |
8п
2+
| 5п(+)К
или
А(-)М§
|
М§5О
4
| |
5п5О
4
| Зп(+)К
?',,;
3. Составить схему коррозионного гальванического
элемента, возникающего при контакте железа с цинком в:
Ч
э
а) атмосферных условиях
(Н
2
О
+
О
2
);
б) кислой среде
(Н
2
8О
4
);
в) кислой среде в присутствии кислорода (НС1 +
О
2
).
Написать уравнения электродных процессов и суммарной
реакции процесса коррозии.
РЕШЕНИЕ:
По таблице П7[1] находим значение стандартных
электродных потенциалов железа (II) и цинка:
Так как
ф°
,
+
«р°
,
.
, то анодом коррозионного
'
2п
/
Ъ\
т
Ре
/
Ге
г
г
гальванического элемента будет являться цинк, катодом -
железо.
а) Коррозия в атмосферных условиях
(Н
2
О
+
О
2
).
Составляем схему коррозионного ГЭ:
А(-)2п
Н
2
О
+
О
2
Ре(+)К
Составляем уравнения электродных процессов и
суммарной
реакции процесса коррозии:
83
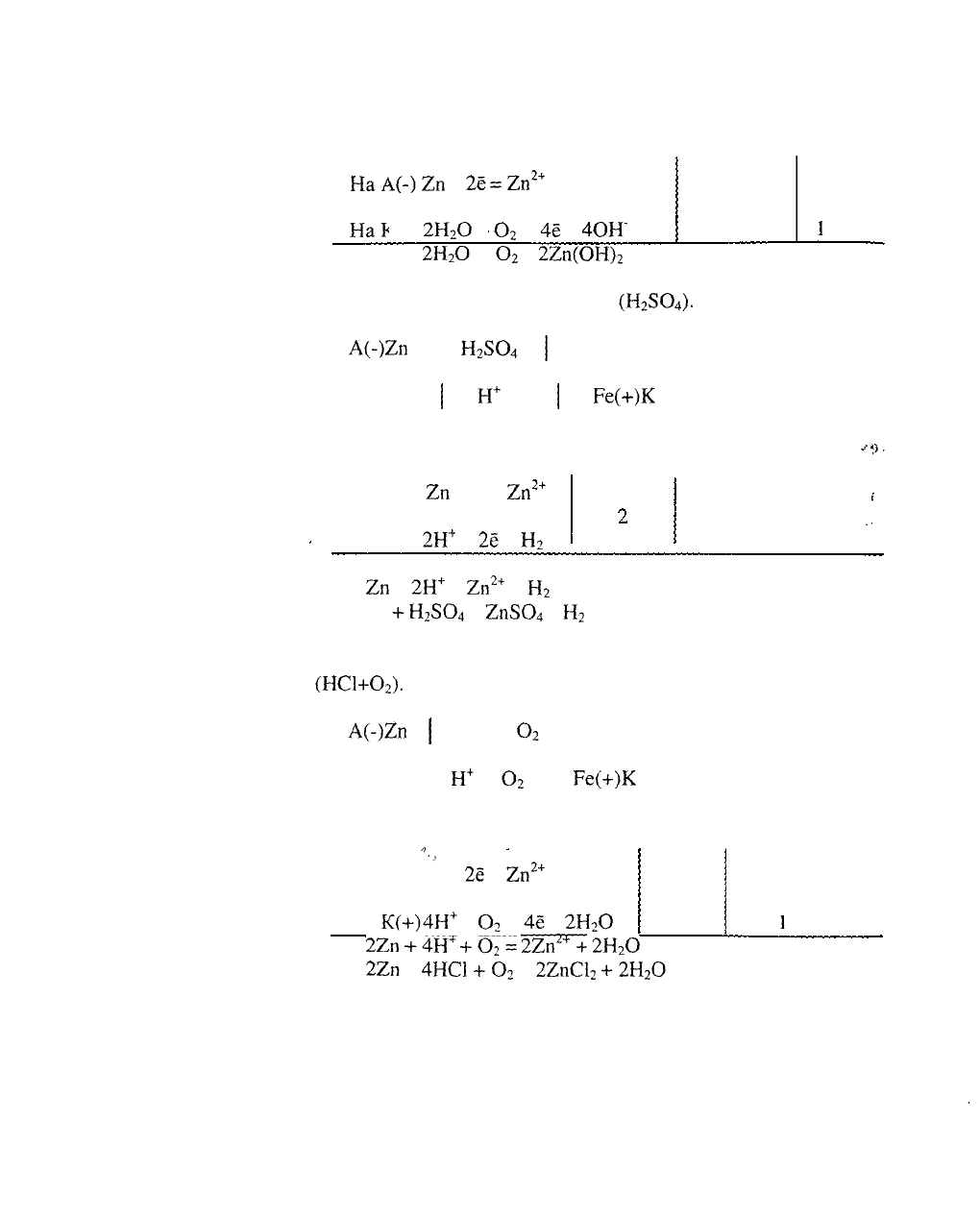
На/
На*
^(~)
2п
-
25
С(+)
2Н
2
О
+
_2п
2+
О
2
+
4ё
= 4ОН~
НОК
4
дм
2
1
22п +
2Н
2
О
+
О
2
-
22п(ОН)
2
- суммарная реакция процесса
коррозии.
б) Коррозия в кислой среде
(Н
2
5О
4
).
Составляем схему коррозионного ГЭ:
А(-)2п
|
Н
2
5О
4
|
Ре(+)К
или
А(-)2п
|
Н
+
|
Ре(+)К
Составляем уравнения электродных процессов и
суммарной реакции процесса коррозии:
*$.
НОК ДМ *
1
На А(-)
2п
- 2ё = 2п
2+
На
К(+)
2Н
+
+
2ё
=
Н
2
1
2п
+
2Н
+
= 2п
2+
+
Н
2
2п
+
Н
2
5О
4
=
2п5О
4
+
Н
2
- суммарная реакция процесса
коррозии.
в) Коррозия в кислой среде в присутствии кислорода
СНС1+О
2
).
Составляем схему коррозионного ГЭ:
А(-)2п
|
НС1 +
О
2
/ Ре(+)К
или
А(-)2п |
Н
+
+
О
2
|
Ре(+)К
Составляем уравнения электродных процессов и
суммарной реакции процесса коррозии:
'.,
На А(-) 2п -
2ё
= 2п
2+
На
К(+)
4Н
+
+
О
2
+
4ё
= 2Н
2
О
НОК
4
ДМ
2
1
22п!
+
4РГ
+
ОГ=
22^+
2Н
2
О
22п
+
4НС1
+
О
2
=
22пС1
2
+
2Н
2
О
- суммарная реакция
процесса коррозии.
Во всех случаях коррозионному разрушению будет
подвергаться более активный металл - цинк.
84
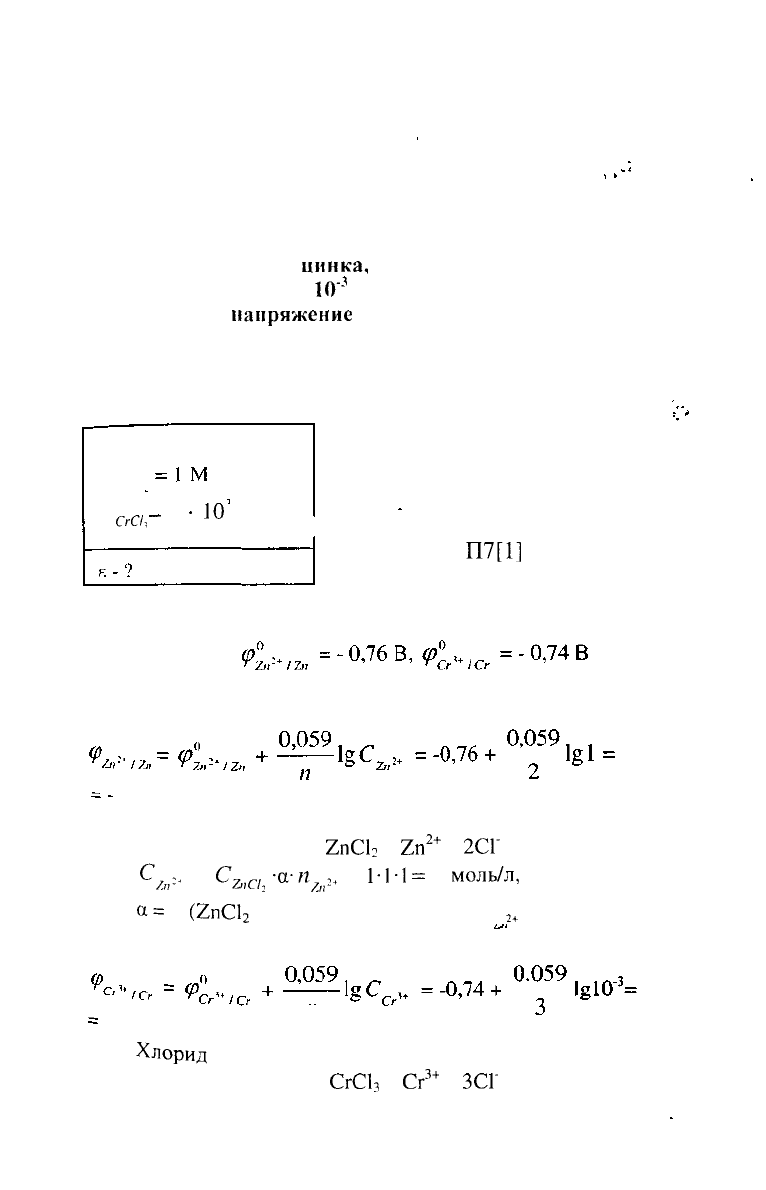
УРОВЕНЬ С
1. Составить схему гальванического элемента (ГЭ),
образованного цинковым электродом, погруженным в 1М
раствор хлорида
цинка,
и хромовым электродом,
погруженным в 1 •
10"
3
М раствор хлорида хрома (III).
Рассчитать
напряжение
ГЭ, написать уравнения
электродных процессов и суммарной токообразующей
реакции.
Дано:
С
РЕШЕНИЕ:
Для составления схемы ГЭ
необходимо знать величины
ас/,
электродных потенциалов
С
—-
1
*
10
М
СгС/1
металлов - цинка и хрома.
По таблице
П7[1]
определяем
стандартные электродные
потенциалы металлов:
Рассчитываем электродный потенциал цинка по
уравнению Нернста:
0,76
В
Хлорид цинка диссоциирует по уравнению:
2пС1
2
=
2п
2+
+
2СГ
С
/„>
=
С
г„а
2
-а--",^
=
1'Н
=
1
моль/л,
а=
I
(2пС1
2
- сильный электролит), и
2+
= 1.
Рассчитываем электродный потенциал хрома:
VI
-
0,80
В
Хлорид
хрома (III) диссоциирует по уравнению:
=
3+
СгС1
3
=
Сг
3+
+
ЗСГ
85
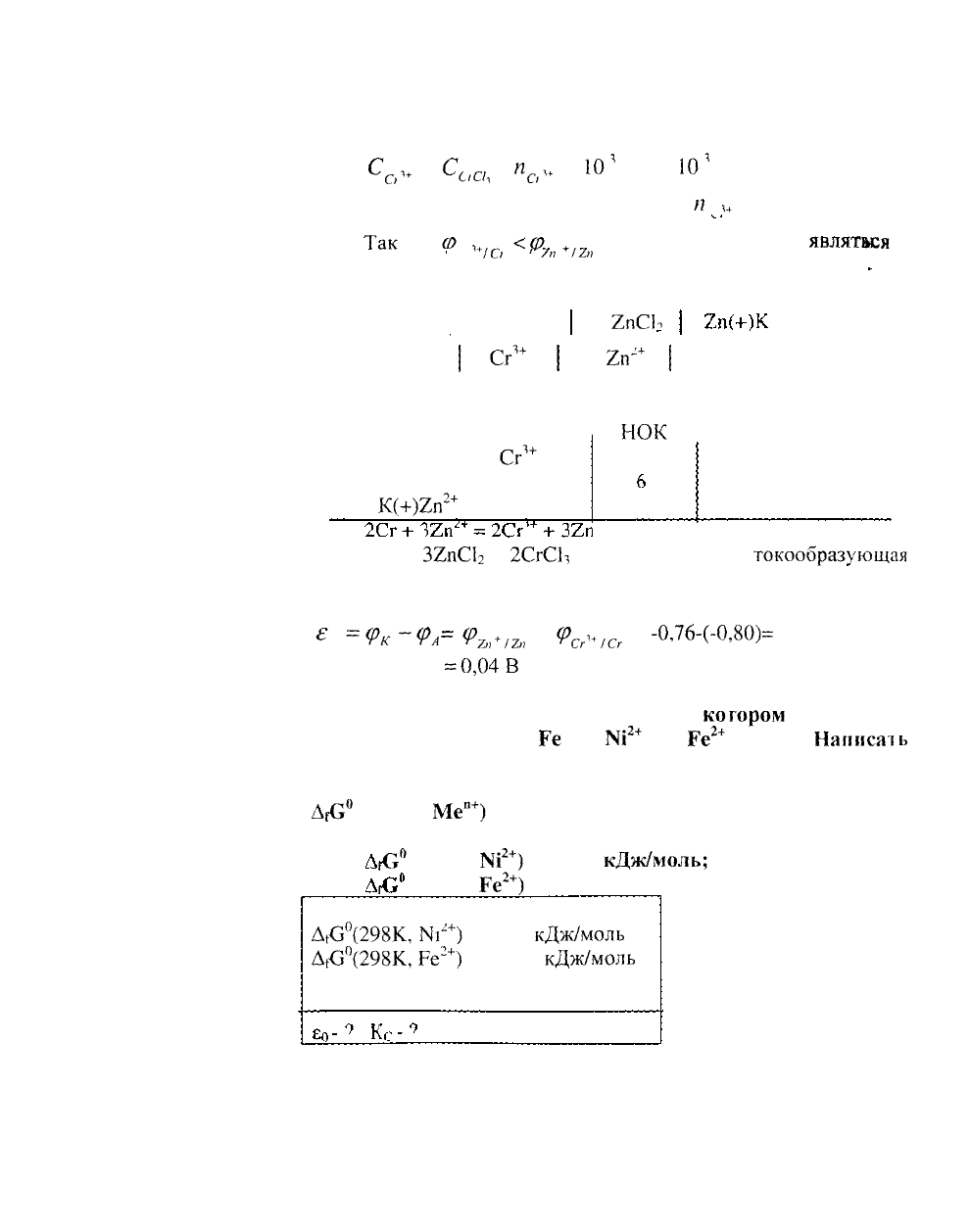
С
0
,
+
=
С
осл
а
я
с/
,
+
=
10'
1 1 =
10'
моль/л,
а = 1 (СгСЬ - сильный электролит),
п
,
+
= 1
Так
как
Ф
,
+
<Ф
+
, то в ГЭ анодом будет
являтася
О
/С/
'
7/?
/2/;
2пСЬ
хром, катодом - цинк
Составляем схему ГЭ
А(-)Сг | СгСЬ I
или
А(-)Сг
|
Сг
1+
|
|
2п-
+
|
2п(+)К
Составляем уравнения электродных процессов и
суммарной тообразующей реакции
НОК
ДМ
На А(-)Сг - За =
Сг'
+
На К(+)2п
2+
+ 26 = 2п
2
3
2Сг +
32пС1
2
=
2СгСЬ
+ 32п - суммарная
токообразующая
реакция
Рассчитываем напряжение ГЭ
е
=<р
к
-(р
А
=
(р
2п
+/2;;
-
<Р
Сг
^,
Сг
=
-0,76-(-0,80)=
0,04 В
Ответ е
=
0,04В
2. Составить схему ГЭ, в
котором
протекает
химическая реакция
Ге
+
№
2+
=
Ре
2+
+ №.
Написать
уравнения электродных процессов . На основании
стандартных значений энергий Гиббса образования ионов
А
Г
С°
(298 К,
Ме
п+
)
рассчитать стандартное напряжение ГЭ и
константу равновесия реакции при 298 К.
О°
(298 К,
№
2+
)
= - 64,4 кДж/моль;
(298 К,
Ге
2+
)
= - 84,94 кДж/моль.
РЕШЕНИЕ
На основании реакции
приведенной в условии
задачи составляем
-уравнения электродных
Дано
А^<3°(298К,
Nг
+
)
= -64 4
кДж/моль
АКЗ°(298К,
Ре
3+
)
=
-84,94
кДж/моль
Т = 298 К
процессов
86
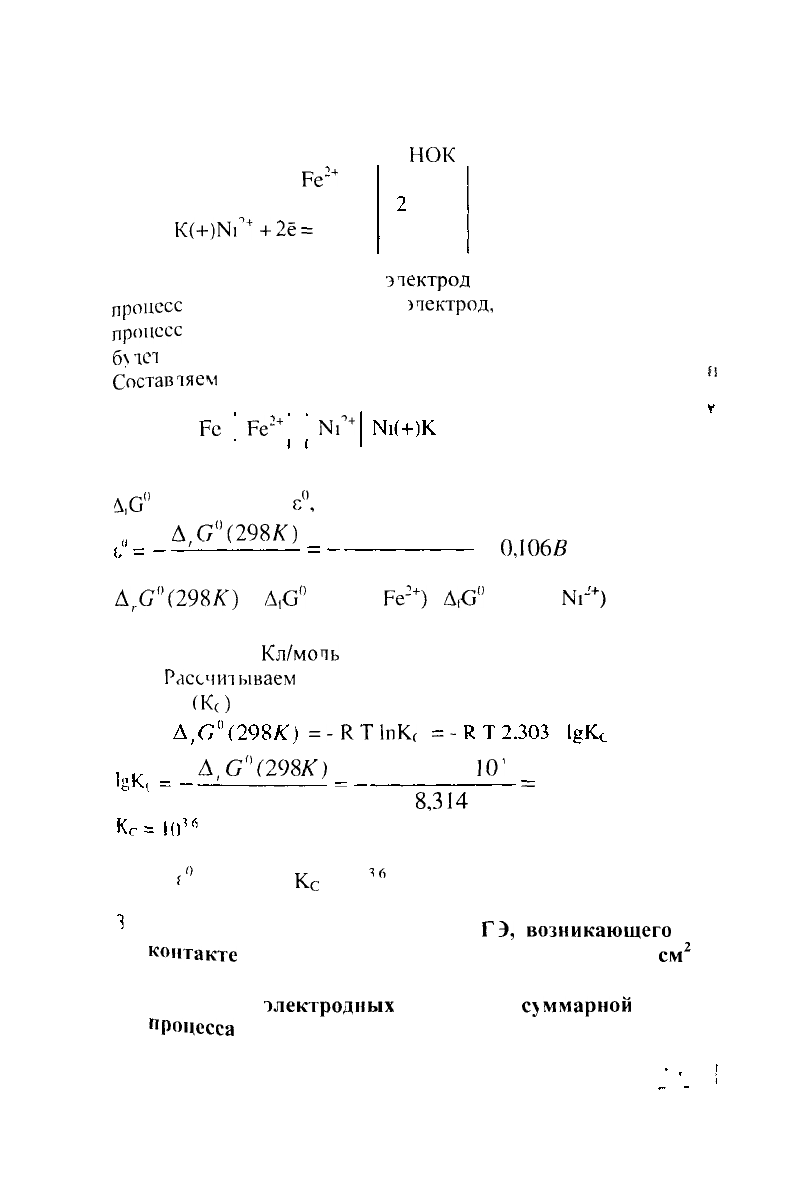
На А(-)Ре - 2ё =
Ре
:+
На К(+)МГ
+
+
2ё
=
N1
нок
дм
1 окисление
1 восстановление
Анодом ГЭ является
этектрод
на котором происходит
процесс
окисления Катодом -
эчектрод,
на котором происходит
процесс
восстановления Тогда в рассматриваемом ГЭ анодом
б\
чет
являться железо, катодом - никель
Составпяем
схему ГЭ
(!
А(-)
Ре
Ре
2+
НГ
+
Рассчитываем стандартное напряжение ГЭ
\0"
(298
К) = - г Р
с".
Д,С°(298К)
(-20.54) 10
=
0,1065
7 Р 2 96500
Л
Г
С°(298К) =
А,О°
(298 К.
Ре
:+
)
-
А,О
0
(298 К,
Нг
+
)
=
= 84.94-( 64,4) = -20,54 кДж.
/ = 2. Р =
96500
Кл/мопь
Рассчитываем
константу равновесия токообразующей
реакции
(К
с
)
=-КТ1пК
с
=-
Л,
С"
(298
А")
(-20,54)
10'
2,3 К Т
2,3
8,314
298
=
3,6
1Й
Ответ
г
()
= 0,106 В,
К
с
= 10
Составить схему коррозионного
ГЭ,
возникающего
при
контакте
железной пластинки площадью 20
см
2
с
никелевой в растворе соляной кислоты НС1. Написать
Уравнения
электродных
процессов и
суммарной
реакции
процесса
коррозии.
87
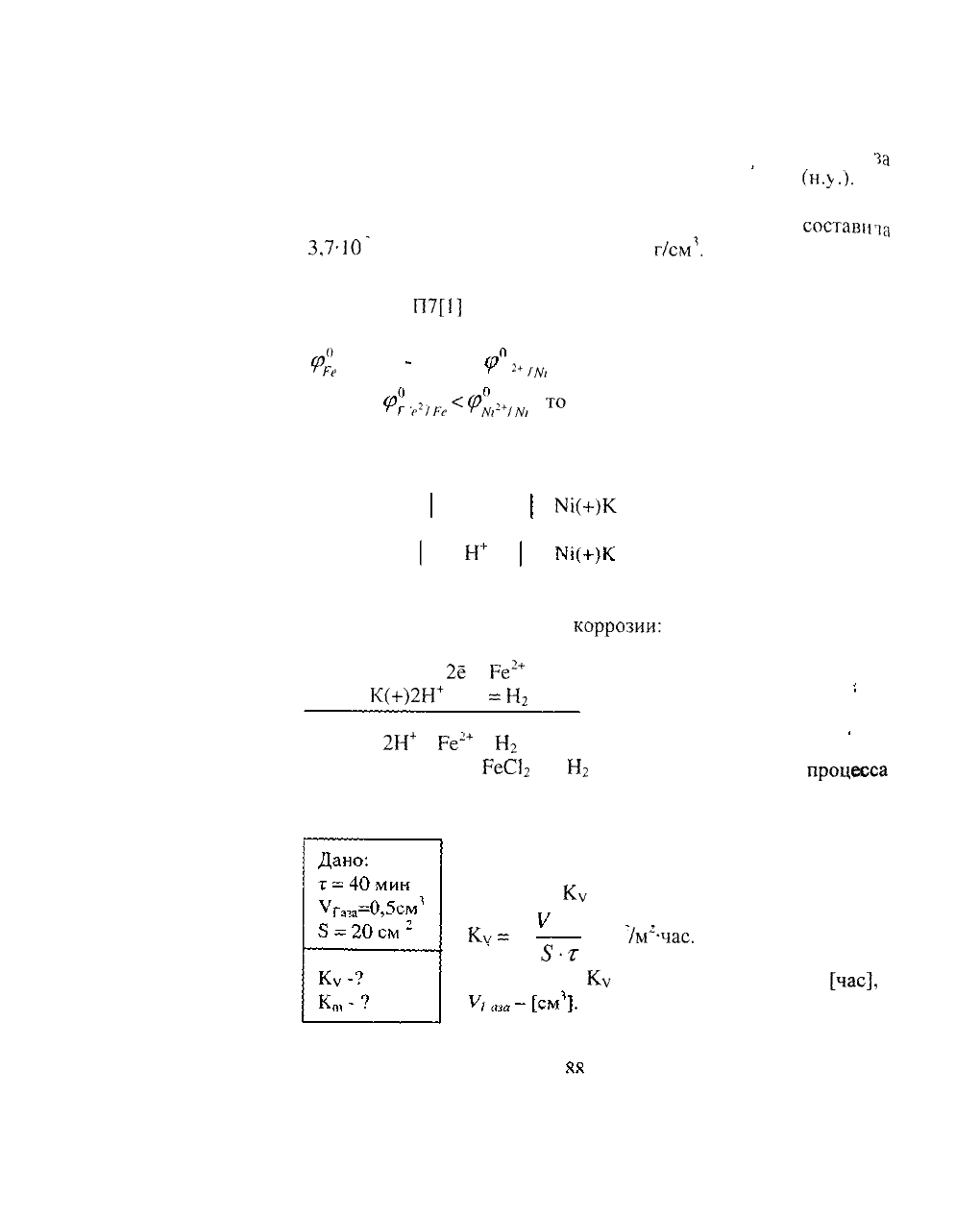
а) Вычислить объемный и весовой показатели коррозии, если
за
40 минут в процессе коррозии выделилось 0.5 см газа
(н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если
за 120 минут потеря массы железной пластинки
состашлд
3,7-10
г. Плотность железа равна 7,9
г/см
1
.
РЕШЕНИЕ
По таблице
П7[1]
находим значения стандартных электродных
потенциалов железа (II) и никеля (II):
д>
п
=
-
0,44
В,
г
Ре
I Ре
г
.
1
д;
N1
I
М:
= -
0,25
В.
Так как
^
1Ре
<(
Р^
1т
.
то
анодом коррозионного ГЭ будет
являться железо, катодом - никель.
Составим схему коррозионного ГЭ:
А(-)Ре
или
А(-)Ре
на
н
+
N^(+)К
Составляем уравнения электродных
суммарной реакции процесса
коррозии:
На А(-)Ре -
2ё
=
Ре
2+
На К(+)2Н
+
+ 2ё
=
Н
2
процессов и
а)
Ре +
2Н
+
=
Ре-
+
+
Н
2
Ре + 2НС1 =
РеС1
2
+
Н
2
- суммарная реакция
процетса
коррозии.
РЕШЕНИЕ:
Рассчитываем объемный показатель
коррозии
XV
по формуле:
XV
=
Газа
8-т
, см
/м'-час.
При расчете
Ку
принимаем: 5 - [м
2
], т -
[час],
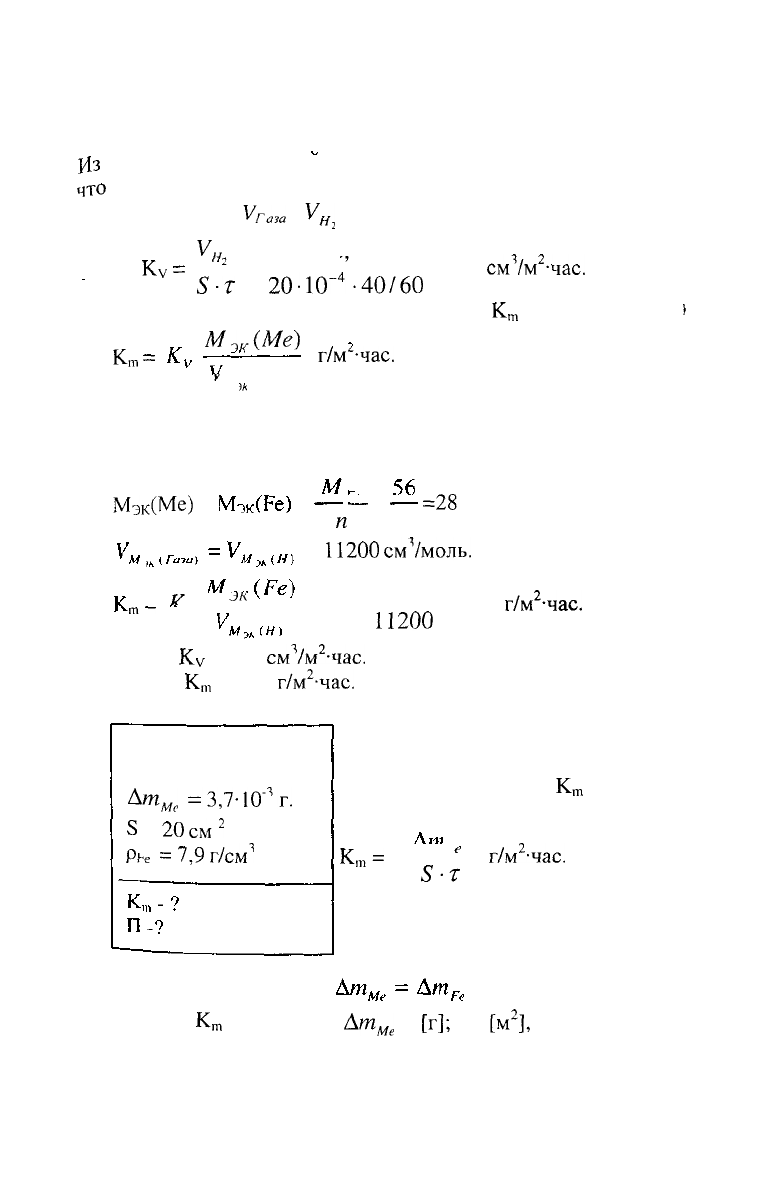
{4з
уравнения суммарной реакции процесса коррозии следует,
что
при коррозии выделяется водород.
Следовательно,
V
Га1а
=
У„
2
.
У
н
0,5
Тогда,
К
у
=
2
=
,'
= 375
см
3
/м
2
-час.
5-т
20-Ю"
4
-40/60
Рассчитываем весовой показатель коррозии
К
т
по формуле:
>
М,ЛМе)
К
т
-
'
, г/м-час.
М
№
(Газа)
В процессе коррозии разрушению подвергается железо и
выделяется водород.
Следовательно:
Мэк(Ме)
= =
—
—
=
—
=28
г/моль,
п
2
=
П200
см'/моль.
б)
К
—
V
^
Л
т
~
V
Ответ:
Ку
= 375
см
1
/м
2
-час.
К
П1
= 0,94
г/м
2
-час.
28
= 375 • = 0,94
г/м
2
-час.
11200
Дано:
т = 120 мин
Дт„
г
=3,7-1(Г
1
г.
5
=
20
см
2
Рне
=7,9
г/см
1
РЕШЕНИЕ:
Рассчитываем весовой
показатель коррозии
К
т
по
формуле:
К
т
=
е
,
г/м
2
-час.
5-т
Коррозии подвергается
железо. Тогда потеря массы
металла
При
Расчете
К
т
принимаем:
Ат
Ме
-
[г];
8 -
[м
2
],
г -
[час].
89
Тогда
К
т
=
3,7
10"
8т
20
10~
4
120/60
-=0,925г/м
час
Рассчитываем глубинный показатель коррозии по формуле:
П
=
К
т
8
'
76
=
0,925
^
=
1,03
мм/год
Рме
7,9
Ответ
К
т
=
0,925 г/м
2
час, П = 1,03 мм/год
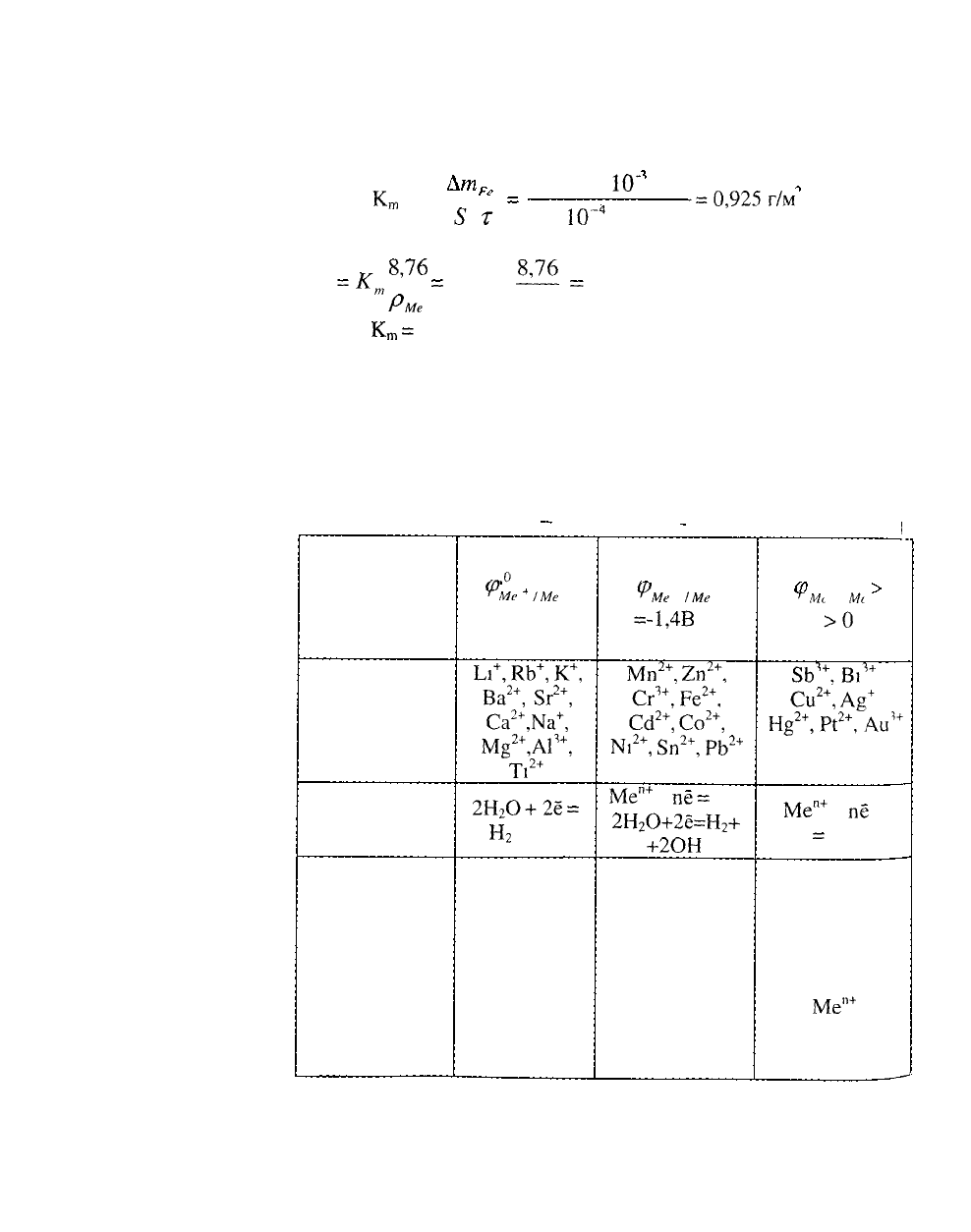
11. ЭЛЕКТРОЛИЗ РАСТВОРОВ
При составлении схем электролиза растворов могут быть
использованы таблицы катодных и анодных процессов
(таб
1 и 2)
КАТОДНЫЕ ПРОЦЕССЫ
Таблица
Электродный
потенциал
процесса
восстановле
ния
Группы
катионов
металлов
Катодный
процесс
Описание
процесса
^о
Ф
<
т
Ме
*
1
Ме
<-
1,4В
1л",
КЬ
+
,
К
+
,
Ва
2+
,
5г
2+
,
Са
2+
,№
+
,
М
ё
2+
,А1
1+
,
Т,
2+
2Н
2
О+2ё
=
=
Н
2
+ 2ОН
Восстанавли
ваются
только
молекулы
воды, а
ионы
металлов
остаются в
католите
о _
™Ме
*
1Ме
~
=-1,4В 0
Мп
2+
,
2п
2+
,
Сг
3+
,
Ре
2+
,
Сс1
2+
,
Со
2+
,
М1
2+
,
Зп
2+
,
РЬ
2+
Ме'
1+
+
пё
=
Ме
2Н
2
О+2ё=Н
2
+
+2ОН
Одновременно
восстанавлива
ются и ионы
металлов, и
мо текулы
воды
•"
0
^Мс
I
Мс
>0
5Ь
1+
,В1
3+
Си
2+
,
А
ё
+
Н
Я
2+
,Р{
2+
,Аи'
+
Ме
п+
+
пё
=
=
Ме
Восстанавлива
ются только
ионы металла
Ме"
+
_^
90
