Яглов В.Н. (ред.) Задачи предлабораторного контроля по химии
Подождите немного. Документ загружается.

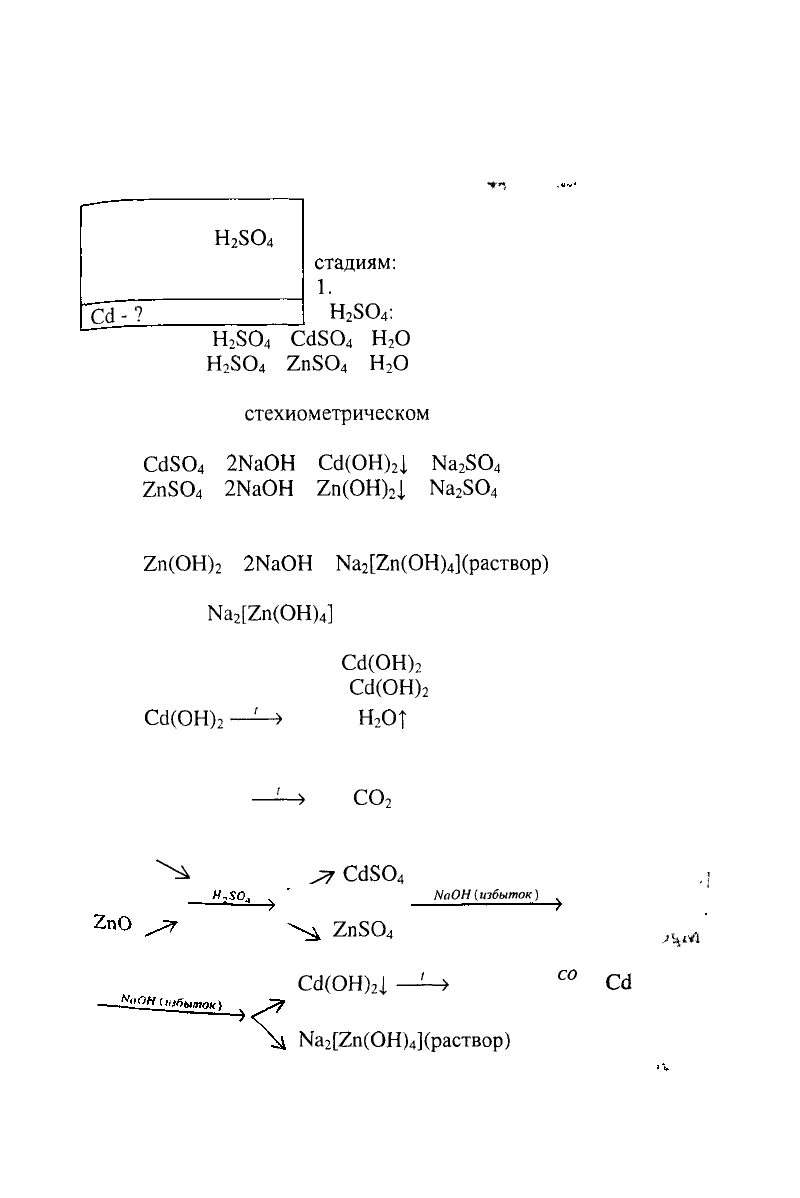
Дано:
СсЮ, 2пО, Н
2
5О
4
-
- растворитель
СО - восстановитель
СсЬ?
РЕШЕНИЕ:
•*"•
Составляем схему разделения оксидов
и записываем уравнения реакций по
стадиям:
1.
Растворение оксидов кадмия и цинка
в Н
2
5О
4
:
СсЮ +
Н
2
ЗО
4
=
Сё5О
4
+
Н
2
О
2пО +
Н
2
ЗО
4
=
2пЗО
4
+
Н
2
О
2. Осаждение гидроксидов кадмия и цинка гидроксидом
натрия при
стехиометрическом
соотношении солей и
гидроксида натрия:
Сс15О
4
+
2МаОН
=
Сё(ОН)
2
].
+
Ыа
2
5О
4
2пЗО
4
+
2МаОН
=
2п(ОН)
2
|
+
Ма
2
ЗО
4
3. Растворение амфотерного гидроксида цинка в избытке
щелочи:
2п(ОН)
2
+
2МаОН
=
На
2
[2п(ОН)
4
](раствор)
избыток
Так как
Ыа
2
[2п(ОН)
4
]
- растворимая соль, в осадке остается
гидроксид кадмия.
4. Отделение осадка
Сс1(ОН)
2
от раствора фильтрацией.
5. Разложение осадка
Сс1(ОН)
2
при нагревании:
Сй(ОН)
2
—-!-»
СсЮ +
Н
2
ОТ
6. Восстановление СсЮ оксидом углерода (II) при
нагревании:
СсЮ + СО
—'—>
Сё +
СО
2
Общая схема получения металлического кадмия из смеси
оксидов будет иметь вид:
СсЮ \^
^Сс130
4
,;
NаОН(избыток)
2п5О
4
^
м
Сё(ОН)
2
|
—!—>
СсЮ '
со
)
Сс1
Ыа
2
[2п(ОН)
4
](раствор)
101
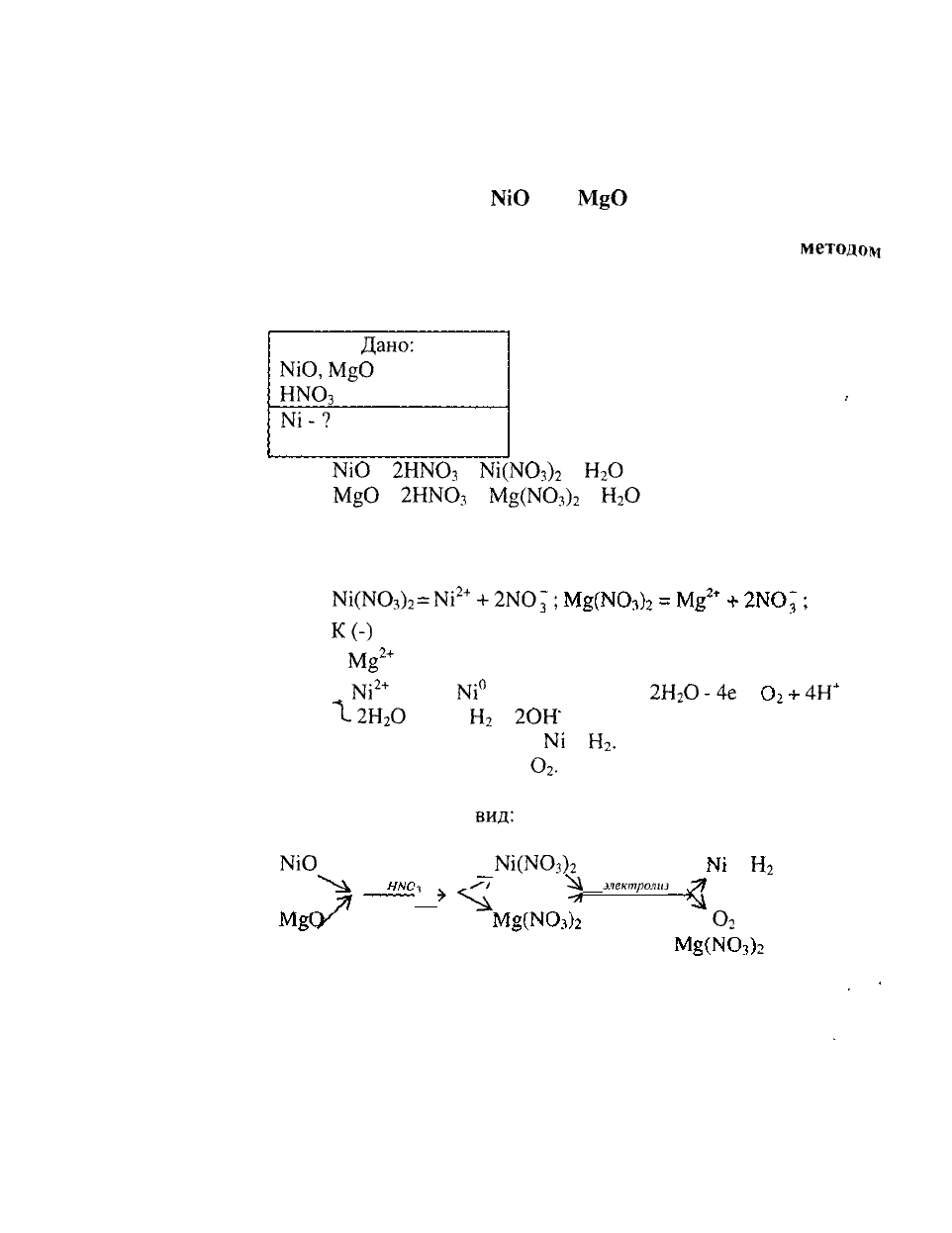
3. Составить схему получения металлического никеля
из смеси оксидов
№О
и
М§О
гидрометаллургическим
методом. В качестве растворителя использовать азотную
кислоту. Никель из раствора выделить
методом
электролиза. Написать уравнения реакций и составить
схему электролиза.
РЕШЕНИЕ:
Составляем уравнения
реакций растворения оксидов
никеля и магния в азотной
-
кислоте:
Дано:
№О,
М§О
Н1ЧО
3
- растворитель
№-?
№О
+
2НЖ)
3
=
№(N03)2
+
Н
2
О
М§О
+
2НКО
3
=
Мя(Ш
3
)
2
+
Н
2
О
Составляем схему электролиза полученного раствора
солей с инертным анодом. В соответствии с таблицей 1 и 2 (см.
электролиз) схема электролиза будет иметь вид:
№(КО
3
)
2
=
№
2+
+
2Ж)~;
К(-)
М
В
2+
Г
№
2+
+ 2е =
№°
12Н
2
О
+ 2е =
Н
2
+
2ОН
На катоде выделяется
N1
и
Н
2
.
На аноде выделяется
О
2
.
Общая схема получения металлического никеля из смеси
оксидов будет иметь
вид:
А (+) (инертный)
N0;
2Н
2
О
-4е
=
4Н"
№О
№(N03)2
'т
\
*^*
^*
электролиз
»
Я^
-*
и
Н
2
(на катоде)
О
2
(на аноде)
2
(в растворе)
102
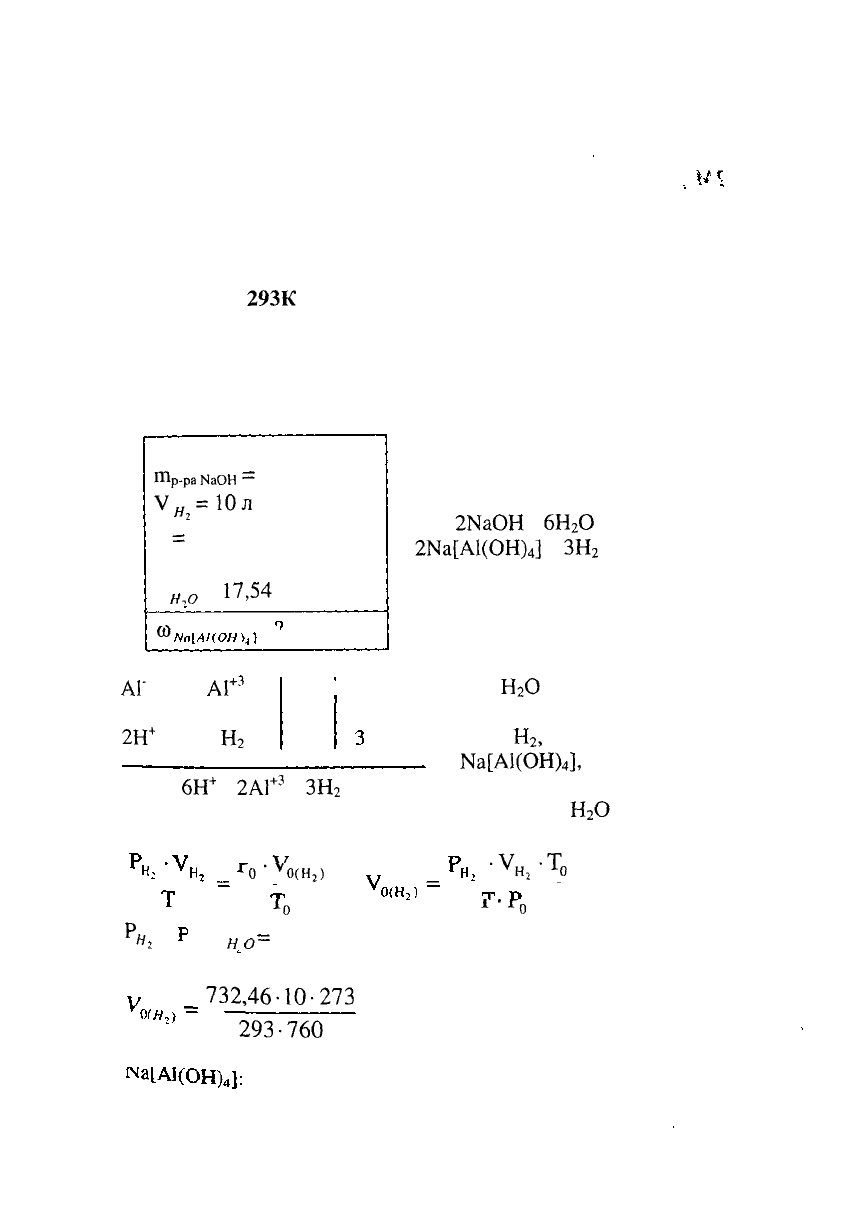
УРОВЕНЬ С
1. Навеску алюминия растворили в 80 г водного
раствора гидроксида натрия. При этом выделилось 10 л
водорода, собранного над водой и измеренного при
температуре
293К
и давлении 750 мм рт. ст. Давление паров
воды при этой температуре 17,54 мм рт.ст. Написать
уравнение реакции, расставить коэффициенты. Вычислить
массовую долю образовавшегося тетрагидроксоалюмината
натрия.
РЕШЕНИЕ:
Дано:
ГПр.ра
НаОН
=
80 Г
У
Яз
=10л
Р
=
750 мм рт.ст.
Т = 293 К
Р
н
^
0
=
17,54
мм рт.ст.
10
~ •
Записываем уравнение
протекающей реакции:
2А1 +
2ЫаОН
+
6Н
2
О
=
= 2№[А1(ОН)
4
] +
ЗН
2
АГ
- Зё =
А1
+3
2Н
+
+ 2ё =
Н
2
НОК ДМ
|
2
6
Т.к.
Н
2
О
расходуется не
только на получение 3-х
моль
Н
2
,
но и 2-х моль
На[А1(ОН)
4
],
то всего для
протекания реакции требу-
ется 6 моль
Н
2
О
2А1 +
6Н
+
=
2АГ
3
+
ЗН
2
Вычисляем объем выделившегося водорода при н.у.
Р
-V
Г
0
У
0(Н
2
)
•у
Нз
-т
0
Р
н,
=
А
о
*
'
г
о
' - Р
н
0
=
750 - 17,54 = 732,46 мм рт.ст.
_
732,46-10-273
—
= 8,98л
293-760
По уравнению реакции определяем массу образовавшегося
103

2Л/
""--
)4]
-
3-22,4
л
Н
2
и Г
8,98
л
Н
2
•2-
п
-
22Л
Определяем
мае™
ВСТЛ/Г7
вступившего
в
Ответ:
:
со
104
8^^27
3-22,4
Определяем массу выделившегося водорода:
22,4
л
Н
2
-2
г
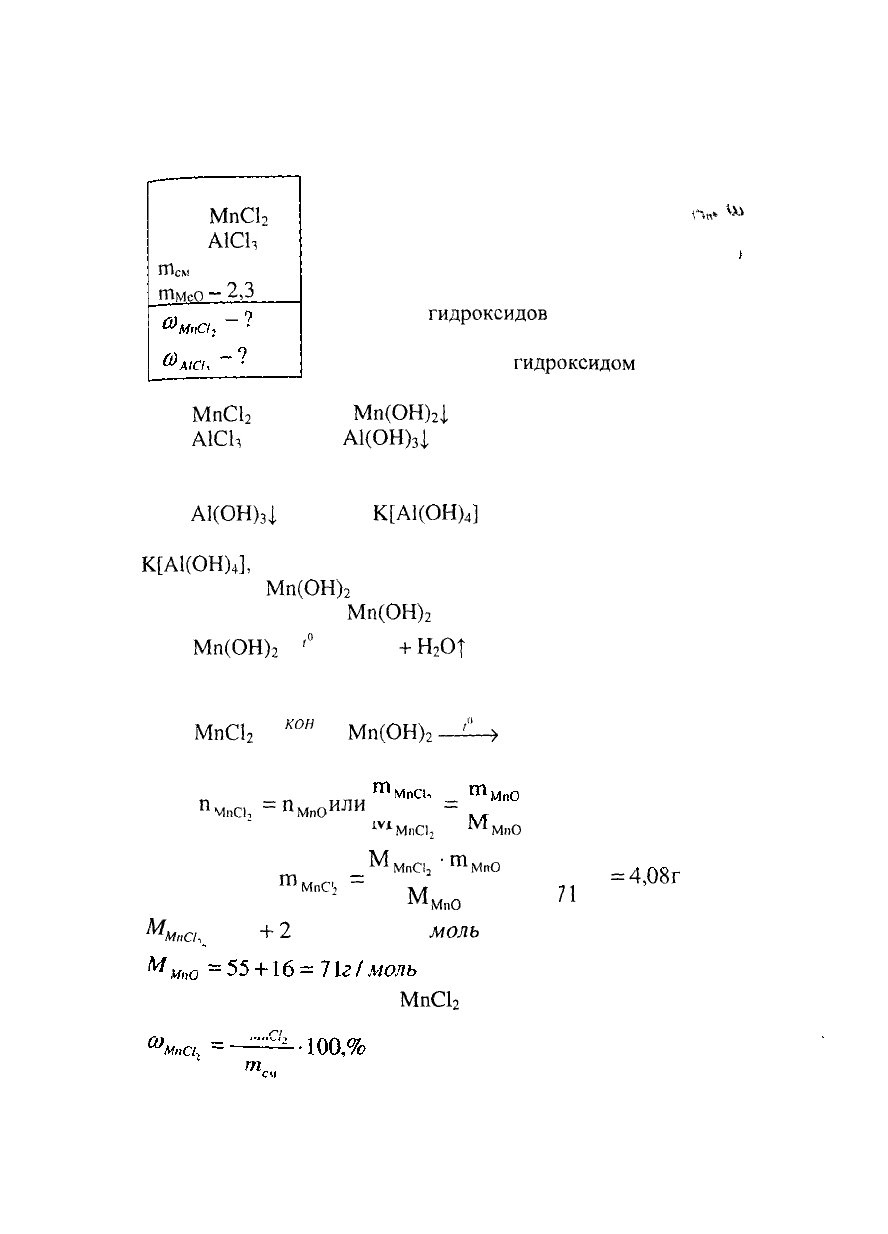
Дано:
Соль
МпС1
2
Соль
А1С1,
т
см
= 6,5 г
ГПМеО
~
2,3
Г
РЕШЕНИЕ:
Составляем уравнения ~
г«»
^
реакций разделения хлоридов
марганца (II) и алюминия,
растворенных в воде.
Осаждение
гидроксидов
марганца (II)
и алюминия при стехиометрическом
соотношении солей
гидроксидом
калия проте-
кает по уравнениям:
МпС1
2
+ 2КОН =
Мп(ОН)
2
|
+ 2КС1
А1СЬ
+ ЗКОН =
А1(ОН)
3
|
+ ЗКС1
Растворение амфотерного гидроксида алюминия в избытке
гидроксида калия протекает по уравнению:
А1(ОН)
3
|
+ КОН =
К[А1(ОН)
4
]
(раствор)
Гидроксид алюминия переходит в раствор в виде
К[А1(ОН)
4
],
в осадке остается гидроксид марганца (II).
Осадок
Мп(ОН)
2
отделяется от раствора фильтрацией. При
прокаливании осадка
Мп(ОН)
2
протекает реакция:
Мп(ОН)
2
'"
> МпО
+
Н
2
ОТ
Схема получения оксида марганца (II) из хлорида
марганца (II) имеет вид:
МпС1
2
кон
)
Мп(ОН)
2
—?—>
МпО
Из схемы получения оксида марганца (II) следует:
Пмю
2
=п
мл
или -
=
1У1
МпСЦ
1У1
МпО
М
МпС
,-т
мп0
126-2,3
Откуда:
ш
МпС1
=
"
=
=4,У5Г
2
^N4.
/1
МпО
М
м„а,
= 55
+
2
- 35,5 = 126г /
моль
Рассчитываем содержание
МпС1
2
в смеси хлоридов:
т..
,,,
105

со
м
__
4,08
*Л/СУ,
,
Содержание
д
РЕШЕНИЕ-
а
соответствии со
-едствием
из
р
Яда
С
°
стандартных
элек-тп
гг--~
Пределяе
«
стандартные
из
сплава
будет
-1 67В
п
Раств
орятьс
я
только
106

2М
А1
- 3 • 22400
см
3
Н
2
Откуда
2-М
д
,
•
3-22400
где
М
А
|=27г/моль
Объем водорода при н.у. -
У
О(ЯЗ)
рассчитываем по
объединенному уравнению приведенного газового состояния:
Р
-V
Р • V
Г
Н
2
Н
2
_
Г
0
У
0(Н
2
)
Т Т
1
А
о
Р
-V
-Т
^
Т/
Н
-
Н
2
О
Откуда:
У
0(Н
^
=
1
'
*о
(Р-Рн,о)'^н
2
-Т
0
(740
-26,74)-
43,56
-273
= = — -- = 37,2мл
Т-Р
0
300-760
где
Р
Нг
=Р-Р
(Н
,_
0)
Подставляя величину
У
0(Н
,
в формулу
(1),
получаем:
т
2.М
Д
,.У
0(Н1
,
=2
.27.37,2
=
3-22400
3-22400
Рассчитываем содержание металлов в сплаве:
Ш
А1
=
ША
'
-100
=
°'°
3
•
100%
= 6%
т
спл
0,5
со
си
=100-ю
А1
-100-6
= 94%
Ответ:
й)
А1
= 6% ,
(Л
Си
- 94%
107

13. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
УРОВЕНЬ А
1. Назвать следующие комплексные соединения:
К
3
[Ее(С1\ад,-
[Р<С1
3
(1УН
3
)з]С1;
[Со(1ЧО
2
)
3
(МШ
Ответ:
1
.
К-^[Ре(СN)ь]
-
гексацианоферрат
(III) калия.
2.
[Р[(]УН1)зС1
т]С\
- хлорид
трихлоротриамминплатины
(IV)
3.
[Со^НчМЖЬЫ-
тринитротриамминкобальт.
2. Написать формулы следующих химических соединений:
сульфат
тетраамминмеди
(II), гексахлороплатинат (IV)
калия,
тетрахлороакваамминплатина.
Ответ.
2.
К
2
[Р1С1
6
]
з.
УРОВЕНЬ В
1. Определить заряд комплексного иона, степень окисления
и координационное число комплексообразователя в каждом
из соединений
Написать уравнения диссоциации этих соединений в
водных растворах.
Дано:
Заряд комплексного
иона-?
кч
-
?
РЕШЕНИЕ:
Диссоциация комплексных
соединений протекает с
отщеплением ионов
внешней сферы по типу
диссоциации сильных
электролитов:
=
4К
+
Заряд комплексного иона
[Мо(СКХ]
равен суммарному
заряду ионов внешней сферы, но противоположен ему по знаку.
108
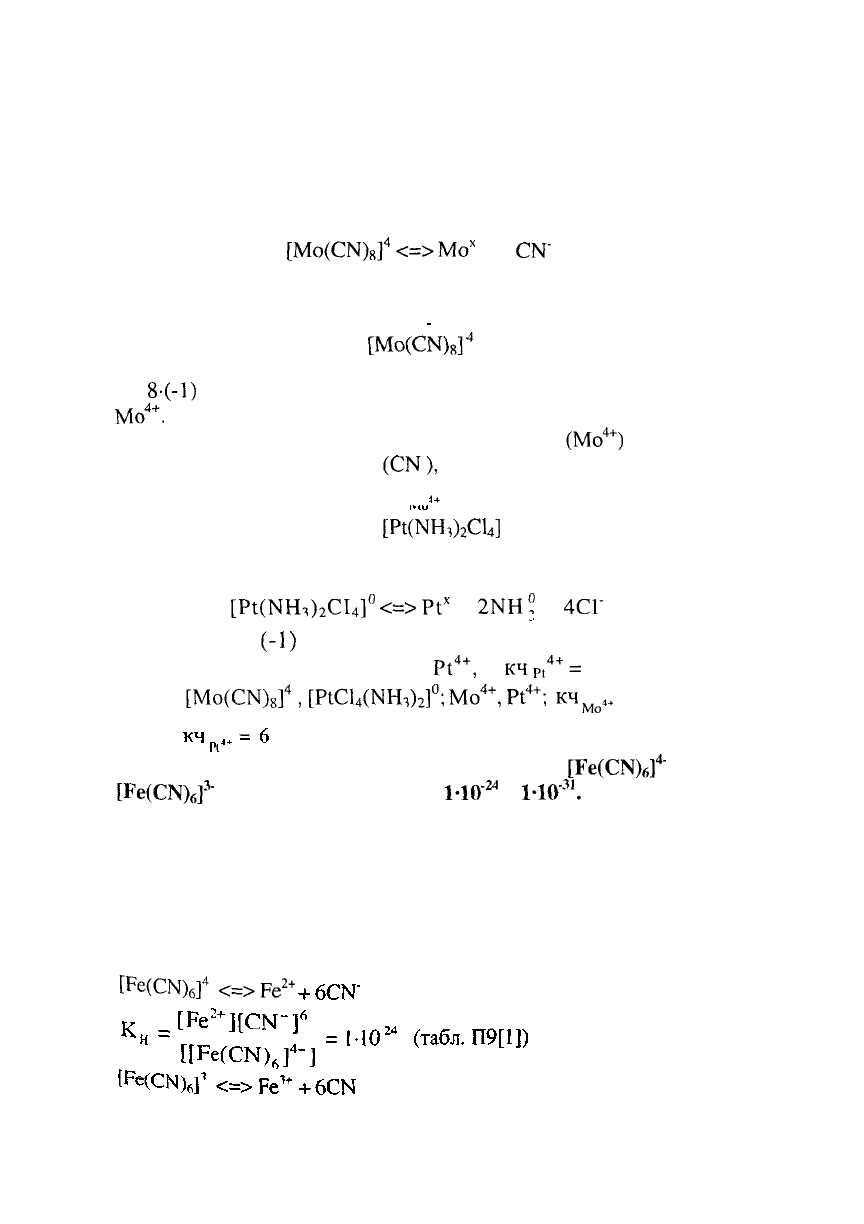
Вторичная диссоциация комплексного иона обратима и
протекает по типу диссоциации слабого электролита:
[Мо(СН)
8
]
4
<=>
Мо
х
+ 8
СМ'
Степень окисления комплексообразователя (х)
определяется по заряду комплексного иона:
х
[Мо(СМ)„]
4
х +
8-(-1)
= -4, откуда х = + 4, т.е. заряд комплексообразователя
Мо
4+
.
Координационное число комплексообразователя (Мо
4+
) равно
суммарному числу лигандов
(СМ),
окружающих
комплексообразователь, т.е. кч
.+
= 8.
Так как соединение
[Р^МН^СЦ]
не содержит внешней
сферы, то его заряд равен нулю (неэлектролит) и для него
наблюдается только вторичная диссоциация:
[РЦМШЬСи]
0
<=>
Р1
Х
+
2МН°
+
4СГ
х + 2 • 0 + 4 •
(-1)
= 0, х = +4, т.е. заряд
комплексообразователя
Р1
4+
,
а
кч
Р
,
4+
=
6
Ответ:
[Мо(СМ)
8
]
4
,
[Р1С1
4
(НН
1
)
2
]°;
Мо
4+
,
Р1
4+
;
кч
Мо4+
= 8;
2. Константа нестойкости комплексных ионов
[Ре(СМ)
б
]
4
~
и
[Ре(СМ)
6
]
3
"
соответственно равны
1-Ю"
24
и
1-Ю'
31
.
Написать
выражения констант нестойкости этих ионов и рассчитать
константы их устойчивости. Какой из комплексных ионов
является более прочным.
РЕШЕНИЕ:
Диссоциация комплексных ионов процесс обратимый и
количественно описываются константами нестойкости.
[Ре(СМ)
6
]
4
<
=
>ре
2+
109

К„
=
РЕШЕНИЕ-
.
Остальные
ьх
«нешнюю
сферу
Ы
ХЛ
°Р
а
110
