Яглов В.Н. (ред.) Задачи предлабораторного контроля по химии
Подождите немного. Документ загружается.


Дано:
Уравнение реакции,
Т-?
РЕШЕНИЕ:
С0
2(г)
+
К =
со
"
р
Г
<=>
2СО
(Г)
Р
г
Значения
Д
(
Н°(298К)
и 5 (298К) веществ берем из табл.3[1]
Д
Г
Н°(298К),
кД
ж/моль
5°(298К),
Дж/(моль-К)
С0
2(г)
_
3
2137
(10
=
2СО
(Г)
2-(-
110,5)
2-(197,5)
-2,ЗКТ1§К
Р
=
Д
Г
Н°(298К)
-
ТД
Г
5°(298К)
Если
К
р
=
1
,
то
1§К
Р
= 0, тогда
Д
Г
Н°(298К)
-
ТД
Г
5°(298К)
= 0, а
_
где
10^
- коэффициент пересчета кДж в Дж
ДгН°(298К)
=
2Д
1
Н°(298К,
СО
(г)
)
-
[Д,Н°(298К,
СО
2(г)
)
+
+ Д,Н
()
(298К,
С
к
)]
А
Г
Н°(298К)
=
2-(-
1
10,5)
-
[(-393,5)
+ 0] = 172,47 кДж.
АгЗ°(298К)
=
2
5°(298К,
СО
(г)
)
-
[5°(298К,
СО
ад
)
+
3°(298К,
С
(Ю
)]
=
2-197,5
- (213,7 + 5,74) = 175,6
Дж/К
т
_
172,47^01
Ответ:
К
р
= 1 при 982 К.
175,6
41
Уровень С
1. Как изменится скорость реакции:
А
(Г
)
+
2В
(Г)
=
2С
(Г
),
если:
а) увеличить давление в системе в 2 раза;
б) увеличить концентрацию вещества В в 3 раза;
в) увеличить объем системы в 3 раза?
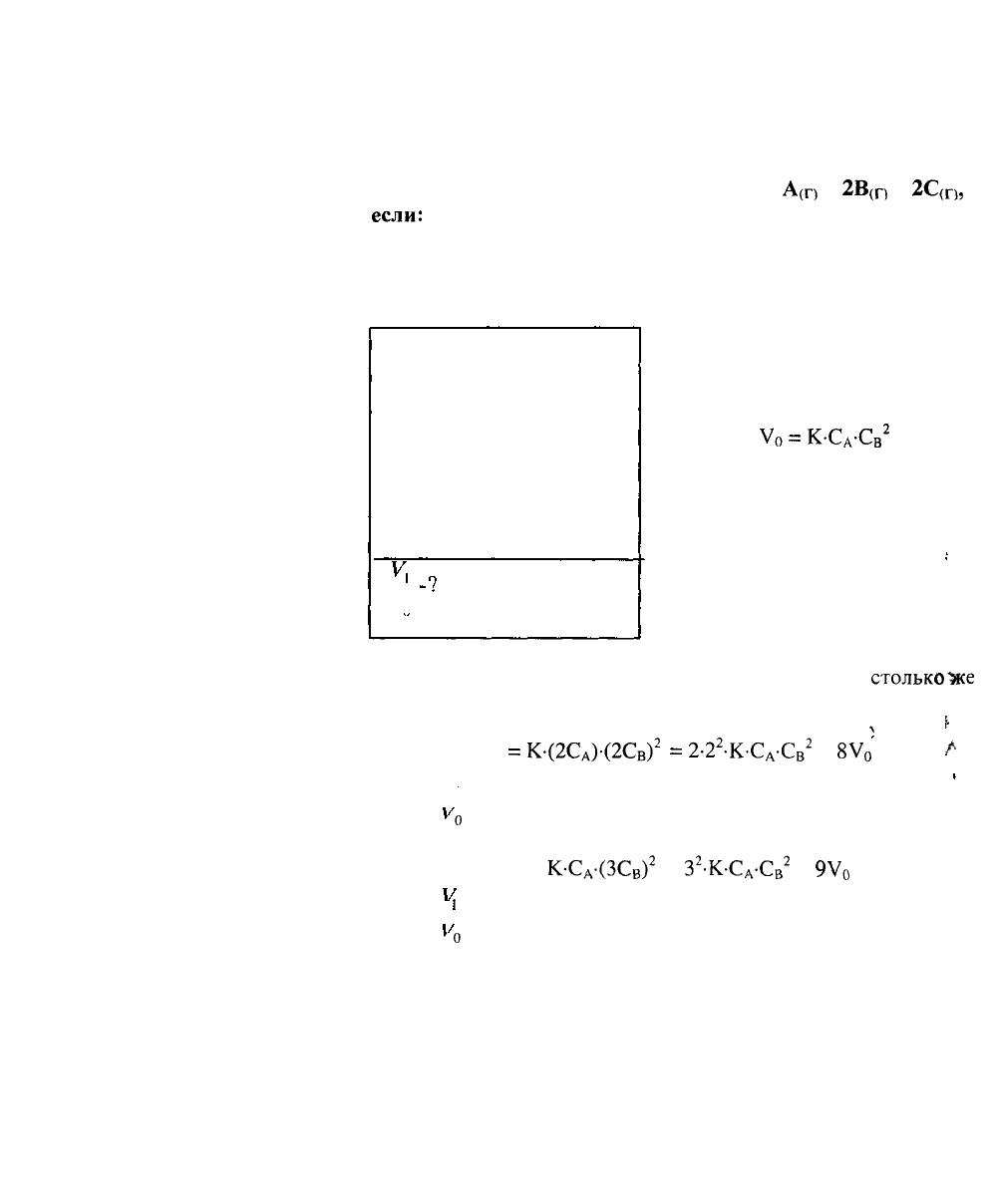
Дано:
Уравнение реакции,
а) Р увеличивается в
два раза
б) Св увеличивается в
три раза
в) V увеличивается в
три раза
К
РЕШЕНИЕ:
На основании закона
действующих масс
Уо
=
К-Сд-Св
2
а) увеличение давления в системе в 2 раза равносильно
увеличению концентрации реагирующих веществ во
столько
"Же
раз.
Следовательно:
^
^
V,
=
К-(2Сд)-(2С
в
)
2
=
2-2
2
.К-Сд.С
в
2
=
8У
0
-
А
V.
Тогда: = 8 раз.
м>
б) при увеличении концентрации вещества В в 3 раза.
V, =
К-С
А
-(ЗСв)
2
=
3
2
-К-С
А
.Св
2
=
9У
0
Тогда:
'
= 9 раз.
мз
в) увеличение объема в системе в 3 раза равносильно
уменьшению концентрации реагирующих веществ во столько
же
раз:
42
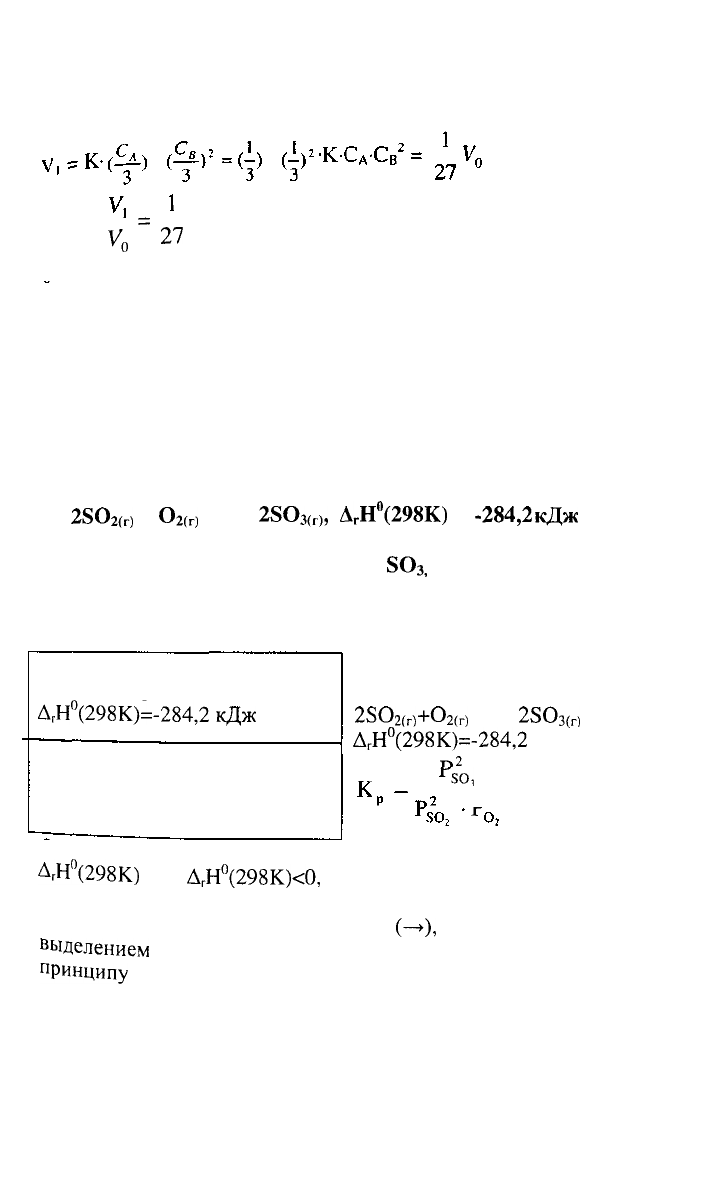
,
Тогда:
^
=
2?
Ответ: а) при увеличении давления в 2 раза скорость реакции
возрастает в 8 раз;
б) при увеличении концентрации вещества В в 3 раза скорость
реакции увеличивается в 9 раз;
в) при увеличении объема системы в 3 раза скорость реакции
уменьшается в 27 раз.
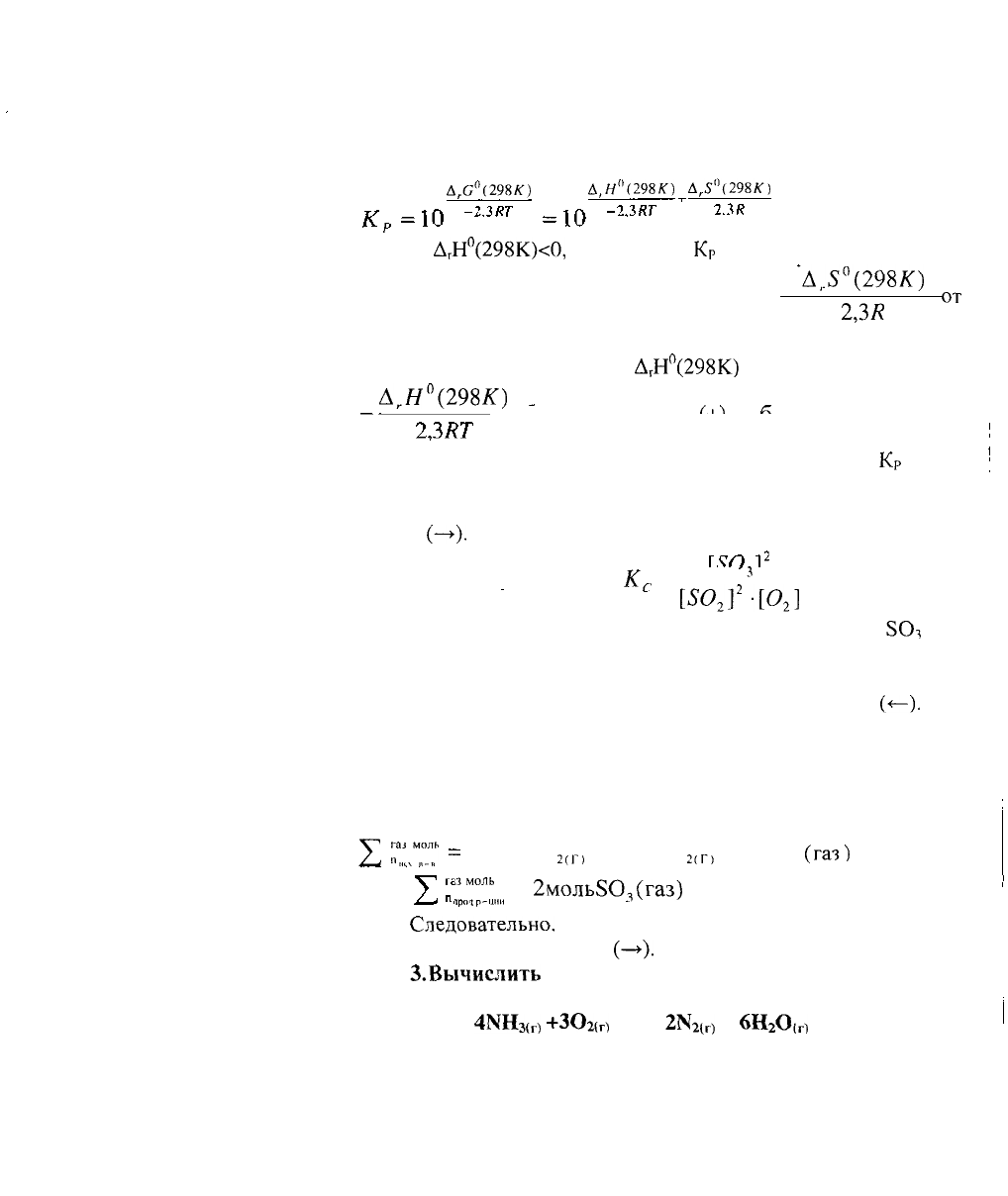
2. На основании принципа Ле Шателье определить, в
каком направлении сместится равновесие в
следующей системе:
250
2(г)
+
0
2(г)
<=>
280
3(г)
,
А
Г
Н°(298К)
=
-284,2
кДж
при: а) понижении температуры,
б) повышении концентрации
8О
3
,
в) повышении давления.
Записать выражения константы равновесия реакции:
Дано:
Уравнение реакции
А
г
Н°(298К)=-284,2
кДж
Определить направление
смещения равновесия
при изменении Т, Р, С
50,
РЕШЕНИЕ:
Константа равновесия реакции
250
2(г)
+0
2(г)
<=>
250
3(г)
Д
г
Н°(298К)=-284,2 кДж
Р
2
_
Г
50,
"
Р
Г
Смещение равновесия реакции зависит от знака
А
Г
Н°(298К)
Т.к.
Д
Г
Н°(298К)<0,
т.е. реакция
экзотермическая, то при понижении температуры равновесие
сместится в сторону прямой реакции.
(—>),
идущей с
выделением
теплоты. Протекание прямой реакции, согласно
принципу
Ле Шателье, ослабит эффект понижения
температуры.
43
К аналогичному выводу приходим из выражения
зависимости константы равновесия и энергии Гиббса
Д,С°(298ЛГ)
Д,Я"(298Л")
А
Г
5"(298Л')
Так как
Д
Г
Н°(298К)<0,
то значение
К
Р
будет равно 10 в дробной
"Д.5°(298/0
положительной степени. Дробное слагаемое
от
2,3^?
температуры не зависит. Тогда при понижении температуры и
отрицательном значении
Д
Г
Н°(298К)
дробное слагаемое
Д.Я°(298*Г)
_
^
к
— будет иметь знак (+) и будет возрастать т.е.
суммарное значение показателя степени и значение
К
Р
будут
возрастать. А это означает, что количество продуктов реакции
должны возрасти, что возможно при смещении равновесия
вправо
(—>•).
б) Константа равновесия
К
г
=
,
3
не зависит от
[50
2
]
2
-[0
2
]
концентрации. Поэтому при повышении концентрации
5СЬ
при
неизменном значении Кс должны возрасти концентрации
исходных веществ, а это возможно при протекании обратной
реакции. Т.е. в этом случае равновесие сместится влево
(<—).
в) В соответствии с принципом Ле Шателье увеличение
давления смещает равновесие в сторону той (прямой или
обратной) реакции, которая сопровождается уменьшением
суммарного числа моль газообразных веществ (уменьшением
давления).
X!
™,\Т?
=
2мольЗО
2(Г)
+ 1мольО
2(П
= Змоль
(газ)
омояь
=
2моль50,(газ)
1Р05
р-ции
-'
Ч
'
Следовательно,
при повышении давления равновесие
системы смещается вправо
(—>).
З.Вычислить
константу равновесия для гомогенной
системы:
41ЧН
3
(
Г
)
+ЗО
2(
г)
<=>
2^
(г)
+
6Н
2
О
(Г)
44
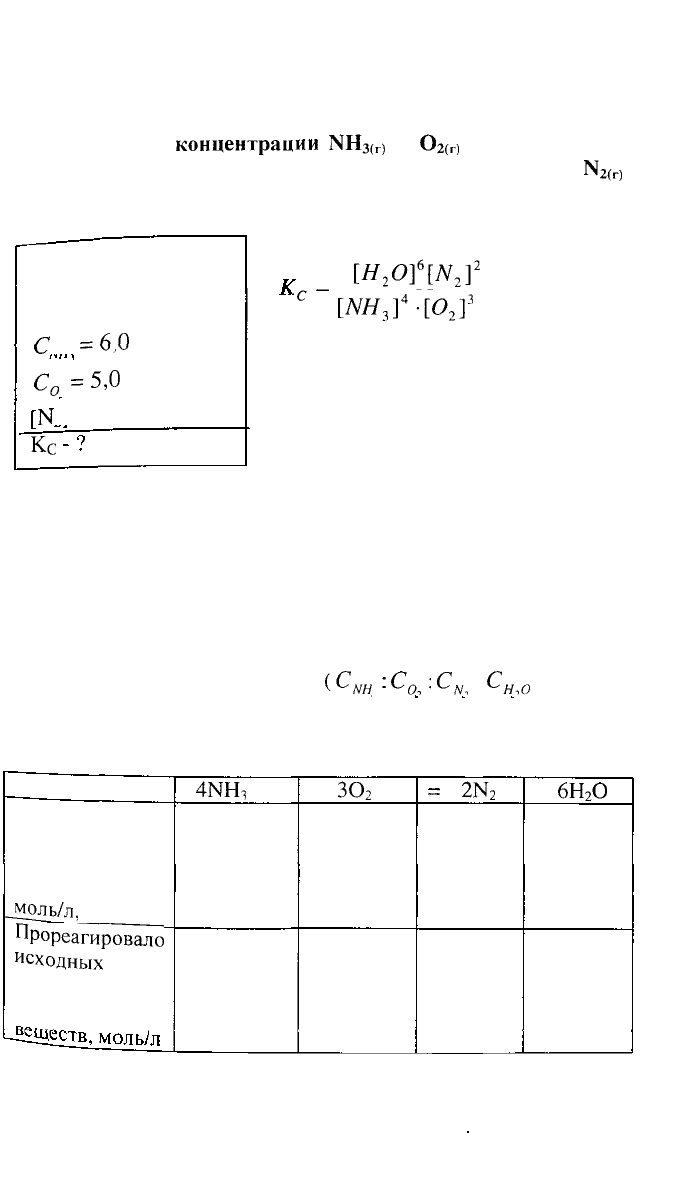
если
равны
исходные
концентрации
МН
3(г)
и
О
2(Г
)
соответственно
6,0 и 5,0 моль/л, и равновесная концентрация
N2^)
равна 1,8 моль/л.
Дано:
Уравнение
реакции,
С
=6,0
моль/л
С
0
=5,0
моль/л
К
= 1.8 моль/л
К
с
РЕШЕНИЕ:
_
[Н
2
О]
6
[М
2
]
2
С
~[М/
3
]
4
.[Ъ
2
]
3
Расчет количеств прореагировавших
и образовавшихся веществ
производится по уравнению
реакции.
Равновесная концентрация исходных веществ равна
разности исходной концентрации и концентрации
прореагировавших исходных веществ. Равновесная
концентрация продуктов реакции равна количеству
образовавшихся продуктов реакции.
Обозначим за X количество моль прореагировавших или
образовавшихся веществ. Тогда с учетом коэффициентов в
уравнении реакции, отношения концентраций во второй строке
под
уравнением реакции равны:
(С
т
:
С
о
^:
С^
:
С
н
^
0
-
4:3:2:6)
Последовательность расчетов равновесных концентраций
веществ, участвующих в реакции показана ниже:
Исходная
концентрация
веществ,
_МОЛЬ/Л,
Прореагировало
исходных
и
образовалось
конечных
4НН
3
+
6,0
4Х
ЗО
2
5,0
зх
=
2^2
0
2Х
+ 6Н
2
О
0
6Х
45

Равновесная
концентрация
веществ, моль/л
6,0-4Х
5,0-ЗХ
2Х
6Х
По условию задачи равновесная концентрация N2 равна
1,8
моль/л. В то же время
ПМ
2
]
=
2Х. Следовательно 2Х =
1,8,
а X
=
0,9. Тогда равновесные концентрации веществ равны, моль/л:
[МНз]
=
6,0-4-0,9
= 2,4 моль/л
[О
2
]
=
5,0-3-0,9
= 2,3 моль/л
[N2]
=
1,8
моль/л
[Н
2
О]
=
6,0-0,9
= 5,4 моль/л
1,8
й
5,4
2
_
=
198,95
2,4
4
-2,3'
б) Схема расчета константы равновесия по второму
варианту приведена ниже:
30
2(г)
<=>
2Ы
2(Г)
+
6Н
2
0
(Г)
исходная
конц.
моль/л
прореаг.,
моль/л
6,0
4/2-1,8
<"
\
5,0
3/2-1,8
Равновес
6,0-4/2'1,8
5,0-3/2-1,8
ная
конц.,
моль/л
0.1.
О
обра-
зова-*-
1,8-^6/2-1,8
лось
моль/л
1,8
6/2-1,8
К
с
=
=198,95
(6/2
24794,91-3,24
(6.0-4/2-1.8)
4
•
(5,0-3/2-1,8)
3
33,18-12,17
Ответ:
К
с
=
198,95
46

6. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
РАСТВОРОВ
УРОВЕНЬ А
1. Привести формулы закона Рауля для водных
оастворов
неэлектролитов
и электролитов (давление
насыщенного
пара).
Ответ:
П
Н
2
О
*™
Н
2
О
т
н
2
о
М
В
но
,
.
- + I -
2. Привести формулы закона Рауля для водных
растворов неэлектролитов и электролитов (изменения
температур кипения и замерзания растворов).
Ответ:
тп
'
1000
Л?
=;.ъ
н
20 г
гп\
,"^
Н
2
т»
I
^>
Т
•С
т
(^)
=
г^
7
.
2
о
т
в
-1000
-1000
47

3. Привести формулы закона Вант-Гоффа для
вод
растворов неэлектролитов и электролитов.
Ответ:
т,
•КТ
-КТ
=
КТ
УРОВЕНЬ В
1. Вычислить температуры кипения и замерзания
водного раствора, содержащего 0,1 моль сахарозы
(С
]2
Я
22
0,,)в
ЮООг
раствора.
Э"
2
°
=0,52
кг-К/моль,
К"
2
°
= 1,86
кг-КУмоль
РЕШЕНИЕ:
Дано:
п
с
р
я ,
т
рра
=
Кр°
1кип
р-ра
1зам
р-ра
п
=0.1
МОЛЬ
(/
|
1
ЮООг
=
0,52
=
1,86
_ V
'
кип
р-ра
-
^
+ Д
{
кип
Цам
р-ра
—
и
ч^
~
Д
мам
С
т
(С\
2
Н
22
О
п
) -
моляльность
сахарозы в растворе, моль/кг.
С
т
(С'
12
//
22
О
П
)
=
«с„я„
0
-1000
где
^с
]2
н
п
о,,
~ количество растворенной сахарозы, моль.
С
т
(С,
2
Я
22
О,,)
=
0,1-1000
1000-0,1-
48
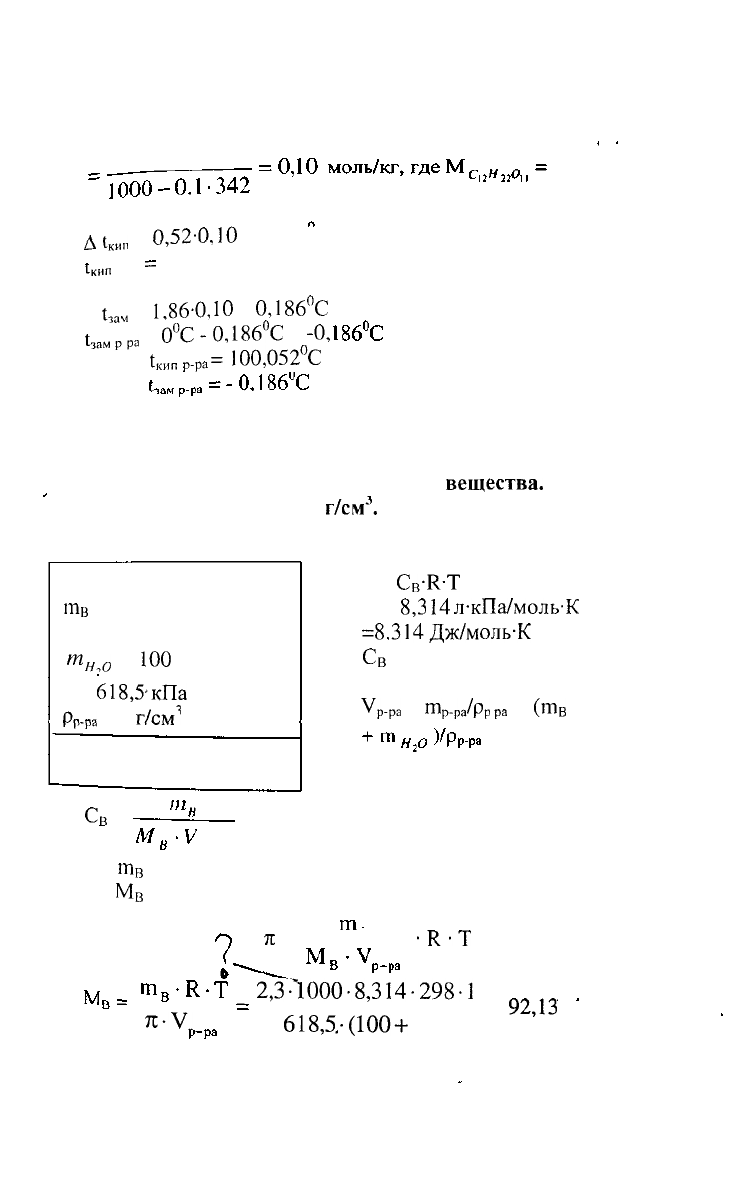
0.1-1000
- 342 г/моль
д
1кип
=
0,52-0,
10
= 0,052С
1кнп
р-ра
=
100°С + 0,052°С = 100,052°С
д
1^
=
1,86-0,
10
=
0,1
86°С
^
р
р.
=
0°С-0,186
0
С
=
-0,
Ответ:
1
КИП
„а
=ЮО,052°С
2. В 100 г воды содержится 2,3г неэлектролита. Раствор
обладает при 25°С осмотическим давлением, равным
618,5кПа. Определить молярную массу
вещества.
Плотность
раствора принять равной 1
г/см'.
Дано:
т
в
= 2.3 г
I = 25°С
т
н-,о
=
ЮО
г
я = 618,5'кПа
рр.
ра
= 1
г/см
1
М-?
РЕШЕНИЕ:
л = Св-КТ
К =
8,314
л-кПа/моль-К
=
=8.314Дж/моль-К
С
в
- молярная концентрация
вещества, моль/л.
У
р
.
ра
=
т
р
.
ра
/рр
ра
=
(т
в
+
С
в
=
р-ра
где
т
в
- масса растворенного вещества, г
М
в
- молярная масса растворенного вещества, г/моль.
п
=
Л-У.
в
.
к
.
т
2,3-1000-8,314-298-1
618,5.-(100+ 2,3)
_,
..
.
=
92,13
г/моль
49
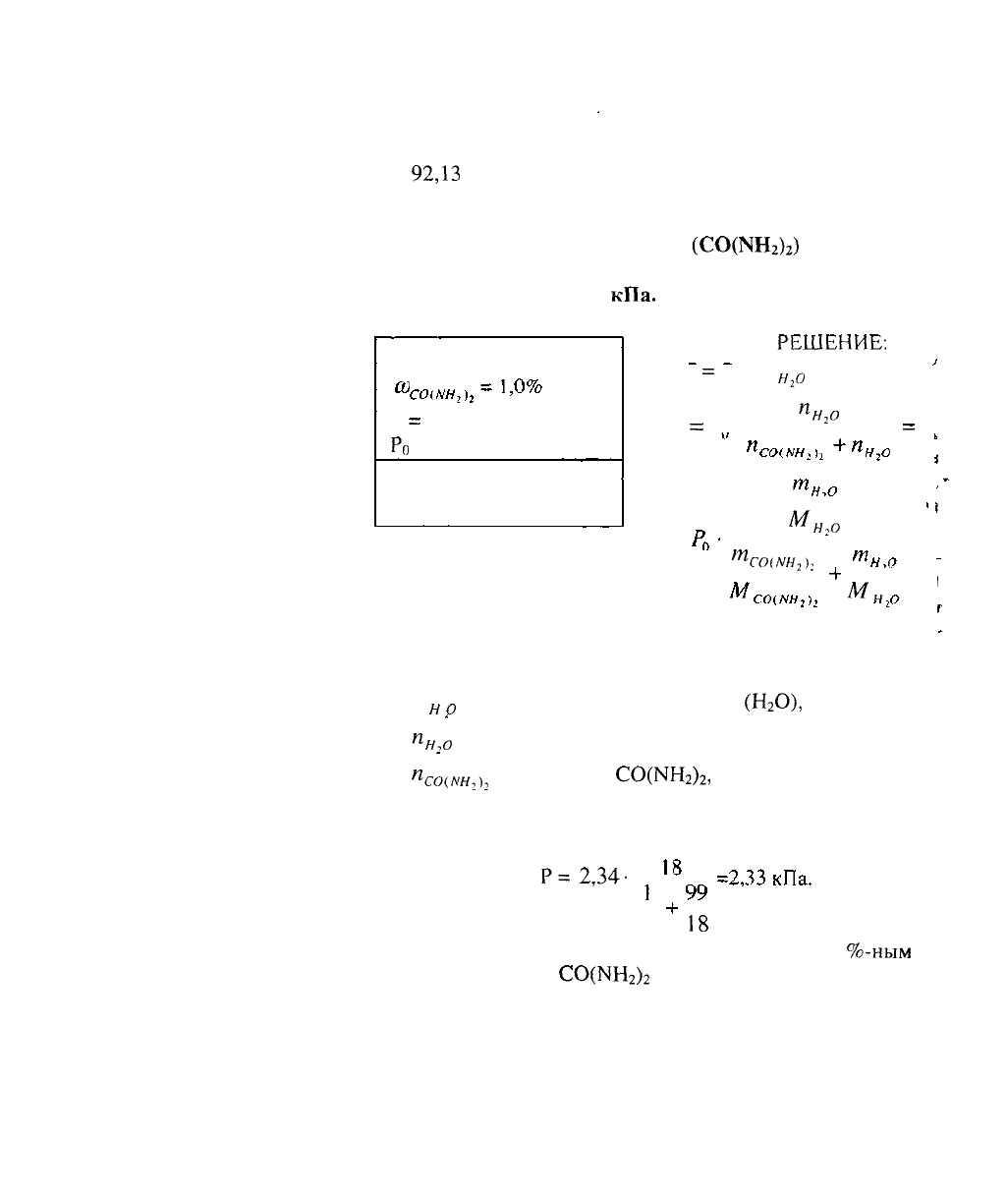
Ответ: молярная масса растворенного вещества равна
92,13
г/моль.
3. Определить давление насыщенного пара над 1,0%
водным раствором карбамида
(СО^НгЪ)
при 298 К, если
давление насыщенного пара над водой при той же
температуре равно 2,34
кПа.
Дано:
Т
=
298К
Ро
=
2,34
кПа
Р-?
РЬШЬНИЬ:
Р
=
РО ' X
н
^
о
—
=
р .
Нн
>°
М
но
т
СО(NН
г
)
г
М„
где Р - давление насыщенного пара растворителя над
раствором, кПа,
РО - давление насыщенного пара чистого растворителя, кПа.
х
н
0
- молярная доля растворителя
(Н
2
О),
п
н,о
' количество воды, моль,
п
со(нн,)^
~ количество
СО(НН2)2,
моль.
В 100 г раствора содержится 1 г карбамида и 99 г воды.
99
Р=2,34-
60
18
Ответ: давление насыщенного водяного пара над 1
%-ным
водным раствором
СО(NН2)2
составляет 2,33 кПа.
50
