Яглов В.Н. (ред.) Задачи предлабораторного контроля по химии
Подождите немного. Документ загружается.


а) хлорида
дигидроксожелеза
(III); * ,
,
б) хлорида
гидроксожелеза
(III);
в) хлорида железа (III).
В каждой реакции вычислить молярную массу
эквивалента гидроксида железа (III) и массу гидроксида
железа (III), необходимую для взаимодействия с 3,65 г
хлороводородной кислоты.
Дано:
/и„„
=3,65 г
Ре(ОН)
3
М,
к
[Ре(ОН)
3
]-?
—
<
зк
(основ.)
=
"
основ
п
ОН"
РЕШЕНИЕ:
М,
, г/моль
п - число гидроксогрупп,
он
замещенных в реакции на кислотный
остаток.
т.
п„(НС1)=
НС1
,
М
ЭК
(НС1)
п(НС1)=
3
'
65
=
0,1
моль
36,5
т,
п
[Ре(ОН)
3
]
=
Ре(ОНЬ
М
ж
[Ре(ОН)
3
]
т
1е(о
Н)!
=
п
ж
[Ре(ОН)
3
]-
М
эк
[Ре(ОН)
3
]
а)
НС1
+
Ре(ОН)
3
=
Ре(ОН)
2
С1
+
Н
2
О
М
ж
[Ре(ОН)
3
]
=
—
ре(ОН)з
=
=
106,8
г/моль
т
ге
(
он,-
=0,1
-106,8
=10,68
г.
б) 2НС1 +
Ре(ОН)
3
=
РеОНСЬ
+
2Н
2
О
М,
к
[Ре(ОН
)з
]
=
Мр
«°"Ъ
=
106
'
8
=
53,4
г/моль
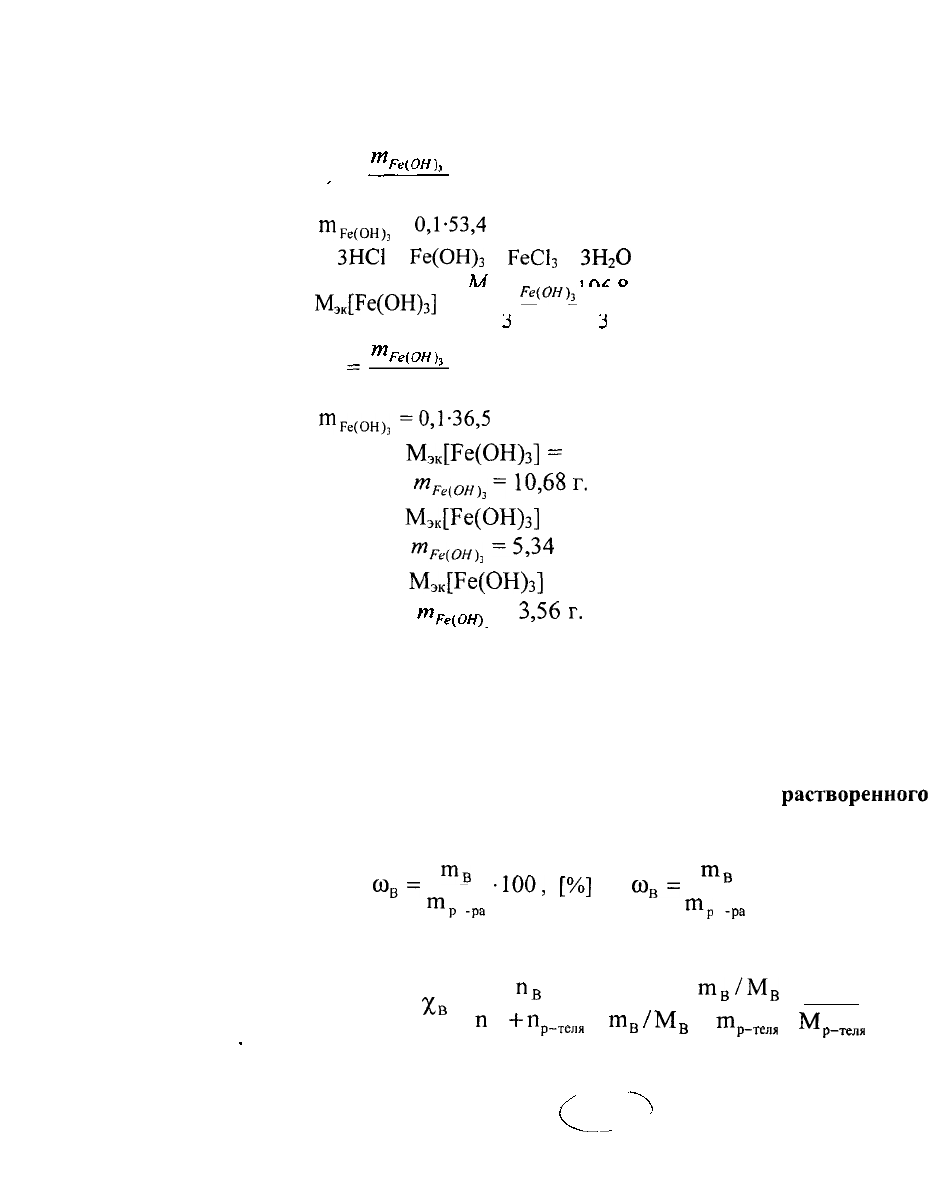
О 1 =
53,4
т
Ре(ОН)з
=
0,1-53,4
=
5,34
г
в)
ЗНС1
+
Ре(ОН)
3
=
РеС1
3
+
ЗН
2
О
М
эк
[Ре(ОН)
3
]
=
р
-
(ОН
^-
== 35,6 г/моль.
0,1
=
36,5
тр
е(
он
)з
=0,1
-36,5
= 3,65 г.
Ответ: а)
М
эк
[Ре(ОН)
3
]
=
106,8 г/моль
т
Ре(он)
3
=
Ю,68г.
б)
М
эк
[Ре(ОН)
3
]
=
53,4
г/моль
т
Ге(ОН)
3
=5,34
Г
в)
М
эк
[Ре(ОН)з]
= 35,6 г/моль.
)
=
3
'
56
Г
'
3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
УРОВЕНЬ А
1. Записать выражение массовой доли
растворенного
вещества. Указать размерность.
Ответ:
со
в
=
т
-
в
-100,
[%]
ш
в
^
тв
т
Р
-
Ра
т
р
.
ра
2. Записать выражение молярной доли растворенного
вещества.
п
в
т
в
/М„
Ответ:
Х
в
=
в
=
в
в
п
в
+
п
р-тш,я
т
в
/
М
в
+
т
р
_
теля
/
М
р
_
теля
22

3. Записать выражение молярной концентрации вещества.
Указать размерность.
п„
т
п
г
,
п
Ответ:
С
в
=
в
=
в
[моль/л]
V
р
_
ра
М
в
-У
р
_
ра
4. Записать выражение молярной концентрации
эквивалентов вещества. Указать размерность.
Ответ:
С
ЭК
(В)
=
"
эк
(В)
=
-
™
в
, [моль/л]
У
р-ра
М
эк
(В)-У
р
_
ра
5. Записать выражение моляльности вещества в растворе.
Указать размерность.
п
в
т
в
-1000 ,
п
С
т
(В)=
=
' [моль/кг]
т
р-теля
М
в
-ГП
р
_
теля
6. Записать выражение титра раствора вещества. Указать
размерность.
Ответ:
Т
в
=
Шв
,
[г/см
1
]
р-ра
УРОВЕНЬ В
1. Сколько граммов хлорида железа (III) содержится в 500
см
3
ОД н раствора?
РЕШЕНИЕ:
Молярная концентрация
эквивалентов вещества равна:
Дано:
С,
к
(РеСЬ)
=
0,1
моль/л
(0,1
н)
Ур-
ра
= 500
см
1
то
С,
к
(РеС1,)=
;
моль/
л
М
эк
(РеС1
3
)-У
р
_
ра
откуда
т
ресц
=С
эк
(РеС1,)-
М^ДРеС!,)-
У
р
_
ра
,
М
М
ж
(РеС1,)=
„^'.где
В-п
М
эк
(РеС1,
)
- молярная масса эквивалента хлорида железа
(Ш),
г/моль.
М
РеСЦ
- молярная масса хлорида железа (III), г/моль.
23

М
РеСЦ
= 56 + 3 • 35,5
=
162,5 г/моль
В - валентность железа (3),
п - число атомов железа в молекуле соли (1).
1
(-\~)
Ч
Тогда
т(РеС1,)
=
0,1-
'
•
500•
КГ
1
=2,708
*
2,71г,
где
10"
3
- пересчет
см
1
в л.
Ответ: т
РеС1,
=
2,71г.
2. Сколько граммов хлорида магния потребуется для
приготовления 800
см
3
25%-ного
раствора плотностью
1,2
г/см
3
?
Дано:
У
р
.
ра
= 800
см
3
СО
М?С
,
2
= 25%
р
р
_
ра
=
1,2
г/см
3
=
РЕШЕНИЕ:
По определению
т»
со
М§С1
2
т
2
• 100%,откуда
р-ра
т
100
т
р
.
ра
=
У
р
.
ра
•
Рр
.
ра
= 800 • 1,2 = 960 г.
Откуда:
25-960
т
100
Ответ: т
МгС
!
2
= 240 г
= 240г
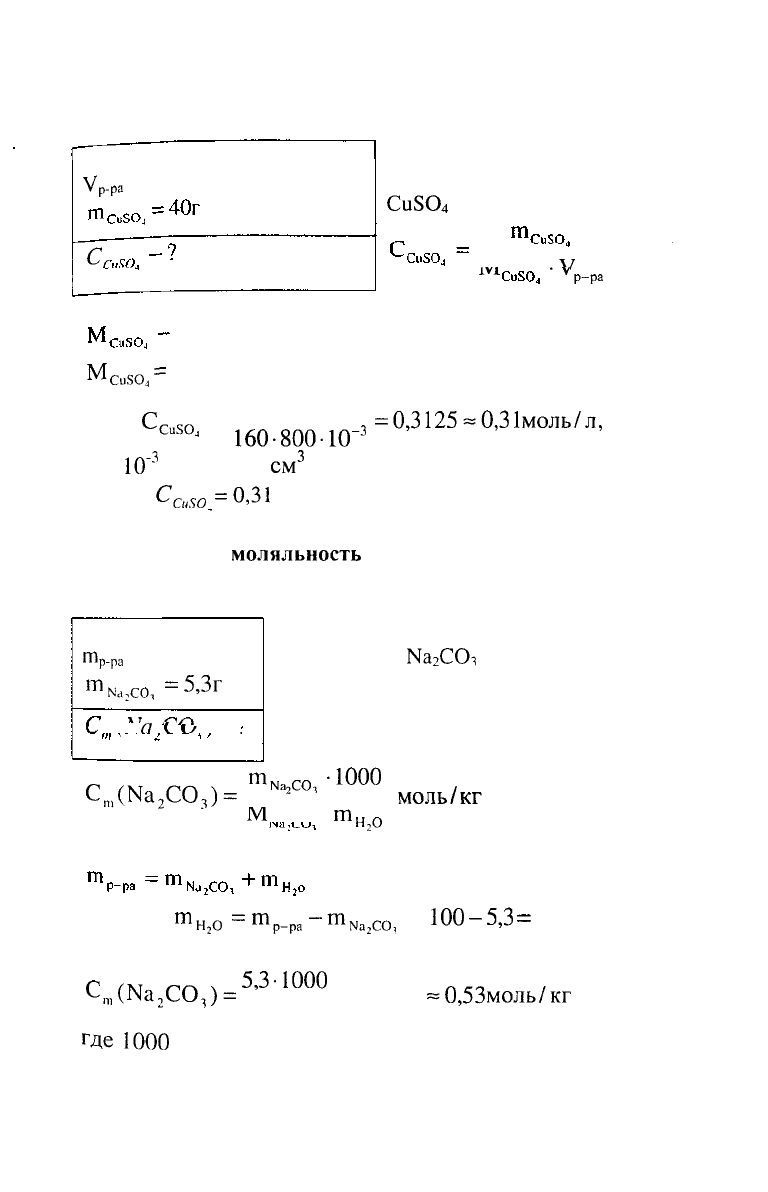
3. Определить молярную концентрацию вещества в
растворе, содержащем 40 г сульфата меди (II) в 800
см
3
раствора.
24
Дано:
Ур-ра
= 800 МЛ
С
г
РЕШЕНИЕ:
Молярную концентрацию
Си5О
4
вычисляем по формуле:
М
1У1
-V
У
, МОЛЬ/Л
р-ра
где:
М
Си804
=
64 + 32 + 64 = 160
г/моль
молярная масса сульфата меди (II), г/моль.
= 1
40
Тогда
С
Си504
=
160
.
800
.
ш
-з
=0,3125-0,31моль/л,
где
10~
3
- пересчет
см
3
в л.
Ответ:
С
См50
=0,31
моль/л.
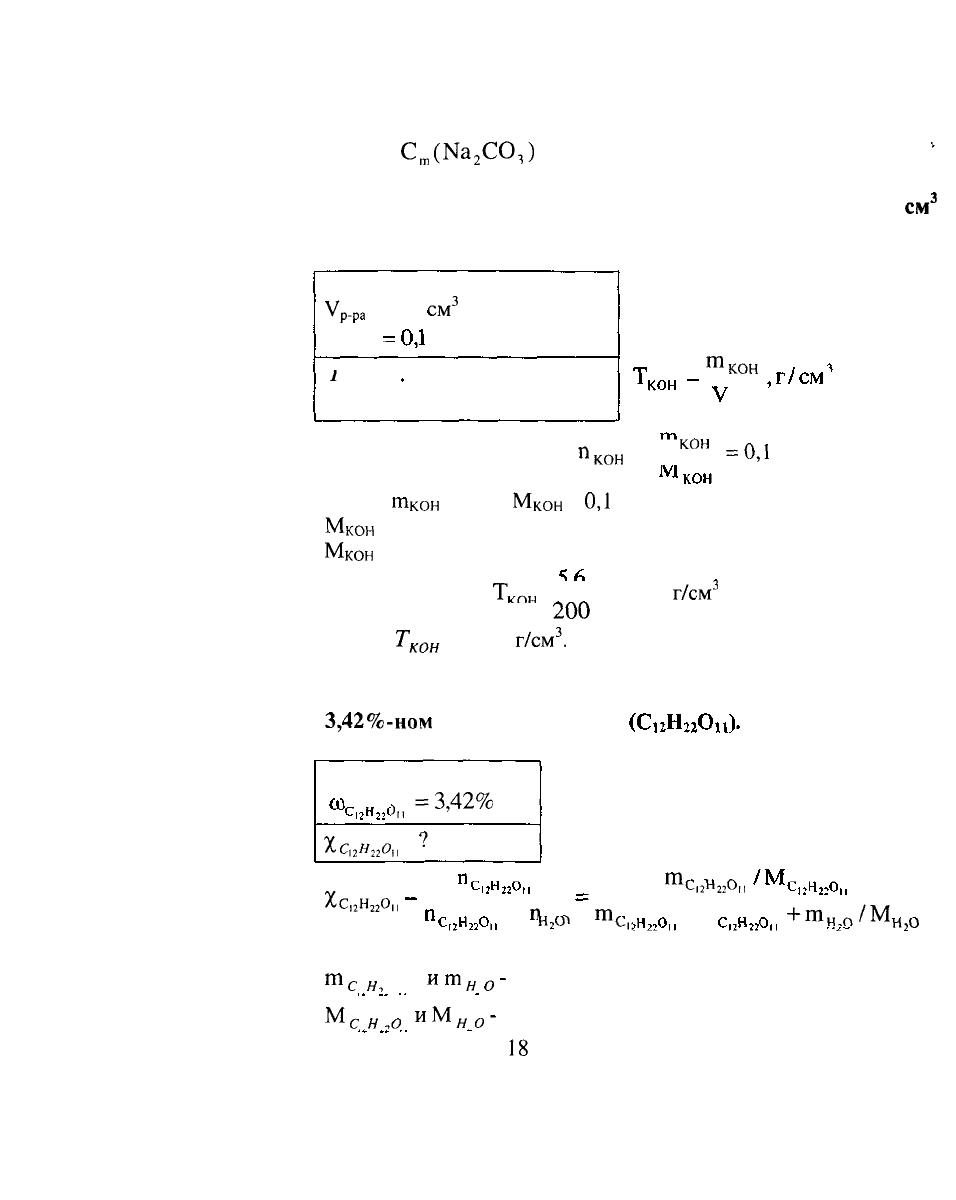
4. Определить
моляльность
вещества в растворе, если в
100 г водного раствора содержится 5,3 г карбоната натрия.
Дано:
ГПр-ра =
т
№
2
сс
100 г
>,
=5
'
3г
С
/
хт
/~*
/~\
Л О
( / V
С1
(.
1
/
) —
РЕШЕНИЕ:
Моляльность
Ыа
2
ССЬ
в растворе определяем
по формуле:
т
№ГО
-1000
С
т
(Ма
2
С0
3
)=
2С
°'
,
моль/
кг
^
'
ГП
Н
:
,О
Массу воды определяем из условия:
Тогда
т
Нз0
-т
р
_
ра
-т
№2С01
=
100-5,3
=
94,7г
Следовательно:
С
П1
(Ыа
2
СО,)=
5
'
3
'
1000
=
0,5279
-0,53моль/кг
106-94,7
г
Де
1000
- пересчет г в кг.
25
Ответ:
С
т
(№
2
СО,)
=
0,53 моль/кг.
5. Определить титр раствора вещества, если в 200
см
3
раствора содержится 0,1 моль гидроксида калия.
Дано:
р
У„.
па
= 200
см
3
п
кон
моль
Г -9
1
КОН
РЕШЕНИЕ:
Титр раствора вещества
определяем по формуле:
_
т
кон
р-ра
Согласно условию задачи:
п
кон
=
кон
=0,1
моль
откуда
т
к
он
= 0,1 •
М
К
он
=
0,1
• 56 = 5,6 г, где
Мкон
- молярная масса гидроксида калия, г/моль,
Мкон
= 39 + 16 + 1 = 56 г/моль.
Следовательно,
Т„
пн
= ' = 0,028
г/см
3
кон
20()
Ответ:
Т
кон
=
0,028
г/см
3
.
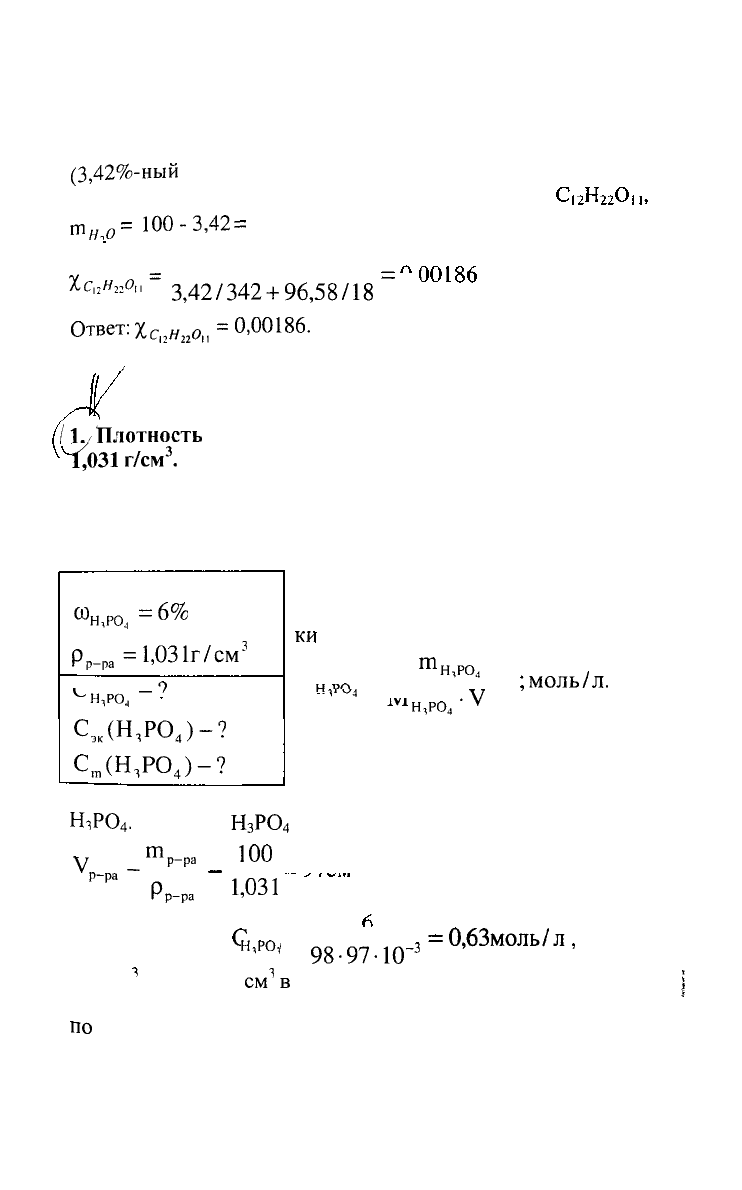
6. Определить молярную долю растворенного вещества в
3,42%
-ном
растворе сахарозы
РЕШЕНИЕ:
Молярную долю сахарозы в
в растворе определяем по
формуле:
т,
Дано:
)м
=3,42%
Хс,
2
я
220
„
-
?
Хс,
2
н
22
о„
~
+
п
н
п
т
г
Н
2
О
С,;
г
н
п
С
|2
Н
22°М
/М
+т
нп
/М
НГ)
Н
2
О
где:
т
с
н,
о
и
т
н
о'
соответственно массы сахарозы и воды, г;
Мс
н
-,о
и
Мн
о'
соответственно молярные массы сахарозы и
воды (342 г/моль и
18
г/моль).
26
Массы сахарозы и воды определяем согласно условию задачи
(3,42%-ный
раствор сахарозы).
Следовательно, в 100 г раствора содержится 3,42 г
т
яо
=
100-3,42
=
96,58 г
3,42/342
Хс
|2
//
22
о,,
=
з,42/342+
96,58/18
~
'
Ответ:
Х
С|2
„
220||
=
0,00186.
УРОВЕНЬ С
/1./Плотность
6% раствора ортофосфорной кислоты равна
1^031
г/см
3
.
Рассчитать:
а) молярную концентрацию кислоты;
б) молярную концентрацию эквивалентов кислоты;
в) моляльность кислоты в растворе.
Дано:
«Н,Р0
4
=6%
р
р
_
ра
=1,031г/см
3
С
-">
^Н,Р0
4
С
ЭК
(Н,Р0
4
)-?
С
т
(Н,Р0
4
)-?
а)
ки
С
РЕШЕНИЕ:
Молярную концентрацию
слоты определяем по формуле:
т
н,ро
4
.
н
рп
-
;
моль/
л.
14
М
-V
1У1
Н,РО
4
у
р-ра
Согласно условию задачи в 100 г раствора содержится 6 г
НчРС>4.
Тогда
6 г
Н
3
РО
4
содержится
в
объеме раствора
у
-
т
р-р*
10
°
з
Р
~
Ра
~Рр-
ра
~
1,031
Следовательно,
С
н
рп
=
=
0,63моль/л,
н
'
ро
'
98-97-КГ
3
где 10
3
- пересчет
см
1
в
л.
|
б) молярную концентрацию эквивалентов кислоты определяем
по
формуле:
27
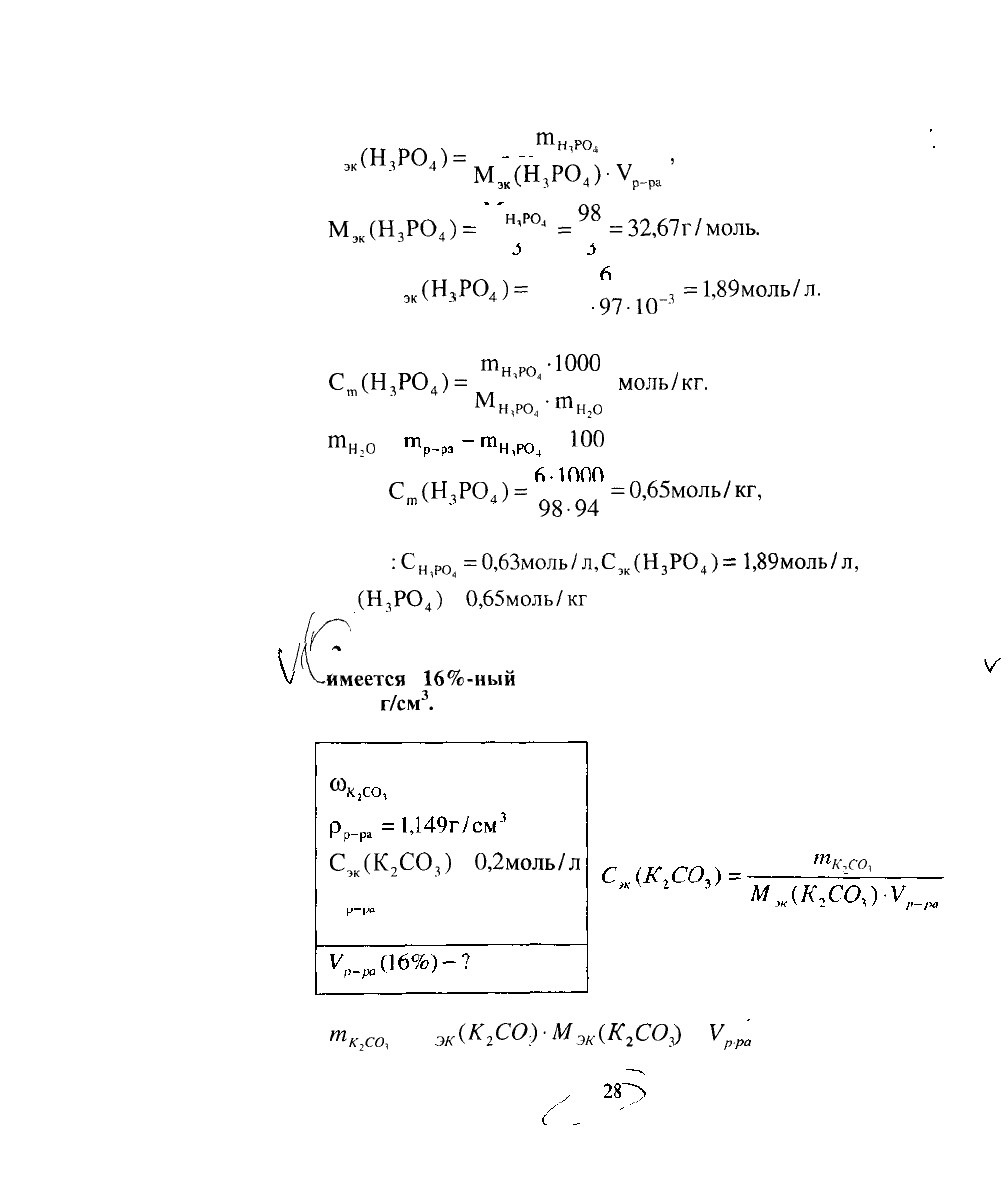
т.
,РО„
С
(Н,РО,)=
-
--
"
1Г
"
4
;моль/л.
ЭК
3
4
М
эк
(Н
3
Р0
4
)-У
р
_
ра
'
М
ЭК
(Н
3
Р0
4
)
=
Н1Р
°
4
=
98
=32,67г/моль.
Тогда Г
(Н
3
РО
4
)
=
.
=1,89моль/л.
эк
3
4
32,67
-97
-Ю-
3
в) моляльность кислоты в растворе определяем по формуле:
т
нро
-1000
С
т
(Н
3
Р0
4
)=
Н
'
Р
°
4
;
моль/
кг.
М
н,ро
4
-
т
н
2
о
т
н,о
=
=
ЮО
- 6 = 94г
Тогда
С
т
(Н,РО
4
)=
=0,65моль/кг,
98-94
где 1000 - пересчет г в кг.
Ответ
:С
Н1
р
04
=0,63моль/л,С
зк
(Н
3
РО
4
)
=
1,89моль/л,
С
(Н
3
РО
4
)
=
0,65моль/кг
1Г"
Д
2. Как приготовить 3 л 0,2 н раствора карбоната калия, если
^.имеется
16%-ный
раствор данного вещества плотностью
1,149
г/см
3
.
ох
Дано:
= 16%
С
эк
(К
2
СО
3
)
=
0,2моль/л
V .. = Зл
РЕШЕНИЕ:
а) Молярную концентрацию
эквивалента карбоната калия
определяем по формуле:
А%ГО,
Следовательно:
"Чсо,
= С
эк
(К
2
СО,
)-М
ж
(К
2
СО,
)
•
V
р
„
ра
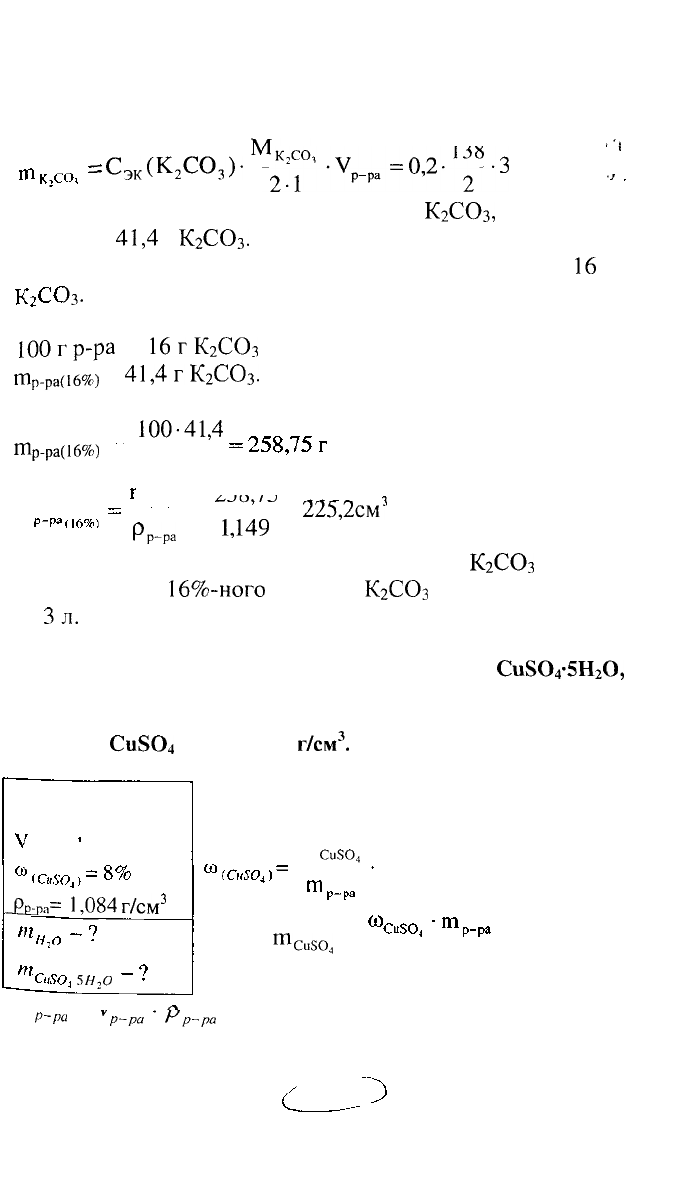
=
С
ЭК
(К
2
С0
3
)-
М
кго
138 "
'"'
-
2
;
1
1
-
У
Р-ра=0,2.
1
^.3 = 41,4г
.,
Рассчитываем массу 16%-ного раствора
К
2
СОз,
который
содержит
41,4
г
К
2
СО
3
.
Согласно условия задачи в 100 г раствора содержится
16
г
)
3
.
Составляем пропорцию:
100гр-ра
-
16гК
2
СО
3
т
р
-
ра
(1б%)
-
41,4гК
2
СОз.
ГПр-
р
а(16%)
-
V,
100-41,4
16
п 258 75
р-ра
^^и,/~»
^г\г
ъ
^
= = 225,2см'
Рр-ра
1Д49
Ответ: для приготовления 3 л 0,2 н раствора
К
2
СОз
нужно
взять 225,2 мл
16%-ного
раствора
К
2
СОз
и разбавить водой
до
Зл.
3. Найти массы воды и кристаллогидрата
Си8О
4
'5Н
2
О,
необходимое для приготовления 1 литра раствора,
содержащего 8% (масс.) безводной соли. Плотность 8%-го
раствора
Си8О
4
равна 1,084
г/см
3
.
Дано:
р-ра
— 1 Л
_й>па=
1,084
г/см
3
5Н
2
0
РЕШЕНИЕ
По определению
т
Си5О
4
100,
%
откуда
т
си504
=
100
Масса раствора равна
т -у
.к
Р-ра
г
р-
ра
Ир-ра
29
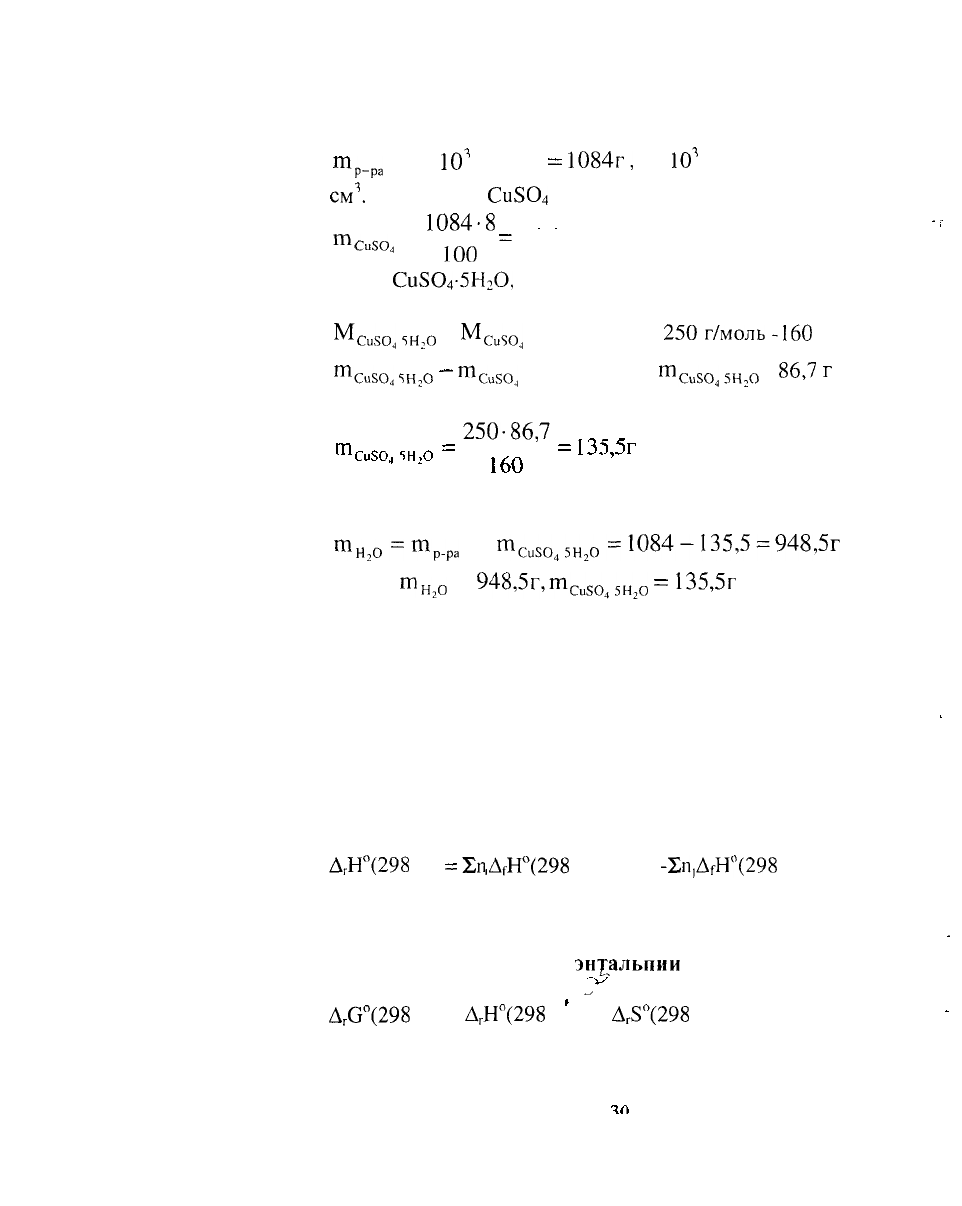
т
р
_
ра
= 1 •
10
1
•
1,084
=
1084г,
где
10
1
коэффициент
перевода
л в
см
1
.
Тогда масса
Си5О
4
в растворе составляет:
1084-8
т
г„чо
-
=
86,7г
Си50
4
1(Ю
Масса
Си5О4-5Н
2
О,
соответствующая массе безводной соли
(Си5О4) может быть найдена по пропорции:
М
Си80
4
™
2
0
-
М
СиТО
4
25
°
Г/МОЛЬ
-160
Г/МОЛЬ
т
Сч50
4
^Н
2
0
~
т
Си50
4
т
Си$О
4
5Н
2
О
"
86
>
7
Г
Тогда
250-86,7
Зная массу раствора и кристаллогидрата, определяем массу
воды:
т
Н,0=
т
р-ра
-
т
Си30
4
5Н
2
0
=1084
-
135
'
5==948
'
5г
Ответ:
т
Нз0
=
948,5г,т
Си5О45Нг0
=
135,5г
4. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
УРОВЕНЬ А
1. Написать формулу для расчета изменения
стандартной энтальпии реакции (I следствие из закона
Гесса).
Ответ:
А
Г
Н°(298
К)
=
2п
АН°(298
К)
прод.
-ЕпДН°(298
К)
исх., (кДж)
2. Написать формулу для расчета изменения
стандартной энергии Гиббса реакции при известных
значениях стандартных
энуальпии
и энтропии реакции.
Ответ: (
-
А
Г
О°(298
К) =
А
Г
Н°(298
К) - Т
А
Г
5°(298
К), (кДж)
