Тихоненко Д.Г., Дегтярьов В.В. та ін. Практикум з грунтознавства
Подождите немного. Документ загружается.


1
7
1
К
ількість прод
у
ктивної вологи визначає тип клімат
у
ґр
у
нт
у
в період ве-
гетації рослин (табл. 50), який є провідним фактором їх продуктивності.
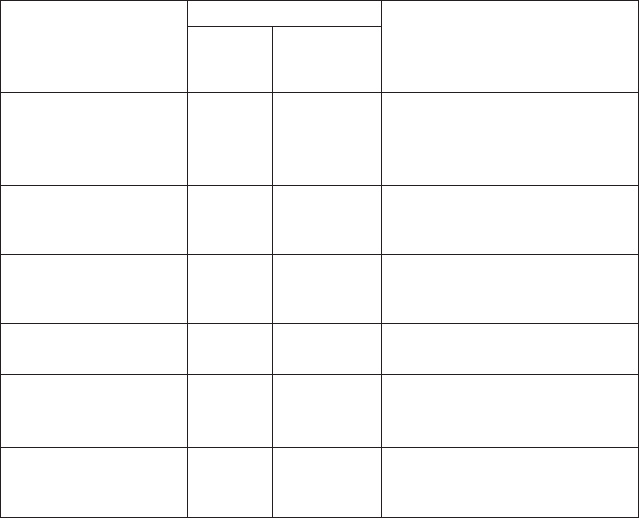
50. Схема типізації клімат
у
ґр
у
нт
у
(за А. М. Ш
у
льгіним
)
З
апас прод
у
ктивної вологи, мм
Клімат ґрунту
в орному шарі в метровому шарі
>50
30
—
50
2
0
—
30
1
0
—2
0
<1
0
>
2
00
1
50
—2
00
1
00
—1
50
50
—1
00
<
50
На
д
лишково вологи
й
Во
л
о
ги
й
П
омірно вологий
Недостатньо вологи
й
С
ухий
В
агрономічній практиці треба не лише констатувати наявність вологи
у ґрунті, а вміти прогнозувати її запаси на відповідний період. Л. А. Ра-
зумова (1971) розробила методику прогнозу запасів продуктивної вологи
в
метровом
у
шарі ґр
у
нт
у
на початок весняно-польових робіт. Вона ґр
у
н-
тується на залежності весняних запасів вологи (
W
вес
W
W
) у ґрунті від запасів
в
ологи восени
(
W
ос
W
W
)
та кількості опадів
(
r
) за осінньо-зимовий період.
r
З
міни запасів продуктивної вологи протягом зимового періоду опи-
с
уються такими рівняннями
:
для районів зі стійкою зимо
ю
∆W
= 0
,
115
·
r
+ 0
,
56 ·
d
—
20
;
для районів з нестійкою зимо
ю
∆W
=
0,
21
·
r
+
0
,
62
·
d
—
33
,
д
е
∆
W
— зміни запасів продуктивної вологи в метровому шарі за період від
W
дати останнього визначення вологості ґрунту восени до дати переходу темпе-
рат
у
ри повітря через
5
о
С
навесні
,
мм
;
r
— кількість опадів за даний період,
r
мм
;
d
— дефіцит вологості ґрунту восени, мм.
d
О
чік
у
вані запаси прод
у
ктивної вологи
у
ґр
у
нті навесні б
у
д
у
ть дорів-
н
ю
вати
:
W
вес
W
W
= W
ос
W
W
+
∆W
.
П
ри інтерпретації даних щодо вологості ґр
у
нт
у
, важливе значення
має характер представлення. Результати великого числа визначень во-
логості, якими супроводжуються більшість польових дослідів, часто
представляють у формі громіздких таблиць, які важко читаються. Тому,
по
р
яд з табличною
ф
о
р
мою подачі мате
р
іалів
(
коли кількість визначень
незначна), застосовують відповідні способи графічного зображення да-
них: п
р
о
ф
ільні к
р
иві, х
р
оно- і топоізоплети вологості, г
р
а
ф
іки динаміки
в
ологозапасів тощо
.
Практичне застосування даних про вологість та водні властивості..
.

В
ИВЧЕННЯ РЕАК
Ц
ІЇ ҐРУНТОВОГО РОЗЧИН
У
П
рирода кислотност
і
ґр
у
нт
і
в
П
ід к
исло
тн
іс
т
ю
розуміють здатність ґрунту підкислювати ґрунто-
в
ий розчин, воду і розчини нейтральних солей. Обумовлена кислотність
наявністю головним чином вуглецевої та органічних кислот, гідролі-
т
ично кислих солей
,
вільних іонів Н
+
у ґрунтовому розчині та обмінних
каті
о
нів
Н
+
і Al
3
+
у
ґр
у
нтовом
у
вбирном
у
комплексі
.
Реакція ґрунтового розчин
у
визначається співвідношенням кон-
центрацій вільних іонів Н
+
та
О
Н
–
. Якщо концентрація іонів водню
дорівнює концентрації гідроксильних іонів
—
реакція нейтральна
;
коли
концент
р
ація іонів Н
+
більша концент
р
ації іонів ОН
–
—
кисла
;
як
щ
о кон-
центрація іонів Н
+
менша концентрації іонів О
Н
–
—
лужна
.
З
алежно від величини рН водної витяжки або суспензії реакція ґрун-
т
у має наступну назву
:
Реакція ґрунтового розчин
у
рН Концентрація Н
+
в 1 л розчин
у
Д
уже кисла
К
и
с
л
а
С
лабокисла
Н
е
й
тральна
С
ла
б
ол
у
жн
а
Л
у
жна
Д
уже лужна
3
—4
4
—
5
5
—
6
7
7—8
8—
9
9
—1
0
1
0
–3
— 1
0
–
4
10
–
4
—
10
–5
10
–5
—
10
–6
10
–7
1
0
–7
— 1
0
–8
1
0
–8
— 1
0
–9
1
0
–9
— 1
0
–10
К
онцентрацію іонів водню в розчині прийнято виражати символом
р
Н, яки
й
є
в
ід’ємний десятковий лога
р
и
ф
м концент
р
ації іонів водню
в розчині: рН= – lg [Н
+
Н
Н
]
+
.
К
исла
р
еакція властива підзолистим, де
р
ново-підзолистим, сі
р
им лі-
с
овим і болотним ґр
у
нтам; нейтральна — чорноземам; л
у
жна — кашта-
новим ґрунтам і солонцям.
Розрізняють два види кислотності ґр
у
нт
у
:
а
ктивн
у
і потенційн
у
.
Активна кислотність ґрунт
у
— це кислотність ґрунтового розчи-
н
у
. Об
у
мовлена вона іонами Н+, які знаходяться в рідкій фазі ґр
у
нт
у
,
в
имірюється в одиницях рН і позначається p
H
H
2
O
або рН
в
одний
.
Активна
кислотність безпосе
р
едньо впливає на
р
іст
р
ослин та життєдіяльність
мікроорганізмів. У табл. 51 наводяться інтервали рН, сприятливі для
росту і розвитку сільськогосподарських культур та ґрунтових мікроор-
гані
з
мів
.
Для одних рослин оптимум рН знаходиться в інтервалі 4,0—5,5, для
і
нших — від 7,0 до 8,0, азотфікс
у
ючі бактерії найкраще розвиваються
1
7
3
при реакції, яка близька до нейтральної, а грибна мікрофлора — при
ки
с
лій
.
І
о
ни Н
+
,
які прис
у
тні
у
ґр
у
нтовом
у
розчині, складають незначн
у
час-
тину від водневих іонів, які знаходяться у ввібраному стані. Крім того,
активна кислотність д
у
же змінюється протягом вегетаційного період
у
.
Тому величина активної кислотності не може бути надійним показником
потреби ґрунту у вапнуванні для нейтралізації кислотності
.
Потен
ц
ійна кислотність — це кислотність твердої фази ґрунту
і
ґрунтового розчину. Обумовлена вона іонами Н
+
і Al
3
+
,
які увібрані
Ґ
КВК. Потенційна кислотність завжди більша активної
,
бо складаєть-
с
я з кислотності ґрунтового розчину і кислотності, яка утворюється за
рах
у
нок
у
вібраних іонів водню та алюмінію.
П
отенційну кислотність умовно ділять на дві форми:
о
бмінну і гід-
ролітичн
у
.
Обмінна кислотніст
ь
— виявляється при взаємодії ґрунту з розчи-
ном нейтральної солі (тобто солі сильного лугу і сильної кислоти): KCl,
B
aCl
2
і т
.
п
.
У водну витяжку іони обмінного водню не переходять, але легко
в
итісняються нормальним сольовим розчином
:
HCl
К
К
ҐKВККCl
Н
Н
ҐKВК 2][2][ +↔+
+
+
+
+
.
О
бмінна кислотність позначається індексом р
Н
K
Cl
а
б
о рН
со
ль
о
ви
й
і
вимірюється в одиницях рН. Титрована обмінна кислотність вимірюєть-
с
я в мг-екв на 100 г ґрунту. Залежить вона від кількості обмінних іонів
Н
+
і наявності
у
ГВК обмінних іонів Al
3
+
,
які здатні витіснятися катіона-
ми нейтральної солі і переходити до ґрунтового розчину за схемою
:
3
3
][3][ AlCl
К
К
К
ҐKВККClAlҐKВК +↔+
+
+
+
+
.
Хлористий алюміній — сіль слабкого лугу і сильної кислоти, у вод-
них розчинах дисоціює за схемо
ю
AlCl
3
l
+ 3H
2
H
H
O
= Al
(
OH
)
3
+ 3H
+
H
H
+ 3Cl
–
l
l
.
A
l
(
OH
)
3
як слабкий луг у водному розчині майже не розпадається,
а HCl у слабких розчинниках дисоціює на іони Н
+
та
C
l
–
,
що п
р
изводить
до підвищення кислотності
.
О
кремі сільськогосподарські культури добре розвиваються на кис-
лих ґр
у
нтах, але при підвищенні р
у
хомого алюмінію різко зниж
у
ють
В
ивчення реакц
ії
ґрунтового розчин
у

З
агальне ґрунтознавств
о
1
7
4
урожайність. По відношенню до вмісту алюмінію в ґрунті рослини роз-
поділяють на чотири групи
:
С
тійкі до високого вміст
у
— тимофіївка, овес, к
у
к
у
р
у
дза;
С
ередньостійкі — люпин, горох, вика, квасоля
;
Ч
у
тливі — ячмінь, льон, озиме жито;
Д
уже чутливі — люцерна, конюшина, цукрові буряки, озима пше-
ни
ц
я
.
Урожайність чутливих культур починає знижуватись при вмісті ру-
х
омого алюмінію 1,5—2,0 мг, а се
р
едньостійких п
р
и — 3,5—4,0 мг-екв
на 100 г ґрунту
.
В
міст рухомого алюмінію в ґрунті залежить від реакції середовища:
ч
им нижче значення рН, тим більше в ґр
у
нті р
у
хомого алюмінію. При
рН
KCl
понад 5 рухомість алюмінію різко знижується і його вміст стає
значно меншим критичних значень.
51. Оптимальна реакц
і
я ґрунтового середовища для с
і
льськогоспо
-
д
арських к
у
льт
у
р, плодових насаджень і мікроорганізмі
в
Ку
льт
у
ра
рН
Ку
льт
у
ра
р
Н
П
шени
ц
я озима
П
шениця я
р
а
Ячмінь
Ж
ит
о
оз
им
е
Овес
К
укурудз
а
Ри
с
П
росо
Г
речк
а
Г
оро
х
С
оя
К
ва
со
ля
В
ик
а
Л
ю
пин
Б
оби кормові
С
оняшник
Б
уряки цукрові
К
артопля
Б
р
у
ква
Т
у
рнепс
Люце
р
н
а
Ко
н
ю
шин
а
Ж
итня
к
Ра
й
грас
Тимофіївка
6,3
— 7
,7
6
,
0 — 7
,5
6
,
8 — 7
,5
5
,
5 — 7
,5
5
,
0 — 7
,5
6
,
0 — 7
,0
4,
0 — 6
,0
5
,
5 — 7
,5
4,
7 — 7
,5
6,0
— 7
,0
6
,
5 — 7
,1
7,
0 — 8
,0
5
,
7 — 6
,5
4,
5 — 6
,0
6
,
0 — 7
,0
6
,
0 — 6
,
8
7,
0 — 7
,5
5
,0
— 5
,5
4,8
— 5
,5
6
,
0 — 6
,5
7,
0 — 8
,0
6
,
0 — 7
,0
7,
0 — 8
,5
6
,
8 — 7
,5
5
,
0 — 7
,5
В
івсяниця л
у
гов
а
Ль
о
н
Ко
н
о
плі
Т
ю
т
ю
н
Моркв
а
К
апуст
а
О
гірки
Ц
ибуля
Т
о
мат
и
С
ала
т
Щ
авел
ь
С
еле
р
а
Ц
ико
р
і
й
Г
ар
б
узи
Я
б
луня
Г
руш
а
А
брикос
С
лив
а
Вишня
В
иног
р
ад
А
зото
б
акте
р
Н
іт
р
и
ф
ікато
р
и
Денітрифікатори
Б
ульбочкові бактерії
к
о
н
ю
шини
5
,
3 — 6
,0
5
,
5 — 6
,5
7,1
— 7
,4
6,
5 —
8,0
5
,
5 — 7
,0
6
,
5 — 7
,4
6
,
4 — 7
,0
6
,
4 — 7
,
9
6
,
3 — 6
,7
6
,
0 — 6
,5
4,
5 — 5
,0
5
,8
— 7
,5
6,0
—
6,5
5
,
3 — 6
,0
6
,
5 — 7
,5
4,
5 — 6
,0
7,
0 — 8
,5
6
,
5 — 8
,0
6
,
5 — 8
,5
7,
0 — 8
,7
6,
7 —
6,8
6,0
—
8,0
7,
0 — 8
,0
6
,
0 — 7
,0
1.
2
.
3.
4.

1
7
5
П
ри внесенні у ґрунт великої кількості фізіологічно кислих міне-
ральних добрив у формі нейтральних солей (NН
4
C
l;
(
NН
4
)
2
SО
4
;
КCl та
і
н.) іон водню переходить
у
ґр
у
нтовий розчин і підкислює його. За таких
умов він збагачується шкідливими для рослин іонами Al
3
+
та М
n
2+
.
Тому
о
бмінна кислотність є найбільш шкідливою для рослин формою кислот-
ності ґрунту
.
П
ідкислення ґрунту може відбуватися за рахунок життєдіяльності
мікроорганізмів. Наприклад, у процесі нітрифікації утворюється НN
О
3
.
Г
і
д
р
ол
і
тична кислотн
і
сть — виявляється при взаємодії ґрунту
з розчином гідролітично лужної солі (солі сильної основи і слабкої кис-
лоти
)
: СН
3
С
ООNа, Са
(
СН
3
С
ОО
)
2
і т
.
п
.
В
становлено, якщо ґр
у
нт о
б
ро
б
ити нормальним розчином оцтово-
кислого натрію, то кислотність буде підвищуватись, бо з ҐКВК у ґрун-
товий розчин б
у
де переходити іон водню, який нейтральною сіллю не
в
иті
с
ня
є
ть
с
я
.
П
ри визначенні гідролітичної кислотності застосовують оцтовокис-
лий натрій. Внаслідок гідролізу СН
3
С
ООNа лужна реакція обумовлена
утворенням NаОН за реакціє
ю
СН
3
Н
Н
СООNа + Н
2
Н
Н
О = СН
3
Н
Н
СООН + NаОН
.
О
цтова кислота дисоціює дуже слабо, а луг, що утворився, реагує
з обмінним воднем, який утворює в розчині гідролітичну кислотніст
ь
[ҐКВК]Н
+
Н
Н
+ NаОН + СН
3
Н
С
ООН = [ҐКВК]Nа
+
+ Н
2
Н
Н
О + СН
3
Н
Н
СООН
П
ри визначенні гідролітичної кислотності враховують усі види кис-
лотності: активну (іони водню ґрунтового розчину), обмінну (увібрані
в
одень та алюміній, які обмінюються на катіони нейтральної солі)
і
гідролітичну. Співвідношення видів кислотності можна зобразити
с
х
е
м
ою:
[ҐКВК]Н
7
Н
Н
*
|Н
6
Н
Н
Н
6
5
Н
| |Н
4
Н
Н
3
Н
Н
| |Н
2
Н
Н
Н
1
Н
| + 6СН
3
Н
СООN
а →
[ҐКВК]Н
7
Н
Н
*
|
Nа
6
Nа
6
5
|
|
Nа
4
N
а
3
|
|
Nа
2
N
а
1
|+ 6СН
3
Н
СООН
,
Н
Н
де
Н
7
НН
— іон водню
,
який не витісняється
.
Іон во
д
ню Н
7
знаходиться в першом
у
прошарці колоїдної частки
і
може бути витіснений при взаємодії з розчином 0,1 н NаОН, тобто
більш л
у
жним розчином, ніж 1,0 н СН
3
СОО
Nа.
У практиці визначати іони водню, які не витісняються катіонами
о
цтовокислого нат
р
ію, немає необхідності, бо доб
р
ив з такою
р
еакцією
не застосовують. Отже, ці іони не є небезпечними при внесенні добрив
у ґрунт, бо будуть у ввібраному стані
.
В
ивчення реакц
ії
ґрунтового розчин
у
*
цифри 1, 2, 3, 4, 5, 6, 7 — це прошарки колоїдної частки
.
З
агальне ґрунтознавств
о
1
7
6
П
ри відс
у
тності обмінної кислотності — гідролітична — не шкідлива
для рослин, бо іони Н
+
гідролітичної кислотності малорухомі. Вимірю-
ю
ть гідролітичн
у
кислотність в мг-екв на 100 г ґр
у
нт
у
і позначають ін-
дексом Нг. За величиною гідролітичної кислотності розраховують дози
в
апна, необхідного для нейтралізації всіх присутніх у ґрунті іонів водню
т
а ал
ю
міні
ю.
За ступенем кислотност
і
розрізняють ґрунти: дуже-, сильно-, серед-
ньо- слабокислі, близькі до нейтральних і нейтральні
.
Г
рупування ґрун-
т
ів за ступенем кислотності, прийняте в Україні, наведено в табл. 52.
52. Гр
у
п
у
вання ґр
у
нтів за ст
у
пенем кислотності
С
тупінь кислотності
П
о
ка
з
ник ки
с
л
о
тн
ос
ті
Ґрунт
рН
К
C
l
Н
г
,
мг-екв
на 1
00
г
ґ
рунт
у
Д
уже сильнокисли
й
<4
,0
>
6
,0
П
ідзол, торфовище верхове,
б
олотно-підзолистий, буро-
з
ем кислий, підзолисто-буро-
зе
мни
й
С
ильнокисли
й
4,1
—
4,5
5,9
—5
,1
Д
ерново-підзолисті оглеєні,
т
орфянисто- і торфовоглейо-
в
і, дерново-б
у
роземні кислі
С
ередньокислий
4,
6—5
,0
5,
0—4
,
1
Д
ерново-підзолисті,
підзолисто-дернові,
ясно-сірі лісові оглеєні
С
ла
б
окислий
5,1
—5
,5
4,0
—
3,1
Ясно- і сі
р
і лісові, темно-сі
р
і
л
ісові оглеєні, дерново-борові
Б
ли
з
ьки
й
до не
й
т
р
альни
х
5,
6—6
,0
3
,
0—2
,
1
Темно-сірі лісові, чорноземи
о
підзолені, вилужені
т
а реградовані, дернові
Не
й
тральни
й
>6,0
<2,0
Чорноземи типові та зви-
чайні, лучно-чорноземні,
коричневі
М
ЕТОДИ ВИЗНАЧЕННЯ КИСЛОТНОСТІ
Ґ
РУНТ
У
В
изначення активної кислотності ґрунт
у
потенц
і
омет
р
ичним методо
м
П
отенціометричний метод визначення концентрації іонів водню
в
розчинах заснований на вимірюванні електрор
у
хаючої сили, яка ви-
никає при занурюванні в розчин індикаторного та допоміжного елект-
родів. Робочою частиною індикаторного (скляного) електроду є скляна
мембрана. При вимірюванні рН між мембраною і розчином виникає різ-
ниця потенціалів, яка залежить від активності іонів водню. За
р
ізницею
потенціалів на скляном
у
електроді та електроді порівняння визначають
рН. Використання скляного електроду дозволяє визначати рН у широко-
м
у
діапазоні. Причом
у
на рез
у
льтати вимірювань не впливають віднов-
ники колоїдів грубих суспензій та забарвлення розчинів
.
Для визначення
р
Н необхідно
:
підготувати ґрунт або суспензію для вимірювання;
підготувати прилад для вимірювання (детальний опис і схема
устрою подана в інструкції, яка надається до кожного приладу)
;
підготувати електроди до вимірювання
.
Х
ід аналіз
у
. 10 г повітряно с
у
хого ґр
у
нт
у
, розтертого і просіяного
крізь сито з отворами діаметром 1 мм, зважують на технічних терезах
з точністю до 0,1 г і переносять
у
плоскодонн
у
колб
у
місткістю 100 мл.
П
риливають мірною колбою або мірним циліндром 50 мл дистильованої
в
оди щоб співвідношення ґр
у
нт: вода становило 1:5, закривають проб-
кою, ретельно збовтують протягом 5 хвилин і залишають на добу. Після
в
ідстоювання прозору частину зливають у скляний стаканчик і вимірю-
ю
ть p
H
H
2
O
потенціометричним методом
.
У торфах і лісових підстилках співвідношення ґрунт: вода повинно
с
тан
о
вити 1
:
25
.
П
ри масових визначеннях застосовують таку методику: 10 г ґрунту
зваж
у
ють на технічних терезах в точністю до 0,1 г і переносять
у
колб
у
на 50—100 мл. До наважки приливають мірним циліндром або мірною
колбою так
у
кількість дистильованої води, щоб співвідношення ґр
у
нт:
в
ода становило 1:2,5, тобто 25 мл. Колбу закривають пробкою і збовту-
ю
ть 5 хвилин
.
У чистий стаканчик після відстоювання зливають освітлену частину
с
успензії і вимірюють pH
H
2
O
потенціомет
р
ичним методом.
Прилади, посуд і реактиви. рН-метр. Колба плоскодонна місткістю
5
0—100 мл. Мі
р
ний цилінд
р
на 50 мл або мі
р
на колба на 25 та 50 мл. Скля-
ний
с
такан мі
с
ткі
с
т
ю
50 мл
.
•
•
•

З
агальне ґрунтознавств
о
1
7
8
Визначення о
б
мінної кислотності ґрунт
у
за методом
Д
а
й
к
у
хар
а
Дана форма кислотності визначається при взаємодії ґрунту з нейт-
р
альною сіллю
:
HCl
К
К
ҐKВККCl
Н
Н
ҐKВК 2][2][ +→+
+
+
+
+
.
К
ількість кислоти, що утворилася при даній реакції, свідчить про на-
явність легкозв’язаних з ҐКВК іонів водню, які можуть бути витіснені
і
ншими іонами. У випадках, коли в ГВК переважають іони алюмінію,
реакція проходить за схемою:
3
3
][3][ AlCl
К
К
К
ҐKВККClAlҐKВК +→+
+
+
+
+
.
Хлористий алюміній легко гідроліз
у
ється в ґр
у
нті з
у
творенням со-
л
ян
ої
ки
с
л
о
ти
:
AlCl
3
l
+
3
H
2
H
H
O
→ Al
(
OH
)
3
+
3
H
Cl.
В
становлюючи титруванням кількість кислоти, що утворилася в обох
в
ипадках, визначаємо обмінну кислотність ґрунту
.
Х
ід аналіз
у
.
40 г повітряно сухого ґрунту, розтертого і просіяного
к
р
ізь сито з отво
р
ами діамет
р
ом 1 мм, зваженого на технічних те
р
езах
з точністю до 0,1 г, переносять у колбу місткістю 250—300 мл
.
У колбу приливають мірною колбою 100 мл розчину КСl (рН 5,6—
6,0). Колб
у
закривають пробкою і збовт
у
ють періодично протягом
1 години
.
Су
спензію фільтр
у
ють крізь складчастий фільтр середньої щільності.
П
ерші порції фільтрату відкидають. Мутний фільтрат перефільтровують
крізь той же фільтр з ґрунтом
.
П
іпеткою відбирають 50 мл прозорого фільтрату і переносять у колбу
на 100—150 мл для титрування. В колбу прибавляють 2—3 краплі фе-
нолфталеїну і титрують 0,1 н розчином NаОН до слабо рожевого забарв-
л
ення, яке не зникає п
р
отягом 1 хвилини
.
З
а кількістю л
у
г
у
, який пішов на титр
у
вання, розрахов
у
ють величин
у
о
бмінної кислотності у мг-екв на 100 г ґрунту за формулою
:
Р
К,Ка
Н
ОНNaOH
2
7511002н
обм
⋅⋅⋅⋅⋅⋅
=
,

1
7
9
М
етоди визначення кислотност
і
ґрунт
у
де
а
— кількість мл розчин
у
NаОН, який пішов на титр
у
вання 50 мл фільт-
рату; н — нормальність розчину NаОН;
К
— поправочний коефіцієнт на
К
нормальність розчину NаОН; 2 — коефіцієнт переводу проби, що титрується
(
50 мл), на весь об’єм розчину (100 мл); 100 — коефіцієнт переводу резуль-
т
атів аналізу на 100 г повітряно сухого ґрунту; 1,75 — умовний коефіцієнт
для введення поправки на повнот
у
витіснення всього обмінного водню, за
умов однократної обробки ґрунту розчином КСl;
К
H
К
2
H
O
— коефіцієнт гігро-
с
копічності ґр
у
нт
у
;
Р
— наважка ґрунту.
Р
Приклад розрахунк
і
в. Наважка повітряно сухого ґрунту 40 г. Ви-
трачено на титр
у
вання 50 мл фільтрат
у
1,6 мл 0,1 н розчин
у
NаОН.
К
NаОН
К
= 1.
Н
К
H
К
2
H
O
= 1
,
02
.
З
агальна обмінна кислотність
у
мг-екв на 100 г ґр
у
нт
у
б
у
де ста-
н
о
вити
:
431
40
02175110021061
обм
,
,,,,
Н =
⋅⋅⋅⋅⋅
=
.
Пос
у
д та реактиви. Колби плоско
д
онні на 250—300 мл — 2 шт. Колба
конічна на 100—150 мл. Колба мірна на 100 мл. Лійка. Піпетка на 50 мл. Бю-
р
етка на 50 мл. Фільт
р
и се
р
едньої щільності. Розчин 1,0 н КСl
(р
Н 5,6—6,0
)
.
Титрований розчин 0,2 н NаОН. Індикатор фенолфталеїн
.
Визначення обмінної кислотност
і
потенціометричним методо
м
Даний метод застосов
у
ють при масових аналізах, а обмінн
у
кислот-
ність ґрунту вимірюють в одиницях рН
КС
l
.
Х
ід аналіз
у
.
20 г повітряно с
у
хого ґр
у
нт
у
, розтертого і просіяного
крізь сито з діаметром отворів 1 мм, зважують на технічних терезах
з точністю до 0,1 г і переносять у плоскодонну колбу місткістю 100 мл.
Мірною колбою приливають 50 мл 1,0 н розчину КСl (рН 5,6—6,0).
К
олбу закривають пробкою і періодично збовтують протягом 1 години.
П
ісля відстоювання в чистий скляний стаканчик зливають прозор
у
час-
тину суспензії і вимірюють рН
КСl
потенціомет
р
ичним методом.
В
изначення гідролітичної кислотност
і
з
а мето
д
ом
Г
.
К
аппен
а
Дана форма кислотності обумовлена іонами водню, які більш міцно
зв’язані з ҐКВК і проявляється при взаємодії ґр
у
нт
у
з розчинами гідролі-
тично лужних солей або лугів. Реакція може відбувається у дві стадії
:

З
агальне ґрунтознавств
о
1
8
0
NaOHCOOHCHOHCOONaCH +→+
323
,
,
.
З
а таких умов у розчин переходить більша кількість іонів водню, ніж
при взаємодії ґрунту з нейтральною сіллю (КСl). Гідролітично лужна
с
іль взаємодіє як з ҐКВК, так і з ґр
у
нтовим розчином, том
у
гідролітична
кислотність являє собою суму активної і потенційної кислотності. Да-
ний показник використов
у
ють
у
практиці для розрах
у
нк
у
доз вапна на
кислих ґрунтах
.
Х
ід аналіз
у
. На технічних терезах зваж
у
ють з точністю до 0,1 г
4
0 г повітряно сухого ґрунту, розтертого і просіяного крізь сито з отвора-
ми діаметром 1 мм. Наважку вміщують у колбу місткістю 250—300 мл,
приливають 100 мл 1,0 н розчину СН
3
С
ООNа (рН 8,3—8,4), закривають
пробкою і збовтують 1 годину на ротаторі. Часове збовтування можна
замінити 3-хвилинним з наст
у
пним відстоюванням протягом доби і пе-
ріодичним (5—6 разів) збовтуванням
.
Су
спензію фільтр
у
ють крізь с
у
хий складчастий фільтр (діаметром
11,0—12,5 см) середньої щільності (біла стрічка). Перед титруванням
в
міст склянки збовт
у
ють від р
у
ки і переносять на фільтр більш
у
частин
у
ґрунту. Перші 10—20 мл фільтрату відкидають, щоб видалити домішки,
які перейшли в нього. В подальшому, якщо фільтрат мутний, його пере-
фільтровують крізь той же фільтр
.
В
ідбирають піпеткою 50 мл прозорого фільтрату, вміщують у коніч-
н
у
колб
у
місткістю 250 мл, прибавляють 2—3 краплі фенолфталеїн
у
і
титрують 0,1 н розчином NаОН до слабко-рожевого забарвлення, яке
не зникає протягом одної хвилини. Якщо фільтрат забарвлений, то тит-
рування здійснюють у присутності «свідка». За кількістю витраченого
на титр
у
вання л
у
г
у
розрахов
у
ють величин
у
гідролітичної кислотності
в
мг-екв на 100 г ґрунту за формулою
:
751
1002н
2
г
,
Р
ККа
Н
ОНNаОН
⋅
⋅⋅⋅⋅⋅
=
,
де
а
— кількість мл розчину NаОН, який пішов на титрування 50 мл фільт-
рат
у
; н — нормальність розчин
у
NаОН;
К
NаОН
К
— поправочний коефіцієнт
Н
на нормальність розчину NаОН; 2 — число перерахунку титруємої проби
(
50 мл) на весь об’єм розчин
у
(100 мл); 100 — коефіцієнт перерах
у
нк
у
ре-
