Шмелева В.Г. Определение белков и аминокислот в микробной биомассе
Подождите немного. Документ загружается.

Министерство образования Российской Федерации
_____________________________________
Государственное образовательное
учреждение высшего профессионального образования
Санкт-Петербургский государственный технологический институт
(Технический университет)
__________________________________________________________
Кафедра технологии микробиологического синтеза
В.Г. Шмелева
ОПРЕДЕЛЕНИЕ БЕЛКОВ И АМИНОКИСЛОТ В МИКРОБНОЙ БИОМАССЕ
Методические указания
к лабораторной работе
Санкт-Петербург
2006
ВЕДЕНИЕ
Микробные клетки содержат значительное количество белков. В процентном отношении к массе сухой
биомассы содержание белков колеблется, достигая 40-80% в зависимости от условий культивирования, организма и
возраста популяции (или фазы роста).
Среди продуктов обмена в микробной клетке находятся аминокислоты, которые входят в состав
метаболического фонда (пула). Аминокислоты метаболического фонда качественно те же самые, что входят в состав
белков. Относительно биомассы аминокислоты фонда составляют 1-5мМ на 1 грамм сухой биомассы.
Основная цель лаборатории состоит в определении студентами компонентного состава биомассы
различных видов дрожжей.
Лабораторная работа 1 Выделение свободных аминокислот из биомассы микроорганизмов
1 Цель работы состоит в получении экстракта аминокислот после механического разрушения
клеточной стенки дрожжевой клетки. В полученном экстракте содержатся свободные аминокислоты, составляющие
метаболический фонд (пул).
2 Приборы и материалы
Ступка с пестиком
Электроплитка
Кварцевый песок
Биомасса дрожжей
Дистиллированная вода
3 Описание работы
На первом этапе исследуемую биомассу дрожжей необходимо отмыть от компонентов питательной
среды. Для этого берут 5-7 грамм влажной биомассы добавляют 100 мл дистиллированной воды, перемешивают и
центрифугируют 15-20 мин при 8000об/мин. Надосадочную жидкость сливают.
К навеске отмытой влажной биомассы (2-3 г) приливают 5 мл горячей дистиллированной воды (t=80
о
С) и растирают в ступке с кварцевым песком в течение 15 мин. Аминокислоты при этом переходят в водную фазу.
Остатки клеточной массы отделяют центрифугированием в течение 20 мин на настольной центрифуге при 3000
об/мин. Экстракт, содержащий аминокислоты переносят в стакан или колбу. Далее проводят повторную
экстракцию аминокислот 5-ю мл горячей воды из полученного осадка. Экстракт отделяют центрифугированием и
объединяют с первым супернатантом. Измеряют объем полученного суммарного экстракта. Параллельно
определяют влажность отмытой биомассы полученной после центрифугирования.
4 Оформление результатов работы
В полученном экстракте анализируют качественный состав пула аминокислот одним из хроматографических
методов (лабораторная работа 2.1 или 2.2) и визуально выявляют какая аминокислота содержится в экстракте в
наибольшем количестве (является доминирующей).
Затем проводят определение количества аминокислот в этом же экстракте химическим методом по Штейну-
Муру (лабораторная работа 3.2) и хроматографическим методом определяют количество одной из
идентифицированных аминокислот (доминирующей, лабораторная работа 3.1).
5 Контрольные вопросы
1. Какие существуют способы разрушения клеток?
2 .Какие растворители используются для экстракции низкомолекулярных компонентов метаболического фонда?
Лабораторная работа 2 Методы качественного анализа аминокислот в экстракте
Наиболее современным методом качественного и количественного анализа аминокислот в смесях является их
определение с помощью автоматических анализаторов аминокислот (ААА). Это сложные приборы, принцип
действия которых основан на использовании ионообменных колонок, заполненных сульфополистирольными
катионитами.
При отсутствии ААА используют другие методы анализа: электрофорез на бумаге или в тонком слое,
распределительную хроматографию (на бумаге или в тонком слое), ионообменную хроматографию в тонком слое,
газовую хроматографию.
Лабораторная работа 2.1 Качественный анализ аминокислот методом бумажной хроматографии
2
Метод основан на различной растворимости отдельных аминокислот в двух частично смешивающихся
жидкостях, одной из которых является вода, другой - водонасыщенный органический растворитель (смесь
бутилового спирта с уксусной кислотой или смесь пропилового спирта с аммиаком).
Сущность метода заключается в том, что определённый объем экстракта аминокислот наносят на полоску
хроматографической бумаги или пластину “Silufol”, конец которой опускают в подходящий органический
растворитель. Растворитель всасывается фильтровальной бумагой или тонким слоем силуфола и увлекает за собой
нанесенные аминокислоты. Скорость перемещения аминокислот зависит от химического строения бокового
радикала аминокислот и их способности растворяться в подвижном и неподвижном растворителе. Неподвижным
растворителем является вода. Чем меньше растворимость аминокислот в воде и чем больше их растворимость в
органическом растворителе, тем быстрее они движутся вслед за фронтом органического растворителя.
Скорость перемещения отдельных аминокислот выражают посредством коэффициента распределения
R
f .
Коэффициентом распределения называют отношение расстояния (в мм) пройденного аминокислотой (от места
нанесения аминокислоты до середины её пятна), к расстоянию пройденному растворителем (от места нанесения
аминокислоты до фронта растворителя).
Коэффициент распределения является характерной величиной для каждой аминокислоты и постоянен
при данных условиях опыта. Идентификация аминокислот на хроматограммах проводится путем использования
чистых аминокислот - “свидетелей”
1 Цель работы состоит в качественной оценке аминокислот в экстракте, полученном при выполнении
лабораторной работы 1, методом бумажной хроматографии
2 Приборы и материалы
Хроматографическая камера
Хроматографическая бумага: ватман 1-4 или FN-2-5
Система растворителя - бутанол: уксусная кислота (концентр.): вода в соотношении 4:1:1
Растворы аминокислот - “свидетелей”.
Готовят растворы аминокислот: лизина, глицина, глутаминовой кислоты,
лейцина, аспарагиновой кислоты, валина, аланина с концентрацией
2мг/мл,
Раствор для проявления хроматограммы. 0,5 г нингидрина растворяют в смеси 95 мл ацетона, 4 мл
воды, 1 мл уксусной кислоты.
3 Описание работы
3.1 Подготовка хроматографической камеры
Для того чтобы предотвратить испарение растворителя при движении его по бумаге, камеру
необходимо насытить парами растворителя. Для этого в камеру помещают рулон фильтровальной бумаги,
занимающий половину окружности камеры и не доходящий на 5 см до верхнего расширения камеры. На дно камеры
наливают небольшое количество системы растворителя, достаточное для того, чтобы пропитать рулон бумаги.
3.2 Подготовка бумаги для хроматографии
Вырезают полосу бумаги, ширина которой должна быть на 5 см меньше диаметра камеры, а длина
равна высоте камеры. На расстоянии 3,5см от конца полосы проводят простым карандашом стартовую линию и
отмечают точки нанесения аминокислот-“свидетелей” и исследуемых растворов. Точки нанесения растворов
должны находиться на расстоянии 3 см от боковых краев хроматограммы и на расстоянии 2,5 см одна от другой.
3.3 Нанесение проб
В отмеченные на стартовой линии точки наносят микропипеткой или откалиброванным капилляром по
40 мкл растворов аминокислот-“свидетелей” и 80мкл исследуемого раствора. Диаметр наносимого пятна не должен
превышать 5 мм. Для этого после каждого касания капилляром пятно подсушивают на воздухе или током теплого
воздуха. При нанесении проб нельзя касаться полосы бумаги руками.
3.4 Восходящая хроматография.
В верхнее расширение камеры помещают стеклянную палочку и подвешивают бумагу с пробами так,
чтобы она на 3-5 мм не доставала до дна камеры. На дно камеры осторожно наливают систему растворителя слоем
7-10 мм.
Камеру закрывают крышкой и наблюдают движение растворителя по бумаге.
3.5 Проявление хроматограммы
3
После того как фронт растворителя пройдет 4/5 длины хроматограммы, бумагу вынимают, отмечают
границу фронта растворителя. Хроматограмму сушат сначала на воздухе под тягой, затем в сушильном шкафу при
60
0
С. Высушенную хроматограмму проявляют, опрыскивая ее нингидриновым реактивом из пульверизатора или
осторожно погружая в ванночку с проявителем, высушивают на воздухе и прогревают в сушильном шкафу при t
100
0
С 10 мин. Проявившиеся пятна обводят карандашом и вычисляют R
f
для каждой аминокислоты. Визуально
оценивают количественное содержание аминокислот в смеси по интенсивности окрашивания отдельных пятен.
4 Оформление результатов работы
Приводят значения R
f
для аминокислот свидетелей и аминокислот экстракта. Делают заключение о
составе аминокислот метаболического фонда с указанием доминирующей аминокислоты.
5 Контрольные вопросы
1 На чём основан метод хроматографического разделения аминокислот?
2 Содержание какой аминокислоты доминирует в исследуемом экстракте?
Лабораторная работа 2.2 Качественный анализ аминокислот методом тонкослойной
хроматографии
1 Цель работы состоит в качественной оценке содержания аминокислот в экстракте, полученном при
выполнении лабораторной работы 1, методом тонкослойной хроматографии.
2 Приборы и материалы
Хроматографическая камера
Система растворителя - пропанол : аммиак(25%) - 1:1
Пластины “Silufol”.
Растворы аминокислот-“свидетелей” (см. лабораторную работу 2.1)
Раствор для проявления хроматограммы - 2%-ный раствор нингидрина в ацетоне
3 Описание работы
На пластине “Silufol” на расстоянии 1,5 см от нижнего края пластины простым карандашом отмечают
стартовую линию и точки нанесения проб на расстоянии 1,5 см друг от друга. Пробы наносят микропипеткой или
калиброванным капилляром по 40 мкл растворов “свидетелей” и 80мкл исследуемого экстракта. Нанесение проб
проводят так, как это описано для бумажной хроматографии в лабораторной работе 2.1
Камера для тонкослойной хроматографии представляет собой плоский сосуд с притертой крышкой.
Для создания атмосферы насыщенных паров растворителя с трех сторон в камеру помещают фильтровальную
бумагу. В камеру наливают растворитель и ждут пока им не пропитается вся фильтровальная бумага. На дне камеры
должно остаться 5-7 мм растворителя. В камеру помещают пластинку таким образом, чтобы она не касалась
фильтровальной бумаги и фронт растворителя двигался строго горизонтально.
Процесс ведут до тех пор, пока фронт растворителя не достигнет уровня 1-2 см от верхнего края
пластинки. После этого пластинку вынимают, отмечают границу фронта и тщательно сушат на воздухе, а затем в
сушильном шкафу при
60
0
С до полного исчезновения запаха аммиака.
Далее проводят проявление и качественный анализ аминокислот так же, как описано в лабораторной
работе 2.1
4 Оформление результатов работы
Приводят значения R
f
для аминокислот свидетелей и аминокислот экстракта. Делают заключение о
составе аминокислот метаболического фонда с указанием доминирующей аминокислоты.
5 Контрольные вопросы
1 На чём основан метод хроматографического разделения аминокислот?
2 Содержание какой аминокислоты доминирует в исследуемом экстракте?
Лабораторная работа 3 Методы количественного анализа аминокислот
Для количественного определения аминокислот применяют различные методы: химические,
ферментативные, микробиологические, методы с применением изотопов и хроматографические, которые
являются одновременно и методами разделения.
Наиболее эффективное разделение аминокислот достигается с помощью хроматографических методов.
Благодаря применению этого метода были достигнуты значительные успехи в изучении аминокислотного
состава белков и полипептидов.
4

Лабораторная работа 3.1 Определение количества аминокислот хроматографическим методом
1 Цель работы состоит в определении количества доминирующей аминокислоты, выявленной
при хроматографическом разделении аминокислот экстракта (лабораторная работа 2.1 и 2.2)
2 Приборы и материалы
Фотоэлектрокалориметр КФК-2МП
Стандартные растворы анализируемой аминокислоты, содержащие 01, 0,2 и 0,5 мг/мл аминокислоты.
Раствор для элюирования - 0,5% раствор CdCl
2
в этаноле.
Остальные реактивы те же, что используются в бумажной или тонкослойной хроматографии
3 Описание работы
На стартовую линию хроматограммы наносят по 40 мкл стандартных растворов анализируемой
аминокислоты и 100 мкл исследуемого образца.
Остальные операции выполняют так, как это описано в лабораторной работе 2.1 и 2.2.
После высушивания и проявления хроматограммы окрашенные участки, соответствующие
анализируемой аминокислоте, обводят простым карандашом, вырезают и помещают в чистые сухие пробирки.
Окрашенные участки бумажной хроматограммы предварительно измельчают ножницами. Аминокислоту из пятна
элюируют 5 мл 0,5% спиртового раствора CdCl
2
, периодически встряхивая. Элюирование считается оконченным,
когда в раствор полностью переходит краска наиболее интенсивно окрашенного пятна. Интенсивность окраски
полученного экстракта измеряют на фотоэлектрокалориметре при длине волны 540 нм. против контроля,
содержащего экстракт с неокрашенного участка хроматограммы.
4 Оформление результатов работы
Строят калибровочный график зависимости оптической плотности Д
540
от концентрации
аминокислоты в стандартном растворе. Содержание анализируемой доминирующей аминокислоты в экстракте
находят по этой калибровочной кривой (С
мг/мл
.). Количество аминокислоты в мМ на грамм сухой биомассы
рассчитывают по формуле:
С
мг/мл
х V
С=
А х М.м
V – объем экстракта, мл
А – навеска биомассы, г
М.м – молекулярная масса анализируемой аминокислоты
Лабораторная работа 3.2 Определение количества аминокислот по методу Штейна-Мура
Метод основан на образовании окрашенных соединений при нагревании аминокислот с
нингидриновым реактивом. Это реакция на свободную аминогруппу, находящуюся в α-положении. Нингидриновая
реакция широко используется для открытия отдельных аминокислот и для их количественного определения.
Нингидрин восстанавливается аминокислотой до ендиола, затем конденсируется с отщепившимся аммиаком и
второй молекулой нингидрина, образуя краситель типа мурексида (пурпурный Руэмана).
1 Цель работы состоит в определении суммарного количества аминокислот в анализируемом
экстракте из биомассы дрожжей
2 Приборы и материалы
Фотоэлектроколориметр КФК-2МП
Нингидриновый реактив: 2 г нингидрина растворяют в 75 мл метилцеллозольва, добавляют 25 мл 4 М
ацетатного буфера рН 5,5
Этанол
Исследуемый раствор: водный экстракт из биомассы дрожжей, полученный при выполнении
лабораторной работы 1
Стандартные растворы аминокислот с концентрацией 2мкМ/мл: глицин, лизин, фенилаланин, пролин
3 Описание работы
К 2 мл исследуемого экстракта приливают 1 мл нингидринового реактива. Смесь хорошо
перемешивают и ставят на кипящую водяную баню на 15 мин. Пробирки охлаждают под струёй холодной воды.
После охлаждения в каждую пробирку добавляют по 5 мл этанола. Перемешивают и колориметрируют при длине
волны 540 нм (для аминокислоты пролин 440 нм) в кювете с толщиной слоя 5 мм. Для контроля вместо
исследуемого раствора берут 2 мл воды.
Для расчета содержания аминокислот строят калибровочную кривую. Поскольку молярный
коэффициент экстинкции значительно зависит от химического строения аминокислотного бокового радикала, то
калибровочные кривые строят для аминокислот: глицина (алифатическая аминокислота), лизина
(диаминомонокарбоновая аминокислота), фенилаланина (ароматическая аминокислота). Для аминокислоты пролин
строят отдельную калибровочную кривую при 440 нм.
5

Для построения калибровочных кривых готовят стандартные растворы аминокислот, содержащие 2
мкМ в мл. Заполнение проб ведут по таблице 1.
Таблица 1- Приготовление проб для построения калибровочного графика при определении
аминокислот по методу Штейна-Мура
Стандар-
тный
раствор,
мл
Дист.
вода,
мл
Концентра-ция
аминокис-лот,
мкМ/мл
Д
540
Лизин
Д
540
Глици
н
Д
540
Фенил-
аланин
Д
440
Пролин
0,2 1,8 0.2
0,4 1,6 0.4
0,6 1,4 0.6
0,8 1,2 0.8
1,0 1,0 1.0
- 2,0 -
Для каждой аминокислоты по калибровочному графику определяют молярный коэффициент
экстинкции - оптическую плотность 1М раствора или 1 мкМ/мл
Калибровочный график для суммы аминокислот рассчитывается методом наименьших квадратов
или вычисляется средний молярный коэффициент экстинкции для всех аминокислот.
4 Оформление результатов работы
По калибровочному графику для суммы аминокислот находят суммарное содержание
аминокислот в мкМ в 1 мл анализируемого экстракта и рассчитывают содержание аминокислот на 1 г. сухой
биомассы.
5 Контрольные вопросы
1. На чем основан метод определения суммарного содержания аминокислот в биомассе?
2. Рассчитайте долю или процентное содержание доминирующей аминокислоты, найденное при
выполнении лабораторной работы 3.1, по отношению к суммарному содержанию аминокислот.
Лабораторная работа 3.3 Определение количества лизина химическим методом
1 Цель работы – определить содержание незаменимой аминокислоты лизина в полученном
экстракте из биомассы.
Химический метод основан на способности аминокислоты лизина образовывать цветной
продукт реакции в кислой среде. Другие аминокислоты (кроме пролина и орнитина) при значении
кислотности среды меньше 3 не образуют с нингидрином цветных комплексов.
2 Приборы и материалы
Фотоэлектроколориметр любой марки
15% раствор нингидрина в метилцеллозольве (хранят в холодильнике)
3 М раствор соляной кислоты
Ортофосфорная кислота (концентрированная) или этанол
3 Описание работы
К 0,3 мл исследуемого экстракта (концентрация лизина 60 -200 мкг/мл) приливают 0,2 мл 3 М НСl и
0,5 мл нингидринового реактива. Процесс проводят в пробирках на 10-20 мл со стеклянными пробками. Пробирки
помещают на 1 час в кипящую водяную баню, затем охлаждают при комнатной температуре и добавляют 3 мл
концентрированной ортофосфорной кислоты или этанола. В контроль вместо исследуемого раствора вносят
дистиллированную воду.
Измеряют оптическую плотность раствора против контроля при 540 нм в кювете с толщиной слоя 5 мм.
Концентрацию лизина определяют по калибровочному графику.
Построение калибровочного графика
Готовят стандартный раствор L-лизина, содержащий 1 мг/мл аминокислоты. Для построения
калибровочной кривой из стандартного раствора готовят ряд рабочих растворов по схеме, представленной в таблице
2.
6
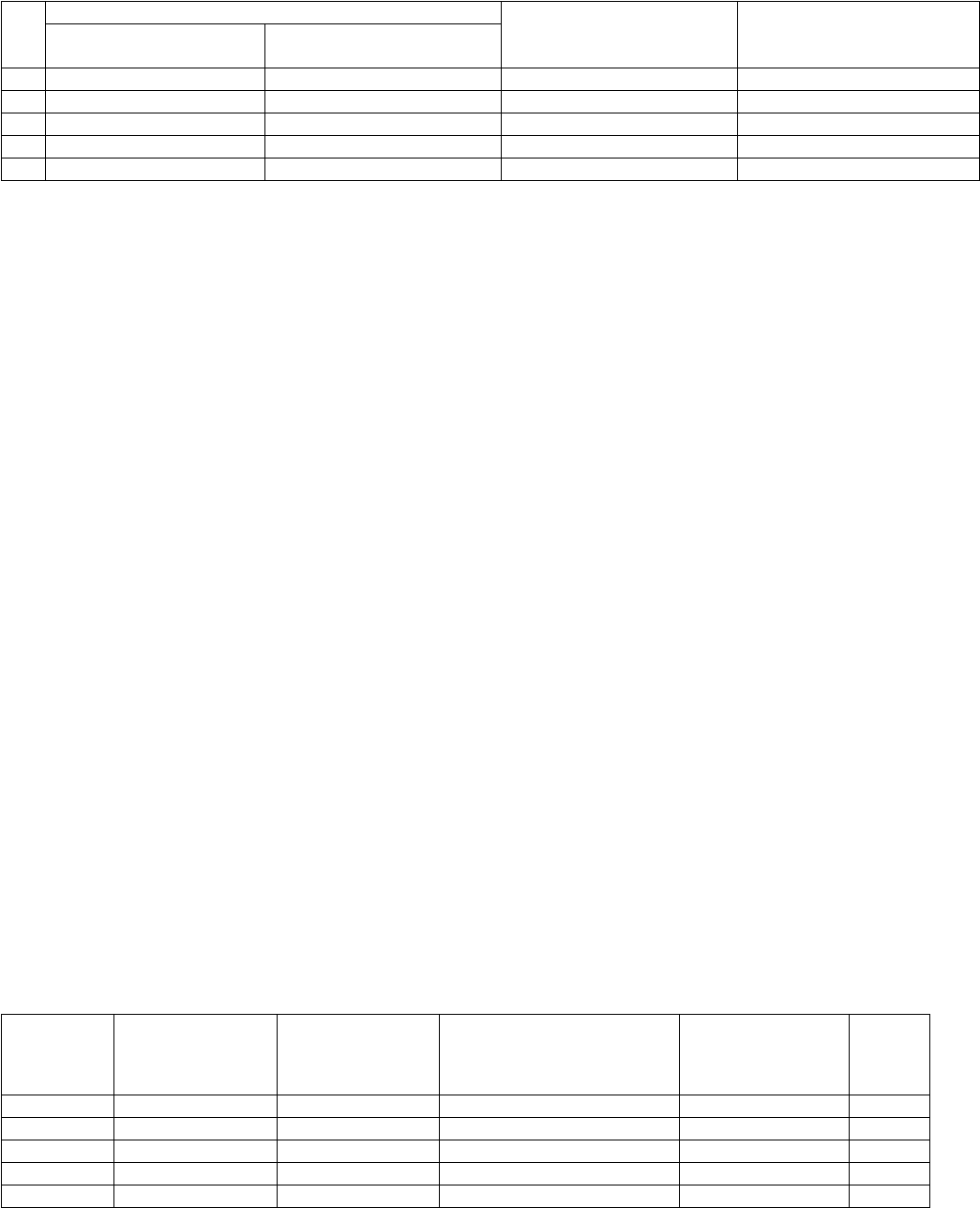
Таблица 2- Схема заполнения проб для построения калибровочного графика при определении лизина
химическим методом
Рабочий раствор Объем рабочего
раствора, мл
Концентрация лизина,
мкг/мл
Стандартный раствор,
мл
Дистиллированная вода,
мл
1 1 4 0,3 200
2 1 5 0,3 166
3 1 7 0,3 125
4 1 9 0,3 100
5 1 16 0,3 60
4 Оформление результатов работы
Определяют содержание лизина в исследуемом экстракте по калибровочной кривой и рассчитывают
содержание лизина на грамм сухой биомассы.
5 Контрольные вопросы
1. На чём основан метод определения лизина?
2. Рассчитайте долю лизина в суммарном содержании аминокислот на грамм сухой биомассы, определённом
по методу Штейна - Мура (лабораторная работа 3.2)
Лабораторная работа 4. Методы определения количества белка в растворах
В литературе описаны разные методы определения количества белка в растворе. Выбор того или
иного метода определяется количественным содержанием белка и, как следствие, чувствительностью
используемого метода.
Лабораторная работа 4.1 Определение количества белка биуретовым методом
1 Цель работы определить содержание белка в растворе биуретовым методом. Метод основан
на том, что вещества, содержащие две или более пептидные связи, дают сине-пурпурную окраску в
присутствии солей меди в щелочной среде.
Существуют две разновидности этого метода: по одной из них определяют от 2 до 10 мг белка в пробе,
чувствительность другой (микробиуретовой) - от 0,1 до 2 мг. Определению мешает присутствие солей аммония.
2 Приборы и материалы
Фотоэлектроколориметр любой марки
Стандартный раствор белка, содержащий 10 мг/мл сывороточного альбумина.
Биуретовый реактив: 0,15 г СuSO
4
*5H
2
O и 0,6 г NaKC
4
H
4
O
6
* 4H
2
O (калий-натрий виннокислый или
сегнетова соль) растворяют в 50 мл воды, приливают при постоянном перемешивании 30 мл 10%-ного раствора
NaOH, добавляют 0,1 г КJ и объем раствора доводят водой до 100 мл. Реактив хранят в темноте.
3 Описание работы
К 1 мл раствора, содержащего от 2 до 10 мг белка, добавляют 4 мл биуретового реактива. Пробы
перемешивают и оставляют при комнатной температуре на 30 мин, после чего фотометрируют при 540 нм в кювете
с толщиной слоя 5 мм. В качестве контроля используют 1 мл воды с добавлением 4 мл биуретового реактива.
Содержание белка в исследуемых растворах рассчитывают по калибровочному графику.
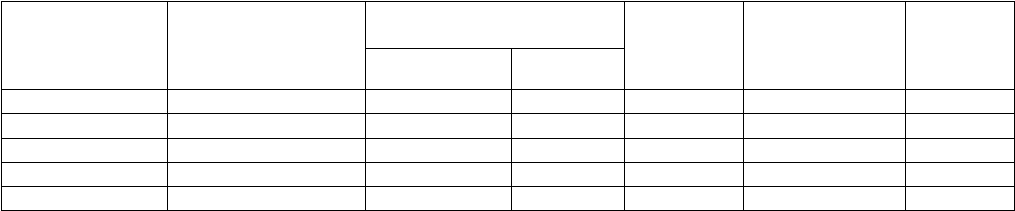
Заполнение проб для построения калибровочного графика проводят по таблице 3.
Таблица 3-Заполнение проб для построения калибровочного графика при определении белка
биуретовым методом
Проба Стандартный
раствор белка,
мл
Дистил.
вода, мл
Концентрация белка, мг/
мл
Биуретовый
реактив, мл Д
540
1 0.2 0.8 2 4
2 0.4 0.6 4 4
3 0.6 0.4 6 4
4 0.8 0.2 8 4
5 1.0 0.0 10 4
4 Оформление результатов работы
Определяют содержание белка в исследуемом растворе и рассчитывают количество белка в 1 г сухой
анализируемой биомассы
7
Лабораторная работа 4. 2 Микробиуретовый метод определения белка
1 Цель работы состоит в освоении метода определения белка микробиуретовым методом и
построении калибровочной кривой для оценки содержания белка в растворе. Чувствительность этого метода почти
на порядок выше, чем биуретового: от 0.1 до 2мг в пробе.
2 Приборы и материалы
ФЭК любой марки
6%-ный раствор едкого натра
Реактив Бенедикта. Растворяют последовательно в мерной колбе на 100
мл 17,3 г цитрата натрия, 10 натрия углекислого при нагревании и 1,73 г
меди сернокислой предварительно растворенной в 10 мл воды, и доводят
содержимое до 100 мл водой.
Стандартный раствор белка, содержащий 1 мг/мл сывороточного
альбумина.
3 Описание работы
К пробам, содержащим 2 мл раствора белка и 2 мл 6%-ного раствора едкого натра, добавляют 0,2 мл
реактива Бенедикта. Перемешивают, оставляют на 15 мин при комнатной температуре и фотометрируют при 330 нм
против контроля (вместо раствора белка берут 2 мл дистиллированной воды) в кюветах с толщиной слоя 5 мм.
Определение количества белка в пробе проводят по калибровочной кривой.
Построение калибровочного графика проводится по схеме, представленной в таблице 4
Таблица 4-Схема приготовления проб для построения калибровочного графика при определении белка
микробиуретовым методом
Стандартный
раствор
белка, мл.
Дистиллированная
вода, мл
Концентрация белка, 6%NаОН,
мл
Реактив
Бенедикта,
мл
Д
330
мг/пробе мг/мл
0,1 1.9 0.1 0.05 2 0.2
0.5 1.5 0.5 0.25 2 0.2
1.0 1.0 1.0 0.50 2 0.2
1.5 0.5 1.5 0.75 2 0.2
2.0 - 2.0 1.00 2 0.2
4 Оформление результатов работы
Определяют содержание белка в исследуемом растворе и рассчитывают количество белка в 1 г
анализируемой биомассы
Лабораторная работа 4.3 Определение количества белка в растворе по методу Лоури
1 Цель работы состоит в освоении метода определения белка в растворе и построении
калибровочного графика
. Данный метод является одним из наиболее чувствительных и точных в настоящее время. Он
позволяет вести определение белков в сильно разбавленных растворах с концентрацией 10 - 100 мкг в пробе. Метод
основан на сочетании биуретовой реакции на пептидную связь с реакцией Фолина на ароматические аминокислоты.
К недостаткам следует отнести то, что он применим только для прозрачных растворов и имеет довольно большую
длительность определения. Кроме того, на развитие окраски влияет большое количество веществ: компоненты
буферных систем, восстановители, комплексные детергенты, сернокислый аммоний в концентрации 0,15%, сахароза
в концентрации 10%.
2 Приборы и материалы
Фотоэлектроколориметр любой марки
Стандартный раствор белка, содержащий 0,25 мг/мл.. 25 мг бычьего сывороточного альбумина
постепенно растворяют в мерной колбе на 100 мл в 0,1 М NаОН.
Реактив А - 2%-ный раствор Nа
2
СО
3
в 0,1 М NаОН. 2 г NаОН растворяют в небольшом количестве
воды в мерной колбе на 500 мл. После полного растворения добавляют 10 г Nа
2
СО
3
. Объем доводят водой до метки.
Реактив В - 0,5%-ный раствор СuSO
4
в 1%-ном растворе цитрата натрия. 1 г цитрата натрия
растворяют в небольшом количестве воды в мерной колбе на 100 мл. После полного растворения добавляют 0,5 г
СuSO
4
* 5H
2
O. Доводят объем до метки дистиллированной водой.
8
Реактив С - готовится непосредственно перед употреблением. Смешивают 1 мл реактива В и 49 мл
реактива А.
Реактив Фолина. Перед использованием разбавляют водой 1:1
3 Описание работы
К 0,4 мл исследуемого белкового раствора приливают 2 мл реактива С. Смесь тщательно
перемешивают и оставляют при комнатной температуре на 10 мин. Затем приливают 0,2 мл реактива Фолина,
предварительно разбавленного дистиллированной водой 1:1, энергично перемешивают и оставляют на 30 мин в
темноте для развития окраски. Желтая окраска раствора постепенно переходит в синюю. Оптическую плотность
раствора измеряют на фотоэлектроколориметре при 750 нм в кювете с толщиной слоя 5 мм.
Содержание белка в исследуемых растворах рассчитывают по калибровочному графику.
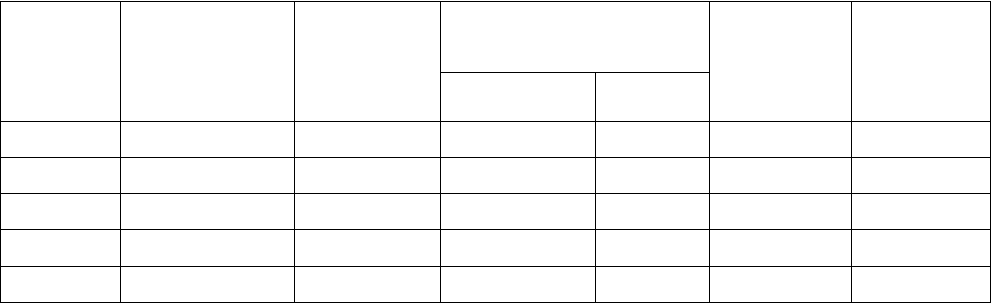
Заполнение проб для построения калибровочной кривой проводят по таблице 5
Таблица 5 - Схема заполнения проб для построения калибровочной кривой при определении белка по
методу Лоури
N
Проба
Стандартный
раствор белка,
мл
Дистиллиро
ванная вода,
мл
Концентрация
белка
Реактив
С
Реактив
Фолина, мл
мг/пробе мг/мл
1 0.1 0.3 0.025 0.062 2 0.2
2 0.2 0.2 0.050 0.125 2 0.2
3 0.3 0.1 0.075 0.188 2 0.2
4 0.4 - 0.100 0.250 2 0.2
К - 0.4 - - 2 0.2
По результатам измерений, выполненных в трех повторностях, строят график зависимости Д
750
от
концентрации белка мг/мл. При использовании новых реактивов А, В и реактива Фолина калибровочную кривую
нужно строить вновь.
4 Оформление результатов работы
Определяют содержание белка в исследуемом растворе и рассчитывают количество белка в 1 г
анализируемой биомассы
Лабораторная работа 4.4 Определение белка спектрофотометрическим методом
1 Цель работы состоит в освоении метода определения белка по поглощению в ультрафиолетовой
области. Метод основан на способности ароматических аминокислот (триптофана, тирозина) поглощать
ультрафиолетовый свет (УФ) с максимумом при 280 нм. Поскольку белки отличаются по содержанию
ароматических аминокислот, то их поглощение в УФ области спектра может сильно различаться. Условно считают,
что при концентрации усредненного белка в растворе 1 мг/мл, величина оптической плотности при 280 нм равна 1,0
при толщине слоя жидкости в кювете спектрофотометра 1 см.
Определению белка данным методом мешает присутствие нуклеиновых кислот и нуклеотидов,
имеющих максимум поглощения при 260 нм. Данный метод является весьма ценным для ориентировочного и
быстрого определения белка в бесцветных прозрачных растворах.
2 Приборы и материалы
Спектрофотометр любой марки
Стандартный раствор белка с концентрацией не более 1 мг/мл
3 Описание работы
Исследуемый раствор помещают в кювету с толщиной слоя 10мм и определяют оптическую плотность
последовательно при длине волны 280 и 260 нм. Содержание белка в исследуемых растворах рассчитывают по
калибровочному графику.
9
Построение калибровочного графика. Готовят разведения стандартного раствора. Содержание белка в
рабочих растворах должно составлять от 0.2 мг/мл до 1 мг/мл. Определяют оптическую плотность рабочих
растворов при двух длинах волн 260 и 280 нм. Строят калибровочный график зависимости содержания белка от
разницы Д
280
- Д
260.
4 Оформление результатов работы
Содержание белка в исследуемом растворе находят по графику и сравнивают с содержанием белка,
найденным по формуле:
С белка = 1,45 Д
280
- 0,74 Д
260
, мг/мл
Лабораторная работа 4.5 Определение количества белка по методу Бредфорда
1 Цель работы состоит в определении количества белка с использованием красителя Кумасси синим.
Метод основан на связывании с белками кислотного красителя - Coomassie brilliant blue G-250. При
связывании с белками спектр поглощения красителя меняется. Интенсивность окраски линейно зависит от
концентрации белка в диапазоне 10 - 100 мкг/мл белка.
2 Приборы и материалы
Фотоэлектроколориметр любой марки
Стандартный раствор белка, содержащий 1 мг/мл бычьего альбумина.
Реактив Кумасси. 10 мг красителя (G - 250) гомогенизируют в 5 мл 95%-ного спирта (на магнитной
мешалке). Полученный раствор смешивают с 10 мл 95%-ной фосфорной кислоты, доводят объем водой до 100 мл (в
мерной колбе). Реактив отфильтровывают.
3 Описание работы
К 0,1 мл раствора белка добавляют 5 мл реактива Кумасси. Инкубируют 2 мин и измеряют оптическую
плотность при 595 нм. Для контроля берут 0,1 мл воды и 5 мл реактива Кумасси.
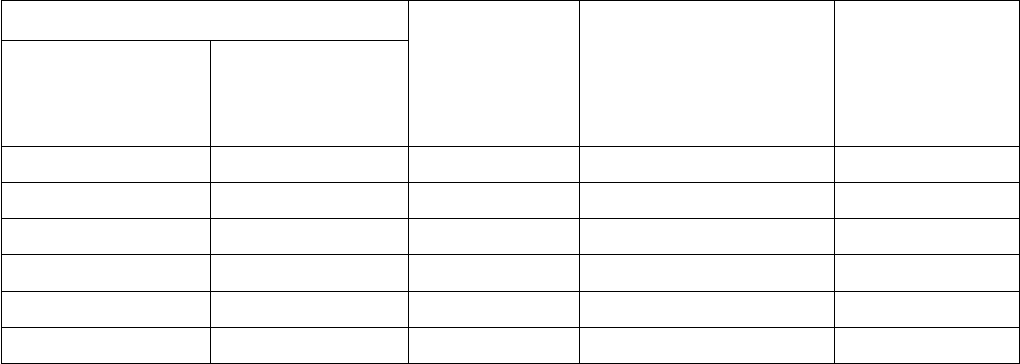
Для определения концентрации белка строят калибровочную кривую. Схема заполнения проб для
построения калибровочной кривой приведена в таблице 6
Таблица 6 -Схема приготовления проб для построения калибровочной кривой для определения белка
методом Бредфорда
Рабочий раствор Объём
рабочего
раствора, мл
Концентрация белка в
пробе, мкг/мл
Реактив Кумасси,
мл
Стандартный
раствор
белка, мл
Дистиллированная
вода, мл
1 9 0.1 10.0 5
1 7 0.1 12.5 5
1 3 0.1 25.0 5
1 1 0.1 50.0 5
3 1 0.1 75.0 5
1 0 0.1 100.0 5
4 Оформление результатов работы
Определяют содержание белка в исследуемом растворе и рассчитывают количество белка в 1 г
анализируемой биомассы
Лабораторная работа 5 Методы определения количества белка в микробной биомассе.
Белковый состав клетки неоднороден. Белки микробной клетки отличаются по растворимости и по
локализации. Наряду с растворенными в цитоплазме белками, клетка содержит структурные белки, входящие в
состав липопротеинов и гликопротеинов.
10
