Кукк В.А., Сергеев С.В., Решетников Б.А. Учебное пособие концепции современного естествознания
Подождите немного. Документ загружается.

170
предложил свою атомную теорию и установил закон кратных отношений,
молодой шведский химик Берцелиус, руководимый стремлением найти закон
образования химических соединений, тщательно изучил вопрос об их со-
ставе. Проведя не одну сотню анализов, он представил столько
доказательств, подтверждающих закон постоянства состава, что химики
были вынуждены признать справедливость этого закона, а следовательно, и
принять атомистическую теорию, которая непосредственно вытекала из
закона постоянства состава.
После этого Берцелиус обратился к проблеме определения атомных весов
элементов, разрабатывая более сложные и точные методы экспериментов,
чем те, которые были доступны Дальтону. В результате длительной и
тщательной аналитической работы Берцелиус пришел к выводу, что в солях
существуют простые и постоянные отношения между атомами кислорода
основания и атомами кислорода кислоты. Этого правила он постоянно
придерживался при изучении атомной проблемы.
На основании своих исследований и расчетов в 1826 г. Берцелиус опубли-
ковал первую таблицу атомных весов, отличающихся высокой точностью,
причем атомные веса были соотнесены им с кислородом, атомный вес
которого был принят за сто. Приведенные в этой таблице величины в
основном совпадают (за исключением атомных весов двух-трех элементов) с
принятыми в настоящее время. Существенное различие между таблицами
Берцелиуса и Дальтона состоит в том, что величины, полученные
Берцелиусом, в своем большинстве не были целыми числами. Эти расчеты
потом были подтверждены и уточнены другими учеными.
С работами Берцелиуса по атомистике тесно связано введение в употреб-
ление символов, предложенных им в 1814 г. для обозначения не только
элементов, но и химических реакций. Все символы, формулы соединений и
химические уравнения следует вести от Берцелиуса. Его система химической
символики весьма содействовала развитию химии. В качестве символа эле-
мента принимается первая буква его латинского или греческого названия. В
тех случаях, когда названия двух или более элементов начинаются с одних и
тех же букв, к ним добавляется вторая буква названия. Так появились
химические символы элементов, которые используются во всем мире и
поныне.
В рамках нашей работы трудно дать полный обзор открытий Берцелиуса
и его вклада в развитие химии, но еще об одной его заслуге следует
упомянуть обязательно. Еще в начале своей научной деятельности он
предложил все вещества разделить на органические и неорганические.
Элемента
р
ны
е частицы
Ато
м
ные
частицы
Молекуля
р
ные
частицы
Ассоциаты Агрегаты
Рис
. 10.
Схема
усложнения
частиц
вещества

171
Издавна со времени открытия огня человек стал делить все вещества на
две группы: горючие и негорючие. К горючим относились, в частности,
дерево и жир, которые в основном служили топливом. Дерево продукт
растительного происхождения, а жир или масло — продукты как животного,
так и растительного происхождения. В отличие от них вода, песок, горные
породы и большинство других веществ минерального происхождения не
горят и даже гасят огонь. Таким образом, между способностью вещества к
горению и его принадлежностью к живому или неживому миру просматрива-
лась определенная связь.
Накопленные в течение восемнадцатого столетия знания позволили хими-
кам сделать вывод, что судить о природе веществ, исходя только из их
горючести или негорючести, ошибочно. Вещества неживой природы могли
выдерживать жесткую обработку, и именно их Берцелиус назвал
неорганическими. А вещества живой или некогда живой материи такой обра-
ботки не выдерживали, и их он назвал органическими.
Во многих своих проявлениях эти две группы веществ вели себя принци-
пиально различным образом. Так, химиков не переставало удивлять, что
органические вещества при нагревании или каком-либо другом воздействии
легко превращаются в неорганические (возможность обратного перехода
была установлена гораздо позже). В то время в науке господствовал витализм
— учение, рассматривающее жизнь как особое явление, подчиняющееся не
законам мироздания, а влиянию особых жизненных сил. Сторонники
витализма утверждали, что для превращения неорганических веществ в
органические требуется какое-то особое воздействие ("жизненная сила"),
которое проявляется только внутри живой ткани. По этой причине
неорганические соединения, например, воду, можно было найти повсюду,
тогда как органические соединения, образующиеся под воздействием
жизненной силы, можно найти только в живых тканях.
Химики того времени, имевшие дело с самыми обычными соединениями
и пользовавшиеся самыми обычными методами, осуществить превращение,
требовавшее участия жизненных сил, естественно, не могли.
История химии свидетельствует, что до середины XIX в. ее развитие про-
исходило беспорядочно и хаотически. Химики открывали все новые и новые
химические элементы, описывали их свойства, способность вступать в
различные реакции и благодаря этому постепенно накопили огромный
эмпирический материал, который необходимо было привести в опреде-
ленную систему. Логическим завершением всего многовекового процесса
возникновения и развития химии стал первый международный химический
конгресс, который состоялся в сентябре 1860 г. в немецком городе Карлсруэ.
На конгрессе присутствовали самые знаменитые химики того времени.
Проведение конгресса в Карлсруэ имело большое значение для развития
химии. На нем были сформулированы и приняты основополагающие прин-
ципы, теории и законы химии, которые не вызывали никаких сомнений у
участников. Тем самым химия заявила о себе де факто как о самостоятельной
науке.

172
Однако гораздо большее значение имели научные результаты и последст-
вия конгресса. К 60-м гг. позапрошлого столетия в химии еще сохранилась
путаница с атомными и молекулярными весами, что не позволяло точно
решить вопрос о системе элементов и отрицательно сказывалось на развитии
самой химии. Разногласия по поводу относительных атомных весов,
приписываемых атомам различных элементов, привели к разногласиям в
отношении числа атомов отдельных элементов, входящих в данную
молекулу. Ученые неоднократно предпринимали попытки придать этим
проблемам системный вид, но их предложения были весьма
несовершенными, потому что в качестве системообразующих факторов
брались чаще всего несущественные, второстепенные и даже чисто внешние
признаки элементов.
Инициатором обсуждения и решения данной проблемы стал итальянский
химик Станислао Канниццаро, который предложил разграничить понятия
"атомный вес", "молекулярный вес" и "эквивалентный вес". На конгрессе
Канниццаро произнес яркую речь, и ему удалось убедить участников в
правильности предлагаемых им идей. С этого момента в вопрос об атомных
весах была внесена ясность, и было по достоинству оценено значение
таблицы атомных весов, составленной Берцелиусом.
Применительно ко всей химии это решение означало возможность
договориться об эмпирических формулах соединений и продолжить изучение
строения молекул, уточняя расположение атомов сначала в плоскости, а
затем в пространстве. Кроме того, решения конгресса, по сути дела,
подготовили условия для создания периодической системы элементов.
Периодический закон и периодическая
система химических элементов Д. И. Менделеева
Ранее мы установили, что многие химические свойства веществ сегодня
можно объяснить, прибегая к законам физики. Однако так было не всегда. На
заре зарождения физики и химии они существовали отдельно. Каждая из них
развивалась по своему определенному пути. Тем более значительными
кажутся гениальные открытия, которые способствовали
взаимопроникновению наук, устанавливали взаимосвязь между физическими
и химическими свойствами элементов [8].
Основоположником системного подхода в химии стал русский химик
Дмитрий Иванович Менделеев. Во время работы конгресса он находился в
Германии и работал над диссертацией. Он, естественно, был участником кон-
гресса и слышал выступление Канниццаро, в котором тот четко изложил
свою точку зрения на проблему атомного веса. Вернувшись в Россию,
Менделеев приступил к изучению элементов и обратил особое внимание на
периодичность изменения валентности у элементов, расположенных в
порядке возрастания атомных весов.
Менделеев считал, что любое точное знание составляет систему, в основе
которой должен быть единый систематизирующий фактор. В качестве такого

173
фактора он выбрал атомный вес, полагая, что последний является главной ха-
рактеристикой всех химических элементов.
Д. И. Менделеев сделал это открытие в 1869 г., совершив революцию в
естествознании, так как оно не просто устанавливало связь между
химическими и физическими свойствами отдельных элементов, но и
взаимную связь между всеми химическими элементами. Группы и ряды
периодической системы стали надежной основой для выявления семейств
родственных элементов.
Первым практическим применением периодического закона было исправ-
ление величин валентности и атомных весов некоторых элементов, для
которых в то время принимались неверные значения. Это относилось, в
частности, к индию, церию, торию, урану.
Основным принципом, по которому Менделеев строил свою таблицу
было размещение элементов в порядке возрастания их атомных весов.
Основываясь на валентности и химических свойствах элементов, Менделеев
расположил все элементы по 8 группам, в каждой из которых размещались
элементы со сходными свойствами.
Практически за два года, в результате напряженной творческой работы
ученый создал (в основном) ту периодическую систему элементов, которой
мы продолжаем пользоваться и до настоящего времени. Он был глубоко
убежден в том, что лучшим доказательством правильности основных
положений периодического закона является осуществление предсказаний, из
него вытекающих. Менделеев, в частности, предполагал существование
неизвестных тогда аналогов бора, алюминия и кремния — экабора,
экаалюминия и экасицилия. Все предсказанные великим ученым элементы
действительно были вскоре открыты химиками. Ими оказались галлий,
скандий и германий. Метод Менделеева по предсказанию свойств еще
неоткрытых элементов с успехом применялся его последователями и в более
поздние годы.
Какова же причина периодических изменений физических и химических
свойств элементов? Она кроется в периодичности строения электронных обо-
лочек атомов.
Одними из наиболее важных свойств атомов, связанных со строением их
электронных оболочек, являются эффективные атомные и ионные радиусы.
Оказывается, что они также периодически изменяются в зависимости от
величины атомного номера элемента. Для элементов одного периода по мере
увеличения порядкового номера сначала наблюдается уменьшение атомных
радиусов, а затем, к концу периода, их увеличение. Это необычное
физическое свойство находит простое объяснение, основанное на знании
строения внешней электронной оболочки атомов, принадлежащих одному
периоду: все дело в электростатике! Действительно, в начале периода на
внешней электронной оболочке атома находится небольшое количество
электронов, которые располагаются на относительно больших расстояниях
друг от друга — свободного места предостаточно, поэтому основным
взаимодействием в этом случае будет притяжение электронов ядром атома, а

174
не электростатическое отталкивание одноименно заряженных электронов.
Вот и получается, что при возрастании порядкового номера элемента
увеличивается величина заряда ядра и величина общего отрицательного
заряда электронной оболочки — значит возрастает и сила Кулоновского
притяжения между ядром и электронами — происходит "стягивание"
электронной оболочки к центру атома и радиус этого атома уменьшается. По
мере же заполнения электронной оболочки все большим количеством
электронов, им становится все "теснее и теснее" на одной оболочке и
поэтому у элементов, стоящих в конце любого периода таблицы Менделеева,
радиусы атомов возрастают: отрицательно заряженные электроны как бы
"расталкивают" друг друга, стремясь удалиться друг от друга на максимально
возможные расстояния.
Благодаря аналогичным рассуждениям, нашли свое объяснение и другие
периодически изменяющиеся физические свойства веществ: плотность,
температура плавления, прочность связей электронов в атоме и т.д.
Но самое главное заключалось в том, что таблица Менделеева не просто
давала объяснение физическим свойствам элементов, а ставила им в
соответствие и химические свойства этих элементов. Основным постулатом
таблицы являлось то, что валентность химического элемента определяется
числом электронов на внешней электронной оболочке, поэтому эти
электроны так и называются — валентные электроны. Важная роль
периодического закона заключается именно в том, что в нем устанавливается
связь между строением атомов и влиянием этого строения на физические и
химические свойства элементов.
Благодаря периодическому закону были сначала теоретически предска-
заны, а затем открыты и исследованы множества химических элементов и ве-
ществ, кроме того, появилась возможность моделирования химических
процессов. Поэтому периодический закон лег в основу теоретической химии.
В 1872 г. Д. И. Менделеев писал: "Основной задачей современной химии
является установление зависимости состава, реакций и свойств простых и
сложных тел от основных свойств входящих в их состав элементов, чтобы на
основании известного характера данного элемента можно было заключить о
неизвестном еще составе и свойствах его соединений". С тех пор минуло
больше 130 лет. На вооружении современных химиков для успешного
решения этой задачи имеются ЭВМ с новейшими пакетами программ,
позволяющие обнаруживать разнообразные свойства химических элементов
и веществ на основе квантовой химии. Эти машины работают с огромными
массивами данных. И как во времена Менделеева, результаты подобных
теоретических исследований приводят к развитию синтеза сложных
химических соединений, в том числе, органического синтеза. Задача,
поставленная ученым в позапрошлом веке, по-прежнему остается актуальной
и в наши дни.

175
10.6. Концепции физической химии
До конца XIX в. химия в основном была единой целостной наукой.
Внутреннее ее деление на органическую и неорганическую не нарушало
этого единства. Но последовавшие вскоре многочисленные открытия как в
самой химии, так и в биологии, физике положили начало быстрой ее
дифференциации [4].
Современная химическая наука, опираясь на прочные теоретические ос-
новы, непрерывно развивается вширь и вглубь. В частности, происходит от-
крытие и изучение новых, качественно различных дискретных химических
частиц. Так, еще в первой половине XIX в. при изучении электролиза были
обнаружены ионы — особые частицы, образованные из атомов и молекул, но
электрически заряженные. Ионы являются структурными единицами многих
кристаллов, кристаллических решеток металлов, они существуют в
атмосфере, в растворах и т.д.
Английский химик Эдуард Франкланд (1825–1899) первым заинтересо-
вался металлорганическими соединениями, в которых органические группи-
ровки присоединены непосредственно к атомам металла, например цинка. В
соединениях такого типа, как было установлено, каждый атом металла
присоединяет определенное число органических групп, причем оно различно
для разных металлов. Например, атомы цинка соединяются с двумя (не
больше и не меньше) органическими группами. В 1852 г. Франкланд
выдвинул теорию, которая позднее стала известна как теория валентности (от
латинского valentia — сила), согласно которой каждый атом обладает
определенной способностью к насыщению (или валентностью).
Теория валентности сыграла важнейшую роль в развитии теории химии
вообще и органической химии в особенности. Исходя из теорий
валентности, немецкий химик Кекуле предположил, что атом углерода
четырехвалентен, и в 1858 г. попытался, опираясь на это предположение,
представить строение наиболее простых органических молекул и радикалов.
В том же 1858 г. шотландский химик Арчибальд Скотт Купер (1831–1892)
предложил изображать силы, соединяющие атомы (или связи, как их принято
называть), в виде черточек. После того как была "построена" первая
органическая молекула, стало совершенно ясно, почему органические
молекулы, как правило, значительно больше и сложнее, чем неорганические.
Согласно представлениям Кекуле, углеродные атомы могут соединяться
друг с другом с помощью одной или нескольких из четырех своих валентных
связей, образуя длинные цепи — прямые или разветвленные. По-видимому,
никакие другие атомы не обладают этой замечательной способностью в той
мере, в какой обладает ею углерод.
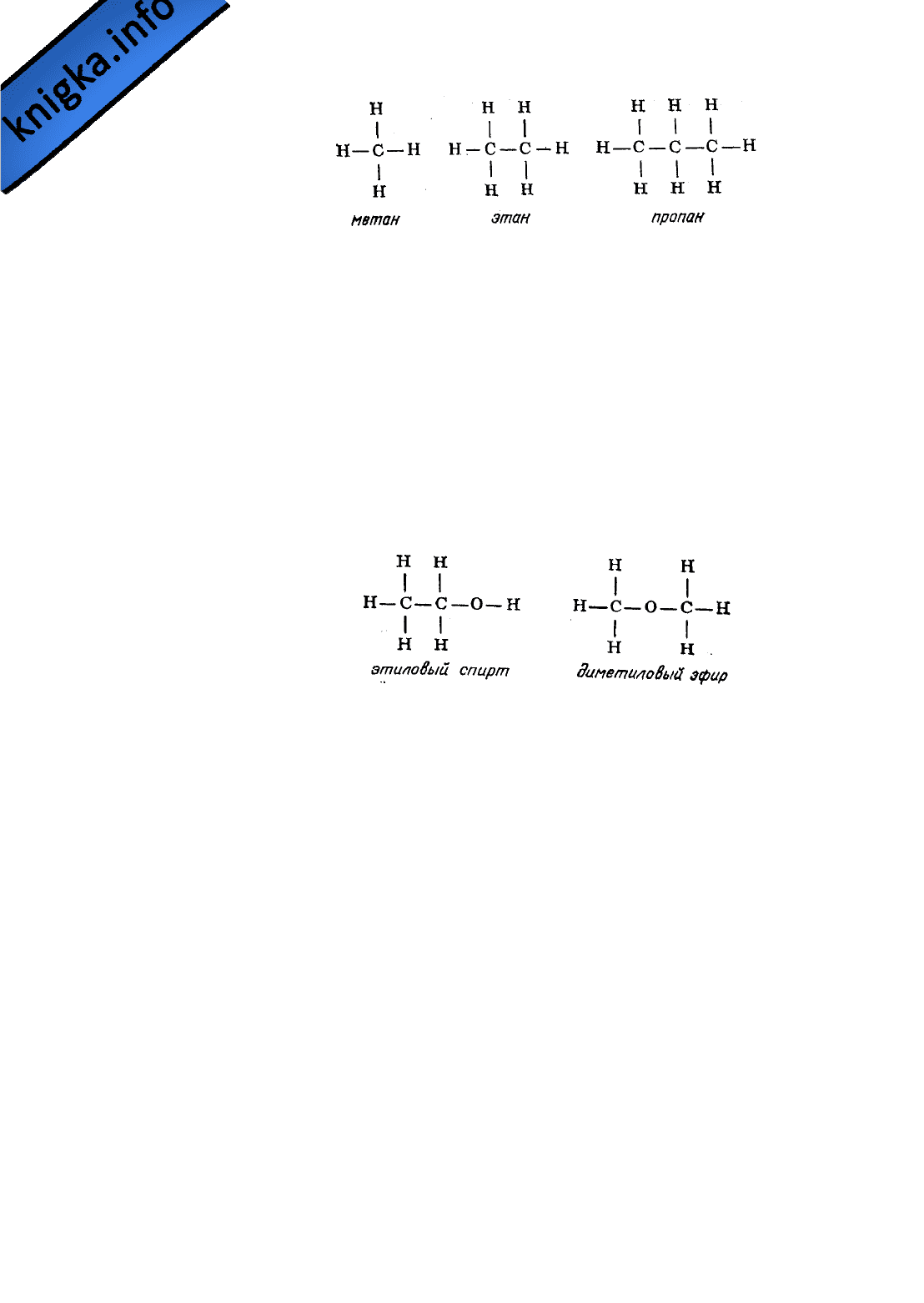
Итак, представив себе, что у каждого атома углерода четыре валентные
связи, а у каждого атома водорода одна такая связь, можно изобразить три
простейших углеводорода (соединения, молекулы которых образованы
только атомами углерода и водорода), метан СН
4
, этан С
2
Н
6
и пропан С
3
Н
8
,
следующим образом:
176
Полезность структурных формул была настолько очевидной, что многие
химики-органики приняли их сразу. Они признали полностью устаревшими
все попытки изображать органические молекулы как структуры,
построенные из радикалов. В результате было признано необходимым,
записывая формулу соединения, показывать его атомную структуру.
Русский химик Александр Михайлович Бутлеров (1823–1886)
использовал эту новую систему структурных формул в разработанной им
теории строения органических соединений. В 60-х гг. XIX в. он показал, как
с помощью структурных формул можно наглядно объяснить причины
существования изомеров. Так, например, у этилового спирта и диметилового
эфира одна и та же эмпирическая формула С
2
Н
6
О, однако структурные
формулы этих соединений значительно различаются:
Поэтому не удивительно, что изменение в расположении атомов приводит
к двум наборам очень разных свойств. В этиловом спирте один из шести
атомов водорода присоединен к атому кислорода, в то время как в
диметиловом эфире все шесть атомов водорода присоединены к атомам
углерода. Атом кислорода удерживает атом водорода слабее, чем атом
углерода, так что металлический натрий, добавленный к этиловому спирту,
замещает водород (одну шестую общего количества). Натрий, добавленный к
диметиловому эфиру, совсем не вытесняет водород. Таким образом, при
составлении структурных формул можно руководствоваться химическими
реакциями, а структурные формулы, в свою очередь, могут помочь понять
суть реакций.
Бутлеров особенно много внимания уделил одному из типов изомерии,
называемому таутомерией (динамической изомерией), при которой
некоторые вещества всегда выступают как смеси двух соединений. Если одно
из этих соединений выделить в чистом виде, оно сразу же частично перейдет
в другое соединение. Бутлеров показал, что таутомерия обусловлена
спонтанным переходом атома водорода от атома кислорода к соседнему
атому углерода и обратно. Чтобы убедительноо доказать справедливость
системы структурных формул, необходимо было определить структурную
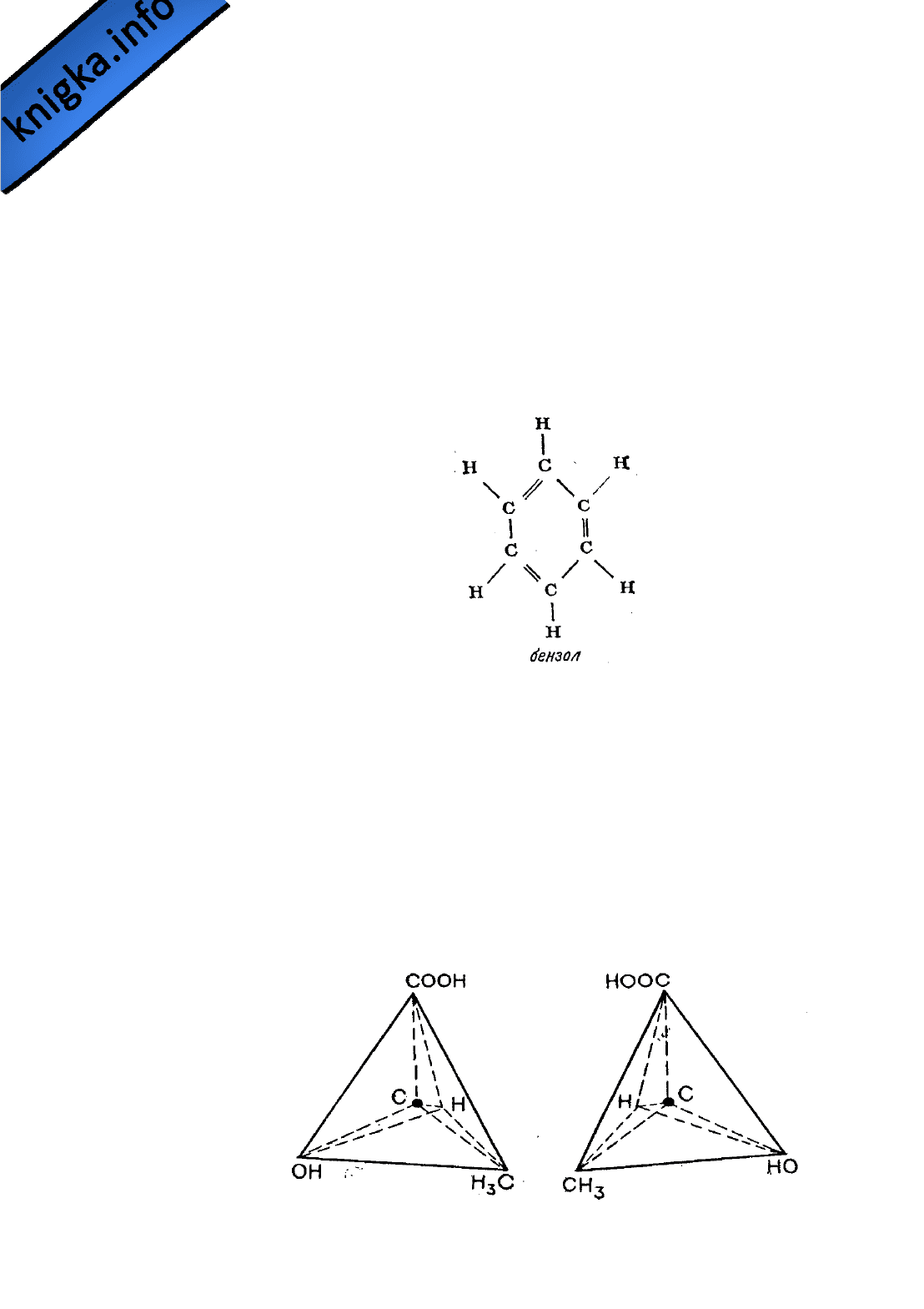
формулу бензола — углеводорода, содержащего шесть атомов углерода и
шесть атомов водорода. Сделать это удалось далеко не сразу. Казалось, не
существует такой структурной формулы, которая бы, отвечая требованиям
валентности, в то же время объясняла бы большую устойчивость соединения.
177
Первые варианты структурных формул бензола очень походили на формулы
некоторых углеводородов — соединений весьма нестойких и не похожих по
химическим свойствам на бензол.
Решить эту задачу смог опять-таки Кекуле. В один из дней 1865 г. (как он
сам рассказывает) Кекуле в полудреме ехал в омнибусе, и ему пригрезилось,
что он видит атомы, кружащиеся в танце. Вдруг конец одной цепи
соединился с ее началом, и образовалось вращающееся кольцо. И Кекуле
решил, что именно такой должна быть структурная формула бензола. До тех
пор структурные формулы строились только в виде линейных цепей
углеродных атомов, но теперь Кекуле ввел понятие "кольцо" (или "ядро")
атомов углерода и предложил следующую структурную формулу бензола:
Это объяснение было принято, и представление о структурных формулах
расширилось.
Молодой датский химик Якоб Гендрик Вант-Гофф (1852–1911), когда ра-
ботал над докторской диссертацией в 1874 г, выдвинул смелое
предположение, согласно которому четыре связи углеродного атома
направлены к четырем вершинам тетраэдра, в центре которого находится
этот атом.
Представить себе это можно так: три связи атома углерода образуют тре-
ногу, а четвертая связь направлена прямо вверх. Все четыре связи при этом
равноудалены друг от друга, а угол между любыми двумя соседними связями
равен примерно 109° (рис. 11).
Рис
. 11.
Тетраэдрическое
расположение
связей
атомов
углерода
допускает
две
конфигурации
,
одна
из
которых
является
зеркальным
отображением
другой
.
На
рисунке
показаны
два
возможных
варианта
расположения
атомов
в
молекуле
молочной
кислоты

178
Почти одновременно с Вант-Гоффом подобные предположения опублико-
вал французский химик Жозеф Ашиль Ле Бель (1847–1930). Поэтому
тетраэдрическую модель атома углерода иногда называют моделью Вант-
Гоффа — Ле Беля.
Гипотеза Вант-Гоффа — Ле Беля быстро завоевала признание. Этому, в
частности, способствовала книга, выпущенная в 1887 г. немецким химиком
Йоханнесом Адольфом Вислиценусом (1835–1902), который был широко
известен в научном мире и пользовался большим авторитетом.
В конце XIX столетия утвердилось мнение, что пространственное распо-
ложение связей присуще не только атому углерода.
Немецкий химик Виктор Мейер (1848–1897) показал, что некоторые типы
оптической изомерии, наблюдаемые у азотсодержащих соединений, можно
объяснить, лишь допустив пространственное расположение связей азота. В
1900–1902 гг. английский химик Уильям Джексон Поуп (1870–1939)
продемонстрировал, что трехмерную модель можно распространить также на
атомы серы, селена и олова, а несколько позднее швейцарский химик
Альфред Вернер (1866–1919) добавил к этому списку кобальт, хром, родий и
ряд других металлов. Начиная с 1891 г. Вернер занимался разработкой
координационной теории, которая позволила бы объяснить свойства
некоторых "необычных неорганических соединений". Согласно этой теории,
кроме главных валентных сил имеются еще и силы побочной валентности.
Первоначально считалось, что они резко отличаются от основных валентных
сил, но впоследствии выяснилось, что существенного различия между ними
не существует.
Другим важнейшим положением теории Вернера была идея о том, что
группировки, связанные с атомами металла, располагаются вокруг них в про-
странстве в вершинах определенных многогранников (атом металла,
расположенный в центре многогранника, получил название центрального
атома). Теория Вернера смогла объяснить и предсказать многочисленные
случаи изомерии координационных соединений, в том числе и оптической
изомерии.
С появлением трехмерной модели молекулы теория строения молекулы
начала быстро развиваться. Виктор Мейер показал, что обычно группы
атомов могут свободно вращаться вокруг единственной связи, соединяющей
их с остальной частью молекулы, но в ряде случаев этому вращению
препятствуют соседние объемные группы. Немецкий химик Иоганн Фридрих
Вильгельм Адольф фон Байер (1835–1917) использовал в 1885 г. идею
трехмерного строения молекул для изображения пространственного строения
циклических соединений (в виде плоских колец). Если четыре связи атомов
углерода направлены к четырем углам тетраэдра, то угол между любыми
двумя связями составляет 109°28'. Байер утверждал, что в любом
органическом соединении атомы располагаются, как правило, так, что углы
между связями атома углерода примерно соответствуют приведенному
значению. Если же по какой-либо причине угол меняется, то атом
оказывается в напряженном состоянии.

179
После проверки немецким химиком Эмилем Фишером (1852–1919), зани-
мавшимся изучением простых сахаров теория Вант-Гоффа — Ле Беля к
1900 г. была принята практически всеми учёными.
10.7. Учение о химических процессах
В XVII и XVIII вв. мир химии и мир физики разделяла четкая граница.
Химия изучала процессы, сопровождающиеся изменением молекулярной
структуры, в то время как физика изучала такие процессы, которые
подобными изменениями не сопровождались [9].
В начале XIX столетия, когда Дэви разрабатывал классификацию молекул
неорганических соединений, а Бертло — классификацию молекул
органических соединений, физики изучали потоки теплоты, другими словами
— термодинамику (от греческого — движение тепла).
Выдающихся успехов в этой области достигли английский физик Джеймс
Прескотт Джоуль (1818–1889) и немецкие физики Юлиус Роберт Майер
(1814–1878) и Герман Людвиг Фердинанд Гельмгольц (1821–1894). К 40-м гг.
позапрошлого столетия в результате проведенных ими работ стало ясно, что
в процессе перехода одной формы энергии в другую энергия не создается и
не исчезает. Этот принцип получил название закона сохранения энергии, или
первого начала термодинамики.
В своих работах французский физик Никола Леонар Сади Карно (1796–
1832), английский физик Уильям Томсон, впоследствии лорд Кельвин (1824–
1907), и немецкий физик Рудольф Джулиус Эмануэль Клаузиус (1822–1888)
развили механическую теорию теплоты. Было показано, что при
самопроизвольном переходе теплоты от точки с более высокой температурой
к точке с более низкой температурой работа производится только в случае
существенной разности температур, ибо часть теплоты неизбежно
рассеивается в окружающую среду. Этот вывод можно обобщить и
распространить на любой вид энергии.
В 1865 г. Клаузиус, пытаясь найти соотношение между количеством теп-
лоты в изолированной системе и абсолютной температурой этой системы,
ввел термин энтропия. Он показал, что при любых самопроизвольных
изменениях энергии энтропия системы должна увеличиваться. Этот принцип
был назван вторым началом термодинамики.
Учение о химических процессах — это такая область науки, в которой су-
ществует наиболее глубокое взаимопроникновение физики, химии и
биологии. В основе этого учения находятся химическая термодинамика и
кинетика, поэтому все это учение о химических процессах в равной степени
относится как к химии, так и к физике.
Одним из основоположников этого направления в химии стал русский хи-
мик Н.Н. Семенов — лауреат Нобелевской премии, основатель химической
физики. В своей Нобелевской лекции (1965) он заявил, что химический про-
цесс — то основное явление, которое отличает химию от физики, делает ее
