Кравченко Т.А., Введенский А.В., Козадеров О.А. Сборник примеров и задач по физической химии. Химическая термодинамика. Часть I
Подождите немного. Документ загружается.


11
1.3. Примеры решения задач
Пример 1.1. Аргон, находящийся под давлением 101300 Па, расширяется
обратимо адиабатически от 0,5⋅10
–3
до 1⋅10
–3
м
3
. Начальная температура равна
298 К. Какова конечная температура, сколько работы проделано при расшире -
нии?
Решение:
Любая работа расширения может быть найдена по уравнению
.
dV
P
W
⋅
=
δ
(П–1.1)
Работа , совершаемая системой в адиабатическом процессе , согласно первому
началу термодинамики равна изменению внутренней энергии, взятому с проти -
воположным знаком:
.
dU
W
−
=
δ
(П–1.2)
Если считать аргон идеальным газом, то в соответствии с законом Джоуля
(внутренняя энергия идеального газа зависит только от температуры ) пол-
ный дифференциал внутренней энергии (см . уравнение (1.7)) в отсутствие хи-
мической реакции (ξ=0) для n моль газа имеет следующий вид :
,dTCndU
V
⋅
⋅
=
(П–1.3)
где С
V
– теплоемкость газа при постоянном объеме. Таким образом,
.dTCnW
V
⋅
⋅
−
=
δ
(П–1.4)
Общая работа адиабатического процесса будет представлять собой интеграл
∫
⋅⋅−=
2
1
T
T
Vа
.dTCnW
(П–1.5)
Так как теплоемкость идеального газа не зависит от температуры, имеем:
(
)
.TTCnW
12Vа
−
⋅
⋅
−
=
(П–1.6)
Молярная теплоемкость аргона C
V
=12,476 Дж/(моль⋅К) (согласно таблице 1
Приложения). Количество аргона находим по уравнению состояния, используя
начальные P, V, T:

12
()
33
1
1
PV101300 Па 0,510 м
n0,02
моль
RT8,314 Дж/мольК 298 К
−
⋅⋅
===
⋅⋅
.
Для поиска конечной температуры скомбинируем уравнения (П–1.1) и (П–1.4);
получим:
.dVPdTCn
V
⋅
=
⋅
⋅
−
Считая аргон идеальным газом, делаем подстановку
V
nRT
P = :
V
V
nRT
nCdTdV,
V
dTdV
CR
TV
−⋅⋅=⋅
⋅=−⋅
После интегрирования получаем:
22
11
TV
V
TV
dTdV
CR
TV
=−
∫∫
,
22
V
11
TV
CR
TV
⋅=−⋅lnln ,
V
R
C
21
12
TV
TV
=
lnln .
V
8,314 Дж/(Кмоль)
R
33
12,476 Дж/(Кмоль)
C
1
21
33
2
V0,510 м
TT298K188
К
V
110 м
⋅
−
⋅
−
⋅
=⋅=⋅=
⋅
.
Таким образом,
()
()
аV21
WnCTT
0,02
моль 12,476 Дж/(Кмоль)188 К 298К 27,45Дж.
=−−=
=−⋅⋅⋅−=

13
Пример 1.2. Алюминий плавится при 931,5 К , его скрытая удельная эн-
тальпия плавления равна 386,6 Дж/г. Вычислить , сколько тепла потребуется на
плавление 500 г алюминия, если начальная температура была равна 298 К.
Температурная зависимость молярной теплоемкости алюминия при постоянном
давлении выражается уравнением:
(
)
(
)
(
)
3
P,м.
CAl20,6712,3810
ТДж/Кмоль
−
=+⋅⋅⋅.
Решение:
Cогласно выражению (1.10), для бесконечно малого изменения энтальпии
в процессе нагревания n моль или m г любого вещества (химическая реакция
отсутствует, ∆
0
=
ξ
) имеем:
(
)
P,м.
dHn
С TdT
=⋅⋅
, (П–1.7)
если дана молярная теплоемкость вещества, и
(
)
P,уд .
dHm
С TdT
=⋅⋅
, (П–1.8)
если известна удельная теплоемкость вещества. Интегрируя уравнения (П–1.7)
и (П–1.8), получаем конечное изменение энтальпии при нагревании вещества от
температуры T
1
до T
2
:
()
2
1
Т
P,м.
Т
Hn
С TdT
∆=⋅⋅
∫
; (П–1.9)
()
2
1
Т
P,уд .
Т
Hm
С TdT
∆=⋅⋅
∫
. (П–1.10)
Рассчитаем количество алюминия:
m500 г
n18,52
моль
M27 г /моль
===. Искомая
теплота равна сумме теплот, затраченных на нагревание от 298 К до темпера-
туры плавления и на плавление 18,52 моль алюминия:
пл
T
T
HHH
пл
1
∆+∆=∆ . В
нашем случае теплота , затраченная на нагревание, вычисляется по уравнению
(П–1.9):
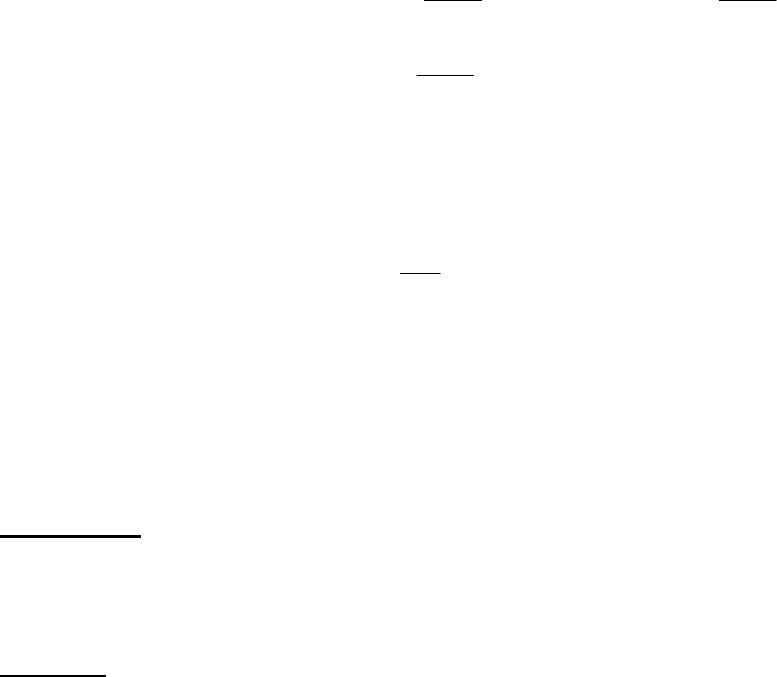
14
()
.Дж 331794
моль
Дж
17915моль52,18
моль
Дж
2985,931
2
38,12
)2985,931(67,20моль52,18
dTT
3
1038,1267,20моль52,18dT)T(Сn
22
К 5,931
К298
T
T
.м,p
T
T
3
10
пл
1
пл
1
=⋅=
=
−+−⋅⋅=
=⋅
−
⋅+⋅=⋅⋅=∆Η
−
⋅
∫∫
Теплота , требуемая на плавление, рассчитывается по формуле:
пл . уд . пл .
HmH
∆=⋅∆
; (П–1.11)
.Дж193300
г
Дж
6,386г500
пл
=⋅=∆Η
Таким образом, всего затрачивается
пл
T
T
HHH
пл
1
∆+∆=∆ =331794 Дж + 193300 Дж = 525094 Дж.
Пример 1.3. В калориметре смешаны 50 г льда, взятого при 273 K, и 150 г
воды, взятой при 323 K. Определить конечную температуру системы, если
удельная энтальпия плавления льда
уд . пл .
H
∆
=334,7 Дж/г и удельная теплоем-
кость воды
в
С
=4,184 Дж/(К⋅г).
Решение:
Рассмотрим происходящие в калориметре процессы и соответствующие
им тепловые эффекты :
1) Охлаждение воды, находящейся при 323 К, до искомой температуры Т
Х
(процесс экзотермический, ∆
.охл
H <0);
2) Плавление льда, контактирующего с теплой водой (процесс эндотермиче-
ский, ∆
.пл
H >0);
3) Нагревание растаявшего льда от 323 К до искомой температуры Т
Х
(процесс
эндотермический, ∆
.нагр
H
>0).
Калориметр – адиабатически изолированная система, следовательно , общее из-
менение энтальпии
∆H = ∆
.охл
H +∆
.пл
H + ∆
.нагр
H = 0. (П–1.12)
Запишем выражения для тепловых эффектов процессов 1–3, пользуясь инте -
гральной формулой (П–1.10). Учтем, что удельная теплоемкость воды С
В
есть
величина постоянная в данном интервале температур :

15
1) ∆
.охл
H =
()
вxвв
T
T
вв
TTС mdTСm
x
в
−⋅⋅=⋅⋅
∫
;
2) ∆
.пл
H =
⋅
л
m
.пл.уд
Н
∆
;
3) ∆
.нагр
H =
()
лxвл
T
T
в. л
TTС mdTСm
x
л
−⋅⋅=⋅⋅
∫
.
Согласно уравнению теплового баланса (П–1.12), запишем:
(
)
вxвв
TTС m
−
⋅
⋅
+
⋅
л
m
пл.уд
Н
∆
+
(
)
лxвл
TTС m
−
⋅
⋅
=0;
вввxвв
TСmT С m
⋅
⋅
−
⋅
⋅
+
⋅
л
m
.пл.уд
Н
∆
+
лвлxвл
TСmT С m
⋅
⋅
−
⋅
⋅
=0.
Отсюда находим конечную температуру T
Х
:
(
)
)mm(С
TСНmT С m
T
лвв
лввлввв
x
+
⋅
−
∆
⋅
−
⋅
⋅
= ;
()
г50г150
К
г
Дж
184,4
К273
Кг
Дж
184,4
г
Дж
7,334г50К323
Кг
Дж
184,4г150
T
x
+
⋅
⋅
⋅
−⋅−⋅
⋅
⋅
= =290,5 К .
Пример 1.4. Истинная молярная теплоемкость серебра в интервале тем-
ператур от 273 К до 1234 К выражается уравнением
(
)
(
)
(
)
352
P
CT23,975,2810
Т 0,2510 ТДж/Кмоль
−−
=+⋅⋅−⋅⋅⋅
.
Вычислить среднюю молярную теплоемкость
P
C
серебра в интервале от 298 К
до 700 К.
Решение:
Средняя теплоемкость в интервале температур от Т
1
до Т
2
рассчитывается
по уравнению:
∫
⋅⋅
−
=
2
1
T
T
p
12
p
,dT)T(C
TT
1
C ( П–1.13)
где С
р
(Т) – истинная теплоемкость . Подставляя в уравнение (П–1.13) выраже-
ние для С
р
(Т) и температуру из условия задачи, получаем:
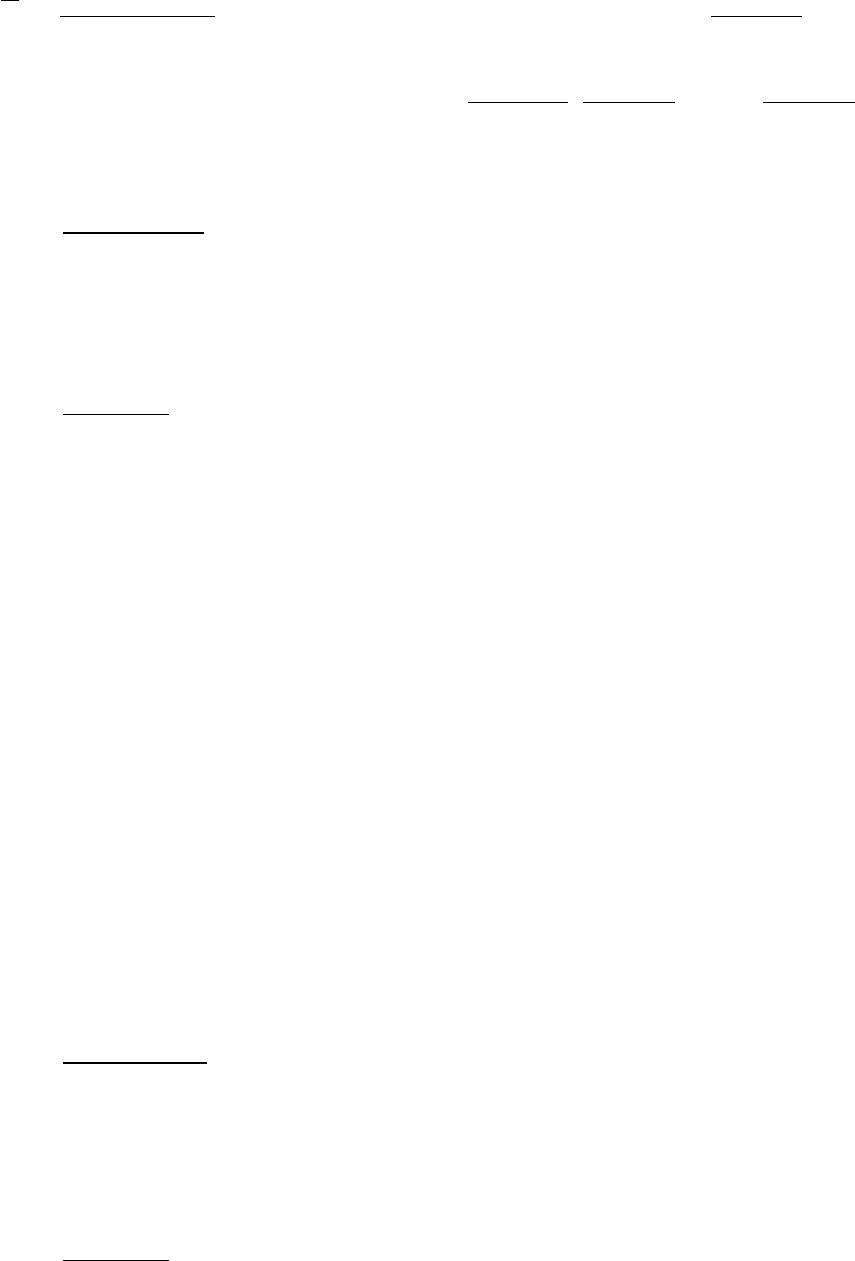
16
∫
=⋅
⋅
⋅⋅−⋅⋅+⋅
−
=
−−
К 700
К298
253
p
dT.
Кмоль
Дж
T1025,0T1028,597,23
К298К700
1
C
()
.
Кмоль
Дж
48,26
Кмоль
Дж
700298
1025,0
7002981028,55,097,23
5
3
⋅
=
⋅
⋅
⋅
−+⋅⋅⋅+=
−
Пример 1.5. Определить энтальпию реакции
CaC
2
(тв .)
+2H
2
O(ж .) = Ca(OH)
2
(тв .) + C
2
H
2
(г.),
пользуясь данными о стандартных молярных энтальпиях образования веществ
( см . Приложение, таблица 2).
Решение:
Энтальпию реакции определим, пользуясь законом Гесса. Согласно
уравнению (1.14), тепловой эффект химической реакции равен
()
(
)
(
)
()
()
()
2222
2
r обр.,CH обр.,CaC обр.,HO
обр.,CaOH
H ННН2Н
986,59кДж/моль 226,75кДж/моль
62,76 кДж/моль 2285,83кДж/моль 125,42кДж/мо
ль.
∆=∆+∆−∆+⋅∆=
=−+−
−−+⋅−=−
Размерность теплового эффекта энергия/количество вещества (Дж/моль) связа-
на с новым в СИ определением физической величины количеством вещества и
его единицей (моль). Согласно этому определению тепловой эффект химиче-
ской реакции можно относить к любому из исходных веществ или продуктов
реакции или ко всем реагентам . В нашем случае тепловой эффект
Н 125,42кДж/моль
∆=−
относится к 1 моль СаС
2
(тв .), или к 1 моль
Са(ОН )
2
(тв .), или к 1 моль С
2
Н
2
(г.), или к 1 моль 2Н
2
О(ж .). Однако к какому
бы из участников ни относили тепловой эффект, эта величина характеризует
реакцию в целом.
Пример 1.6. Найти молярную энтальпию образования аммиака на осно -
вании данных о реакциях в газовой фазе :
.моль/кДж26,1530H,N2OH6O3NH4
;моль/кДж68,571H,OH2OH2
22223
1222
−=∆+=+
−
=
∆
=
+
Решение:
Напишем реакцию образования аммиака

17
,,NHN
2
1
H
2
3
.обр322
∆Η=+
где ∆H
обр.
– искомая теплота образования. H
2
O и O
2
не входят в наше уравне -
ние, поэтому исключим их из уравнений, приведенных в условии. Для этого
первое уравнение умножим на 3 и вычтем из него второе. Получим:
,HH3H,N2OH6OH6O3NH4O3H6
212222322
∆
−
∆
=
∆
−
−
=
−
−
+
или
(
)
(
)
.моль/кДж78,184
моль/кДж26,1530моль/кДж68,5713H,NH4N2H6
322
−=
=
−
−
−
⋅
=
∆
=
+
Сравнив полученное уравнение с уравнением образования аммиака, получим:
.моль/кДж2,46
4
моль/кДж78,184
4
.обр
−=−=
∆Η
=∆Η
Пример 1.7. Вычислить стандартный тепловой эффект реакции растворе -
ния цинка в разбавленном водном растворе сульфата меди, взяв необходимые
данные из справочных таблиц (см . Приложение).
Решение:
Требуется найти
o
298
H∆
для реакции
Zn(тв .) + CuSO
4
(водн.) = Cu(тв .) + ZnSO
4
(водн.).
Эту реакцию можно записать так:
Zn(тв .) + Cu
2+
(водн.) = Cu(тв .) + Zn
2+
(водн.), ∆H
°
.
По таблице 2 Приложения находим :
(
)
2+
обр,298
HZn(
водн.) 152,40
∆=−
o
кДж/моль
; для
(
)
2+
обр,298
HCu(
водн.) 64,39кДж/моль
∆=
o
. В соответствии с
уравнением (1.14) и с учетом того , что стандартные теплоты образования про -
стых веществ равны нулю, получим:
o
298
H∆
= (–152,40 кДж/моль – 64,39 кДж/моль) = – 216,79 кДж/моль.
18
Пример 1.8. Энтальпия растворения 1 моль BaCl
2
в воде равна –8,66 кДж.
Энтальпия растворения кристаллогидрата 1 моль BaCl
2
⋅2H
2
O равна 20,5 кДж.
Чему равна энтальпия гидратации хлорида бария?
Решение:
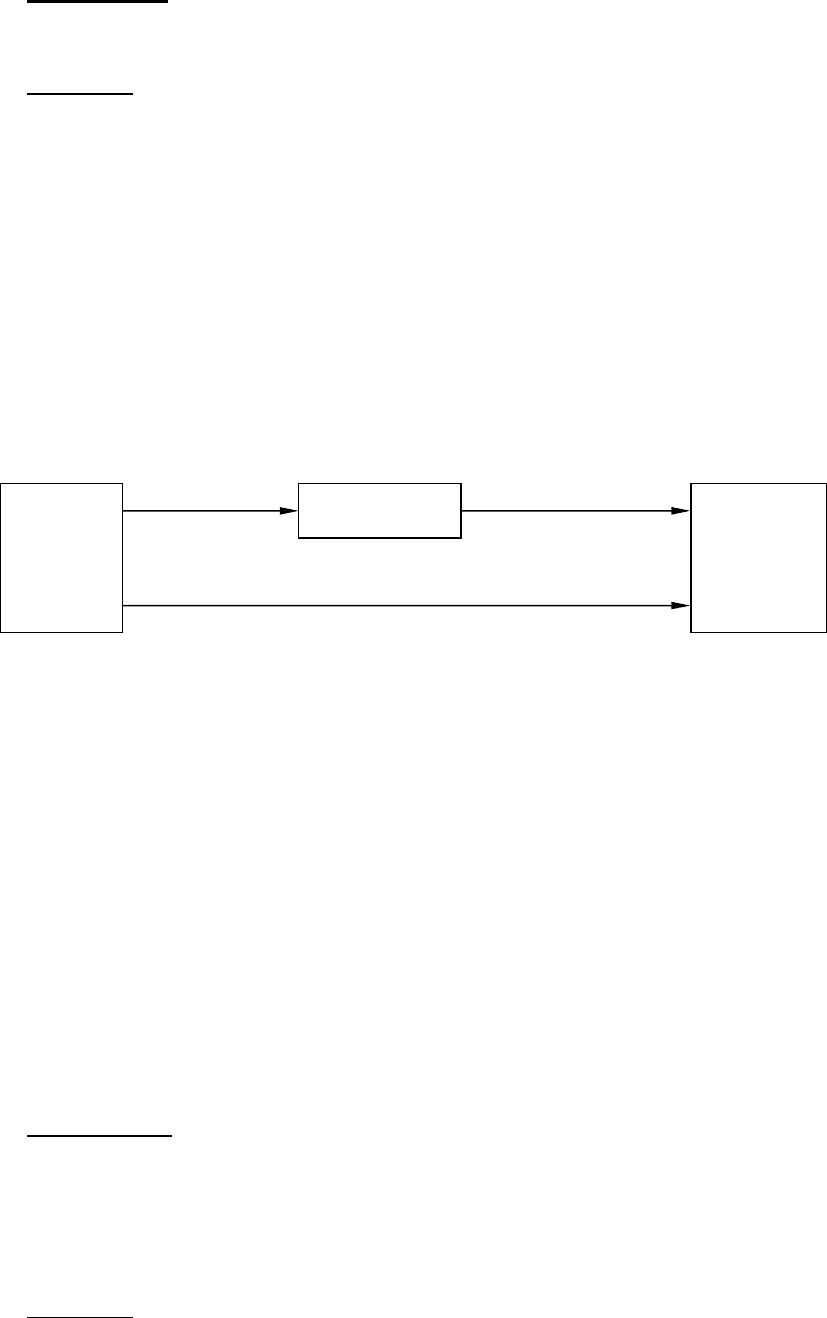
Раствор хлорида бария можно получить двумя путями:
Первый путь : 1 моль BaCl
2
растворить в большом количестве воды; про -
цесс растворения – экзотермический: ∆H
р
(BaCl
2
)
= – 8,66 кДж/моль.
Второй путь состоит из двух этапов:
1) Сначала провести реакцию гидратации по уравнению:
BaCl
2
+2H
2
O = BaCl
2
⋅2H
2
O, ∆H
г
(BaCl
2
),
2) Затем полученный кристаллогидрат растворить в большом количестве воды;
тепловой эффект этого процесса равен ∆H
р
(BaCl
2
⋅2H
2
O)
= 20,5 кДж/моль.
На основании закона Гесса составим термохимическую схему:
Так как тепловой эффект получения раствора не зависит от пути процесса, то
энтальпия растворения BaCl
2
равна сумме энтальпий процессов гидратации
хлористого бария и растворения кристаллогидрата :
∆H
р
(BaCl
2
) = ∆H
г
(BaCl
2
) + ∆H
р
(BaCl
2
⋅2H
2
O).
Отсюда следует, что энтальпия гидратации соли равна разности энтальпий
растворения кристаллической соли и соответствующего кристаллогидра-
та:
∆H
г
(BaCl
2
) = ∆H
р
(BaCl
2
) –∆H
р
(BaCl
2
⋅2H
2
O), (П–1.14)
∆H
г
(BaCl
2
) = – 8,66 кДж/моль – 20,5 кДж/моль = –29,16 кДж/моль.
Пример 1.9. Энтальпия нейтрализации 1 моль соляной кислоты раство-
ром гидроксида натрия равна –55,9 кДж, а энтальпия нейтрализации 1 моль
монохлоруксусной кислоты CH
2
ClCOOH тем же раствором NaOH равна –59,75
кДж. Чему равна энтальпия диссоциации монохлоруксусной кислоты ? Какая
часть соли разлагается при прибавлении 1 моль HCl к 1 М раствору
CH
2
ClCOONa, если при этом поглощается 1,904 кДж?
Решение:
BaCl
2
Раствор
BaCl
2
BaCl
2
⋅
2H
2
O
+2H
2
O
+nH
2
O
+(n
–
2)H
2
O
∆
H
г
(
BaCl
2
)
∆H
р
(BaCl
2
⋅2Н
2
О)
∆H
р
(BaCl
2
)
19
Запишем уравнения протекающих реакций с соответствующими тепло-
выми эффектами:
HCl + NaOH = NaCl + H
2
O, ∆H
1
= – 55,9 кДж/моль; (a)
CH
2
ClCOOH + NaOH = CH
2
ClCOONa + H
2
O, ∆H
2
= – 59,75 кДж/моль; (б)
CH
2
ClCOONa + HCl = CH
2
ClCOOH + NaCl, ∆H
3
= 1,904 кДж/моль. (в)
Вычитая уравнение (а) из уравнения (б), получаем:
CH
2
ClCOOH + NaOH – HCl – NaOH = CH
2
ClCOONa + H
2
O – NaCl – H
2
O,
CH
2
ClCOOH – HCl = CH
2
ClCOONa – NaCl.
Переписывая последнее уравнение в краткой ионной форме, получаем:
CH
2
ClCOOH
+
= CH
2
ClCOO
–
,
или
CH
2
ClCOOH = CH
2
ClCOO
–
+ H
+
.
Прибавим к правой и левой части Н
2
О , тогда
CH
2
ClCOOH + Н
2
О = CH
2
ClCOO
–
+ H
3
О
+
. (г)
Уравнение (г) есть уравнение диссоциации монохлоруксусной кислоты в вод-
ной среде. Тепловой эффект этого процесса находим как разность тепловых
эффектов реакций (б) и (а). Отсюда следует, что энтальпия диссоциации сла -
бой кислоты равна разности энтальпий нейтрализации слабой и сильной
кислот :
∆H
дисс.слабой
= ∆H
нейтр . слабой
– ∆H
нейтр . сильной
. (П–1.15)
В применении к нашей задаче имеем:
∆H
дисс
(CH
2
ClCOOH) = ∆H
нейтр
(CH
2
ClCOOH)– ∆H
нейтр
(HCl),
∆H
дисс
(CH
2
ClCOOH) = –59,75 кДж/моль– (–55,9 кДж/моль) = –3,85 кДж/моль.
Уравнение реакции (в ), наоборот, получается при вычитании из (а) уравне -
ния (б). Однако тепловой эффект третьего процесса зависит от доли (α) разло-
жившейся соли CH
2
ClCOONa, и не равен разности тепловых эффектов
(∆H
нейтр . сильн.
– ∆H
нейтр . слаб.
), а определяется выражением:
∆H
разл .
(CH
2
ClCOONa) = α⋅(∆H
нейтр .
(HCl) – ∆H
нейтр .
(CH
2
ClCOOH)) =
= –α⋅∆H
дисс
(CH
2
ClCOOH).

20
Таким образом,
(
)
()
разл 2
дисс 2
HCHClCOONa
1,904 кДж/моль
0,49.
HCHClCOOH3,85 кДж/моль
∆
α=−=−=
∆−
Пример 1.10. Вычислить энтальпию образования 1 моль твердого рас-
твора nKBr⋅qKCl из индивидуальных веществ при 298 К. Состав твердого рас-
твора: n=1 моль KBr на q=8 моль KCl. Энтальпия растворения 2 г твердого рас-
твора в 100 мл воды –460 Дж, а энтальпия растворения 2 г механической смеси
(KBr+8KCl) в 100 мл воды равна –471 Дж.
Решение:
Воспользуемся тем, что раствор смеси хлорида и бромида калия можно
получить двумя путями:
1) Приготовить механическую смесь из n моль KBr и q KCl и растворить в m
моль воды:
(nKBr + qKCl)
мс
+ mH
2
O →
(
)
(
)
OHmOHqClOHnBrOHKqn
2222
γ−β−α−+γ⋅+β⋅+α⋅+
−
−
+
, ∆H
р.мс
.
(здесь α, β, γ – числа гидратации ионов). Отметим, что тепловой эффект этого
процесса согласно закону Гесса равен сумме энтальпий отдельных процессов
растворения солей с соответствующими коэффициентами:
∆H
р.мс
= n⋅∆H
р
(KBr) + q⋅∆H
р
(KCl).
2) Предварительно приготовить твердый раствор:
(nKBr + qKCl)
мс
→ nKBr⋅qKCl, ∆H
обр.тр
Затем растворить его в m моль воды:
nKBr⋅qKCl + mH
2
O →
(
)
(
)
OHmOHqClOHnBrOHKqn
2222
γ−β−α−++γ⋅+β⋅+α⋅+
−
−
+
, ∆H
р.тр
.
Согласно закону Гесса запишем:
∆H
р.мс
= ∆H
обр.тр
+ ∆H
р.тр
.
Отсюда находим энтальпию образования твердого раствора:
∆H
обр.тр
= ∆H
р.мс
– ∆H
р.тр
.
