Ковалевский А.В., Басова Л.А., Вшивцев В.И., Жуковин С.В., Радина И.А. Химия. Учебное пособие по решению типовых задач и задания для самостоятельной работы
Подождите немного. Документ загружается.

11
1. Из 10 кг раствора соли с массовой долей соли 20% при охлаждении выделилось
400 г соли. Чему равна массовая доля охлажденного раствора?
2. Сколько граммов растворенных веществ содержится:
а) в 1500 мл раствора Na
2
S с молярной концентрацией 0,1 моль/л;
б) в 300 мл раствора MnCl
2
с молярной концентрацией эквивалента 0,5 моль/л?
Вариант 19
1. Смешали 247 г раствора серной кислоты с массовой долей H
2
SO
4
62% и 145 г
раствора серной кислоты с массовой долей H
2
SO
4
18%. Какова массовая доля
H
2
SO
4
в полученном растворе ?
2. Сколько граммов растворенных веществ содержится:
а) в 1 л раствора CaBr
2
с молярной концентрацией 0,1 моль/л;
б) в 100 мл раствора СrCl
3
c молярной концентрацией эквивалента 2 моль/л?
Вариант 20
1. Какую массу NaNO
3
нужно растворить в 400 г воды, чтобы приготовить рас-
твор нитрата натрия с массовой долей NaNO
3
20%?
2. Сколько граммов растворенных веществ содержится:
а) в 10 л раствора SrCl
2
с молярной концентрацией 1 моль/л;
б) в 100 мл раствора H
2
SO
4
с молярной концентрацией эквивалента 0,1 моль/л?
Вариант 21
1. В воде массой 800 г растворили оксид серы (IV) объемом 7,84 л (н.у.). Вычис-
лите массовую долю SO
2
в полученном растворе.
2. Сколько граммов растворенных веществ содержится:
а) в 400 мл раствора H
3
PO
4
с молярной концентрацией 2 моль/л;
б) в 1,5 л раствора NaOH с молярной концентрацией эквивалента 1 моль/л?
Вариант 22
1. К раствору K Cl с молярной концентрацией 2 моль/л объемом 40 мл
(пл.1,09 г/мл) прилили воду массой 200 г.
Определить массовую долю KCl в растворе.
2. Сколько граммов растворенных веществ содержится:
а) в 40 мл раствора H
2
SO
4
с молярной концентрацией 0,1 моль/л;
б) в 0,5 л раствора HNO
3
с молярной концентрацией эквивалента 0,5 моль/л?
Вариант 23
1. В воде массой 1000 г растворили сульфат калия количеством вещества 2 моль.
Вычислите массовую долю растворенного вещества.
2. Сколько граммов растворенных веществ содержится:
а) в 35 мл раствора СoCl
2
с молярной концентрацией 1 моль/л;
б) в 2 л раствора H
2
SO
3
с молярной концентрацией эквивалента 0,5 моль/л?
Вариант 24
12
1. Какой объем хлороводорода (н.у.) потребуется для приготовления раствора
массой 500 г с массовой долей HCl 8%?
2. Сколько граммов растворенных веществ содержится:
а) в 250 мл раствора CdCl
2
с молярной концентрацией 3 моль/л;
б) в 2,5 л раствора Ba(OH)
2
с молярной концентрацией эквивалента 1 моль/л?
Вариант 25
1. Хлороводород объемом 5,6 л (н.у.) растворили в воде массой 500 г. Вычислите
массовую долю HCl в полученном растворе.
2. Сколько граммов растворенных веществ содержится:
а) в 300 мл раствора Na
2
SiO
3
с молярной концентрацией 2 моль/л;
б) в 5 л раствора HNO
3
с молярной концентрацией эквивалента 2 моль/л?
ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ.
ЭЛЕМЕНТЫ ТЕРМОДИНАМИКИ
Термодинамика является теоретической основой современной химии. Она
изучает переход энергии из одной формы в другую, от одной части системы к
другой, энергетические эффекты, сопровождающие химические (и физические)
процессы, возможность и направление самопроизвольного протекания процессов.
В любом процессе соблюдается закон сохранения энергии. Этот закон вы-
ражается равенством Q = ∆U + A. Это равенство означает, что если к системе (ве-
ществу) подводится теплота Q, то она расходуется на изменение внутренней энер-
гии ∆U и на совершение работы А. Под внутренней энергией U подразумевается
общий ее запас, а под величиной А имеют ввиду работу против всех сил, дейст-
вующих на систему.
Сумму внутренней энергии и произведения объема вещества на внешнее
давление называют энтальпией и обозначают буквой Н:
H = U + pV.
Энтальпия, подобно объему, давлению, температуре и внутренней энергии,
является функцией (характеристикой) состояния системы. Научное и практиче-
ское значение имеет разность ∆Н = Н
2
- Н
1
, т.е. изменение энтальпии в ходе про-
цесса ( 1 и 2 - начальное и конечное состояния системы).
ТЕРМОХИМИЯ
Термохимия занимается изучением тепловых эффектов химических процес-
сов. Химические процессы протекают либо с выделением, либо с поглощением
теплоты. Первые называются экзотермическими, вторые - эндотермическими. Ко-
личество выделенной или поглощенной теплоты называют тепловым эффектом
процесса. Вместо термина “тепловой эффект” используют также термин “измене-
ние энтальпии в процессе” или просто “энтальпия процесса”. Химические уравне-
ния, в которых указан тепловой эффект реакции при постоянных давлении и тем-
пературе (∆Н процесса), называются термохимическими уравнениями. Тепловой
13
эффект ∆Н считают положительным для эндотермических процессов и отрица-
тельным - для экзотермических. Значение ∆Н реакции (в кДж) указывают после
уравнения реакции (через точку с запятой). Значение ∆Н относят к числу молей
веществ, участвующих в реакции, которое указывают стехиометрическими коэф-
фициентами (часто они бывают дробными). Кроме того, в термохимических урав-
нениях отмечают состояние веществ (жидкое, газообразное, твердое). Если специ-
ально не оговорено, то ∆Н приводится для стандартной температуры и стандарт-
ного давления. Между системами реагентов и конечных продуктов ставят знак
равенства, а не стрелку. Слово “моль” в единицах измерения кДж/моль опускают,
так как ∆Н относится не к одному молю, если стехиометрический коэффициент не
равен единице:
1/2Н
2(г)
+ 1/2Cl
2(г)
= HСl
(г)
; ∆Н = -92 кДж.
Основной закон термохимии был сформулирован русским ученым Гессом в
1940 г.: если из данных исходных веществ можно различными способами полу-
чить заданные конечные продукты, то независимо от путей их получения суммар-
ный тепловой эффект будет одним и тем же. Из закона Гесса, который сам являет-
ся одним из следствий закона сохранения энергии, вытекает ряд выводов, наибо-
лее важными из которых являются два:
- тепловой эффект реакции равен сумме теплот образования продуктов ре-
акции за вычетом суммы теплот образования исходных веществ;
- тепловой эффект реакции равен сумме теплот сгорания исходных веществ
за вычетом суммы теплот сгорания продуктов реакции.
Первое следствие имеет общее значение, второе важно для органических
соединений.
Под теплотой (энтальпией) образования обычно понимают тепловой эффект
образования одного моля вещества из простых веществ, устойчивых при 25°С и 1
атм.
Аналогично определяется теплота сгорания.
Стандартная энтальпия образования вещества (∆Н°) - это изменение энталь-
пии в процессе образования данного вещества в стандартном состоянии из термо-
динамически устойчивых форм простых веществ, также находящихся в стандарт-
ном состоянии. Для многих веществ стандартные теплоты образования известны
и сведены в табл.1. Составление таких таблиц упрощает расчеты, так как путем
комбинации нескольких сот известных величин можно получить значения ∆Н°
для десятка тысяч реакций, не прибегая к эксперименту.
Пример. Рассчитайте стандартное изменение энтальпии реакции
BaCO
3(тв)
= ВaO
(тв)
+ СО
2(г)
,
пользуясь стандартными теплотами образования реагирующих веществ. Сколько
теплоты выделится (поглотится) при разложении карбоната бария количеством
вещества 15 моль?
Решение. ∆Н°
х.р
= ∆Н°[BaO
(тв)
] + ∆Н°[CO
2(г)
] - ∆Н°[BaCO
3(тв)
]
Пользуясь табличными данными, получаем численное значение
∆Н°
х.р
= -557,6 + (-393,3) - (-1217,6) = 266,7 (кДж/моль).

14
При разложении 15 молей BaCO
3
поглотится 15⋅266,7 = 4000 (кДж).
Таблица 1
Стандартные термодинамические величины некоторых веществ
Вещество
(формула)
Состо-
яние
∆H
0
,
кДж/моль
S
0
,
Дж/(моль⋅К)
∆G
0
,
кДж/моль
1 2 3 4 5
Al
Al
2
O
3
Ba
BaCO
3
BaO
BeCO
3
BeO
C
(графит)
CO
CO
2
CH
4
C
2
H
2
C
2
H
4
C
2
H
6
CH
3
OH
C
2
H
5
OH
C
2
H
5
OH
Ca
CaO
CaCO
3
Ca(OH)
2
Cl
2
CuO
CuS
Cd
CdS
Fe
FeO
Fe
2
O
3
Fe
3
O
4
H
2
HCl
тв.
тв.
тв.
тв.
тв.
тв.
тв.
тв.
г.
г.
г.
г.
г.
г.
ж.
г.
ж.
тв.
тв.
тв.
тв.
г.
тв.
тв.
тв.
тв.
тв.
тв.
тв.
тв.
г.
г.
0,0
-1668,2
0,0
-1217,6
-557,6
-1201,1
-610,3
0,0
-110,3
-393,3
-74,8
226,9
52,3
-84,7
-238,8
-235,5
-277,8
0,0
-634,9
-1206,0
-985,6
0,0
-155,0
-48,5
0,0
-144,2
0,0
-266,2
-821,4
-1116,0
0,0
-92,3
28,3
51,0
66,9
112,0
70,2
112,2
14,2
5,7
197,7
213,6
186,0
200,9
219,6
229,7
126,9
282,2
160,8
41,4
39,7
92,8
76,0
222,8
43,4
66,4
51,4
71,0
27,2
53,9
88,9
146,3
130,4
186,4
0,0
-2213,2
0,0
-1138,8
-528,4
-944,8
-581,6
0,0
-137,4
-394,7
-50,8
209,4
68,2
166,3
0,0
-604,6
-1129,6
-897,4
0,0
0,0
0,0
-244,3
-741,0
-1014,2
0,0
-95,3
Окончание табл.1
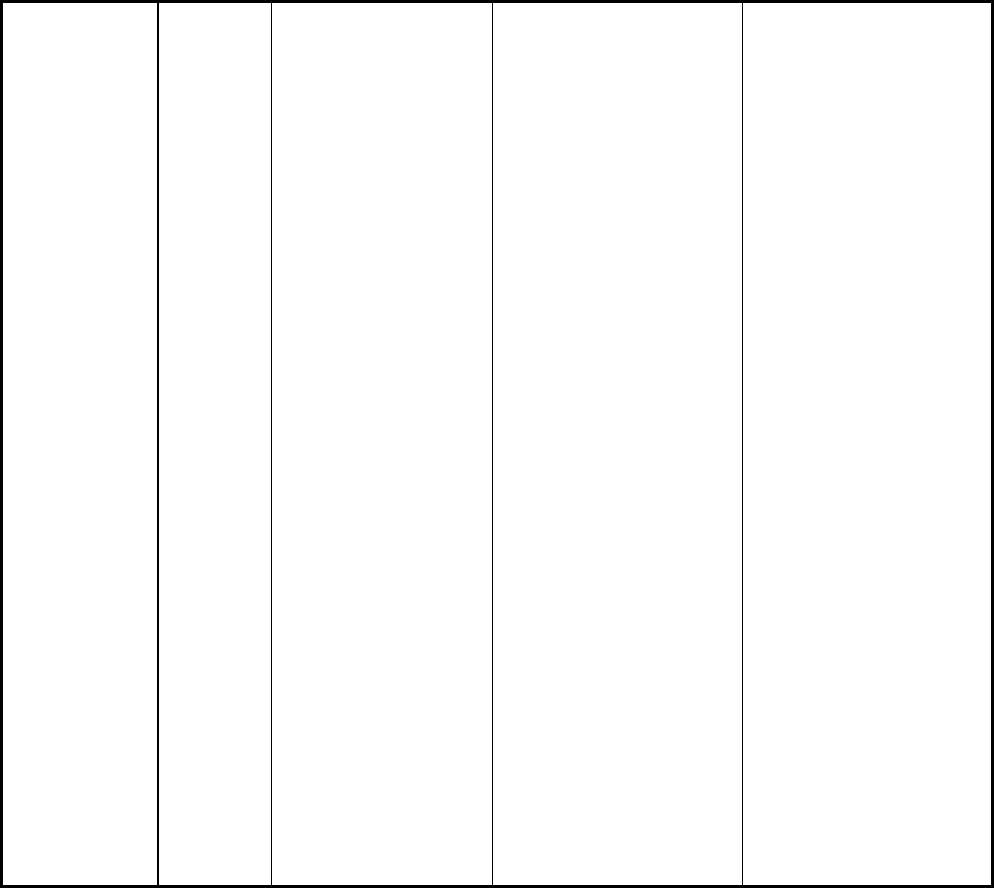
15
H
2
O
H
2
O
Н
2
S
HI
I
2
N
2
NH
3
NH
4
Cl
NO
NO
2
N
2
O
Na
2
CO
3
NaOH
O
2
PCl
3
PCl
5
Pb
PbO
Pb
3
O
4
PbSO
4
S
SO
2
SO
3
Si
SiO
2
Ti
TiO
2
г.
ж.
г.
г.
тв.
г.
г.
тв.
г.
г.
г.
тв.
тв.
г.
г.
г.
тв.
тв.
тв.
тв.
тв.
г.
г.
тв.
тв.
тв.
тв.
-241,6
-285,5
-20,1
25,9
0,0
0,0
-46,0
-315,2
90,3
33,8
81,5
-1129,8
-426,4
0,0
-306,0
-591,5
0,0
-217,8
-734,0
-917,5
0,0
-293,0
-395,0
0,0
-856,9
0,0
-940,1
188,5
69,8
205,4
206,0
116,0
191,4
192,3
94,5
210,2
240,3
219,8
135,8
64,0
204,8
311,4
324,3
64,8
69,4
211,1
147,1
31,7
248,3
255,8
18,8
42,6
302,6
50,1
-228,8
-237,9
-33,0
-1,3
0,0
0,0
-16,7
-213,8
90,4
51,9
103,6
0,0
-286,5
-324,9
0,0
0,0
-300,6
-370,6
0,0
0,0
Состоянию простых веществ всегда соответствует ∆Н° = 0. Кроме того, при
алгебраическом суммировании теплот следует учитывать стехиометрические ко-
эффициенты в химических уравнениях.
Пример. Реакция горения аммиака выражается термохимическим уравне-
нием 4NH
3(г)
+ 3O
2(г)
= 2N
2(г)
+ 6Н
2
О
(ж)
; ∆Н° = -1530,28 кДж.
Вычислите теплоту образования NH
3(г)
.
Решение. ∆Н°
х.р
= Σ∆Н°
прод
- Σ∆Н°
исх
.
Воспользуемся табличными данными и решим полученное уравнение отно-
сительно ∆Н°(NH
3
):
-1530,28 = 2⋅0 + 6 ⋅ (-285,84) - 4 ∆Н°(NH
3
) - 3⋅ 0,
4 ∆Н°(NH
3
) = - 184,76 ; ∆Н°(NH
3
) = - 46,19 (кДж/моль).
ЭНТАЛЬПИЙНЫЙ И ЭНТРОПИЙНЫЙ ФАКТОРЫ ПРОЦЕССОВ
16
Направление, в котором самопроизвольно протекает химическая реакция,
определяется двумя факторами. С одной стороны, система стремится перейти в
состояние с наименьшей внутренней энергией (в случае изобарных процессов - с
наименьшей энтальпией). С другой стороны, система стремится к беспорядку.
Мерой неупорядоченности системы является энтропия (S). Она растет при плав-
лении или возгонке твердого вещества, при кипении жидкости, т.е. при переходе
вещества из состояния с меньшей энергией в состояние с большей энергией. Рос-
том энтропии сопровождается химическое взаимодействие, протекающее с увели-
чением объема. Наоборот, все процессы, идущие с увеличением упорядоченности,
например отвердевание, конденсация, - связаны с уменьшением энтропии.
Уменьшением энтропии сопровождается и химическая реакция, протекающая с
уменьшением объема, например полимеризация. Изменение энтропии ∆S в хими-
ческих реакциях вычисляют как разность между энтропиями конечного и началь-
ного состояний. Например, для реакции, протекающей в системе
aA + bB = dD + cC
∆S = (dS
D
+ cS
C
) - (aS
A
+ bS
B
).
При расчете ∆S следует иметь в виду, что для простых веществ S ≠ 0 (в от-
личие от ∆Н). Единицей измерения энтропии является Дж/моль⋅К.
Энтропия в стандартном состоянии называется стандартной и обозначается
S°.
Пример. Вычислите изменение энтропии для реакции, протекающей по
уравнению 2CH
4(г)
= С
2
Н
2(г)
+ 3Н
2(г)
, и объясните полученный результат.
Решение. Согласно изложенному выше, ∆S = S (C
2
H
2
) + 3S(H
2
) - 2S(CH
4
).
Воспользуемся табличными данными:
∆S = 200,9 +3⋅130,4 - 2⋅ 186,0 =220 (Дж/моль⋅К), тогда
∆S>0. Возрастание энтропии в данном примере связано с увеличением объ-
ема системы.
Поскольку ∆Н измеряется в кДж/ моль, а ∆S - кДж/моль⋅К, то для количест-
венного сопоставления этих тенденций нужно выразить характеризующие их фак-
торы в одинаковых единицах измерения. Такое преобразование можно осущест-
вить, умножив ∆S на Т. Тем более, что в величине Т∆S оба сомножителя выража-
ют стремление к беспорядку.
Произведение Т∆S (кДж/моль) является энтропийным фактором процесса, а
∆Н (кДж/моль) - энтальпийным фактором. В состоянии равновесия две тенден-
ции: стремление частиц к объединению в более крупные агрегаты и, наоборот, их
стремление к дезагрегации – одинаковы, т.е. энтальпийный ∆Н и энтропийный
Т∆S факторы компенсируют друг друга. При этом справедливо равенство ∆Н =
Т∆S.
Это равенство является условием термодинамического равновесия системы.
Из этого условия всегда можно рассчитать температуру, при которой начнется тот
или иной процесс.

17
Пример. Рассчитайте, при какой температуре начнется реакция восстанов-
ления Fe
3
O
4
, протекающая по уравнению: Fe
3
O
4(тв)
+ СО
(г)
= =3FeO
(тв)
+ CO
2(г)
;
∆Н = +34,2 кДж/моль, если изменение энтропии в данном процессе
∆S = 31,02 Дж/моль⋅К.
Решение. Исходим из условия, что ∆Н = Т∆S. Отсюда Т = ∆Н/∆S. Подста-
вим значения ∆Н и ∆S:
Т = 34,2 кДж/моль
= 1102,4 К.
0,03102 кДж/моль⋅К
ПОНЯТИЕ ОБ ЭНЕРГИИ ГИББСА
Для решения вопроса о возможности протекания реакции недостаточно об-
ладать “химической интуицией”. Необходим количественный критерий принци-
пиальной осуществимости реакции. Химические процессы характеризуются сво-
им потенциалом, который уменьшается в самопроизвольно протекающих реакци-
ях. Потенциал, являющийся движущей силой химических процессов, протекаю-
щих при P =const и Т = const, принято называть изобарно-изотермическим потен-
циалом или просто изобарным потенциалом. Его обозначают буквой G в честь
американского ученого Гиббса, который ввел в термодинамику эту функцию. В
его же честь эту величину принято также называть энергией Гиббса.
Условием принципиальной осуществимости процесса, т.е. возможности са-
мопроизвольного протекания реакции, является неравенство ∆G < 0, где ∆G -
убыль изобарного потенциала.
Если рассматриваемая реакция осуществима в прямом направлении (для
равновесных процессов), то в обратном направлении при данных условиях она
протекать не может, так как в этом случае ∆G>0. Это неравенство является крите-
рием принципиальной невозможности процесса.
Любая реакция может протекать самопроизвольно только в направлении,
приближающем систему к состоянию равновесия. Если в системе наступило ис-
тинное химическое равновесие, то дальнейшего изменения энергии Гиббса проис-
ходить не будет, т.е. ∆G=0.
Итак, критерием протекания процесса является убыль энергии Гиббса, т.е.
∆G. Это движущая сила процесса. Чем ∆G меньше нуля, тем дальше система от
состояния химического равновесия и тем более она реакционноспособна.
Подобно энтальпии Н энергию Гиббса G определить нельзя. Однако можно
точно измерить разность ∆G для различных процессов. Для вычисления значения
∆G реакции применим метод расчета, аналогичный способу вычисления ∆Н и ∆S
реакции.
Например, для процесса aA + bB = cC + dD
∆G = [ d∆G(D) + c∆G(C)] - [ a∆G(A) + b∆G(B)].
При этом, как и для ∆Н, значения ∆G простых веществ равны нулю.
18
Прогноз возможности или невозможности протекания процесса по величине
∆G совершенно не зависит от механизма реакции,т.е. от того химического пути,
по которому фактически протекает процесс, ибо величина ∆G равна разности зна-
чений G продуктов реакции и исходных веществ. Однако это также означает, что
никакой информации о самом процессе и, в частности, о его скорости, которая
весьма чувствительна именно к пути реакции, извлечь из ∆G невозможно. Эти во-
просы решаются другими методами. О них речь пойдет далее.
Величина ∆G связана с ∆Н и ∆S соотношением ∆G = ∆Н - Т∆S.
Это уравнение, записанное в виде ∆Н = ∆G + Т∆S, показывает, что энерге-
тический эффект процесса можно рассматривать как сумму двух слагаемых, одно
из которых ∆G соответствует той части теплоты, которую можно превратить в
работу (“свободная” энергия), а второе Т∆S показывает, какое количество тепло-
ты будет бесполезно рассеяно (“связанная” энергия).
Изменение энергии Гиббса для процессов, в которых каждое вещество нахо-
дится в стандартном состоянии, принято обозначать ∆G
0
. Эти значения (как и ∆Н
0
и S
0
) также сведены в табл.1. Имея значения ∆G
0
и ∆S
0
для веществ, участвующих
в реакции, можно вычислить ∆Н
0
реакции.
Пример. Может ли в стандартных условиях самопроизвольно протекать в
прямом направлении реакция Fe
2
O
3(тв)
+ 3Н
2(г)
= 2Fe
(тв)
+ 3H
2
O
(ж)
? Задачу решите
на основании стандартных теплот образования и абсолютных стандартных энтро-
пий реагирующих веществ.
Решение. Воспользовавшись табличными данными, как показано выше,
найдем:
∆Н
0
х.р
= -35,4 кДж/моль,
∆S
0
х.р
= -213,8 Дж/моль⋅К.
Подставим эти значения в уравнение ∆G = ∆Н - Т∆S.
Тогда найдем:
∆G
0
= -35,4 кДж/моль - 298(-213,8⋅10
-3
кДж/моль);
∆G
0
= 28,34 кДж; ∆G > 0.
Значит, в данных условиях реакция невозможна.
ХИМИЧЕСКАЯ КИНЕТИКА
Как известно, химические реакции протекают с различными скоростями.
Некоторые из них, например реакции разложения взрывчатых веществ, протека-
ют в течение десятитысячных долей секунды. Время протекания других измеряет-
ся минутами, часами, сутками. Есть процессы, требующие для своего протекания
десятки, сотни, тысячи лет. Сюда относятся процессы, происходящие в земной
коре. Кроме того, одна и та же реакция в зависимости от условий может протекать
с различной скоростью. Так, смесь водорода с кислородом при обычных условиях
может сохраняться сколько угодно долго. Если же в эту смесь внести катализатор,
она прореагирует со взрывом. При 630°С эта смесь реагирует и в отсутствие ка-
тализатора.

19
Раздел химии, изучающий скорости химических реакций и их зависимости
от природы и концентрации реагирующих веществ, температуры, влияния катали-
заторов и т.п., называется химической кинетикой.
Скорость химической реакции характеризуется изменением концентрации
реагирующих веществ в единице объема в единицу времени:
_
υ = ∆n(Х)
,
_ V⋅τ
где υ - средняя скорость реакции, моль/л⋅с;
∆n(Х) - изменение количества вещества Х, участвующего в реакции, моль;
V - объем системы, л;
τ - время реакции, с.
Пример. В сосуде объемом 2 л смешали газ А количеством вещества
4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответст-
вии с уравнением
А + В = С.
Через 20 с в системе образовался газ С количеством вещества 2 моль. Опре-
делите среднюю скорость реакции. Какие количества непрореагировавших газов
А и В остались в системе?
Решение. Согласно уравнению реакции ∆n(А)=∆n(В)=∆n(С)=2 моль. Сле-
довательно, в сосуде после реакции осталось: n
2
(А)=n
1
(A)- ∆n(A);
n
2
(А)=(4,5-2)моль=2,5 моль; n
2
(В)=n
1
(В)-∆n(В); n
2
(В)=(3,0-2)моль = 1,0 моль,
где n
1
(А) и n
1
(В) - исходные количества реагентов, а n
2
(А) и n
2
(В) - количества не-
прореагировавших газов А и В.
Согласно определению,
_
υ = ∆n(А)
= 2моль =0,05 моль/л⋅с .
V⋅τ 2л⋅20с
Зависимость скорости реакции от концентрации реагирующих веществ вы-
ражается законом действующих масс: скорость химической реакции прямопро-
порциональна произведению концентраций реагирующих веществ, взятых с пока-
зателем степени, равным коэффициенту перед формулой данного вещества в сте-
хиометрическом уравнении реакции. Пусть реакция протекает по схеме
аА + вВ ⇔ сС + dD.
Тогда закон действующих масс для прямой реакции, протекающей слева на-
право, можно записать так:
→ →
υ = k ⋅ [A]
a
⋅ [B]
b
,
→
где υ - скорость прямой реакции, моль/л⋅с;
→
k - константа скорости прямой реакции;
20
[A] и [B] - концентрации веществ А и В, моль/л;
а и b - стехиометрические коэффициенты.
Пример. Во сколько раз изменится скорость прямой и обратной реакций в
системе
2SO
2(г)
+ О
2(г)
⇔ 2SO
3(г)
,
если объем газовой смеси уменьшить в 3 раза?
Решение. Обозначим концентрации всех веществ: [SO
2
] = a; [O
2
] = b;
[SO
3
] = c. Согласно закону действующих масс скорости прямой и обрат-
ной реакций до изменения объема,
→ → ← ←
υ
нач
= k ⋅ а
2
⋅ b и υ
нач
= k ⋅ с
2
.
После уменьшения объема гомогенной системы в 3 раза концентрация каж-
дого из реагирующих веществ увеличится в 3 раза, т.е. [SO
2
] = 3a; [O
2
] = 3b;
[SO
3
] = 3c. При новых концентрациях скорости прямой и обратной реакции будут
равны:
→ → → ← ← ←
υ
кон
= k⋅(3а)
2
⋅ 3b = 27 k ⋅а
2
⋅b и υ
кон
= k ⋅ (3с)
2
= 9 k ⋅с
2
.
Отсюда
→ → ← ←
υ
кон
27 ⋅ k ⋅ а
2
⋅ b υ
кон
9 ⋅ k ⋅ с
2
=
= 27 и = = 9.
→ → ← ←
υ
нач
k ⋅ а
2
⋅ b υ
нач
k ⋅ с
2
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной -
только в 9 раз.
В случае большого числа исходных данных подобную задачу можно ре-
шать, оформляя эти данные в виде табл. 2.
Пример. Как и во сколько раз изменятся скорости прямой и обратной реак-
ций в гомогенной системе
2СO
(г)
+ О
2(г)
⇔ 2СO
2(г)
к моменту, когда прореагирует 50% кислорода, если исходные концентрации ок-
сида углерода (II), кислорода и оксида углерода (IV) равны 1,3 моль/л; 0,8 моль/л
и 0,2 моль/л соответственно?
Решение. Согласно условию задачи, количество прореагировавшего кисло-
рода ∆n(О
2
) = 0,8 ⋅ 50/ 100 моль/л = 0,4 моль/л.
Найдем концентрации всех реагирующих веществ к моменту, когда прореа-
гировало 0,4 моль кислорода.
Таблица 2
