Гроссе Э., Вайсмантель X. Химия для любознательных. Основы химии и занимательные опыты
Подождите немного. Документ загружается.

никелевых сплавов: монель-металл, который содержит никель медь и небольшие количества других металлов;
никелин; константан; инвар; платиний и др.
Чистый никель применяют для получения гальванических покрытий. Из чистого металла или сплавов с
высоким содержанием никеля изготовляют электроды радиоламп. Воспользуемся для опытов никелевым
анодом старой радиолампы.
Растворим кусочек металла в азотной кислоте — в крайнем случае осторожно нагреем. (Осторожно!
Ядовитые пары! Работать под тягой или на открытом воздухе.) Раствор окрасится в зеленый цвет благодаря
образованию нитрата никеля Ni(NO
3
)
2
. После полного или частичного растворения металла разбавим раствор
водой и осторожно нейтрализуем разбавленным раствором гидроксида натрия.
Если к отобранной пробе будем и далее добавлять раствор гидроксида натрия, то выпадет зеленый
осадок гидроксида никеля Ni(OH)
2
.
Похожие осадки, правда, дают также медь и двухвалентное железо. Чтобы различить эти металлы,
добавим к смеси немного бромной воды или кашицу хлорной извести. (Осторожно! Яд!) Из названных
металлов только никель дает черный или коричнево-черный осадок, свидетельствующий о получении диоксида
никеля NiO
2
.
Специфической реакцией обнаружения никеля служит взаимодействие с органическим реагентом
диметилглиоксимом C
4
H
8
N
2
O
2
. В нескольких миллилитрах спирта приготовим раствор этого реактива (взятого
на кончике ножа) и добавим несколько миллилитров концентрированного раствора аммиака. Будем хранить
реагент в плотно закрытом сосуде (лучше всего с притертой пробкой). Нейтральный сильно разбавленный
раствор соли никеля при добавлении нескольких капель реактива даст ярко-красный осадок. Некоторые другие
металлы, например железо, в этом случае дают коричневатые осадки. Можно таким образом проанализировать
и металлические предметы. Для этого подержим в несветящемся пламени бунзеновской горелки часть
предмета, благодаря чему металл окислится и затем смочим это место реактивом. В присутствии никеля
образуется розовое пятно.
Если нагреть в окислительном пламени перл буры со следами никелевой соли и затем охладить, то он
окрасится в красно-коричневый цвет. Восстановленный перл бесцветен или окрашен в серый цвет из-за
присутствия тонкодисперсного никеля.
АНАЛИТИКА - ПРОБНЫЙ КАМЕНЬ ДЛЯ ЮНОГО ХИМИКА
По поводу изученных реакций обнаружения металлов и их соединений необходимо сделать несколько
общих замечаний. Мы познакомились прежде всего с характерными реакциями, которые служат для
обнаружения металлов, то есть вникли в чрезвычайно важную область аналитической химии, главной задачей
которой является определение состава любых соединений или смесей.
Различают качественный и количественный анализ, в зависимости от того, требуется ли только
обнаружить элемент или его соединение или же нужно определить его количественное содержание. Описанные
ранее реакции служат для качественного определения металлов, которые присутствуют в растворах их солей
чаще всего в виде катионов. Речь пока шла об обнаружении катионов, хотя, как мы видели, многие металлы
склонны к образованию анионов. С некоторыми важными методами определения анионов (например, сульфат-,
нитрат- или хлорид-ионов) мы познакомимся позже, анализируя удобрения, а качественное определение
органических веществ проведем в начале главы 4 («Химия углерода»).
Нельзя недооценивать значение аналитической химии. Аналитические задачи постоянно решаются и
на промышленных предприятиях. Это прежде всего постоянный контроль сырья по чистоте, контроль состава
промежуточных и конечных продуктов. Систематическое изучение аналитической химии полезно и юным
химикам, которые знакомятся со свойствами веществ и приемами химической практики. Аналитические
работы требуют аккуратности и тщательности при проведении эксперимента. Аналитика по праву занимает
большой объем в учебных программах студентов-химиков. Мы хотим посоветовать нашим читателям
исследовать на наличие описанных металлов как можно больше различных проб — металлов, солей, смесей
известного и неизвестного состава. Только таким образом лучше всего можно приобрести тонкое чутье,
которое необходимо химику-аналитику. С самого начала давайте работать по возможности с небольшими
количествами исследуемых веществ. Это не только поможет сэкономить реактивы, но и будет соответствовать
положению вещей в практике, где зачастую в распоряжении имеются только незначительные количества
веществ.
Разумеется, каждого может постигнуть разочарование. Мы указывали уже, что посторонние вещества
зачастую мешают проведению отдельных аналитических реакций. Поэтому, даже при безупречном проведении
качественного анализа чаще всего не обойтись без химического разделения.
Анализ начинается с так называемых предварительных проб, к которым относятся реакции с перлом
буры, окрашивание пламени, сплавление с содой и др. Наконец, вещество растворяют и, добавляя осадители,
отфильтровывая и вновь осаждая вещества из фильтрата, разделяют его на шесть аналитических групп.
1 группа. Разбавленной соляной кислотой осаждаем хлориды ртути, серебра и свинца (последний
неустойчив). Осадки отфильтровываем и исследуем на данные металлы.
2 группа. В фильтрат (после первого осаждения) добавляем сероводородную воду (Осторожно! Яд!
Работать под тягой или на открытом воздухе!) — в осадок выпадают сульфиды свинца, меди, ртути, олова,
мышьяка, сурьмы, висмута и кадмия. Осадок отфильтруем и исследуем вызывающие сомнение элементы. Для
этого необходимо провести дальнейшее разделение.
3 группа. Фильтрат (после второго осаждения) прокипятим под тягой, чтобы удалить избыток
сероводорода (Осторожно! Не вдыхать сероводород!); далее прокипятим раствор с азотной кислотой, чтобы
окислить ионы двухвалентного железа до трехвалентных, и обильно добавим нашатырный спирт и раствор
хлорида аммония. Железо, хром и алюминий выпадут в осадок в виде гидроксидов, и их можно определить с
помощью описанных реакций.
4 группа. При добавлении бесцветного сульфида аммония из фильтрата (после третьего осаждения)
выпадут в осадок сульфиды цинка, кобальта, никеля и марганца
5 группа. Фильтрат (после четвертого осаждения) подкислим, удалим избыток сероводорода
кипячением под тягой, добавим твердый карбонат аммония и снова прокипятим. Таким образом мы отделим
карбонаты щелочноземельных металлов: кальция, стронция и бария.
6 группа. Фильтрат (после пятого осаждения) содержит еще щелочные металлы натрий и калий, а
также щелочноземельный металл магний в форме хлоридов, сульфатов и нитратов.
Начинающим исследователям очень полезно подвергнуть такому разделению несколько проб.
Подробности и возможные осложнения описаны в учебниках по аналитической химии. Но там описание хода
разделения дано только для важнейших металлов. О редких элементах придется справляться в специальных
изданиях.
В заключение хотим напомнить, что в аналитической химии большое значение имеет опыт, и там, где
новичок не сможет узнать осадок или окраску, нередко искушенный аналитик «почувствует» результат.
ПОЛУЧИМ МЕТАЛЛЫ
В промышленности получение металлов начинается с добычи руды. Наибольшее значение имеют
сульфидные и оксидные руды, такие как магнетит Fe
3
O
4
, пирит FeS
2
, медный колчедан CuFeS
2
, свинцовый
блеск PbS. Применяются также карбонаты, сульфаты, хлориды и другие соли. Большинство руд, однако, не
является чистыми соединениями одного металла, а смешаны с горными породами или другими соединениями.
Обогащение руд состоит в том, что сырые руды переводятся в состояние, пригодное для металлургической
обработки. В простых случаях достаточно механической сортировки. Сульфидные руды необходимо с
помощью обжига переводить в оксиды. Особенно трудно обогащать так называемые бедные руды, в которых
нужного элемента совсем мало.
Например, доля меди в медистых сланцах Мансфельда составляет не более 3 %, а никелевые и оловянные руды саксонских
Рудных гор содержат только незначительные количества металла. Поэтому меднолитейный завод в Мансфельде или металлургический
завод по производству никеля в г. Эгидине оснащены сложными обогатительными установками.
Из оксидов чистые металлы получают путем восстановления углеродом или другими средствами.
Доменный процесс является примером этого метода.
Легкие металлы, такие как алюминий и магний, получают, разлагая соли, чаще всего хлориды,
электрическим током. Таким образом производят алюминий, магний и щелочные металлы. Титан и цирконий
получают также электролизом или восстановлением соединений металла с помощью магния или натрия.
Получив неочищенный сырой металл, необходимо его очистить, потому что примеси оказывают
существенное влияние на их механические свойства и коррозионную стойкость. Так, фосфор, придающий
стали хрупкость, удаляют в томасовском процессе, а углерод частично окисляют, продувая через сталь воздух
или кислород. Медь и свинец очищают с помощью электролитического рафинирования, удаляя примеси,
причем в качестве побочного продукта получают ценное серебро.
Современная техника все чаще требует применения чистых металлов и металлов в
монокристаллической форме. В промышленном масштабе уже производится алюминий с содержанием в
среднем 99,999 %. В то время как обычно металлы состоят из маленьких кристалликов (поликристаллическое
строение), из расплава при точном соблюдении условий затвердевания можно получить единые большие
кристаллы (монокристаллы). Они обладают характерными и несколько лучшими механическими и другими
свойствами. Из монокристаллического металла уже изготовлены, например, опытные образцы лопастей турбин.
В Дрездене и Фрайберге ученые постоянно работают над дальнейшим развитием методов получения металлов
высокой чистоты и определенной структуры.
Естественно, мы сможем провести только некоторые простые опыты, которые дают нам представление
о принципах металлургии.
ПРОМЫВКА И ОБЖИГ РУД
Начнем с некоторых опытов по подготовке руды. Так как у нас вряд ли найдется руда, искусственно
приготовим обедненную руду. Добавляя раствор соды в раствор сульфата меди, осадим карбонат меди или,
например, смешаем раствор нитрата свинца с сероводородом. (Лучше непосредственно ввести газообразный
сероводород в раствор. Осторожно! Соли свинца ядовиты; ядовитый сероводород вводить только под тягой или
на открытом воздухе!) Полученный карбонат меди или сульфид свинца отфильтруем или отделим с помощью
отстаивания и декантации. Высушенный осадок смешаем с тонкодисперсными примесями, например мелким
песком (кизельгуром), известью (отмученным мелом) и порошком каменного угля. Лучше всего приготовить
много различных смесей в небольших количествах.
Обогащение руды
Поместим эти смеси в пробирки, зальем водой и добавим немного смазочного масла. Затем сильно
взболтаем. При этом образуется эмульсия из мелких капелек масла в воде, которая, однако, сразу после
взбалтывания опять разделится на два слоя: верхний — масляный и нижний — водный. В большинстве случаев
чистая «руда» соберется в верхнем слое масла, а «примеси» окажутся на дне. Казалось бы, соединения
металлов тяжелее, значит, следовало ожидать обратного результата. Но дело в том, что частички руды
смачиваются маслом, а известь, песок и т.д. — не смачиваются. Этот эффект усиливается, если добавить
пенообразующие вещества, которые обеспечивают более тесный контакт между рудой, водой и маслом. В
другую пробирку со смесью добавим немного стирального порошка или мыла и также будем наблюдать
разделение.
Подобным образом обогащают в технике медные, свинцовые, молибденовые и урановые руды. Для
этого руды необходимо тонко размолоть, смешать с водой, маслом и поверхностно-активными веществами и
пропустить через эту смесь интенсивный поток воды или воздуха. Верхний слой отделяется, он содержит
обогащенную руду. Этот способ называется флотационное обогащение или просто флотация.
Обжиг руды
Для обжига сульфидной руды используем сульфид цинка или свинца, имеющиеся в продаже.
Поместим грубый порошок сульфидной руды (половину чайной ложки) в середину тугоплавкой стеклянной
трубки длиной около 25 см. Один конец трубки закроем тампоном из стеклянной ваты и пробкой, которую
обернем алюминиевой фольгой для защиты от высокой температуры. В отверстие в пробке вставим согнутую
стеклянную трубку и соединим ее с промывной склянкой, в которой находится раствор красителя фуксина или
простая вода. Во время опыта над сульфидом необходимо пропускать воздух. Для этой цели либо используем
водоструйный насос, либо будем нагнетать воздух с противоположной стороны стеклянной трубки с помощью
воздушного насоса, фена или работающего как воздуходувка пылесоса. Однако поток воздуха не должен быть
слишком сильным. В случае необходимости будем таким образом регулировать его с помощью Т-образной
трубки со шлангом или крана, чтобы в промывной склянке постоянно, с большой частотой образовывались
пузырьки.
Будем нагревать сульфид до красного каления в тугоплавкой трубке с помощью сильной бунзеновской
горелки (со щелевой насадкой) и пропускать над ним поток воздуха в течение 10—15 минут. При этом сульфид
превратится в оксид. При нагревании сульфида цинка мы заметим знакомую желтую (а после охлаждения —
белую) окраску оксида цинка. Одновременно обесцветится раствор фуксина, и распространится резкий запах
оксида серы (IV) — сернистого газа. Общее уравнение процесса выглядит следующим образом:
2MeS +3O
2
→ 2МеО + 2SO
2
Процесс обжига тяжелых металлов экзотермичен, то есть идет с выделением тепла. Поэтому после
начала реакции можно прекратить или ограничить подвод тепла. В техническом процессе температура
поддерживается самопроизвольно.
ВЫПЛАВКА МЕДИ И СВИНЦА В ЛАБОРАТОРНОМ ТИГЛЕ
Самым простым и дешевым восстановителем оксидных руд является углерод. Раньше для
металлургической переработки оксидов применяли древесный уголь, а теперь — кокс. Углерод может
восстановить оксиды многих металлов, но для проведения реакции чаще всего требуется высокая температура.
Для получения меди и свинца необходима температура яркого красного каления. Чтобы можно было нагреть до
нужного состояния маленький фарфоровый тигель вместимостью 10 мл, построим простую тигельную печь. В
нескольких старых кусках шамота с помощью острого зубила и маленького молотка необходимо выдолбить
углубление таким образом, чтобы при сборке кусков получилось грушевидное отверстие, в глубине которого
подвесим тигель на треугольнике из проволоки. Верхний выход закроем небольшим перевернутым цветочным
горшком с отверстием в дне. Смысл этого приспособления состоит в том, чтобы сосредоточить тепло только в
тигельном пространстве и уменьшить его потери, возникающие из-за охлаждения потоками воздуха или
излучения. На всякий случай обмотаем цветочный горшок стальной проволокой, чтобы черепки не
развалились, если горшок лопнет.
Установку укрепим на треножнике и будем нагревать снизу сильным несветящимся пламенем
бунзеновской горелки. При наличии стеклодувной горелки нужная температура, конечно, достигается быстрее.
Восстановление оксида меди
Высушим около 10 г оксида меди (II) СuO при умеренном нагревании открытого тигля или
фарфоровой чашки при температуре более 100
0
C. Разотрем оксид пестиком и смешаем с 1 г тонкодисперсного
древесного угля (с куска угля можно соскоблить порошок ножом).
Смесь поместим в маленький фарфоровый тигель, который неплотно закроем крышкой, чтобы
образующийся углекислый газ мог улетучиваться. Будем сильно нагревать смесь в нашей печи, пока не
начнется реакция. После этого охладим тигель и зальем его содержимое водой. Если взмутить суспензию, то
легкие частицы древесного угля отделятся от более тяжелых красноватых шариков меди. Можно попытаться
сплавить шарики в плотно закрытом тигле при наивысшей температуре в печи. Заодно проверим, достижима ли
в печи температура более 1000 °С.
Свинец из свинцового глета
В качестве исходного вещества используем оксид свинца (II), иначе называемый свинцовым глетом.
Этот тяжелый желтый порошок применяют для изготовления пластырей и замазки, поэтому его можно
приобрести в аптеке или в хозяйственном магазине. Высушим 15 г оксида свинца, как было описано выше, и
смешаем с 1 г порошкообразного древесного угля. Заполним смесью тигель, положим сверху кусочки угля и
неплотно закроем крышкой. Сильно нагреем смесь в печи, через 10 минут после начала опыта перемешаем ее
угольным стержнем и продолжим нагревание еще в течение 10 минут. Затем откроем печь, тигельными
щипцами возьмем горячий тигель и выльем расплавленный свинец.
МЕТАЛЛ ИЗ ПИРОЛЮЗИТА
Металлические оксиды можно разложить при взаимодействии с более активными металлами, которые
вытесняют менее активные из соединений с кислородом. В качестве восстановителей особенно часто
применяют алюминий, магний и натрий. Реакция с магнием протекает очень бурно, и в результате образуются
сильно загрязненные продукты, поэтому мы применим безвредный алюминий. Но и при выполнении
следующих опытов следует точно соблюдать количественные соотношения веществ и правила техники
безопасности!
Получим марганец
Смешаем 6 г оксида марганца (пиролюзита) МnО
2
и 2 г алюминиевых опилок или очень тонкой
стружки. Смесь положим на большой фарфоровый или глиняный черепок, помещенный на огнеупорной
подставке. Для воспламенения насыплем на смесь небольшое количество (!) магниевого порошка и воткнем
кусок магниевой ленты, которую осторожно подожжем. Чтобы можно было держаться на надлежащем
расстоянии, укрепим бунзеновскую горелку на палке длиной около 1 м. Смесь также можно поджечь
непосредственно бунзеновской горелкой, если направить на нее несветящееся пламя. Реакция протекает с
яркой вспышкой. После охлаждения мы обнаружим темный комочек сплавленного марганца (содержание
марганца 95— 98 %). Металл очень хрупок, его можно раздробить в порошок молотком — только делать это
надо на стальной подставке. Свежие сколы на металле серебристо-белые, но на воздухе они быстро темнеют
вследствие образования тонких пленок цветов побежалости.
Алюминий превращается в оксид алюминия по следующему уравнению:
3МnО
2
+ 4Аl → 2Аl
2
О
3
+ 3Мn
При проведении опыта следует надеть защитные очки, так как в ходе реакций могут вылетать очень
горячие искры. Вблизи не должно быть никаких легковоспламеняющихся предметов и веществ.
Если вас постигла неудача (воспламенения не произошло) ни в коем случае нельзя пытаться сразу
близко рассматривать смесь. Подождите по меньшей мере 5 минут, так как нередко может последовать
неожиданное «позднее зажигание».
Восстановление оксидов металлов металлическим алюминием называют алюмотермией. Аналогично
можно восстановить оксиды никеля и хрома. Чтобы выход металла при алюмотермическом методе был выше,
вместо порошка используют алюминиевую крупку; она не только реагирует не так бурно, но и воспламеняется
труднее.
ПОЛУЧЕНИЕ МАГНИЯ ЭЛЕКТРОЛИЗОМ РАСПЛАВА
В одном из первых опытов мы разлагали воду на элементы с помощью электрического тока. Таким же
образом можно разлагать соединения металлов, если пропускать через расплав соли постоянный ток.
Расплавленные соли часто обладают значительной электропроводностью. Положительно заряженные ионы
металлов выделяются в электрическом поле на отрицательном электроде (катоде), а анионы — на
положительном электроде (аноде). Так можно получить очень активные металлы, но при этом они не должны
реагировать с воздухом или материалом электрода.
Магний из карналлита
Английский химик Дэви в 1809 г. впервые получил натрий и калий путем электролиза расплава их
соединений. Мы попытаемся получить таким же образом немного металлического магния.
Прежде всего для электролиза понадобится сильный источник постоянного тока. Можно
воспользоваться аккумулятором с напряжением 12 В, причем не обязательно новым, так как опыт лучше всего
удается при высокой силе тока, которая легко может привести к короткому замыканию и при этом испортить
батарею. Также пригоден отслуживший автомобильный аккумулятор, который надо зарядить.
В качестве электролита для получения магния используем карналлит, смешанный хлорид калия —
магния состава KCl-MgCl
2
-6H
2
O, который встречается, например, в отбросных солях Штасфурта. Безводная
соль пригодна для электролитического получения магния благодаря относительно низкой точке плавления.
Правда, чаще всего электролиты готовят искусственно, извлекая из различных магниевых минералов сначала
оксид магния MgO, и затем получают из него хлорид магния MgCl
2
. Эту соль сплавляют с хлоридом калия и
другими солевыми добавками.
В фарфоровой чашке при постоянном перемешивании и нагревании в минимальном количестве воды
растворим 15 г кристаллического хлорида магния (горькой соли), 5 г хлорида калия и 2 г хлорида аммония;
продолжая перемешивать, выпарим раствор досуха, нагреем остаток при температуре 300 °С, чтобы удалить из
соли воду. После охлаждения разотрем соль в порошок и поместим в маленький фарфоровый тигель, который
будет служить электролизной ячейкой. В качестве электродов используем угольный стержень и расплющенный
гвоздь или, лучше, тонкую стальную полоску шириной примерно 10 мм. Чтобы избежать соединения магния и
хлора, надо поставить между электродами разделительную стенку из асбестового картона; в нижней части ее
гвоздем проделаем много маленьких отверстий. Картон перед опытом надо многократно нагреть над пламенем,
чтобы удалить органические примеси.
После сборки ячейки подсоединим угольный стержень к положительному полюсу батареи, а стальной
электрод — к отрицательному. Между батареей и ячейкой подключим в качестве сопротивления стальную
проволоку длиной 2 м и диаметром 0,5 мм. Цепь будет разомкнута до тех пор, пока ее не подсоединят к
клеммам аккумулятора.
Тигель надо нагревать самым сильным пламенем бунзеновской или стеклодувной горелки до тех пор,
пока содержимое не расплавится. При этом будем перемешивать смесь стальным гвоздем или вязальной
спицей. После этого уменьшим пламя и замкнем электроцепь. Через 20—30 минут прекратим опыт, выльем
расплав из тигля, охладим и раздробим ножом. Мы обнаружим, особенно в околокатодном пространстве,
шарики магния. Соберем их, погрузим на короткое время на фарфоровой или пластмассовой ложке в сильную
соляную кислоту и бросим их тотчас в метиловый или в чистый этиловый спирт. На металле появится
серебристый блеск, который, однако, на воздухе быстро тускнеет.
ЖЕЛЕЗО И НИКЕЛЬ В НЕОБЫЧНОЙ ФОРМЕ
Металлы можно получать также, нагревая легкоразлагаемые соединения. Так, большинство солей
благородных металлов при нагревании распадаются на компоненты. Таким же образом можно получить
неблагородные металлы в виде очень тонкого порошка, который чрезвычайно химически активен. Это мы
можем изучить прежде всего на примере железа.
Получим железную пыль
В 10 мл воды растворим около 3 г лимонной кислоты и добавим половину чайной ложки тонкого
порошка железа или очень мелких опилок. Будем нагревать содержимое пробирки до тех пор, пока железо не
растворится. По мере надобности необходимо добавлять воду. Затем нагреем до полного испарения воды,
закроем пробирку тампоном из стеклянной ваты и продолжим интенсивный нагрев до тех пор, пока пробирка
не покроется темным налетом. Удалим ватный тампон, и проволокой выгребем образовавшиеся крошки
тонкодисперсного железа на огнеупорную подложку. Часто они начинают сами раскаляться на воздухе.
Железо, полученное термическим разложением лимоннокислого железа, способно к самовоспламенению
(пирофорное железо), что может привести к пожару.
Никель по тому же рецепту
Никель также можно получить в виде тонкого порошка, разлагая соли органических кислот. Но так как
никель плохо растворяется в органических кислотах, получим метанат (или формиат) никеля, то есть
никелевую соль метановой (или муравьиной) кислоты, следующим образом.
Из раствора сульфата никеля осадим, добавляя соду, карбонат никеля, который при взаимодействии с
водой (гидролиз) частично переходит в гидроксид никеля. Осадок быстро отфильтруем и растворим при
нагревании в 30—50%-ной метановой кислоте. При этом удаляется угольная кислота, и образуется метанат
никеля Ni(HCOO)
2
, который выкристаллизовывается при увеличении концентрации раствора. (Осторожно!
Метановая кислота едкая, а летучие пары ядовиты. Опыт проводить под тягой или на открытом воздухе!)
Кроме этого, можно приготовить соль с помощью реакции двойного обмена. Растворим 5 г сульфата
никеля в воде и добавим раствор 4 г метаната (формиата) натрия. Соли взаимодействуют по схеме:
NiSO
4
+ 2NaHCOO → Ni(HCOO)
2
+ Na
2
SO
4
При увеличении концентрации раствора сначала выделяется метанат никеля; легкорастворимый
сульфат натрия останется в маточном растворе.
Прокаливая соль в пробирке, получим легкие крошки порошка никеля. Благодаря своей большой
поверхности тонкодисперсные металлы химически очень активны. Например, порошок никеля является
незаменимым катализатором при присоединении водорода (гидрирование) органическими молекулами. Эта
реакция описана на стр. 263 применительно к отверждению жиров. Пероксид водорода (как мы можем легко
проверить) каталитически разлагается тонкодисперсными металлами.
В технике металлы часто получают в виде порошков (порошковая металлургия).
ИЗ МЕТАЛЛУРГИЧЕСКИХ РЕЦЕПТОВ
Окружающие нас металлические предметы редко состоят из чистых металлов. Только алюминиевые
кастрюли или медная проволока содержат около 99 % чистого элемента. В большинстве же других случаев мы
имеем дело со сплавами (смесями многих, металлов), к которым иногда добавлены и неметаллы. Так,
различные виды железа и стали содержат наряду с металлическими добавками незначительные количества
углерода, которые оказывают решающее влияние на механическое и термическое поведение сплавов.
Общий рецепт для получения сплава: сначала расплавляют компонент с наивысшей точкой плавления
и добавляют затем остальные компоненты. По этой простой схеме можно получить несколько сплавов.
Сплавы свинца
Сначала сплавим свинец с оловом и получим сплав, примерно соответствующий составу припоя.
Поместим в тигель несколько граммов свинца и расплавим его. Затем добавим олово и хорошо
перемешаем расплав железной проволокой. Возьмем тигель щипцами и поставим его в цветочный горшок, на
одну треть наполненный сухим песком. Термометр, опущенный в тигель, покажет температуру 300—360
0
С. Во
время охлаждения каждые полминуты будем отмечать температуру и заносить ее в подготовленную заранее
таблицу, где в левом столбце отмечается время, а в правом — температура. После полного затвердевания еще
несколько минут проследим за ходом охлаждения и затем прекратим опыт.
Тот, кто хочет получить полное представление о термическом поведении сплава, должен начать опыты
с чистого свинца и затем перейти к добавлению сначала небольших, а затем все увеличивающихся, точно
взвешенных количеств олова. Таким образом можно снова использовать предыдущие сплавы.
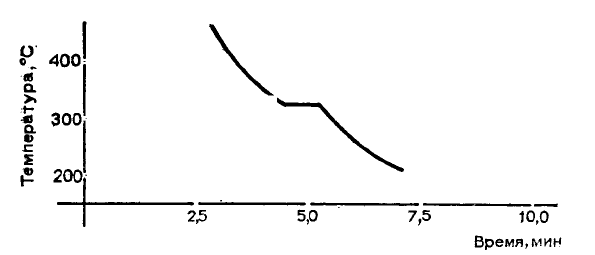
Найденную взаимосвязь представим графически. На листе миллиметровой бумаги отложим на оси
абсцисс (горизонтально) время, а на оси ординат (вертикально) — температуру. На рисунке вверху приведена
полученная таким образом кривая. Чистый свинец равномерно охлаждается до 327 °С. Затем появляется
площадка, так как металл застывает, высвобождая то тепло, которое было поглощено при плавлении. После
полного застывания опять наблюдается равномерное остывание, которому соответствует на графике почти
прямая линия.
При увеличении содержания олова сплавы затвердевают при все более низкой температуре. Начало
затвердевания выражается в более или менее отчетливом перегибе кривой охлаждения. Только при 183,3 °С
опять наблюдается (независимо от состава сплава) область постоянной температуры. После этого расплав
полностью затвердевает и равномерно охлаждается.
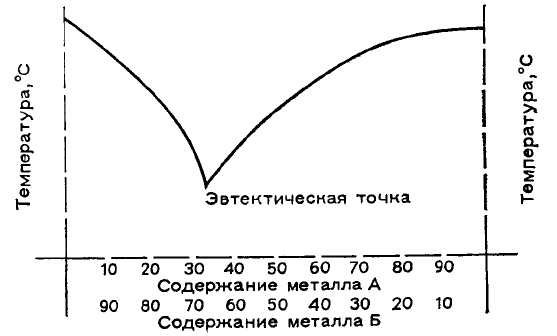
Объяснить это своеобразное
поведение сплавов можно следующим
образом. Из богатого свинцом сплава
выделяется сначала чистый свинец (область
от первого изгиба до площадки). Так
продолжается до тех пор, пока еще жидкий
сплав не достигнет состава, который
обладает самой низкой точкой плавления.
Этот сплав, называемый эвтектическим,
выделяется в виде единого целого и является
причиной появления площадки при 183 °С.
Его состав: 73,9% (ат.) олова и 26,1% (ат.)
свинца, то есть 16,2 г олова приходится на
10 г свинца. Если мы сразу приготовим
сплав этого состава, то он затвердеет при 183
°С, а на кривой охлаждения не будет точек перегиба. В сплавах с более высоким содержанием олова
выделяется сначала олово, а затем опять — эвтектический состав. Из множества кривых охлаждения получают
полную термическую диаграмму состояния (смотри рисунок), которая характеризует важнейшие свойства
сплавов. Она может быть существенно усложнена, например иметь несколько эвтектических точек.
Наши сплавы можно использовать в качестве припоя. Для этой цели лучше всего подходят сплавы с
содержанием свинца 50—70 % (масс).
По следующим рецептам можно получить легкоплавкие сплавы.
Сплав Ньютона: 31 массовая часть свинца, 19 частей олова и 50 частей висмута. Температура
плавления 95 °С.
Сплав Вуда: 25 частей свинца, 12,5 частей олова, 50 частей висмута и 12,5 частей кадмия (кадмий
лучше всего получить в гальванической мастерской). Температура плавления 60 °С.
Ложка из такого сплава расплавится, если ею помешать горячий кофе. Раньше это демонстрировали в
качестве шутливого опыта. Перемешанный таким образом напиток ядовит из-за солей свинца и висмута!
В нашей маленькой печи мы можем получить немного латуни. Для этого расплавим медь с помощью
бунзеновской или, лучше, стеклодувной горелки и затем добавим кусочки цинка; можно и сразу поместить
кусочки обоих металлов в тигель. Латунь 60 содержит, например, 60 весовых частей мели и 40 весовых частей
цинка (В СССР так называемые двойные латуни тоже маркируются по содержанию меди. Марка Л80,
например, означает, что в латуни содержится 79— 81 % меди, а остальное — цинк. — Прим. перев.).
Для литья цинка под давлением применяют сплав, содержащий около 94% цинка, 4% алюминия и 2%
меди.
Закалка стали
Самое большое значение среди всех сплавов имеют стали различных составов. Простые
конструкционные стали состоят из железа относительно высокой чистоты с небольшими (0,07—0,5%)
добавками углерода, а легированные стали получают, добавляя к железу кремний, медь, марганец, никель,
хром, вольфрам, ванадий и молибден.
Мы удовлетворимся некоторыми простыми опытами. Для экспериментов по закалке возьмем
отслужившие лезвия безопасной бритвы. Применим не только простые стальные лезвия, но и лезвия из
нержавеющей легированной стали, такие как «Polsilver» или «Chroma» (Можно воспользоваться лезвием
«Ленинград». — Прим. перев.). Лезвия изготовлены из очень мягкого материала, ими нельзя, например,
поцарапать стекло. Если взять лезвие пинцетом или щипцами и подержать в несветящемся пламени
бунзеновской горелки, то поверхность его станет сначала желтой, затем голубой и наконец серой. Это в
результате нагревания появились цвета побежалости в тонких пленках железной окалины Fe
3
O
4
. Если светло-
красное раскаленное лезвие быстро погрузить в холодную воду, то слой, образовавшийся в окислительной
атмосфере, отделится в виде блесток. Сталь станет хрупкой и легко сломается при сгибании. Но зато повысится
ее твердость, так что можно будет без труда поцарапать стекло. Чтобы избавиться от хрупкости, сохранив
большую твердость, после быстрого охлаждения сталь «отпускают», короткое время нагревая ее при
температуре 220—700 °С в зависимости от качества и целей применения.
Если на закрытой плитке или на масляной бане (Осторожно!) нагреть лезвия до 230—330 °С, мы опять
увидим сначала желтый, затем коричневый, красный, голубой и, наконец, серый цвета побежалости. Часто
граммофонные иглы и лезвия безопасных бритв обрабатывают «отпуском» до желтого цвета при 230 °С,
часовые стрелки — до светло-голубого при 310 °С, пилы и ножи — до василькового при 295 °С.
Исключительные механические свойства при отличной коррозионной стойкости имеют
высоколегированные, и потому дорогие, хромоникелевые стали. Самую распространенную из них мы уже
упоминали на стр. 87 как сталь 18/8. Входящий в ее состав хром, образуя пассивирующую поверхностную
пленку (подробнее см. в разделе «Небольшой курс электрохимии металлов»), сильно повышает коррозионную
стойкость, а добавка никеля улучшает механические свойства,
В нескольких опытах убедимся прежде всего в том, что пробы из нержавеющей стали (нержавеющие
лезвия, сломанные ножи) почти не разрушаются сильной азотной или серной кислотой. Однако соляная
кислота, вследствие частичного разрушения защитного слоя, подвергает сталь сквозной коррозии. Чтобы
перевести в раствор небольшое количество металла, обработаем в пробирке стальную пробу царской водкой.
(Царская водка состоит из 3 объемных частей концентрированной соляной и 1 части концентрированной
азотной кислоты. Внимание! Смесь очень агрессивна, пары ядовиты!). Затем осторожно разбавим раствор
водой примерно в пятикратном размере, нейтрализуем, постепенно добавляя раствор соды, и проведем
описанные выше реакции обнаружения хрома, никеля и молибдена. Часто нержавеющие стали содержат около
2 % молибдена — это дополнительно увеличивает твердость изготовленных из них инструментов.
Мы предоставляем самому читателю подвергнуть коррозионным испытаниям железные или стальные
пробы различного происхождения и обработки. Для этой цели частично погрузим их в водные растворы,
которые находятся на дне стеклянных сосудов (например, стеклянных банок). Рекомендуем проверить действие
обычной и дистиллированной воды, соленой воды, растворов хлорида магния, аммиака, сернистой кислоты, а
также разбавленных минеральных и органических кислот. В малоагрессивных жидкостях ржавчина
интенсивнее всего образуется вблизи поверхности раствора, потому что здесь самое высокое содержание
кислорода. Сильное коррозионное воздействие оксида серы (IV) является важнейшей проблемой при очистке
промышленных отработанных газов, которые выделяются в процессе переработки угля и руд и содержат SO
2
.
НЕБОЛЬШОЙ КУРС ЭЛЕКТРОХИМИИ МЕТАЛЛОВ
Мы уже познакомились с электролизом растворов хлоридов щелочных металлов и получением
металлов с помощью расплавов Сейчас попробуем на нескольких несложных опытах изучить некоторые
закономерности электрохимии водных растворов, гальванических элементов, а также познакомиться с
получением защитных гальванических покрытий. Электрохимические методы применяются в современной
аналитической химии, служат для определения важнейших величин теоретической химии. Наконец, коррозия
металлических предметов, которая наносит большой урон народному хозяйству, в большинстве случаев
является электрохимическим процессом.
РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ
Основополагающим звеном для понимания электрохимических процессов является ряд напряжения
металлов. Металлы можно расположить в ряд, который начинается с химически активных и заканчивается
наименее активными благородными металлами: Li, Rb, К, Ва, Sr, Са, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe, Cd, Tl, Co,
Ni, Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.
Так выглядит, по новейшим представлениям, ряд напряжений для важнейших металлов и водорода. (О
ряде напряженно уже упоминалось. Здесь этот ряд представлен в том виде, который соответствует 1 н. водным
растворам солей металлов при температуре 25
0
С и нормальном атмосферном давлении. Учитываются также и
некоторые другие условия: концентрация кислоты или щелочи, способность к комплексообразованию и пр. В
связи с тем, что не нее Эти условия могут быть строго выдержаны, приведенный ряд носит ориентировочный
характер. — Прим. ред.)
Если из двух любых металлов ряда изготовить электроды гальванического элемента, то на
предшествующем в ряду материале появится отрицательное напряжение. Величина напряжения (разность
потенциалов) зависит от положения элемента в ряду напряжении и от свойств электролита.
Сущность ряда напряжения установим из нескольких простых опытов, для которых нам понадобятся
источник тока и электрические измерительные приборы.
Металлические покрытия, "деревья" и "ледяные узоры" без тока
Растворим около 10 г кристаллического сульфата меди в 100 мл воды и погрузим в раствор стальную
иглу или кусочек железной жести. (Рекомендуем предварительно до блеска зачистить железо тонкой
наждачной шкуркой.) Через короткое время железо покроется красноватым слоем выделившейся меди. Более
активное железо вытесняет медь из раствора, причем железо растворяется в виде ионов, а медь выделяется в
виде металла. Процесс продолжается до тех пор, пока раствор находится в контакте с железом. Как только медь
покроет всю поверхность железа, он практически прекратится. В этом случае образуется довольно пористый
слой меди, так что защитные покрытия без применения тока получать нельзя.
В следующих опытах опустим в раствор сульфата меди небольшие полоски цинковой и свинцовой
жести. Через 15 минут вытащим их, промоем и исследуем под микроскопом. Мы различим красивые, похожие
на ледяные, узоры, которые в отраженном свете имеют красную окраску и состоят из выделившейся меди.
Здесь также более активные металлы перевели медь из ионного в металлическое состояние.
В свою очередь, медь может вытеснять металлы, стоящие ниже в ряду напряжений, то есть менее
активные. На тонкую полоску листовой меди или на расплющенную медную проволоку (предварительно
зачистив поверхность до блеска) нанесем несколько капель раствора нитрата серебра. Невооруженным
взглядом можно будет заметить образовавшийся черноватый налет, который под микроскопом в отраженном
свете имеет вид тонких игл и растительных узоров (так называемых дендритов).
Чтобы выделить цинк без тока, необходимо применить более активный металл. Исключая металлы,
которые бурно взаимодействуют с водой, находим в ряду напряжений выше цинка магний. Несколько капель
раствора сульфата цинка поместим на кусок магниевой ленты или на тонкую стружку электрона. Раствор
сульфата цинка получим, растворив кусочек цинка в разбавленной серной кислоте. Одновременно с сульфатом
цинка добавим несколько капель денатурата. На магнии через короткий промежуток времени заметим,
особенно под микроскопом, выделившийся в виде тонких кристалликов цинк.
В общем, любой член ряда напряжения может быть вытеснен из раствора, где он находится в виде
иона, и переведен в металлическое состояние. Однако при испытании всевозможных комбинаций, нас может
постичь разочарование. Казалось бы, если полоску алюминия погрузить в растворы солей меди, железа, свинца
и цинка, на ней должны выделяться эти металлы. Но этого, однако, не происходит. Причина неудачи кроется не
в ошибке в ряду напряжений, а основана на особом торможении реакции, которое в данном случае обусловлено
тонкой оксидной пленкой на поверхности алюминия. В таких растворах алюминий называют пассивным.
ЗАГЛЯНЕМ ЗА КУЛИСЫ
Чтобы сформулировать закономерности протекающих процессов, мы можем ограничиться
рассмотрением катионов, а анионы исключить, так как они сами в реакции не участвуют. (Правда, на скорость
осаждения влияет вид анионов.) Если для простоты предположить, что и выделяющийся и растворенный
металлы двухвалентные, то можно записать:
Me
1
+ Me
2
2+
→ Ме
1
2+
+ Ме
2
причем для первого опыта Ме
1
= Fe, Me
2
= Сu. Итак, процесс состоит в обмене зарядами (электронами)
между атомами и ионами обоих металлов. Если отдельно рассматривать (в качестве промежуточных реакций)
растворение железа или осаждение меди, то получим:
Fe → Fe
2+
+ 2е
-
Сu
2+
+ 2е
-
→ Сu
Теперь рассмотрим случай, когда металл погружен в воду или в раствор соли, с катионом которой
обмен невозможен из-за его положения в ряду напряжений. Несмотря на это, металл стремится перейти в
раствор в виде иона. При этом атом металла отдает два электрона (если металл двухвалентный), поверхность
погруженного в раствор металла заряжается по отношению к раствору отрицательно, а на границе раздела
образуется двойной электрический слой. Эта разность потенциалов препятствует дальнейшему растворению
металла, так что процесс вскоре приостанавливается. Если в раствор погрузить два различных металла, то они
оба зарядятся, но менее активный — несколько слабее, в силу того, что его атомы менее склонны к
отщеплению электронов. Соединим оба металла проводником. Вследствие разности потенциалов поток
электронов потечет от более активного металла к менее активному, который образует положительный полюс
элемента. Протекает процесс, при котором более активный металл переходит в раствор, а катионы из раствора
выделяются на более благородном металле.
Сущность гальванического элемента
Проиллюстрируем теперь несколькими опытами приведенные выше несколько абстрактные
рассуждения (которые к тому же представляют собой грубое упрощение).
Сначала наполним химический стакан вместимостью 250 мл до середины 10 %-ным раствором серной
кислоты и погрузим в нее не слишком маленькие куски цинка и меди. К обоим электродам припаяем или
приклепаем медную проволоку, концы которой не должны касаться раствора.
Пока концы проволоки не соединены друг с другом, мы будем наблюдать растворение цинка, которое
сопровождается выделением водорода. Цинк, как следует из ряда напряжения, активнее водорода, поэтому
металл может вытеснять водород из ионного состояния. На обоих металлах образуется двойной электрический
слой. Разность потенциалов между электродами проще всего обнаружить с помощью вольтметра.
Непосредственно после включения прибора в цепь стрелка укажет примерно 1 В, но затем напряжение быстро
упадет. Если подсоединить к элементу маленькую лампочку, потребляющую напряжение 1 В, то она загорится
— сначала довольно сильно, а затем накал станет слабым.
По полярности клемм прибора можно сделать вывод, что медный электрод является положительным
полюсом. Это можно доказать и без прибора, рассмотрев электрохимию процесса. Приготовим в маленьком
химическом стакане или в пробирке насыщенный раствор поваренной соли, добавим примерно 0,5 мл
спиртового раствора индикатора фенолфталеина и погрузим оба замкнутых проволокой электрода в раствор.
Около отрицательного полюса будет наблюдаться слабое красноватое окрашивание, которое вызвано
образованием на катоде гидроксида натрия.
В других опытах можно помещать в ячейку различные пары металлов и определять возникающее
напряжение. Например, магний и серебро дадут особенно большую разность потенциалов благодаря
значительному расстоянию между ними ряду напряжений, а цинк и железо, наоборот, очень маленькую, менее
десятой доли вольта. Применяя алюминий, мы не получим из-за пассивации практически никакого тока.
Все эти элементы, или, как говорят электрохимики, цепи, имеют тот недостаток, что при съемке тока
на них очень быстро падает напряжение. Поэтому электрохимики всегда измеряют истинную величину
напряжения в обесточенном состоянии с помощью метода компенсации напряжения, то есть сравнивая его с
напряжением другого источника тока.
Рассмотрим процессы в медно-цинковом элементе несколько подробнее. На катоде цинк переходит в
раствор по следующему уравнению:
Zn → Zn
2+
+ 2е
-
На медном аноде разряжаются ионы водорода серной кислоты. Они присоединяют электроны,
поступающие по проволоке от цинкового катода и в результате образуются пузырьки водорода:
2Н
+
+ 2е
-
→ Н
2
Через короткий промежуток времени медь покроется тончайшим слоем пузырьков водорода. При этом
медный электрод превратится в водородный, а разность потенциалов уменьшится. Этот процесс называют
поляризацией электрода. Поляризацию медного электрода можно устранить, добавив в ячейку после падения
напряжения немного раствора бихромата калия. После этого напряжение опять увеличится, так как бихромат
калия окислит водород до воды. Бихромат калия действует в этом случае как деполяризатор.
На практике применяют гальванические цепи, электроды которых не поляризуются, или цепи,
поляризацию которых можно устранить, добавив деполяризаторы.
В качестве примера неполяризуемого элемента рассмотрим элемент Даниэля, который раньше часто
использовали как источник тока. Это тоже медно-цинковый элемент, но оба металла погружены в различные
растворы. Цинковый электрод помещается в пористой глиняной ячейке, наполненной разбавленной (примерно
20 %-ной) серной кислотой. Глиняную ячейку подвешивают в большом стакане, в котором находится
концентрированный раствор сульфата меди, а на дне — слой кристаллов сульфата меди. Вторым электродом в
этом сосуде служит цилиндр из медного листа.
Этот элемент можно изготовить из стеклянной банки, имеющейся в продаже глиняной ячейки (в
крайнем случае используем цветочный горшок, закрыв отверстие в дне) и двух подходящих по размеру
электродов.
В процессе работы элемента цинк
растворяется с образованием сульфата цинка,
а на медном электроде выделяются ионы
меди. Но при этом медный электрод не
поляризуется и элемент дает напряжение
около 1 В. Собственно, теоретически
напряжение на клеммах составляет 1,10 В, но
при съеме тока мы измеряем несколько
меньшую величину, вследствие
электрического сопротивления ячейки.
Если мы не снимем ток с элемента, нужно вытащить цинковый электрод из раствора серной кислоты,
потому что иначе он будет растворяться с образованием водорода.
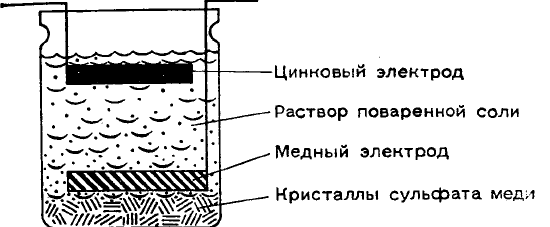
Схема простой ячейки, для которой не требуется пористой перегородки, показана на рисунке.
Цинковый электрод расположен в стеклянной банке наверху, а медный — вблизи дна. Вся ячейка наполнена
насыщенным раствором поваренной соли. На дно банки насыплем горсть кристаллов сульфата меди.
Образующийся концентрированный раствор сульфата меди будет смешиваться с раствором поваренной соли
очень медленно. Поэтому при работе элемента на медном электроде будет выделяться медь, а в верхней части
ячейки будет растворяться цинк в виде сульфата или хлорида.
Сейчас для батарей используют почти исключительно сухие элементы, которые более удобны в
употреблении. Их родоначальником является элемент Лекланше. Электродами служат цинковый цилиндр и
угольный стержень. Электролит представляет собой пасту, которая в основном состоит из хлорида аммония.
Цинк растворяется в пасте, а на угле выделяется водород. Чтобы избежать поляризации, угольный стержень
опускают в полотняный мешочек со смесью из угольного порошка и пиролюзита. Угольный порошок
увеличивает поверхность электрода, а пиролюзит действует как деполяризатор, медленно окисляя водород.
Правда, деполяризующая способность пиролюзита слабее, чем у упоминавшегося ранее бихромата калия.
Поэтому при получении тока в сухих элементах напряжение быстро падает, они «утомляются» вследствие
поляризации. Только через некоторое время происходит окисление водорода пиролюзитом. Таким образом,
элементы «отдыхают», если некоторое время не пропускать ток. Проверим это на батарейке для карманного
фонарика, к которой подсоединим лампочку. Параллельно лампе, то есть непосредственно на клеммы,
подключим вольтметр. Сначала напряжение составит около 4,5 В. (Чаще всего в таких батарейках
последовательно включены три ячейки, каждая с теоретическим напряжением 1,48 В.) Через некоторое время
напряжение упадет, накал лампочки ослабеет. По показаниям вольтметра мы сможет судить, как долго
батарейке нужно отдыхать.
Особое место занимают регенерирующие элементы, известные под названием аккумуляторы. В них
