Горохов А.А. Общая химия: Курс лекций
Подождите немного. Документ загружается.


41
Рисунок 1 – Схема передачи теплоты в работу
В формулировке Клаузиуса утверждается: теплота не может переходить
от холодного тела к горячему сама собою, даровым процессом. По Кельвену:
невозможно превратить в работу теплоту какого-либо тела, не производя
никакого другого действия, кроме охлаждения этого тела. Согласно Освальду:
осуществление вечного двигателя второго рода невозможно. Под вечным
двигателем второго рода подразумевается такая периодически действующая
тепловая машина, которая способна была бы полностью превращать теплоту в
работу, т. е. без передачи части ее холодильнику. Данные формулировки
второго закона термодинамики являются эквивалентными. Достаточно одну из
них выбрать в качестве постулата, тогда из него в качестве следствия будут
вытекать остальные.
Процесс превращения теплоты в работу подчиняется определенной
физической закономерности, которую можно сформулировать строго
математически, если ввести особую функцию состояния – энтропию. Так, для
термодинамической системы, совершающий квазистатический (бесконечно
медленно) циклический процесс, в котором система последовательно получает
малые количества теплоты Qδ при соответствующих значениях абсолютной
температуры Т, интеграл от «приведенного» количества теплоты Т
/
Qδ по
всему циклу равен нулю:
0
Т
Q
=
δ
∫
– т. н. равенство Клаузиуса.
теплоисточник
холодильник
Рабочее
тело
W=Q
1
-
Q
1
Q
2

42
Если интеграл, взятый по замкнутому контуру равен нулю, то существует
функция состояния (обозначим ее через S), полный дифференциал которой
равен подынтегральной величине:
Т
Q
dS
квази
δ
= (7)
Эту функцию состояния Клаузиус назвал энтропией (слово энтропия
образовано от слова энергия «эн» и «тропе» – превращение). Уравнение
является аналитическим выражением второго закона термодинамики для
любого квазистатического процесса. Так как энтропия является функцией
состояния, то ее изменение S∆ зависит от начального и конечного состояния,
но не от пути процесса. Подставляя значение Q
δ
в уравнение (2):
'
квази
WPdVdUQ
δ
+
+
=
δ
получаем формулу:
'
квази
WPdVdUTdS
δ
+
+
= (8)
которая объединяет математически оба закона термодинамики для
квазистатических процессов. Если работа производится системой против сил
внешнего давления, то:
PdVdUTdS
+
=
(9)
Из выражения (9) непосредственно вытекает, что S является функцией U
и V.
При протекании квазистатического процесса в изолированной системе
( constV const, U,0Q ===δ ) энтропия системы в целом остается неизменной:
0)S(
v,u
=∆ . Если же в ней будет протекать нестатический процесс, то энтропия
ее будет возрастать 0)S(
v,u
〉∆ . Обобщая уравнения, приходим к выводу, что в
изолированной системе возможны лишь такие процессы, при которых
0)S(
v,u
≥∆ .
Чтобы вычислить изменение энтропии в необратимом (нестатистическом)
процессе, нужно этот процесс (мысленно) разбить на стадии, которые
проводятся обратимо (квазистатически), и вычислить для них изменение

43
энтропии по уравнениям обратимых процессов. Просуммировав изменения
энтропии всех стадий, можно получить изменение энтропии в необратимом
процессе.
Часто физико-химические процессы осуществляются при нормальном
атмосферном давлении. Энтропия в этих условиях называется стандартной
энтропией и обозначается S
0
(T). Наличие табличных данных S
0
(298) позволяет
вычислить изменение энтропии )298(S
0
∆
для разных процессов.
При нагревании любого вещества от Т
1
до Т
2
при постоянном объеме
(V=const) или постоянном давлении (P=const) теплота процесса приобретает
свойства функции состояния и не зависит от пути процесса. Изменение
энтропии определяется по формулам:
1
2
v
T
T
lnСS ν=∆ (10)
1
2
р
T
T
lnСS ν=∆ (11)
При фазовых превращениях (плавление, испарение, возгонка,
полиморфные превращения) изменение энтропии можно вычислить из
уравнения:
T
Н
S
v
∆
=∆ , (12)
где Н
v
∆ – изменение энтальпии системы при фазовом переходе;
Т – температура фазового перехода.
В качестве примера рассмотрим изменение энтропии при плавлении и
испарении 1 моль воды соответственно при 273 и 373 К и нормальном
атмосферном давлении. При процессе плавления:
)Кмоль/(Дж 99,29
2,273
6008
T
H
SSS
пл
m
0
)тв(
O
2
H
0
)ж(
O
2
H
0
⋅==
∆
=−=∆
При процессе испарения:
)Кмоль/(Дж 93,108
2,373
406373
T
H
SSS
v
v
0
)ж(
O
2
H
0
)г(
O
2
H
0
⋅==
∆
=−=∆
44
Энтропия при фазовых переходах изменяется (возрастает) скачком.
На практике чаще всего процессы протекают в закрытых и открытых
системах, когда в качестве независимых параметров выступают V и Т или Р и
Т. При этом критерием направленности процесса будет изменение других
функций состояния.
В химических процессах проявляются две тенденции: а) стремление к
образованию прочных химических связей между частицами, к возникновению
более сложных веществ, к понижению энергии системы; б) стремление к
разъединению частиц, к беспорядку и возрастанию энтропии. Первая тенденция
в изобарно-изотермических условиях количественно выражается через
изменения энтальпии )моль
/
кДж(∆Η (энтальпийный фактор). Вторая
тенденция количественно выражается произведением абсолютной температуры
на энропию процесса, т. е. )моль
/
кДж(SТ∆ (энтропийный фактор). Взятые по
отдельности энтальпийный и энтропийный факторы не могут быть критериями
самопроизвольного течения химических реакций или мерой химического
сродства.
В разное время пытались оценивать химическое средство по разным
параметрам реакций. В середине 19 в в качестве меры химического средства
начали использовать тепловой эффект реакции. Однако существование
самопроизвольно протекающих эндотермических реакций показало
ограниченную применимость этого положения. Вант-Гофф, применив второй
закон термодинамики, доказал что направление самопроизвольного течения
реакции определяется не тепловым эффектом, а максимальной работой ее. В
настоящее время вместо максимальной работы рассматривают изменение
изобарно-изотермического потенциала (энергии Гиббса) G∆ для реакций,
протекающих при постоянных Р и Т, или изменение изохорно-изотермического
потенциала (энергии Гельмгольца) F
∆
для реакций, происходящих при
постоянных Т и V. Движущую силу процесса (P=const и Т= const) можно найти
из соотношения:
SТG
∆
−
∆
Η
=
∆
(13)

45
Уравнение (13) можно записать в виде:
SТGН
∆
+
∆
=
∆
Как видно, энергия Гиббса – это часть энергетического эффекта
химической реакции, которую можно превратить в работу:
max
pт
WG
=
∆
−
(14)
Поскольку энергию Гиббса можно превратить в работу, то ее также
называют свободной энергией.
Второй член правой части уравнения – энтропийный фактор –
представляет собой часть энергетического эффекта, которую невозможно
превратить в работу. Эта часть эффекта рассеивается в окружающую среду в
виде теплоты. Поэтому энтропийный фактор ST
∆
называют связанной
энергией.
Самопроизвольно протекающие процессы идут в сторону уменьшение
потенциала и, в частности, в сторону уменьшения G
∆
. Если 0G〈∆ , процесс
принципиально осуществим, если 0G〉
∆
, процесс самопроизвольно проходить
не может. Чем меньше G∆ , тем сильнее стремление к протеканию данного
процесса и тем дальше он от состояния равновесия, при котором 0G
=
∆ и
SТН ∆=∆ .
Из соотношения (13) видно, что самопроизвольно могут протекать
процессы, для которых 0Н〉∆ (эндотермические). Это возможно, когда
изменение энтропии 0S〉∆ , но |||SТ|
∆
Η〉
∆
, тогда 0G
〈
∆
. С другой стороны,
экзотермические реакции (0Н
〈
∆ ) самопроизвольно не протекают, если при
0S〈∆ окажется, что 0G〉
∆
. Например, реакция:
СОО
2
1
С
2)графит(
=+
Эта реакция экзотермическая )моль
/
кДж5,110Н(
−
=
∆
, в результате ее
протекания возрастает число молей газообразных веществ
)]Кмоль/(Дж38,89S[ ⋅=∆ , т. е. при любых температурах 0G
〈
∆
.
46
Вычисление величины и знака G
∆
сводится к определению изменений
энтальпии и энтропии физико-химического процесса. Рассмотрим в качестве
примера реакцию разложения карбоната кальция при температуре 298 К:
)г(2)к()к(3
СОСаОСаСО
+
=
Значения энтальпии образования участников реакции и абсолютные
значения энтропии приведены в справочных таблицах термодинамических
свойств химических соединений. Основываясь на таблице 1 данных, запишем:
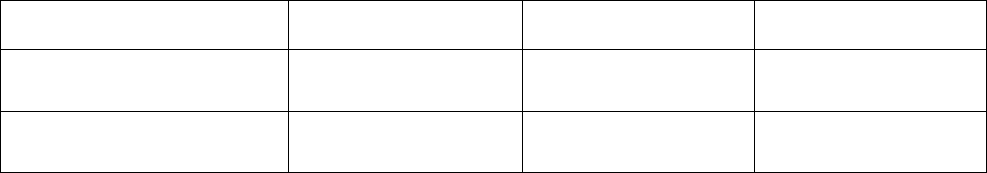
Таблица 1. Термодинамические свойства химических соединений.
Соединение СаСО
3(к)
СаО
(к)
СО
2(г)
моль/кДж ,Н
0
)298(f
∆
-1206 -633 -393
моль/кДж ,10S
30
)298(
−
⋅
+88 +40 +214
Рассчитываем величины
0
)298(r
Н∆ и
0
)298(r
S
∆
и подставляем их в уравнение (13):
кДж/моль 5,12910166298180STHG
30
r
0
r
0
r
=
⋅
⋅
−
=
∆−
∆
=∆
−
Проведенный расчет позволяет сделать вывод, что при 298 К и давлении
атм 1Р
2
СО
= карбонат кальция самопроизвольно не разлагается )0G(
0
r
〉∆ .
При какой температуре будет происходить разложение карбоната
кальция? Такой вопрос возникает при разработке технологий получения
известковых вяжущих веществ, сырьем для которых являются природные
известняки. Для ответа на поставленный вопрос запишем уравнение:
)Т(ST)Т(H)Т(G
0
r
0
r
0
r
∆−∆=∆ , в котором )Т(Н
0
r
∆
и )Т(S
0
r
∆ – значения
соответствующих параметров при искомой температуре разложения карбоната.
Для грубой оценки температуры разложения можно предположить, что
изменение энтальпии и энтропии реакции не зависит от температуры и при
расчетах использовать табличные значения )298(Н
0
f
∆
и )298(S
0
. Тогда:
)298(SТ)298(Н)T(G
0
r
0
r
0
r
∆
−
∆
=
∆

47
При достижении устойчивого состояния (состояния равновесия) при
температуре Т и атм 1Р
2
СО
= , 0G
=
∆ и )298(ST)298(H
0
r
0
r
∆
=
∆
. Отсюда:
K 1084
10166
180
)298(S
)298(H
T
30
r
0
r
=
⋅
=
∆
∆
=
−
Проведенный расчет показывает, что при Т=1084 К СаСО
3
, над которым
атм 1Р
2
СО
= , не претерпевает никаких изменений, то есть находится в
равновесии с СО
2
. При температурах ниже 1084 К СаО, помещенный в
атмосферу СО
2
, взаимодействует с ним, образуя СаСО
3
. Разложение карбоната
кальция происходит лишь при температурах выше 1084 К.
Поэтому обжиг известняков для получения негашеной извести
предпочтительнее вести при температуре 1200-1250 К.
48
7 Химическое равновесие
Химическое равновесие и его признаки.
Равновесие истинное и заторможенное (ложное).
Принцип Ле-Шателье.
Константа равновесия и ее связь с термодинамическими функциями.
Химическое равновесие в гетерогенных системах.
Любой процесс приводит систему в состояние, при котором в ней не
наблюдается никаких изменений при неизменных условиях. Такое состояние
системы называется состоянием равновесия. Это весьма распространенное в
природе состояние, которое достигается как при физических процессах,
(испарение, растворение и т. д.) так и при химических реакциях. Поскольку
законы физического и химического равновесия тождественны, их можно
рассматривать совместно, называя законами физико-химическими равновесия.
Прежде чем перейти к рассмотрению законов равновесия, необходимо
остановиться на тех признаках, по которым можно судить о наличии в системе
этого состояния. Один из признаков равновесия – это неизменность системы со
временем. Однако этот признак является необходимым, но не достаточным.
Никогда нельзя с уверенностью утверждать, что в системе нет изменений, так
как неизвестно, сколько надо наблюдать за ней для того, чтобы констатировать
изменения. Это зависит от скорости протекающих процессов: в системе в одну
сторону может протекать процесс, но с такой малой скоростью, что
практически невозможно заметить в ней изменения (за время, которым
располагает исследователь). В этих случаях говорят, что система находится в
состоянии ложного, или заторможенного, равновесия. Если, например, смешать
Н
2
и О
2
, то в смеси происходит реакция:
2Н
2
+О
2
=2Н
2
О
Однако скорость этого процесса при комнатной температуре столь мала,
что его нельзя обнаружить. Состояние ложного, или заторможенного
49
равновесия особенно часто встречается в твердых телах (сплавы) и
переохлажденных жидкостях (стекла, высокомолекулярные соединения), где
процессы происходят с исчезающее малыми скоростями. Поэтому необходимы
дополнительные признаки, позволяющие отличить истинное состояние
равновесия от ложного. Основным таким признаком, непосредственно
вытекающим из термодинамики, является независимость состояния равновесия
от того, каким путем оно достигнуто. Поясним это на примере. Если смешать
при заданных внешних условиях азот с водородом, начнется процесс
образования аммиака; после достижения равновесия концентрация аммиака в
смеси будет равна некоторой величине
3
NH
С . Но это равновесие можно достичь,
разлагая чистый NH
3
при тех же внешних условиях. Концентрации аммиака в
этих смесях будут равны. По этому признаку всегда легко отличить истинное
равновесие от ложного. Так, например, если при комнатной температуре и Р=1
атм смешать Н
2
и О
2
, то в смеси вода не обнаруживается. Если же при тех же
внешних условиях исходить из воды, то, наоборот, не обнаруживается Н
2
и О
2
.
В этом случае состояние равновесия не зависит от пути, которым оно
достигается, а значит, не является состоянием истинного равновесия. Третий
важный признак истинного равновесия – зависимость от внешних условий
(причем каждому бесконечно малому изменению внешних условий
соответствует бесконечно малое изменение состояния равновесия). Применим
этот признак для того, чтобы доказать, что истинного равновесия в системе
Н
2
+О
2
нет. Если увеличивать температуру в системе, то никаких изменений ее
состояния не наблюдается до тех пор, пока температура не станет выше
определенного критического значения. Как только температура станет выше
этого значения, происходит взрыв. Это скачкообразное изменение состояния
системы при незначительном изменении температуры также свидетельствует о
том, что система Н
2
+О
2
находится в состоянии ложного равновесия.
Основные законы состояния истинного равновесия были первоначально
установлены экспериментально и лишь потом обоснованы термодинамически.
Вначале была установлена качественная закономерность изменения состояния
50
равновесия в зависимости от внешних условий. Эта закономерность,
называемая принципом Ле Шателье-Брауна формулируется следующим
образом: если в равновесной системе изменить внешние условия, то равновесие
смешается так, чтобы эффект внешнего воздействия уменьшался. Принцип Ле
Шателье-Брауна является качественным законом и поэтому не позволяет
количественно рассчитывать изменение состояния равновесия.
Например, если увеличить давление в системе:
322
NH2H3N
⇔
+
то равновесие сместится в том направлении, при котором давление
уменьшается, т. е. в сторону увеличения равновесного выхода NH
3
. Если в
равновесной системе увеличить концентрацию одного из реагирующих
веществ, то равновесие сместится в сторону уменьшения концентрации этого
вещества. С увеличением температуры в равновесной системе происходят
эндотермические процессы, а при охлаждении – экзотермические. Основной
количественный закон химического равновесия – закон действующих масс –
был выведен впервые из кинетических представлений Гульдбергом и Ваге
(1867), а затем термодинамический вывод его был дан Вант-Гоффом (1885).
Очень наглядно закон действия масс можно вывести для реакций,
которые осуществляются при взаимодействии веществ, к которым применимы
законы идеальных газов. К таким реакциям принадлежит, например, реакция:
HI2IH
22
⇔
+
В этом случае скорость прямой реакции (V
1
) при постоянной температуре
прямо пропорциональна концентрациям водорода и йода:
2
I
2
H11
CCKV
⋅
⋅
=
и скорость обратной реакции (V
2
) соответственно:
2
HI22
CKV
⋅
=
Так как при равновесии скорости прямой и обратной реакций равны
V
1
=V
2
, то должны быть равны между собой и правые части равенств, т. е.
2
HI2
2
I
2
H1
CKCCK
⋅
=
⋅
⋅
