Экзамен по физической химии
Подождите немного. Документ загружается.


*************************************************************************************************
ПРЕДМЕТ ФИЗИЧЕСКОЙ ХИМИИ. ЛОМОНОСОВ – ОСНОВОПОЛОЖНИК
ФИЗИЧЕСКОЙ ХИМИИ. ЗНАЧЕНИЕ ФИЗ. ХИМИИ КАК ТЕОРЕТИЧЕСКОЙ
БАЗЫ ХИМИЧЕСКИХ НАУК.
физическая химия-наука, изучающая связи и взаимные переходы между
химической формой движения материи и формами движения, являющимися
предметами исследования физики. Материя- это все что мы видим, ощущаем
объекты живой и не живой природы. Движение материи- все происходящее в
мире изменения: передвижения частиц и тел в пространстве, распространение
волн, тепловые явления, химические реакции. Физическая химия изучает
строение молекул химических соединений их химические свойства и процессы
химических превращений в неразрывной связи с физическими свойствами
веществ, физическими условиями протекания химических превращений.
Физическая химия является теоретическим фундаментом всех химических и
многих смежных с химией наук. Выводами и методами физ. химии пользуются
медики биологи геологи и др. Следовательно, физ. химия имеет общее научное
значение. Велико прикладное значение изучение физ. химии, закономерностей
лежащих в основе тех или иных производственных процессов сначала в
лаборатории, а затем на полузаводских установках, позволяет разрабатывать
научные основы процессов, находить определенные условия ведения
процессов.
Основные разделы физ. химии:
1. молекулярно кинетическая теория агрегатных состояний веществ.
2. химическая термодинамика (изучает взаимосвязь различных форм
энергии)
3. химическая кинетика и хим. равновесие.
4. фазовое равновесие и растворы.
5. электрохимия.
Основоположником физ. химии является М.В. Ломоносов. Он первым
предложил термин физ. химия и дал ей определение. Исключительную роль
в развитии физ. химии внесли русские и зарубежные ученые Менделеев,
Вантгоф, Аррениус, Нерст, Фарадей.
*************************************************************************************************
*************************************************************************************************
ОСНОВНОЕ ПОЛОЖЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
И ЕЕ ОСНОВНОЕ УРАВНЕНИЕ.
1. молекулы газа представляют собой маленькие упругие шарики, постоянно
находящиеся в состоянии хаотического поступательного движения. 2. объем
самих молекуо чрезвычайно мал, по сравнению с общим объемом газа,
поэтому молекулы расматриваются как материальные точки. 3. от столкновения
до столкновения молекулы газа друг на друга не действуют и движутся
прямолинейно. 4. при данной температуре все молекулы движутся с некоторой
постоянной средней скоростью. при повышении т. средняя скорость
увеличивается. 5. при столкновении молекул изменяется и направление
движения молекул, а величина их скорости остается прежней не происходит
обмен энергии между частицами. Масквелл произвел теоретический расчет,
который показал распределение молекул по скорости:
Скорость, с которой движутся наибольшее число частиц называется наиболее
вероятной скоростью движения молекул при данной т. с изменение т.
изменяется наиболее вероятная скорость. кроме нее в МКТ часто пользуются
среднеарифметической и среднеквадратичной скоростями.
;
основное уравнение мкт –
это ур-ние связывает микро- и макро – состояние системы.
Р – общее давление системы; V – общий объем системы;
m - масса 1 молекулы; N – общее число молекул в системе;
среднеквадратичная
**********************************************************************************
*************************************************************************************************
АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА. ПЛАЗМА. ПОНЯТИЕ ОБ
ИДЕАЛЬНОМ ГАЗЕ. АБСОЛЮТНАЯ ТЕМПЕРАТУРА. РАСПРЕДЕЛЕНИЕ
МОЛЕКУЛ ПО СКОРОСТЯМ МАКСВЕЛЛА.
все известные в-ва в зависимости от условий могут находиться в газообразном,
жидком, твердом состоянии. агрегатное состояние одного и того же вещества
не влияют на его хим. св-ва, одднако физ. св-ва не одинаковы. различие в физ.
св-вах обусловлены тем, что частицы в различных агрегатных состояниях
расположены на неодинаковых растояниях друг от друга. в результате чего
силы межмолекулярного взаимодествия проявляются в разной степени.
постепенно изменяя внешнии условия можно осуществить переход из одного
состояния в другое. сравнительно недавно стали изучать 4ое состояние
вещества – плазма – это любой объект, в котором хаотически движутся
электрическизаряженные частицы ē и положительные ядра атомов или ионы.
плазма возникает при действии на в-во в газообразном состоянии каких –либо
ионизирующих факторов (высокая т., радация, электро-магнитные излучения и
т.п.). газы распространены в природе и широко используются в технике. ф
физ.химии различают понятия идеальный и реальный газ. идеальный газ – это
тело, состоящее из множества материальных точек. материальная точка – это
частица, обладающая массой, но не имеющая обьема. между материальными
точками отсутствуют силы притяжения и отталкивания. единственной формой
взаимодействия являются прямое столкновение. газы характерезуются 3мя
параметрами: давление – Р – Па; обем – М- м
3
; температура – Т – К.
абсолютной или термодинамической температурой называется т-ра,
выраженная в градусах кельвина. Т=273
0
+
0
С = К. 0К= 273 абсолютный ноль т-
р. при этой температуре прекращается движение частиц в-ва. достич точки
абсолютного нуля невозможно, следовательно термодинамическая шкала
температур не имеет отрицательных значений.
1. молекулы газа представляют собой маленькие упругие шарики, постоянно
находящиеся в состоянии хаотического поступательного движения. 2. объем
самих молекуо чрезвычайно мал, по сравнению с общим объемом газа,
поэтому молекулы расматриваются как материальные точки. 3. от столкновения
до столкновения молекулы газа друг на друга не действуют и движутся
прямолинейно. 4. при данной температуре все молекулы движутся с некоторой
постоянной средней скоростью. при повышении т. средняя скорость
увеличивается. 5. при столкновении молекул изменяется и направление
движения молекул, а величина их скорости остается прежней не происходит
обмен энергии между частицами. Масквелл произвел теоретический расчет,
который показал распределение молекул по скорости:
Скорость, с которой движутся наибольшее число частиц называется наиболее
вероятной скоростью движения молекул при данной т. с изменение т.
изменяется наиболее вероятная скорость. кроме нее в МКТ часто пользуются
среднеарифметической и среднеквадратичной скоростями.
;
основное уравнение мкт –
это ур-ние связывает микро- и макро – состояние системы.
Р – общее давление системы; V – общий объем системы;
m - масса 1 молекулы; N – общее число молекул в системе;
среднеквадратичная
*************************************************************************************************
*************************************************************************************************
УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА ПРИ НОРМАЛЬНЫХ
УСЛОВИЯХ. УНИВЕРСАЛЬНАЯ ГАЗОВАЯ ПОСТОЯННАЯ И ЕЕ
ФИЗИЧЕСКИЙ СМЫСЛ.
все параметры газа связаны уравнением, получившим название – уравнение
состояния идеального газа. частная формула была предложена Клайпероном.
удельный газ, т.е. объем 1 кг газа. - удельная газовая постоянная,
индивидуальна для каждого газа.
более удобную формулу предложил Менделеев, заменив удельный объем
молекулярным объемом.
- уравнение Менделеева-Клайперона или основное уравнение состояния
идеальных газов. n число молей n=
R – универсальная газовая постоянная = 8, 314 Дж/ моль * к. газовые
параметры связаны друг с другом след. параметрами
чтобы перевести газ к н.у. можно воспользоваться формулой
*************************************************************************************************
************************************************************************************************
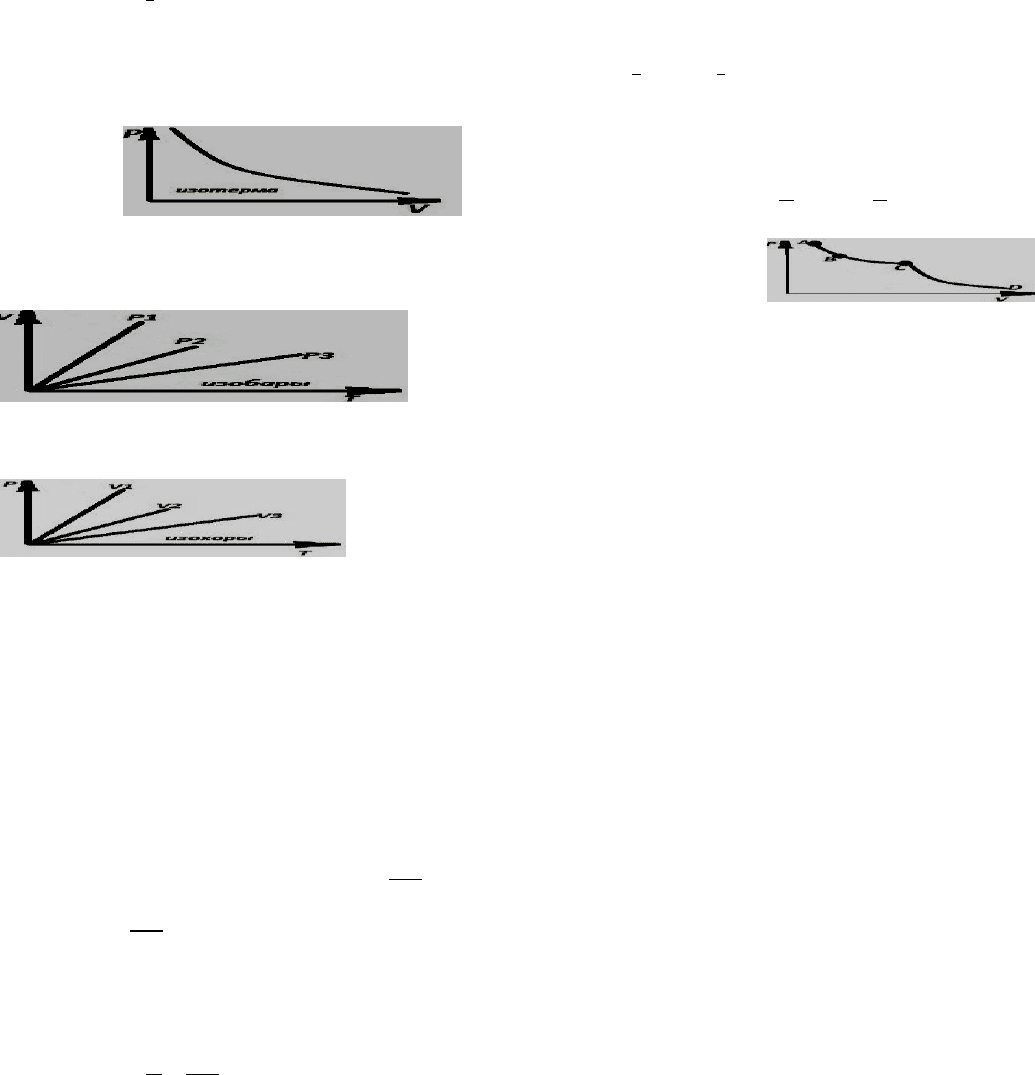
ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ: БОЙЛЯ – МАРИОТТА, ШАРЛЯ,ГЕЙ-
ЛЮССАКА,АВОГАДРО.
Основные законы идеальных газов были выведены на основе основного
уравнения МКТ
Основное уравнение МКТ – это уравнение
связывает микро и макро состояние системы. Р – общее давление системы; V –
общий объем системы;m - масса 1 молекулы; N – общее число молекул в
системе;
среднеквадратичная. К основным законам идеальных газов
относятся: 1.закон Бойля - Мариотта, T=const PV=const; P
1
V
1
=P
2
V
2
; P
1
P
2
/V
1
/V
2
;
объем данной массы газа при постоянной температуре обратно
пропорционален давлению, под которым находится газ, процесс
изотермический.
2. закон гей- люссака:
P=const; V/T=const; V
1
/T
1
=V
2
/T
2
; V
1
T
1
=V
2
T
2
; процесс изобарный, при нагревании
данной массы газа на 1
0
при постоянном давлении, объем его увеличивается на
1
/
273
часть того объема каким бы обладал газ при 0
0
. Vt=Vo (1+
1
/
273
)
1
/
273
коэффициент термического расширения.
3. закон Шарля. V=const, P/T = const, P
1
/T
1
=P
2
/T
2
, процесс изохорный, при
повышении температуры на 1
0
при постоянном объеме, давление данной
массы газа возрастает на 1/273 того давления, которым бы обладал газ при 0
0
.
P
t
=P
0
(1+
1
/
273
) t
4.Закон Авогадро
В 1 моль любого газа при н.у. содержится одинаковое число молекул 6,02*10
23
*************************************************************************************************
*************************************************************************************************
ИДЕАЛЬНЫЕ ГАЗОВЫЕ СМЕСИ. ЗАКОН ДАЛЬТОНА. ПАРЦИАЛЬНОЕ
ДАВЛЕНИЕ И ПАРЦИАЛЬНЫЙ ОБЪЕМ. НОРМАЛЬНАЯ ПЛОТНОСТЬ,
ОТНОСИТЕЛЬНАЯ ПЛОТНОСТЬ ( ПО ВОЗДУХУ, КИСЛОРОДУ, ВОДОРОДУ).
Идеальные газовые смеси – это смеси идеальных газов, так же как и чистые
газы они подчиняются законам идеальных газов. основным законом идеальных
газовых смесей является закон дальтона: «Общее давление газовой смеси,
состоящей из газов химически не взаимодействующих друг с другом, равно
сумме парциальных давлений всех входящих в нее газов. Р общ =
Р1+Р2+Р3+Рn (1). парциальное давление равно тому давлению, которым
обладал бы газ если бы он занимал тот же объем, что и смесь идеальных газов
и имел бы ту же т-ру. в области высоких т-р. и низких Р наблюдается
отклонение от закона дальтона: « в смеси для каждого газа можно применить
уравнение Менделеева - клайперона: P1Vобщ=n
1
RT =>P1=
если подставить это выражение в ур-ние 1, получим:
Робщ=(n
1
+ n
2
+n
3
+…)
; Робщ·Vобщ =
Помимо парциальных давлений различают парциальные объемы газов.
парциальный объем это тот объем, который бы занимал отдельный газ, если
бы находился при т. и р всей газовой смеси.
Vобщ = V1+V2+….+Vn
общий объем газовой смеси равен сумме парциальных объемов, входящих в
состав смеси. для каждого газа можно применить закон Бойля-Мариотта.
Р1Vобщ=Pобщ·V1=>
*********************************************************************************************
*************************************************************************************************
РЕАЛЬНЫЕ ГАЗЫ. ПРИЧИНЫ ОТКЛОНЕНИЯ В ПРОВЕДЕНИИ РЕАЛЬНЫХ
ГАЗОВ ОТ ИДЕАЛЬНЫХ. УРАВНЕНИЕ ВАНН-ДЕР-ВААЛЬСА. ИЗОТЕРМЫ
РЕАЛЬНОГО ГАЗА.
при выводе законов идеальных газов не учитывались силы межмолекулярного
взаимодействия и объем самих частиц. в реальных газах эти параметры есть,
поэтому для реальных газов существуют отклонения от законов идеальных
газов. PV≠nRT эти отклонения тем больше, чем выше плотность газа (выше Р,
ниже Т).
в области средних давлений и средних
температур поведение реальных газов характеризуется уравнением ванн - дер
- вальса. PV=nRT; (p1+p’)(V-b)=nRT p’ – коэффициент, учитывающий силы
притяжения между молекулами берется со знаком + т.к. силы притяжения
действуют в том же направлении, что и Робщ. в – коэффициент, учитывающий
собственный объем частиц. представляет собой предельный объем, до
которого можно сжать газ.
а и в-
коэффициенты, индивидуальные для каждого реального газа. изотерма для
реальных газов выглядит так:
на участке АВ большему изменению давления соответствуют малое изменение
объема (жидкое состояние в-ва). на участке СД малому изменению давления
соответствует большое изменение объема, что характеризует газ. ВС переход
от жидкого состояния в газообразное.
*************************************************************************************************
*************************************************************************************************
СЖИЖЕНИЕ ГАЗОВ. КРИТИЧЕСКИЕ ПАРАМЕТРЫ. ЭФФЕКТ ДЖОУЛЯ -
ТОМПСОНА.
В области высоких Р и низких Т нельзя пользоваться уравнением Ванн-дер-
Ваальса. при данных параметрах расчет проводят по уравнению Менделеева
для реальных газов:
для 1 кмоль. Zc коэффициент сжимаемости газа является функцией от
приведенного Р и Т. для того, чтобы перевести газ в жидкость необходимо
понизить т. и повысить р. Т выше которой не при каких условиях невозможно
перевести газ в жидкость называется критической температурой. давление
которое необходимо для перехода газа в жидкость, при т.крит. называется р.
крит. приведенная температура – приведенное давление .
жидкие газы удобны при транспортировке, используются для получения низких
т. Получение низких температур и сжижение основывается на эффектах джоуля
– Томпсона – это температурный эффект, сопровождающий изменение объема
при свободном расширении от одного постоянного давления до другого без
теплообмена с окр. средой. значительное снижение температуры наблюдается
в том случае, если сильно сжатый газ выпустить в разряженное пространство
(огнетушитель).
*************************************************************************************************
**********************************************************************************
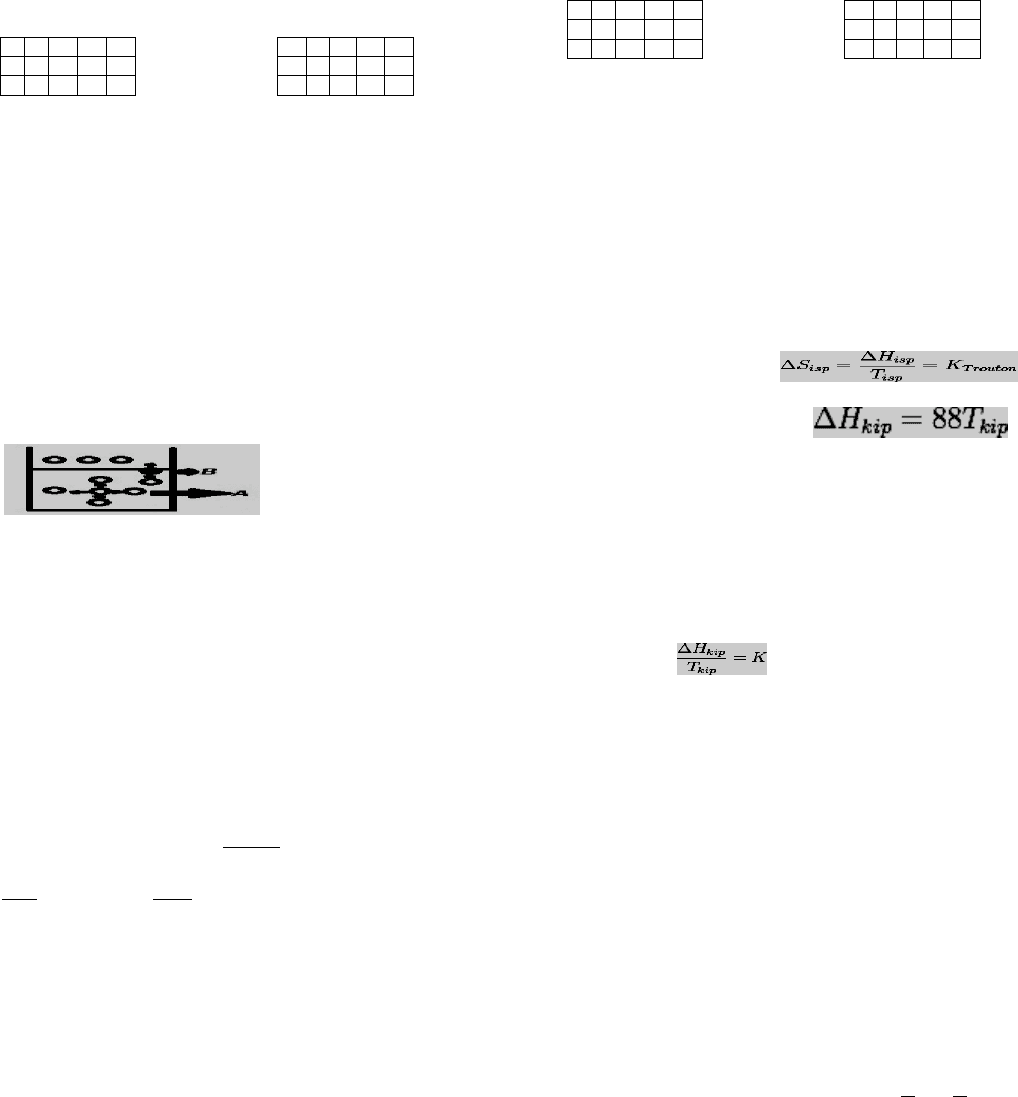
СВОБОДНАЯ И СВЯЗАННАЯ ЭНЕРГИЯ. ПОНЯТИЕ ЭНТРОПИЯ.ПРИНЦИП
МИНИМУМА СВОБОДНОЙ ЭНЕРГИИ.
на основании анализа работы тепловой машины Карно был сделан вывод о
том, что теплота может преобразовываться в другие формы энергии только
частично. поэтому внут. энергию стали условно записывать в виде 2х
слагаемых: U=F+TS, где, F это свободная энергия, TS это связанная энергия.
свободная энергия это та часть внут. энергии, которая свободна к
превращениям и к производству полезной работы. произведение TS
характеризует связанную энергию, неспособную превращаться в работу. S
энтропия мера связанной энергии.. свободная энергия F заключена в системе в
виде потенциальной энергии. по ходу т/д-кого процесса она убывает. в т/д-ких
системах могут самопроизвольно протекать только те физ. и хим. процессы, в
результате которых свободная энергия системы уменьшается условие
протекания самопроизвольного процесса. F2-F1=∆F < 0. химические процессы
характеризуются изменением величин т/д-ких потенциалов. к т/д-ким
потенциалам относятся внутренняя энергия,энтальпия,изохорно-
изотермический потенциал F,изобарно-изотермический потенциал G.F и G
яв-ся мерой свободной энергии в изохорном и изобарном процессах
соответственно.F=U-TS; G=i-TS; ∆F=∆U-T∆S; ∆G=∆i-T∆S; если ∆G (∆F)<0 -
процесс протекает самопроизвольно в обратном направлении. если ∆G (∆F)>0
-система находится в состоянии т\дкого равновесия. при расчете исп-ся
величина S –это мера хаотичного расположения частиц в в-ве или тел в
системе. чем больше S,тем менее упорядоченно располагаются частицы в в-ве
и тем больше связана энергия. газообразное состояние S максимальна, а в
тв.состоянии минимальна. если S1-нач.,S2-конечная энтропия системы.S2-
S1=∆S<0 не может протекать самопроизвольно. самопроизвольно могут
протекать только те процессы которые идут с увеличением энтропии системы.
*********************************************************************************
*************************************************************************************************
ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА. ОСОБЕННОСТИ ЖИДКОГО
СОСТОЯНИЯ ВЕЩЕСТВА. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ И
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ ЖИДКОСТЕЙ. ИЗМЕРЕНИЕ
ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ. ПАВ.
жидкости занимают промежуточное положение между газами и тв. в-вами.
вблизи крит. т. они проявляют сходство с газами. их роднит текучесть, не
способны сохранять свою форму. однако жидкости в отличии от газов не могут
занимать весь предоставленный им объем. с тв. телами жидкости похожи тем,
что обладают высокой плотностью, малой сжимаемостью, зачатки кристал.
структуры. данные свойства объясняются строением жидкости.
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
тв. тело жидкость
«Дальний порядок» «Ближний порядок»
по сравнению с газами расстояние между частицами в ж. не велико. силы
сцепления между молекулами значительны и обуславливают большую
величину внут. давления. поэтому ж. сжижаются очень не значительно.
теоретическое ур-ние состояния жидкостей пока не выведено. ж.
характеризуются след. параметрами:
Т.кип., плотность, вязкость, угол преломления, температура
затвердевания, температура кристаллизации, коэффициент поверхностного
натяжения. большое влияние на св-ва жидкостей оказывает полярность. в
результате взаимодействия полярных молекул друг с другом образуются
молекулярные комплексы различной прочности (ассоциаты). сильно
ассоциированными жидкостями являются вода, спирты, жидкий аммиак, ук.к-та.
и т.д. ассоциация молекул вызывает у жидкостей повышение теплоемкости,
т.кип. теплоты парообразования. Поверхностный слой жидкости, граничащий с
другой средой отличается по св-вам от слоев, находящихся в объеме.
вследствие неуравновешенности сил межмолекулярного притяжения в
поверхностном слое жидкости действуют силы, стремящиеся предельно
сократить поверхность. это силы поверхностного натяжения.
частица а – это частица внутреннего слоя. она окружена себе подобными
частицами и равнодействующая на нее сила межмолекулярного притяжения
равна 0. частица в частица поверхностного слоя, равнодействующая на нее
сила направлена внутрь жидкости, поэтому поверхность стремиться
максимально сократиться. частица в, обладая избытком энергии
сопротивляется втягиванию ее во внутренние слои жидкости. этот избыток
энергии называется поверхностной энергией. чем больше S поверхности, тем
больше поверхностная энергия. она хар-тся коэффициентом поверхностного
натяжения жидкости на границе с данной сферой. А ; - это работа,
которую необходимо затратить при образовании 1 м3 новой поверхности или
сила, действующая на единицу длины поверхности и стремящаяся предельно
сократить поверхность. измеряется в н/м. она зависит от природы двух сред, т-
ры. для растворов также от конц. в-ва, добавление которых снижает
поверхностное натяжение называют павами. по отношению к воде павами
являются спирты, мыла, белковые в-ва. в-ва, повышающие поверхностное
натяжение жидкости называют пинавами. Методы определения пов. натяжения:
1. с помощью сталагмометра (пипетка) метод основан на определении массы
падающей капли
2.метод ребиндера. основан на
определении высоты столба жидкости, поднявшейся по капилляру.
3.метод основан на определении силы отрыва
пластинки с поверхности жидкости.
*************************************************************************************************
***********************************************************************************
ОСОБЕННОСТИ ЖИДКОГО СОСТОЯНИЯ ВЕЩЕСТВА. ИСПАРЕНИЕ И
КИПЕНИЕ. ПРАВИЛО ТРУТОНА.
жидкости занимают промежуточное положение между газами и тв. в-вами.
вблизи крит. т. они проявляют сходство с газами. их роднит текучесть, не
способны сохранять свою форму. однако жидкости в отличии от газов не могут
занимать весь предоставленный им объем. с тв. телами жидкости похожи тем,
что обладают высокой плотностью, малой сжимаемостью, зачатки кристал.
структуры. данные свойства объясняются строением жидкости.
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
тв. тело жидкость
«Дальний порядок» «Ближний порядок»
по сравнению с газами расстояние между частицами в ж. не велико. силы
сцепления между молекулами значительны и обуславливают большую
величину внут. давления. поэтому ж. сжижаются очень не значительно.
теоретическое ур-ние состояния жидкостей пока не выведено. ж.
характеризуются след. параметрами:
Т.кип., плотность, вязкость, угол преломления, температура затвердевания,
температура кристаллизации, коэффициент поверхностного натяжения.
большое влияние на св-ва жидкостей оказывает полярность. в результате
взаимодействия полярных молекул друг с другом образуются молекулярные
комплексы различной прочности (ассоциаты). сильно ассоциированными
жидкостями являются вода, спирты, жидкий аммиак, ук.к-та. и т.д. ассоциация
молекул вызывает у жидкостей повышение теплоемкости, т.кип. теплоты
парообразования. Правило Трутона: молярная энтропия испарения разных
веществ при нормальной температуре кипения является постоянной величиной
и равняется константе Трутона.
В несколько иной формулировке правило Трутона позволяет оценить
энтальпию испарения в точке кипения:
Для неполярных и слабо полярных соединений ошибка такого расчѐта
составляет ±5 %[2]. Для соединений с умеренной полярностью точность
уменьшается в 2 раза, для сильнополярных веществ — в 3 раза, то есть
правило Трутона неприменимо для веществ с заметной полярностью. Отметим,
что в литературе предложено много полуэмпирических формул, связывающих
энтальпию или энтропию испарения с нормальной температурой кипения, но во
многих случаях они практически не повышают точность оценки этих величин по
сравнению с правилом Трутона, в то же время в той или иной степени усложняя
расчет[2]. Более универсальные и точные методы оценки энтальпии испарения
обычно требуют дополнительных данных (критические параметры вещества,
молярный объѐм в точке кипения и т. п.). Отметим, что обобщение правила
Трутона в виде: применяется для расчѐта теплоты испарения
методом термодинамического подобия, когда значение K вычисляется по
свойствам эталона — вещества, однотипного с исследуемым и выбираемого по
определѐнным критериям. Границы применимости правила при этом
существенно расширяются.
**********************************************************************************
**********************************************************************************
ТЕПЛОТА НЕЙТРАЛИЗАЦИИ. ТЕПЛОТА РАСТВОРЕНИЯ.
растворение в-в сопровождается выделением либо поглощением теплоты.
тепловой эффект растворения зависит от природы в-ва и взятого растворителя,
кол-во взятого растворителя и конц. первоначального р-ра. теплого эффект
растворения кол-во выделившегося или поглотившегося тепла при растворении
1 моль в-ва в большом кол-ве растворителя Q1 теплота перехода тв. или
газообразного в-ва в то состояние, в котором оно находится в р-ре9(Q1-),Q2-
теплота сольватации(гидратации).при сольватации теплота всегда выделяется,
т.е.q2>q1.при взаим-ии к-т и щелочей выделяется Qнейтрализации, которая
равна кол-ву теплоты, выделяющейся при нейтрализации 1эквивалента к-ты
одним эквивалентом щелочи. в случае разб.р-ров Q нейтрализации сильных
к-т сильным основаниями всегда одинакова=57,0кДж KOH+HCl=KCl+H2O
K
+
+OH
-
+H
+
+CL
-
= K
+
+ CL
-
+ H2O; OH
-
+H
+
теплоты нейтрализации сильных к-т
сл.основанием различны по величине и всегда меньше чем 57,0 кДж.переход в-
ва из 1ого агрегатного состояния в другое всегда сопровождается изменением
внутренней энергии. Qперехода из 1ого агрегатного состояния в другое
выражается уравнением Клайперона-Клаузиуса L= T
-производная
давления по t.
*********************************************************************************
**********************************************************************************
ВНУТРЕННЕЕ ТРЕНИЕ И ВЯЗКОСТЬ ЖИДКОСТЕЙ. ТЕКУЧЕСТЬ. ЗНАЧЕНИЕ
ВЕЛИЧИНЫ ВЯЗКОСТИ ЖИДКОСТИ В ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССАХ.
ИЗМЕРЕНИЕ ВЯЗКОСТИ.
вязкостью или внутренним трением называется сопротивление текучего тела
перемещению его слоев относительно друг друга. вязкость характеризуется
коэффициентом динамической вязкости «этта» η или коэфициэнтом
внутреннего трения. η = силе трения, возникающее между слоями жидкости
S=1м
2
при градиенте скорости 1м/сек на 1м
η измеряется в пуазах.
динамическая вязкость не учитывает плотность жидкости V=η/p. вязкость
жидкости зависит от природы, темп и давления. для растворов вязкость зависит
также от концентрации. величина обратной вязкости называется текучестью.
вязкость жидкости обусловлена межмолекулярным взаимодействием,
ограничивающим подвижность молекул. по этой причине с повышением темп
вязкость жидкости резко снижается, а с повышением давлением давления
возрастает. методы определения вязкости:1.с помощью вязкозиметра.метод
основан на определении времени истечения исследуемой жидкости из
капилляра. с помощью данного метода вязкость определяют относительно
какой либо эталонной жидкости, как правило дист. воды:
метод не применяют для сильно вязких жидкостей.2. метод Стокса. основан на
определении скорости падения шарика в исследуемой жидкости. жидкость
наливают в цилиндр с двумя метками на расстоянии l друг от друга и помещают
в термостат. опускают в жидкость небольшой металлический или стеклянный
шарик радиусом r и секундомером определяют время падения шарика при
прохождении расстояния. вычисляют скорость падения V шарика. U=l/τ.
ηж=
***********************************************************************************
**********************************************************************************
ТВЕРДОЕ СОСТОЯНИЕ ВЕЩЕСТВА (КРИСТАЛЛИЧЕСКОЕ И АМОРФНОЕ).
ПЛАВЛЕНИЕ И ОТВЕРДЕВАНИЯ ВЕЩЕСТВА. ТИПЫ КРИСТАЛЛИЧЕСКИХ
РЕШЕТОК. СУБЛИМАЦИЯ.
В отличие от газов и жидкостей твердые тела обладают устойчивой формой и
стремятся сохранить ее под действием деформационных сил. характерный
признак тв. в-в геометрически правильное чередование частиц в пространстве,
т.е. наличие пространственной кристаллической решетки. твердые вещества
делятся на кристаллические и аморфные. признаки кристаллических веществ:
1.правильность внешних геометрических форм; 2. анизатропность свойств; 3.
резко выраженная т. плавления. большинство тв. материалов являются
поликристалл., т.е состояние из сросшихся друг с другом. аморфные тела не
обладают определенной т. и постепенно уменьшая свою вязкость переходят в
жидкотекучее состояние, не обладают правильной геометрической формой,
проявляют изотропность свойств подобно газам и жидкостям растворяются как
переохлажденные жидкости. при постепенном охлаждении жидкости скорость
движения их частиц уменьшается, и при некоторой т. они теряют свободу
передвижения, располагаются в определенном порядке, образуя крист.
решетку. жидкость затвердевает. кривые охлаждения:
1. крист. в-во;
2. аморфное в-во;
участок ав хар-ет жидкое состояние; сд – тв. состояние; вс- переход из тв. в
жидкое. образование крист. решетки сопровождается выделением теплоты,
поэтому т. некоторое время остается постоянной если охлаждение происходит
быстро, то т. можно понизить ниже точки в. кристаллы не появляются, жидкость
находится в переохлажденном состоянии.
**********************************************************************************
***********************************************************************************
ФАКТОРЫ,ВЛИЯЮЩИЕ НА ТЕПЛОВОЙ ЭФФЕКТ Р-ЦИИ.ВЫВОД
СООТНОШЕНИЯ МЕЖДУ Qv И Qp.ЗАКОН КИРХГОФФА.
на тепловой эффект р-ции влияет:природа реагирующих в-в,агрегатное
состояние и условия проведения процесса.для газообразных в-в большое
значение имеет проводится ли процесс при P=const или при V=const .при
V=const А=0. Qv=∆U,т.е. Q=U2-U1,т.е. выделяемое тепло в рез-те хим.р-ции при
V=const равно убыли внутренней энергии.при P=const;Qp=-∆i.
СВЯЗЬ МЕЖДУ Qp и Qv: Qp=Qv-nRT
n-приращение числа молей газообразных в-в.
2h2+o2=2H2O ∆N=2-(2+1)=-1
***********************************************************************************
**********************************************************************************
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ.
САМОПРОИЗВОЛЬНЫЕ И ВЫНУЖДЕННЫЕ ПРОЦЕССЫ. ФАКТОРЫ
ИНТЕНСИВНОСТИ И ЭКСТЕНСИВНОСТИ. ВТОРОЕ НАЧАЛО
ТЕРМОДИНАМИКИ.
Обратимые такие в результате которых в самой системе или окружающей
среде не проходят какие – либо неисчезающие изменения. Для практики
интерес представляют 2 типа необратимопротекающих процессов. 1 тип –
процессы для осуществления которых требуется затрата работы из вне. 2. тип
– процессы, которые могут протекать самопроизвольно и не требуют затраты
работы из вне. от таких процессов может быть получена полезная работа.
самопроизвольно протекающие необратимые процессы совершаются до
определенного предела. при этом совершается работа, которая будет тем
больше, чем менее равновесна система. величины разных форм энергии
рассматриваются как произведение 2х величин: фактора интенсивности и
экстенсивности. факторы интенсивности характеризует потенциал данного вида
энергии. факторы экстенсивности зависят от кол-ва в-ва. возможность,
направление и протекание процессов зависят только от факторов
интенсивности. 2ое начало термодинамики устанавливает какие из возможных
процессов могут самопроизвольно протекать в данной системе при данных
условиях. 2ой закон т./Д применим только для систем с большим числом
частиц. 1. «теплота не может самопроизвольно переходить от менее нагретого
тела к более нагретому»; 2. «невозможен процесс единственным результатом,
которого было бы превращение на 100% теплоты в работу»; 3. «невозможно
построить такую машину действия которой бы сводилось к производству
работы только за счет соответствующего охлаждения теплового источника»
(вечный двигатель 2ого рода). Принцип действия теплово машины.
От теплоотдатчика рабочему телу передается теплота q1, но только часть ее
превращается в работу, а другая часть q1 передается теплоприемнику. Вечный
двигатель второго рода включает в себя только теплоотдатчик и рабочее тело.
Т.е предусматривает превращение теплоты в работу при постоянной т. Без
перепада температур, что осуществлять невозможно. Каждая тепловая машина
характеризуется величиной кпд.
************************************************************************************
**********************************************************************************
ЦИКЛ КАРНО
тепловая машина Карно представляет собой идеальный т/д-кий обратимый
круговой процесс, состоящий из 2х изотермических и 2х адиабатических.
рабочее тело 1кмоль идеального газа находящегося в идеальном цилиндре.
для выполнения изотермичности теплоотдатчик и теплоприемник должны быть
бесконечно большими. А – начальное состояние системы, характеризуется
параметрами: Р1V1T1, получив от теплоотдатчика тепло Q газ изотермически
расширяется до точки В p2V2T1, а затем адиабатически до точки С P3V3T2.
затем газ начинают изотермически сжимать до точки Д P4V4T2 а затем
адиабатически сжимать до точки А P1V1T1. на каждом участке газ совершает
полезную работу.
***********************************************************************************

***********************************************************************************
ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ. ТЕПЛОТА, РАБОТА,
ВНУТРЕННЯЯ ЭНЕРГИЯ. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ. ПЕРВОЕ
НАЧАЛО ТЕРМОДИНАМИКИ.
термодинамика – это раздел физической химии, изучающий превращения
различных форм энергии друг в друга и законы этих превращений.
термодинамика рассматривает лишь тела состоящие из большого числа
молекул, т.е макросистемы. т/д базируется на 2х основных законах 1 и 2 начало
т/д. т/д включает в себя: 1.общ. или физическую термодинамику; 2.
техническую, рассматривающую взаимопревращения теплоты и механической
работы, происходящих в паровых машинах; 3. химическую, изучающую
превращение различных видов энергии при хим. реакциях, процессах
испарения, растворения, нейтрализации и т.д. к основным понятиям
термодинамики относятся:
система – это тело или группа тел, находящихся во взаимодействии и
обособленных от окружающей среды.
гомогенная система – не имеет внутри поверхности раздела,
отделяющие отдельные части (фазы), различающиеся по физико-
химическим свойствам.
гетерогенная система – имеет внутри поверхность раздела.
открытая система – имеет обмен с окружающей средой и энергией и
веществом.
закрытая система – есть обмен энергией, но нет обмена веществом.
изолированная система – лишена возможности обмена с окружающей
средой и энергией и веществом (существует только теоретически).
Совокупность всех физических и химических свойств системы
называется ее состоянием. термодинамические функции, которые не зависят
от пути перехода из одного состояния системы в другое, а определяется
только начальным и конечным ее состоянием называется функцией
состояния. функции, которые зависят от пути проведения процесса
называется функциями процесса
процесс-это переход системы из одного состояния в другое. процесс,
при котором т/д система выйдя из некоторого начального состояния
претерпевает ряд изменений, а затем возвращается тем или иным путем в
исходное состояние называется круговым процессом или циклом. изменение
функции состояния в таком процессе = 0.
работа - одна из форм передачи энергии от системы совершающей
работу к системе, над которой работа выполняется; ее выражают кДж и
считают положительный, если она совершается системой над окружающей
средой и отрицательной, если внешние силы совершают работу над
системой.1ый закон т/д является количественной формулировкой закона
сохранения энергии в применении процессам, связанных с превращением
теплоты и работы.
ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ: «во всех явлениях природы энергия НЕ
исчезает бесследно и не возникает из ничего; оно только превращается из
одной формы в другую в строго экв. кол-вах». 1ое начало т/д-ки имеет
несколько формулировок: 1. в изолированной системе сумма всех видов
энергии есть величина постоянная; 2. невозможно создать вечный двигатель
первого рода, т.е. такой двигатель который бы совершал работу без
подведения энергии из вне. в каждом теле в срытом виде заключена энергия,
которая зависит от внутреннего состояния системы – это внут. энергия тела и
складывается из: энергии поступательного движения молекул, энергии
вращательного движения молекул, энергии воздействия между молекулами,
энергии внутримолекулярных колебаний атомов, энергии взаимодействия ê с
ядром и др. кинетическая энергия тела и его потенциальная энергия не
является составляющими внутренней энергии. запас внутренней энергии
системы измерить невозможно, можно лишь экспериментально определить
изменения внутренней энергии: ∆U=U2-U1, U2 конечная внут. энергия
системы, U1 – начальная. если некоторой системе сообщить дополнительное
кол-во теплоты q, то в частном случае, когда объем системы не изменяется,
подведенная теплота будет расходоваться только на изменение внут.
энергии. Q=∆U=U2-U1. это может проявляться в повышении т., изменении
агрегатного состояния вещества или хим. превращением. в общем случае
подведенная к системе теплота расходуется на изменение внут. энергии и
совершении работы. в общем случае закон сохранения можно записать так:
Q=∆U+A. ∆U=Q-A. 3. в любом процессе превращения внут. энергии какой-
либо системы равно кол-ву сообщенной системе теплоты минус кол-во
работы совершаемой системой. ∆U зависит от начального и конечного
состояния системы, т.е. является функцией состояния.
*********************************************************************************
********************************************************************************
РАБОТЫ РАСШИРЕНИЯ ГАЗОВ ПРИ РАЗЛИЧНЫХ ТЕРМОДИНАМИЧЕСКИХ
ПРОЦЕССАХ. ЭНТАЛЬПИЯ.
тепловая машина Карно представляет собой идеальный т/д-кий обратимый
круговой процесс, состоящий из 2х изотермических и 2х адиабатических.
рабочее тело 1кмоль идеального газа находящегося в идеальном цилиндре.
для выполнения изотермичности теплоотдатчик и теплоприемник должны быть
бесконечно большими. А – начальное состояние системы, характеризуется
параметрами: Р1V1T1, получив от теплоотдатчика тепло Q газ изотермически
расширяется до точки В p2V2T1, а затем адиабатически до точки С P3V3T2.
затем газ начинают изотермически сжимать до точки Д P4V4T2 а затем
адиабатически сжимать до точки А P1V1T1. на каждом участке газ совершает
полезную работу.
на основании анализа работы тепловой машины Карно был сделан вывод о
том, что теплота может преобразовываться в другие формы энергии только
частично. поэтому внут. энергию стали условно записывать в виде 2х
слагаемых: U=F+TS, где, F это свободная энергия, TS это связанная энергия.
свободная энергия это та часть внут. энергии, которая свободна к
превращениям и к производству полезной работы. произведение TS
характеризует связанную энергию, неспособную превращаться в работу. S
энтропия мера связанной энергии.. свободная энергия F заключена в системе в
виде потенциальной энергии. по ходу т/д-кого процесса она убывает. в т/д-ких
системах могут самопроизвольно протекать только те физ. и хим. процессы, в
результате которых свободная энергия системы уменьшается условие
протекания самопроизвольного процесса. F2-F1=∆F < 0. химические процессы
характеризуются изменением величин т/д-ких потенциалов. к т/д-ким
потенциалам относятся внутренняя энергия,энтальпия,изохорно-
изотермический потенциал F,изобарно-изотермический потенциал G.F и G
яв-ся мерой свободной энергии в изохорном и изобарном процессах
соответственно. .F=U-TS; G=i-TS; ∆F=∆U-T∆S; ∆G=∆i-T∆S; если ∆G (∆F)<0 -
если ∆G (∆F)<0 -процесс протекает самопроизвольно в обратном направлении.
если ∆G (∆F)>0 -система находится в состоянии т\дкого равновесия. при
расчете исп-ся величина S –это мера хаотичного расположения частиц в в-
ве или тел в системе. чем больше S,тем менее упорядоченно располагаются
частицы в в-ве и тем больше связана энергия. газообразное состояние S
максимальна, а в тв.состоянии минимальна. если S1-нач.,S2-конечная энтропия
системы.S2-S1=∆S<0 не может протекать самопроизвольно. самопроизвольно
могут протекать только те процессы которые идут с увеличением энтропии
системы
**********************************************************************************
**********************************************************************************
ПРЕДМЕТ ЭЛЕКТРОХИМИИ. ПРИКЛАДНОЕ ЗНАЧЕНИЕ ЭЛЕКТРОХИМИИ.
ПРОВОДНИКИ 1ОГО И 2ОГО РОДА. ЭЛКТРОПРОВОДНОСТЬ. УДЕЛЬНАЯ
ЭЛЕКТРОПРОВОДНОСТЬ.
электрохимия раздел, изучающий закономерности взаимных превращений
электрической и химической энергии. э/х рассматривает электрическую
проводимость растворов, работу гальванических элементов, процессы
электролиза. имеет теоретическое и прикладное значение. основоположники:
Вольт, Фарадей, Нернст и др. по электропроводимости все проводники делятся
на проводники 1ого и 2ого рода. к проводникам 1ого рода относятся все Ме,
уголь, графит. их э/проводимость обусловлена движением свободных
электронов. при повышении темп. проводимость проводников 1ого рода
уменьшается. это обусловлено усилением колебаний узлов кристаллической
решетки, что мешает упорядоченному движению электронов. к проводникам
2ого родя относятся растворы и расплавы электролитов- проводимость ионная.
с ростом темп. проводимость проводников 2ого рода увеличивается, так как при
этом уменьшается вязкость среды и увеличивается скорость передвижения
ионов электродам. проводники 2ого рода обладают значительно меньшей
проводимостью чем 1ого рода, однако имеют большое значение в э/х, так как
основные хим. процессы протекают на границе проводников 1ого рода и 2ого
рода. э/п называется способность веществ пропускать л.ток под действием л.
напряжением. э/п это величина обратная сопротивлению R. единица измерения
См- сименс сопротивление проводника рассчитывается по формуле
p удельное сопротивление, тоесть сопротивление столба жидкости длиной l=1m
и S поперечного сечения 1м
2
L/S это постоянная сосуда, она определяется
экспериментально.
- удельная э/п. удельной э/п проводника
2ого рода называется проводимость 1ь
3
раствора заключенного между
платиновыми электродами с поверхностью 1м
2
находящихся на расстоянии на
1 м друг от друга.
***********************************************************************************
********************************************************************************
ТЕРМОХИМИЯ. ЭКЗО- И ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИ. ЗАКОН ГЕССА И
СЛЕДСТВИЕ ИЗ НЕГО.
любые т/д-кие процессы, сопровождающиеся изменением внутр. энергии
системы, в результате чего теплота либо выделяется либо поглощается. при
экзотерм. р-циях U2<U1. значить Q выделяется.при эндотерм. U2>U1 значит
теплота поглощается. для сопоставления энергии до и после процесса
пользуются величиной теплового эффекта, т.е. кол-вом теплоты которая
выделяется или поглощается в ходе р-ции. изучением тепловых эффектов
занимается раздел физ.химии, который наз-тся термохимия. одним из
основоположников термохимии является русский ученый Гессе. в х.
выделяемую теплоту считают положительной поглощающую отрицательную.
тепловые эффекты могут быть определены экспериментально или расчитанны
теоретически., используя величины теплот образования или теплот сгорания
тех или иных соединений. теплота обр. это кол-во выделившейся или
поглотившейся теплоты при образовании одного моля в-ва из простых в-в.
теплота обр. численно равна теплоте разложения но противоположна по
значению. Qобр= -Qразл. чем больше теплоты выделится при образовании в-
ва, тем прочнее это в-во. теплота сгорания – это кол-во теплоты,
выделяющейся при полном сгорании 1моля в-ва в токе кислорода. по методу
Коновалова величины теплот сгорания при V=const рассчитываются по ур-
нию
где, n число атомов кислорода
участвующих в р-ции, m – число молей, образующейся воды, ∑x терм. хар-ка,
хар-ная для каждого гомологического газа. ЗАКОН ГЕССА основной закон тх.
«Суммарный тепловой эффект р-ции не зависит от промежуточных состояний и
пути перехода, а зависит только от начального и конечного состояния
системы». з. гесса точен при условии что все процессы идут либо при P=Const
или V=const, из з. гесса вытекает следствие: 1. тепловой эффект разл. какого-
либо хим. соед-ния = по абс. величине и противоположен по знаку Q его
образованию.
2. если совершаются р-ции, приводящие из различных начальных состояний к
одинаковым конечным, то разность тепловых эффектов этих р-ций
представляет собой тепловой эффект перехода одного начального состояния в
другое. 3. если совершаются 2 р-ции приводящие из одинаковых начальных
состояний к различным конечным, то разность между их Q представляет собой
тепловой эффект перехода из конечного состояния в другое. 4. тепловой
эффект р-ции равен сумме теплот образования исходных в-в с учетом их
стехиометрических коэффициентов.
В табл. представлены не теплоты образования а
энтальпии Qобр = ∆Н обр. 5. тепловой эффект р-ции равен сумме теплот
сгорания исходных в-в минус сумма теплот сгорания продуктов р-ции с учетом
их стехиометрических коэффициентов.
***********************************************************************************
************************************************************************************
ТЕРМРДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ.РАСЧЁТ ТЕПЛОВОГО ЭФФЕКТА Р-
ЦИИ ПО ИЗМЕНЕНИЮ ∆S ПРИ СТАНДАРТНЫХ УСЛОВИЯХ.
на основании анализа работы тепловой машины Карно был сделан вывод о
том, что теплота может преобразовываться в другие формы энергии только
частично. поэтому внут. энергию стали условно записывать в виде 2х
слагаемых: U=F+TS, где, F это свободная энергия, TS это связанная энергия.
свободная энергия это та часть внут. энергии, которая свободна к
превращениям и к производству полезной работы. произведение TS
характеризует связанную энергию, неспособную превращаться в работу. S
энтропия мера связанной энергии.. свободная энергия F заключена в системе в
виде потенциальной энергии. по ходу т/д-кого процесса она убывает. в т/д-ких
системах могут самопроизвольно протекать только те физ. и хим. процессы, в
результате которых свободная энергия системы уменьшается условие
протекания самопроизвольного процесса. F2-F1=∆F < 0. химические процессы
характеризуются изменением величин т/д-ких потенциалов. к т/д-ким
потенциалам относятся внутренняя энергия,энтальпия,изохорно-
изотермический потенциал F,изобарно-изотермический потенциал G.F и G
яв-ся мерой свободной энергии в изохорном и изобарном процессах
соответственно. .F=U-TS; G=i-TS; ∆F=∆U-T∆S; ∆G=∆i-T∆S; если ∆G (∆F)<0 -
если ∆G (∆F)<0 -процесс протекает самопроизвольно в обратном направлении.
если ∆G (∆F)>0 -система находится в состоянии т\дкого равновесия. при
расчете исп-ся величина S –это мера хаотичного расположения частиц в в-
ве или тел в системе. чем больше S,тем менее упорядоченно располагаются
частицы в в-ве и тем больше связана энергия. газообразное состояние S
максимальна, а в тв.состоянии минимальна. если S1-нач.,S2-конечная энтропия
системы.S2-S1=∆S<0 не может протекать самопроизвольно. самопроизвольно
могут протекать только те процессы которые идут с увеличением энтропии
системы
***********************************************************************************
*******************************************************************************
СТАНДАРТНАЯ ЭНТАЛЬПИЯ. РАСЧЕТ ТЕПЛОВОГО ЭФФЕКТА ДЛЯ
СТАНДАРТНЫХ УСЛОВИЙ ПО ТАБЛИЧНЫМ ДАННЫМ. ТЕПЛОТА
ОБРАЗОВАНИЯ И ТЕПЛОТА РАЗЛОЖЕНИЯ ВЕЩЕСТВА.
ЗАКОН ГЕССА основной закон тх. «Суммарный тепловой эффект р-ции не
зависит от промежуточных состояний и пути перехода, а зависит только от
начального и конечного состояния системы». з. гесса точен при условии что все
процессы идут либо при P=Const или V=const, из з. гесса вытекает следствие:
1. тепловой эффект разл. какого-либо хим. соед-ния = по абс. величине и
противоположен по знаку Q его образованию. 2. если совершаются р-ции,
приводящие из различных начальных состояний к одинаковым конечным, то
разность тепловых эффектов этих р-ций представляет собой тепловой эффект
перехода одного начального состояния в другое. 3. если совершаются 2 р-ции
приводящие из одинаковых начальных состояний к различным конечным, то
разность между их Q представляет собой тепловой эффект перехода из
конечного состояния в другое.
В табл. представлены не теплоты образования а
энтальпии Qобр = ∆Н обр. 5. тепловой эффект р-ции равен сумме теплот
сгорания исходных в-в минус сумма теплот сгорания продуктов р-ции с учетом
их стехиометрических коэффициентов.
***********************************************************************************
**************************************************************************************
ХИМ.СРОДСТВО И ЕГО ХИМ.СМЫСЛ. УРАВНЕНИЕ ИЗОТЕРМЫ ХИМ.Р-ЦИИ
И ИХ ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ.
хим.сродство –это способность в-в вступать во взаим-ие друг с другом.оно
зависит от природы в-в,конц-ции (давления) и темпер-ры. хим.сродство нельзя
непосредственно измерить. оно харак-ся изменением термодинамических
потенциалов ∆F и ∆G. для терм-кой обратимой р-ции общего вида при T=const:
эти уравнения дают возможность определить в каком направлении и до какого
предела может протекать р-ция при заданных условиях. можно определить
какими должны быть t и состав исходной смеси,чтобы р-ция протекала в
нужном направлении и требуемой степени. знак - указывает на возможность
самопроизвольного протекания прямой р-ции. + на невозможность
самопроизвольного протекания прямой р-ции. = о состоянии
термодинамического равновесия.
*************************************************************************************
**********************************************************************************
ОСНОВНЫЕ ПОНЯТИЯ ФАЗОВОГО РАВНОВЕСИЯ:ФАЗА, КОМПОНЕНТ,
СТЕПЕНИ СВОБОДЫ. ПРАВИЛО ФАЗ.
фазой наз-ся часть системы,обладающая одинаковыми физико—хим. св-вами
по всему объему и отделенная от др.частей поверхностью раздела
.гетерогенные равновесия, т.е. такие состояния системы при которых процесс
перехода из одной фазы в другую не сопровождается изменением их
хим.состава наз-ют фазовыми равновесиями.к к ним относятся: испарение,
кипение, сублимация, плавление. длительное сосуществование в равновесии
нескольких фаз возможно только в строго определенных условиях. н-р:лед-пар-
вода. сущ-ет только при t=0-0,01С, когда давление пара надо льдом равно
давлению пара над водой. компонент- это химически однородная составная
часть системы,которая при выделении из системы сущ-ет в изолированном
виде как угодно долго. число степеней свободы- это внешние условия (t,p,C),
которые можно менять до определенного предела,не нарушив фазового
равновесия.кол-во фаз, компонентов и число степеней свободы связаны друг с
другом уравнением фаз Гиббса: Ф+С=К+2 (для несконденсированных систем)
где, Ф-число фаз, С-число степеней свободы,К- кол-во компонентов.
С=К+2-Ф=1+2-3=0 – нонвариантная система. гетерогенные системы
классифицируются: 1.по числу компонентов. 2.по числу степеней свободы.
***********************************************************************************
*************************************************************************************
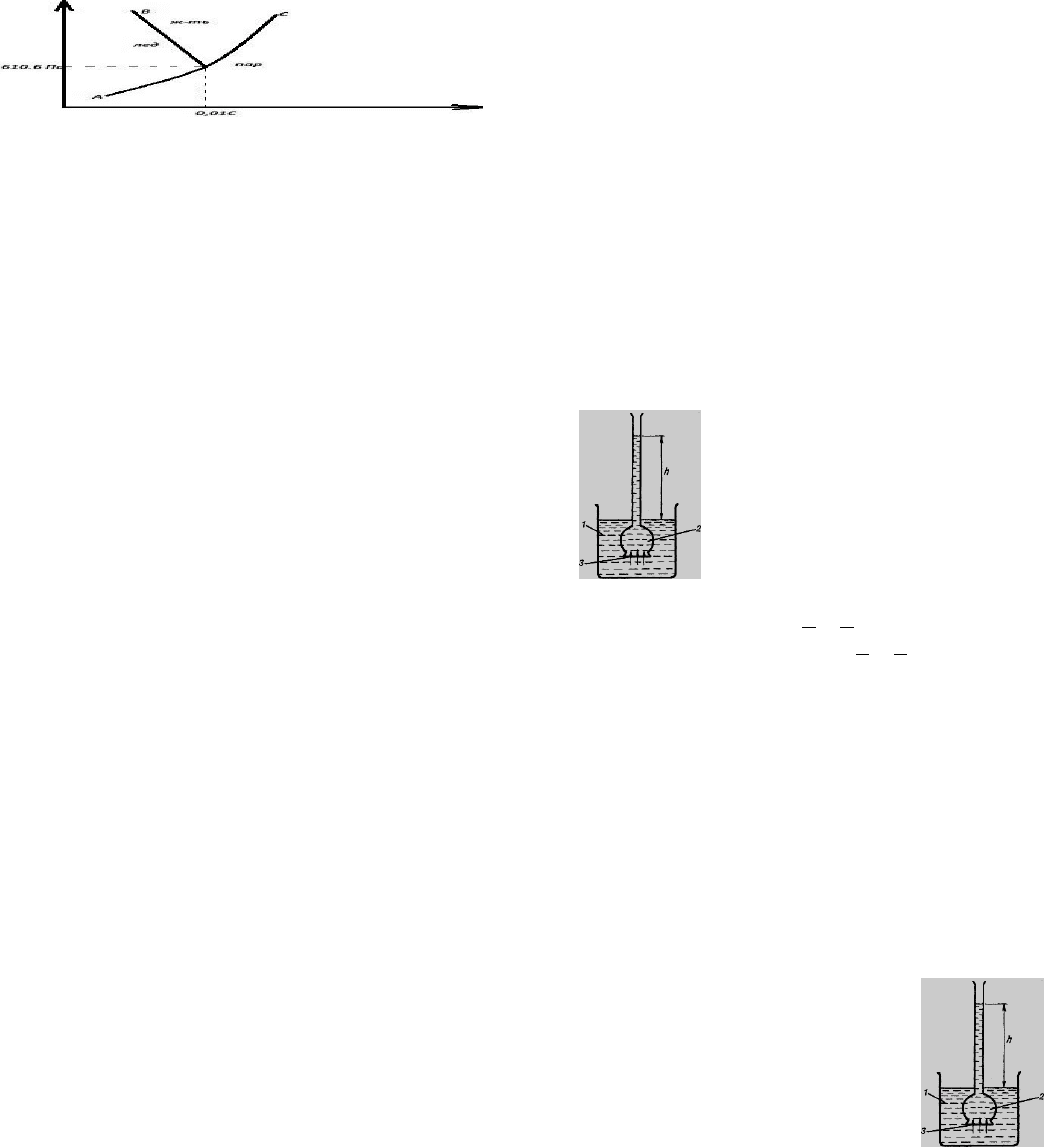
РАВНОВЕСИЕ В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ.ДИАГРАММА
СОСТОЯНИЯ ВОДЫ. ТРОЙНАЯ ТОЧКА ВОДЫ.
к однокомпонентным относится любое чистое, простое или сложное в-
во.проведем анализ однокомпонентных систем, т.е. определим максимальное
число фаз, находящихся в равновесии:
С=К+2+Ф
С=1+2-1=2 при Ф=1
С=1+2-2=1 при Ф=2
С=1+2-3=0 при Ф=3
=== в однокомпонентных системах в равновесии могут находится не более 3х
фаз. рассмотрим фазовую диаграмму однокомпонентнрй системы лед-пар-
жидкость (фазовая диаграмма воды).
кривая АО хар-ет изменение давления пара надо льдом с ростом t. кривая ОС
соответствует изменению пара над жидкостью с ростом t. линия ОВ хар-ет
зависимость tпл. льда от давления.рассчитаем число степеней свободы в
различных точках диаграммы:
точка 1 С=К+2-Ф С=1+2-1
точка2 С=1+2-2
точка3 С=1+2-1
точка4 С=1+2-3
точка О наз-ся 3ей точкой воды. для сконденсированных систем, в которых
отсутствует газовая фаза уравнение Гиббса примет вид: Ф+С=К+1
***********************************************************************************
************************************************************************************
РАВНОВЕСИЕ В ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ. ПОНЯТИЕ О
СПЛАВАХ. ТЕРМИЧЕСКИЙ АНАЛИЗ. ДИАГРАММА ПЛАВКОСТИ
ДВУХКОМПОНЕНТНОЙ СИСТЕМЫ С ОДНОЙ ЭВТЕКТИКОЙ.
если компоненты способны взаим-ть друг с другом с образованием
хим.соединений, то вид диаграммы плавкости усложняется. в этом случае
появляется одна или несколько макс.точек. числа макс.точек соответствует
числу образовавшихся хим.соединений.
при составе Хо Mg и Ca способны образовывать хим.соединения Мg4Са3
обладающее tплав соответствующей точки Д. А- tплав чистого Мg, Д-чистого
Мg4Са3, В-чистого Са, линия АЕ1ДЕ2В- линия Ликвидуса. 1-равновесия Са
кристаллов Мg с жидкими расплавами, 2,3- кристаллы Мg4Са3 с жидким
расплавом, 4- кристаллы Са с жидким расплавом.
**********************************************************************************
***********************************************************************************
Р-РЫ КАК ФИЗИКО-ХИМ. СИСТЕМЫ. НАСЫЩЕННЫЕ, НЕНАСЫЩЕННЫЕ,
ПЕРЕНАСЫЩЕННЫЕ Р-РЫ.СПОСОБЫ ВЫРАЖЕНИЯ КОНЦ-ЦИИ.
р-ры – это гомогенные системы,состоящие из растворителя и растворенного в-
ва,состав которых может изменяться в довольно широких пределах. сущ-ет
несколько направлений в изучении р-ров. согласно физ.теории разб.р-ров
Вантгофа:растворение-физ.процесс,в котором растворитель играет роль
индеферентной среды. согласно хим.теории Менделеева растворение- это
хим.процесс,который сопровождается тепловым эффектом и образованием
гидратов и сольватов. согласно современным представлениям растворение-
это физико-хим. процесс, а р-ры – это физико-хим. системы, занимающие
промежуточное положением между мех.смесями и хим.соединениями. общими
между смесями и р-рами сохраняются хим.св-ва первоначально взятых в-в.
р-ры и смеси не обладают постоянным составом.состав же соединений строго
постоянен.р-ры классифицируются: по агрегатному состоянию, конц-ции и
степени дисперсности.в физ.химии чаще всего применяются: молярная и
моляльная конц-ции и мольная доля растворенного в-ва. моляльная конц-ция
показывает ск-ко молей в-ва может быть растворено в 1000 г растворителя.
мольная доля показывает какую часть от общего кол-ва молей р-ра составляет
растворенное в-во.
Nb- мольная доля растворенного в-ва.
na- мольная доля растворителя
Na- мольная доля растворителя
микрогетерогенные(грубые взвеси)- 10
-5
– 10
-7
м –не устойчивы.
ультрамикрогетерогенные(коллоидные р-ры)- 10
-7
-10
-10
м –довольно устойчивы.
молекулярно и ионодисперсные (истинные р-ры)- ‹10
-10
м –очень устойчивы.
**********************************************************************************
**********************************************************************************
ГИДРАТНАЯ ТЕОРИЯ МЕНДЕЛЕЕВА.ВЛИЯНИЕ ПРИРОДЫ ВЕЩЕСТВА
КОМПОНЕНТОВ,ДАВЛЕНИЯ И ТЕМПЕРАТУРЫ НА РАСТВОРИМОСТЬ.
растворимость самопроизвольный процесс, идущий с уменьшением свободной
энергии, при соприкосновении растворяемого вещества с растворителем.
процесс растворения ТВ. в-в в жидкостях имеет 2 стадии: 1. разрушение
кристаллической решетки, 2. диффузия растворенного вещества в объеме
растворителя. активную роль в 1ом процессе играют молекулы растворителя,
которые внедряясь в кристаллическую решетку, ослабляют силы связи между
частицами и способствуют переходу в-ва из ТВ. в-ва в жидкое. 2ая стадия
процесса проходит медленно и являются лимитирующей. скорость растворения
можно увеличить путем измельчения в-ва, перемешиванием и нагреванием.
скорость растворения зависит от конц. р-ра. по мере увеличения конц. р-ра
скорость растворения уменьшается, и наиболее вероятным становится
обратный процесс. растворимость ТВ.в-в в жидкостях зависит также от природы
раст.в-ва и р-ля, абсолютно нерастворимых в-в не существует.
**********************************************************************************
**********************************************************************************
ОСМОС. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ В РАСТВОРАХ НЕЭЛЕКТРОЛИТОВ.
ОСМОМЕТР. ИЗМЕРЕНИЕ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ.
Осмос – это явление, односторонней диффузии частиц растворителя через
полунепроницаемую мембрану в сторону раствора с большей концентрацией.
полунепроницаемой мембранной яв-тся пергаментная бумага, целлофан,
клеточные оболочки растений и животных, рыбий пузырь, бычий пузырь.
осмотическое давление – это давление, наблюдаемое в р-рах и вызываемое
ударами частиц растворенного в-ва, находящихся в беспорядочном движении о
стенки сосуда. непосредственно измерить осмотическое давление не
возможно, т.к. происходит соударение стенок сосуда и с частицами
растворителя для измерения осмотического давления необходимо отделить р-р
от растворителя. приборы измеряющие осмотическое давление являются
осмометры. А- широкий сосуд с чистым растворителем. В – осмотическая
ячейка, заполненная р-ром, давление которого можно измерить. С – основная
часть осмометра полунепроницаемая мембрана. для измерения о.д. осмометр
соединяют с манометром и источником внешнего Р.
О.д. можно рассчитать, установлено что разб. р-ры подчиняются законам
идеальных газов. 1. Закон Бойля-Мариотта. О.д. р-ров при Т=const
прямопропорционально конц.
2. закон шарля. о.д. р-ров
прямопропорционально Т при с=const
3. закон авогадро. р-ры
различных в-в при одинаковых конц. и температуре обладают одинаковым о.д.
Для неэлектролитов о.д. рассчитывается по формуле: = CmRT.
***********************************************************************************
************************************************************************************
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ.
ИЗОТОНИЧЕСКИЙ КОЭФФИЦИЕНТ. КОЭФФИЦИЕНТ АКТИВНОСТИ, ИОННАЯ
СИЛА РАСТВОРА.
осмотическое давление – это давление, наблюдаемое в р-рах и вызываемое
ударами частиц растворенного в-ва, находящихся в беспорядочном движении о
стенки сосуда. непосредственно измерить осмотическое давление не
возможно, т.к. происходит соударение стенок сосуда и с частицами
растворителя для измерения осмотического давления необходимо отделить р-р
от растворителя. приборы измеряющие осмотическое давление являются
осмометры. А- широкий сосуд с чистым растворителем. В – осмотическая
ячейка, заполненная р-ром, давление которого можно измерить. С – основная
часть осмометра полунепроницаемая мембрана. для измерения о.д. осмометр
соединяют с манометром и источником внешнего Р.
В случае электролитов необходимо учитывать их
диссоциацию на ионы, поэтому в формулу вводят
изотонический коэффициент i, который учитывает
диссоциацию молекул на ионы. Изотонический
коэффициент (также фактор Вант-Гоффа;
обозначается i) — безразмерный параметр,
характеризующий поведение вещества в растворе.
=i Cm R T. i = 1+(R-1)α. α это степень диссоциации в долях.
К – кол-во ионов, образующихся при диссоциации
электролита.
**********************************************************************************
*********************************************************************************
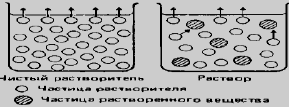
ДАВЛЕНИЕ ПАРА РАЗБАВЛЕННЫХ РАСТВОРОВ. ЗАКОН РАУЛЯ.
ДИАГРАММА «ДАВЛЕНИЕ ПАРА- СОСТАВ».
Опытным путем установлено, что давление пара растворителя над р-ром не
летучих в-в всегда ниже, чем давление пара растворителя над чистым
растворителем при данной т. P
A
0
– давление пара растворителя над чистым
растворителем. P
A
давление пара растворителя над раствором. ∆Р абсолютное
понижение давление пара растворителя над раствором. оно обусловлено
уменьшением общей конц. молекул растворителя в поверхностном слое р-ра и
гидратацией, приводящей к образованию соединений, из которых переход
растворителя в пар затруднен.
относительное понижение давления пара растворителя над раствором. Закон
Рауля основной закон разб. р-ров. «Относительное понижение давление пара
растворителя над раствором равно мольной доле растворного в-ва в р-ре».
Для очень разб. р-ров математическое выражение закона Рауля принимает вид
**********************************************************************************
**********************************************************************************
ЗАМЕРЗАНИЕ И КИПЕНИЕ РАСТВОРОВ. КРИОСКОПИЯ И ЭБУЛИОСКОПИЯ
КАК МЕТОД ОПРЕДЕЛЕНИЯ МОЛЕКУЛЯРНОЙ МАССЫ РАСТВОРЕННОГО
ВЕЩЕСТВА. АНТИФРИЗЫ.
в следствии понижения давления пара растворителя над раствором, Тзам. р-
ров всегда ниже чем у чистого растворителя, а Т.кип выше. рассмотрим р-р
неэлектролита. воспользуемся диаграммой состояния воды.
из графика видно что, чем выше конц. р-ра, тем ниже т-ра кристаллизации. Т.з.
рра < Т. з. р-ля. ∆Тз=Тз.р-ля-Тз.р-ра. ∆Тз.=Ез.·См для неэлектролитов.
∆Тз.=Ез·См·I для электролитов. Ез криоскопическая постоянная для воды =
1,86С. для других в справочнике.
m-масса растворенного в-ва, M – молярная масса раст. в-ва.
G – масса р-ля.
метод определения молекулярной массы в-ва по абс. понижению Тз. р-ра
называется методом криоскопии. поясним с помощью графика повышение Тк
р-ра.
Тк. р-ра>Tк. р-ля, ∆Ткип. = Ткип р-ра – Ткип. р-ля, ∆Ткип.=Ек·Сm·(i)
Ек эбуллиоскопическая постоянная Екводы = 0,516 (0,52)
Метод определения М в-в по абс. повышению Ткип р-ра называют методом
эбуллиоскопии.
***********************************************************************************
***********************************************************************************
СИСТЕМЫ С ОТКЛОНЕНИЕМ ОТ ЗАКОНА РАУЛЯ. ВТОРОЙ ЗАКОН
КОНОВАЛОВА. АЗЕОТРОПНЫЕ СМЕСИ.
с идеальными жидкими смесями на практике приходится встречаться редко. в
большинстве случаев наблюдается значительные отклонения от з. рауля. при +
отклонениях силы притяжения между однотипными молекулами а-а и в-в
значительно выше чем между а-в => испарение отдельных жидкостей
происходит легче чем в идеальных. Р пара отдельного компонента над смесью
выше и на диаграмме давление состав появляются максимулы.
на диаграмме т.кип-состав max над кривой общего Р соответствует min т.кип
при том же составе. в точке минимума кривая пара и жидкости сливаются в
результате чего смесь разгоняться не будет. такая смесь называется
азеатропной. при –отклонения, силы взаимодействия а-а и в-в значитьельно
ниже, чем а-в. испарение происходит значительно хуже и на диаграмме р
состав появляются точки минимума.
т.е. азеатропной смеси соответствует мах т.кип.
***********************************************************************************
**********************************************************************************
ЗАКОН РАСПРЕДЕЛЕНИЯ. ЭКСТРАКЦИЯ. ОБЛАСТИ ЕЕ ПРИМЕНЕНИЕ.
рассмотрим систему вода-хлороформ –жидкости не смешивающиеся друг с
другом. если в такую систему ввести небольшое кол-во йода и взболтать, то он
будет растворяться как в одной так и в другой жидкости но в хлороформе во
много раз больше чем в воде. при в ведении дополнительного кол-ва йода
конц. его в обоих жидкостях будет изменяться, но соотношение конц. Своды/С
хлороформа останется практически неизменным. на основании опытных
данных был сформулирован закон распределения: «отношение конц-ии в-ва
распределяющегося между 2умя несмешивающимися жидкостями являются
для каждой т. величиной постоянной, независящей от количеств каждого и раст-
лей и распределенного в-ва». если распределенное в-во не изменяет при
растворении молекулярной массы, то закон распределения можно записать так:
С1/С2=К. где С1 = конц. в-ва в одной фазе, с2 конц. в-ва во второй фазе, К –
постоянная величина, для данного в-ва и данной пары растворителей наз-тся
коэффициентом распределения. конц С1 и С2 выражаются в мольных долях
или весовых кол-вах на 100 грамм р-ра. если это соотношение не соблюдается
то это указывает на диссоциацию и ассоциацию растворенных молекул на
законе распределения основан процесс экстракции. экстрагирование или
экстракция- это метод извлечения растворенного в-в взбалтыванием с другим,
не смешивающимся с первым растворителем в котором данное в-в
растворяется гораздо лучше. экстракция ускоряется при увеличении
поверхности раздела между фазами, что достигается перемешиванием и
измельчением ТВ-в и др. методами. для выделения в-в в чистом виде экстракт
подвергают перегонке или кристаллизации. в качестве экстрагентов
применяют: бензол, бензин, хлороформ, метанол, этанол и др. орг.
ж.простейший способ экстракции извлечения в-в водой называется
выщелачиванием. при экстракции никогда не удается извлечь в-в на 100%.
полнота экстракции будет больше если раствор обрабатывать малыми
порциями экстрагента многократно. пользуясь коэффициента распределения к
можно рассчитать: кол-во экстрагируемого в-ва g
э
после обработки раствора
определенными порциями экстрагента. пусть, раствор V
1
см3 содержит g0 г
экстрагируемого в-ва и обрабатывается экстрагентом V
2
см3. после
однократной обработки в растворе останется g1 г в-ва, а извлечется
экстрагентом g0-g1. после n обработок в растворе останется gn
а извлечется *
*********************************************************************************
*********************************************************************************
РАВНОВЕСИЕ В СИСТЕМЕ ЖИДКОСТЬ-ГАЗ.ЗАВИСИМОСТЬ
РАСТВОРИМОСТИ ГАЗА ОТ РАЗЛИЧНЫХ ФАКТОРОВ (ПРИРОДЫ
ГАЗА,РАСТВОРИТЕЛЯ,ТЕМПЕРАТУРЫ).ЗАКОН ГЕНРИ.ЗАКОН ГЕНРИ-
ДАЛЬТОНА
при соприкосновении газа с жидкостью происходит абсорбция. в замкнутом
сосуде через некоторое время между ж и г устанавливается динамическое
равновесие: в единицу времени скорость абсорбции равна скорости десорбции.
р-ры газов в ж. как правило являются разб. исключение составляют HCl и NH3-
растворимость велика. растворимость газа выражается его объемом в см3 при
О
0
С и 1 а.т., растворяющихся в 1 литре воды. растворимость газа в жидкости
зависит от природы растворителя, р и т и присутствия других растворенных в-в.
в отличии от ж. и ТВ.в-в растворимость газов увеличивается при понижении т.
на растворимость газов большое влияние оказывает давление. согласно закону
Генри: отношение конц. газа в газовой фазе к конц. его в жидкости при
постоянной т. есть величина постоянная. Cг/Cж=const. частный случай закона
распределения конц. газа в газовой фазе прямо пропорциональна
давления:CгK’P или
или Сж=КР, К=к’/const. конц. газа
растворенного в жидкости прямо пропорциональна давлению газа над р-ром.
при высоких давлениях наблюдаются отклонения от закона Генри. газы,
вступающие с растворителем в хим. взаимодействие не подчиняются закону
Генри. растворимость смеси газов в ж подчиняется закону Генри-Дальтона. При
постоянной т-ре конц. каждого из газов смеси растворенной в данной массе
жидкости пропорциональна ее парциальному давлению и зависит от природы
газа Са=ВРа. Са- конц. компонента в ж. фазе, В коэффициент
пропорциональности. присутствующие в воде электролиты, уменьшают
растворимость газов в данной ж. этим св-вом пользуются в производстве хлора.
газ. хлор хранят не над слоем воды а над раствором поваренной соли. в
результате чего потери хлора снижаются.
************************************************************************************
***********************************************************************************
ХИМИЧЕСКАЯ КИНЕТИКА. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ.
КОНСТАНТА СКОРОСТИ И ЕЕ ФИЗИЧЕСКИЙ СМЫСЛ. ЗАКОН ДЕЙСТВИЯ
МАСС.
химическая кинетика – раздел физ.химии, изучающий скорость хим.р-ции и ее
зависимость от различных факторов. скорость реакции – определяется
изменением конц. реагирующих в-в в единицу времени. различают среднюю и
истинную скорость хим. р-ции.средняя скорость реакции для отрезка времени
.
истинная
скорость р-ции, т.е скорость в данный момент времени это первая производная
конц. его времени. Факторы, влияющие на скорость реакции: 1.Конц.
выражается законом действия масс: «скорость прямо пропорциональна
произведению конц. реагирующих в-в, в степенях равных их стехиометрических
коэффициентов».
В случае если реагирующие в-ва
газы,конц. можно заменить на парциальные давления.
. R-
константа скорости р-ции, она зависит от природы реагирующих в-в и
температуры, но не зависит от конц. в-в. Физ.смысл: R это скорость реакции,
когда конц. реагирующих в-в равны 1моль/л. 2.температура. согласно правилу
вантгофа: при увеличении температуры на каждые 10С, скорость р-ции
увеличивается в 2-4 раза.
μ – тепературный коэффициент
или
. данное правило является приближенным, т.к оно
справедливо только в узких интервалах температур. зависимость скорость р-
ции от т. выражается уравнением аррениуса. 3. катализаторы и ингибиторы.
**********************************************************************************
**********************************************************************************
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПОЛОЖЕНИЕ РАВНОВЕСИЯ В ХИМИЧЕСКОЙ
СИСТЕМЕ. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.
Принцип Ле Шателье: если на систему находящеюся в равновесии оказать
какое-либо влияние, то равновесие сместится в сторону, уменьшающую это
внешнее воздействие.
Существуют р-ции протекающие только в одном направлении они наз-ся не
обратимыми. Не обратимыми являются р-ции в открытой системе
сопровождающиеся выделением газа или выпадения осадка. Большинство хим.
р-ций являются обратимыми, т.е. протекают как в прямом и так в обратном
направлении.
Хим. Равновесие в системе может существовать как угодно долго до изменения
внешних условий. Концентрации всех в-в находящихся в равновесной системе
остаются неизменными, как угодно долго. Хим. Равновесие, подвижно изменяя
внешние условия его можно смещать как вправо, так и влево.
**********************************************************************************
**********************************************************************************
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ
РЕАКЦИЙ В КИНЕТИКЕ. ПОРЯДОК РЕАКЦИИ.
1. по молекулярности, т.е по числу частиц участвующих в р-ции, различают:
одномолекулярные А=В+С, бимолекулярные А+В=С+Д, тримолекулярные
А+В+С=Д. молекулярности не может быть выше 3х, т.к установлено, что
вероятность столкновения более 3х частиц =0. 2. по порядку: известны
одномолекулярные, двумолекулярные, трехмолекулярные р-ции. реакции
нулевого порядка и дробного порядка, порядок р-ции выражается суммой
величин показателей степени при конц. реагирующих в-в в кинетическом
уравнении. как правило, порядок р-ции совпадает с молекулярностью. дробный
порядок бывает в сложных реакциях, состоящих из нескольких элементарных
актов. в р-циях нулевого порядка скорость постоянна и не зависит от конц.
реагирующих в-в, например в р-ции гидролиза
кроме того, различают р-ции параллельные и последовательные.Самая
медленная стадия послдедовательной р-ции, которая определяет общую
скорость всего процесса называется лимитирующей. р-ции хар-тся периодом
полупревращения – это время за которое притерпевает изменение половины в-
ва. для р-ции 1ого порядка:
для р-ции 2го порядка
а и в иначальные конц. 1ого и др. в-в. х – конц. в-ва А.
**********************************************************************************
**********************************************************************************
МОЛЕКУЛЯРНОСТЬ И ПОРЯДОК РЕАКЦИИ. КИНЕТИЧЕСКОЕ УРАВНЕНИЕ
РЕАКЦИИ 1ГО ПОРЯДКА. ПЕРИОД ПОЛУРАСПАДА.
1. по молекулярности, т.е по числу частиц участвующих в р-ции, различают:
одномолекулярные А=В+С, бимолекулярные А+В=С+Д, тримолекулярные
А+В+С=Д. молекулярности не может быть выше 3х, т.к установлено, что
вероятность столкновения более 3х частиц =0. 2. по порядку: известны
одномолекулярные, двумолекулярные, трехмолекулярные р-ции. реакции
нулевого порядка и дробного порядка, порядок р-ции выражается суммой
величин показателей степени при конц. реагирующих в-в в кинетическом
уравнении. как правило, порядок р-ции совпадает с молекулярностью. дробный
порядок бывает в сложных реакциях, состоящих из нескольких элементарных
актов. в р-циях нулевого порядка скорость постоянна и не зависит от конц.
реагирующих в-в, например в р-ции гидролиза
кроме того, различают р-ции параллельные и последовательные.Самая
медленная стадия послдедовательной р-ции, которая определяет общую
скорость всего процесса называется лимитирующей. р-ции хар-тся периодом
полупревращения – это время за которое притерпевает изменение половины в-
ва. для р-ции 1ого порядка:
для р-ции 2го порядка
а и в иначальные конц. 1ого и др. в-в. х – конц. в-ва А.
***********************************************************************************

***********************************************************************************
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ.
ПРИБЛИЖЕННОЕ ПРАВИЛО ВАНТ-ГОФФА. ТЕОРИЯ АКТИВАЦИИ МОЛЕКУЛ
АРРЕНИУСА. ЭНЕРГИЯ АКТИВАЦИИ.
. согласно правилу вантгофа: при увеличении температуры на каждые 10С,
скорость р-ции увеличивается в 2-4 раза.
μ – температурный
коэффициент или
. данное правило является
приближенным, т.к оно справедливо только в узких интервалах температур.
зависимость скорость р-ции от т. выражается уравнением Аррениуса. Для того
чтобы протекла реакция необходимо соударение молекул, однако число
столкновений гораздо больше, чем это соответствует фактической скорости
реакции. оказывается, что к хим. р-ции приводит не любое столкновение, а
только так называемых активных частиц, обладающих энергией активации это
избыток энергии некоторых частиц по сравнению со средним запасом энергии.
при низкой т. число активных молекул мало, поэтому скорость р-ции низкая.
активация молекул происходит за счет соударения, действия лучистой энергии,
эл. заряда, ультразвука и т.п. для того чтобы р-ция была возможна молекулы
должны обладать энергией активации.
чем выше энергия активации, чем ниже скорость р-ции и наоборот. теория
активации объяснила влияние т. конц, кат. на скорость р-ции. при повышении т.
общее число частиц не меняется, а кол-во активных частиц увеличивается за
счет передачи энергии из вне. при увеличении конц. доля активных частиц
увеличивается, за счет увеличения общ. кол-ва частиц.
уравнение Аррениуса.
**********************************************************************************
**********************************************************************************
КАТАЛИЗ, ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ. ГОМОГЕННЫЙ
КАТАЛИЗ. АВТОКАТАЛИЗ.
катализом наз-ся изменение скорости р-ции под влиянием введенных в
реакционную смесь в-в, которые участвуя в процессе к концу р-ции имеют
особенности: 1. кат., участвуя в промежуточных стадиях выделяется в
первоначальном взятом кол-ве и в свободном виде в конце р-ции. поэтому в
хим. ур-ние кат. не вводят. 2. по сравнению с массами реагирующих в-в кол-во
выделенного кат. мало. 3. кат. в одинаковой степени действует на прямую и
обратную р-ции => не влияет на сдвиг равновесия. 4. действие кат. отличается
специфичностью. 5. кат. не изменяет величины теплового эффекта р-
ции.6.посторонние в-ва по отношению к кат могут быть нейтральными,
полезными и вредными. полезные6 в-ва сами не проявляющие кат-кой
активности, но усиливающие во множество раз действие кат. называется
активаторами или промоторами. различают гомогенные, гетерогенные,
ферментативные, автокатализ .гомогенный катализ объясняется теорией
промежуточных соединений Собатье и Зелинского А+С=Д Еакт↑ скорость р-ции
↓. при добавлении в систему кат, он реагирует с одним из исходных в-в образуя
промежуточный комплекс А+кат=Акат Еакт1↓ Скорость р-ции↑. промежуточный
комплекс реагирует со вторым исходным в-вом с образованием продукта Д и
выделением кат в неизменном виде АКат + С= Д+Кат Еакт2↓ Скорость р-ции↑.
************************************************************************************
**********************************************************************************
КЛАССИФИКАЦИЯ КОЛЛОИДНЫХ СИСТЕМ ПО СТЕПЕНИ ДИСПЕРСНОСТИ
И ПО АГРЕГАТНОМУ СОСТОЯНИЮ.
Коллоидная химия изучает дисперсные системы. дисперсными системами
называются системы, состоящие из дисперсной фазы равномерно
распределенной в дисперсной среде. дисперсные системы классифицируются
по агрегатному состоянию в-ва
микрогетерогенные(грубые взвеси)- 10
-5
– 10
-7
м –не устойчивы.
ультрамикрогетерогенные(коллоидные р-ры)- 10
-7
-10
-10
м –довольно устойчивы.
молекулярно и ионодисперсные (истинные р-ры)- ‹10
-10
м –очень устойчивы.
по агрегатному состоянию дисперсной фазы, дисперсной среды.
д
фаза→
д
среда
↓
газ
жидкость
тв.в-во
газ
--------------
пар, туман
пыль, дым
жидкость
пена
эмульсии
суспензия
тв.в-во
пористый
шоколад,
пенобетон
пластилин,
маргарин
глина
сплавы
**********************************************************************************
**********************************************************************************
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ. ПРИЗНАКИ
ИСТИННОГО ХИМИЧЕСКОГО РАВНОВЕСИЯ. КОНСТАНТЫ ХИМИЧЕСКОГО
РАВНОВЕСИЯ КР И КС И СВЯЗЬ МЕЖДУ НИМИ.
р-ция является практически необратимой, только в том случае когда
сопровождается выпадением осадка, т.к. при этом конц. в-в обратимого
процесса малы что не поддаются практическиму изменению. обратимые р-ции
не когда не протекают до конца. пределам протекания обратимых реакций
является хим. равновесие, оно хр-ся след. признаками: 1. в момент равновесия
скорости прямой и обратной реакйии равны, а конц. всех в-в достигнув
определенных значений остаются неизменными как угодно долго при
постоянных внешних условиях. 2. хим.равновесие подвижно даже не
значительное изменение внешних условий (Р, Т, С) приводит к нарушению и
сдвигу хим. равновесия в ту или иную сторону. 3. к одному и тому же состоянию
хим. равновесия можно перийти с 2х сторон, осуществляя процесс с лево на
право или наоборот. 4. в момент хим. равновесия запас свободной энергии
минимальный а энтропия максимальна. переход равновесного состояния в
неравновесное сопровождается увеличением свободной энергии и понижением
устойчивости системы. пусть в однородной среде протекает реакция: А+В=С+Д.
в нач. момент времени конц. а и в максимальна, значит скорость прямой
реакции наибольшая Vпр.=R1·Ca·CB, с течением времени конц. а и в
уменьшается, следовательно скорость прямой реакции уменьшается. в то же
время в системе накапливаются продукты С и Д скорость обратной р-ции V об =
R2·Cc·Cд увеличивается. наступает момент времени, когда V пр = V обр., т.е
химическое равновесие. R1·Ca·Cв= R2·Cc·Cд
для момента хим.равновесия отношение проведения концентрация продуктов к
произведению концентрации исходных веществ есть величина постоянная. С –
равновесные конц. Кс показывает во сколько раз R1≥R2. если скорость
реакции выражена через парциальные давления, то хим. равновесие
записывается так:
СВЯЗЬ МЕЖДУ Кр и Кс.
R – Универсальная газовая постоянная.
приращение числа молей газа.
**********************************************************************************
*********************************************************************************
ТЕПЛОТА СГОРАНИЯ. ТЕПЛОТВОРНАЯ СПОСОБНОСТЬ ТОПЛИВА.
ФОРМУЛА КОНОВАЛОВА.
.теплота сгорания – это кол-во теплоты, выделяющейся при полном сгорании
1моля в-ва в токе кислорода. по методу Коновалова величины теплот сгорания
при V=const рассчитываются по ур-нию
где, n число атомов кислорода участвующих в р-ции, m – число молей,
образующейся воды, Ex терм. хар-ка, хар-ная для каждого гомологического
газа. ЗАКОН ГЕССА основной закон тх. «Суммарный тепловой эффект р-ции не
зависит от промежуточных состояний и пути перехода, а зависит только от
начального и конечного состояния системы». з. гесса точен при условии что все
процессы идут либо при P=Const или V=const, из з. гесса вытекает следствие:
1. тепловой эффект разл. какого-либо хим. соед-ния = по абс. величине и
противоположен по знаку Q его образованию.
2. если совершаются р-ции, приводящие из различных начальных состояний к
одинаковым конечным, то разность тепловых эффектов этих р-ций
представляет собой тепловой эффект перехода одного начального состояния в
другое. 3. если совершаются 2 р-ции приводящие из одинаковых начальных
состояний к различным конечным, то разность между их Q представляет собой
тепловой эффект перехода из конечного состояния в другое. 4. тепловой
эффект р-ции равен сумме теплот образования исходных в-в с учетом их
стехиометрических коэффициентов.
В табл. представлены не теплоты образования а энтальпии
5. тепловой эффект р-ции равен сумме теплот сгорания исходных в-в минус
сумма теплот сгорания продуктов р-ции с учетом их стехиометрических
коэффициентов.
***********************************************************************************
