Экзамен по физической химии
Подождите немного. Документ загружается.


**********************************************************************************
АДСОРБЦИЯ. АДСОРБЦИЯ ТВЕРДЫМИ АДСОРБЕНТАМИ, УРАВНЕНИЕ
ФРЕЙНДЛИХА И ЛЭНГМЮРА.
в гетерогенных системах всякую рорль играют явления, происходящие на
поверхности раздела фаз. на поверхности раздела всегда имеется запас
поверхностной энергии. по мере рабз. в-ва увеличивается число частиц, в
результате растет Sобщ.и удельная S
0
– площадь поверхности. Удельная
поверхность – это отношение общей поверхности всех частиц к общему объему
вещества, она характерезует степень разбавленности. S
0
=S/V Степень
разбавленности или дисперсность – это кол-во частиц, которые можно уложить
плотно друг к другу на расстоянии 1 см. чем больше S
0
, тем выше
поверхностная энергия, которая является свободной. в системах обладающих
избыточной свободной энергией могут самопроизвольно совершаться
процессы, приводящие к понижению этой энергии. одним из таких процессов
является адсорбция – в общем смысле – это изменение конц. в-в у поверхности
раздела фаз. различают адсорбцию: 1. ж-тв.тело, 2. г-тв. 3. г-ж, 4.ж-ж. в-во,
поглощающее своей поверхностью молекулы или ионы других в-в называется –
адсорбентом (серная к-та, силикагель, ак.уголь и др.). в некоторых случаях
процесс начавшийся на поверхности распространяется вглубь поглотителя,
такой процесс называется абсорбцией. если адсорбция сопровождается
образованием на поверхности нового в-ва, то процесс называется
хемосорбцией. например: поглощение CO2 оксидом Са. толщина
адсорбционных слоев может быть равна 1 молекуле (мономолекулярный слой),
бимолекулярный слой и несколько (поли-) молекулярный. процесс адсорбции
обратим. частицы в адсорбционных слоях не закреплены жестко. некоторые из
них могут выходить за пределы действия сил притяжения со стороны
поверхностного слоя – происходит десорбция. адсорбция характеризуется
малой Eакт=> Vр-ции ↑, носит избирательный характер. процесс адсорбции
экзотермичен, поэтому в соответствии с принципом Ле - Шателье, он
ускоряется при понижении t. Согласно химической теории Лэнгмюра и Бурча
поверхность всякого адсорбента не одинакова, на ней имеются участки, где
нескомпенсированность межмолекулярных сил выражается наиболее сильно
(адсорбционные центры); ненасыщенные или некомпенсированные силы
адсорбционных центров являются валентными хим. силами. по теории Полене
природа адсорбционных сил чисто физическая, связанная с проявлением
остаточных ванн-дер-ваальсовских сил. согласно современным
представлениям адсорбция это физ.-хим. процесс. адсорбция газов и
растворенных в-в тв. адсорбентами наиболее важна в практическом
отношении. изучена Зелинским, который в 1915 году сконструировал угольный
противогаз. адсорбция тв.в-вами зависит от величины поверхности. чем
сильнее разбавлено в-во или чем больше его поверхность, тем больше
поверхность и способность к адсорбции. при адсорбции происходит заполнение
активных центров адсорбента частицами в-ва до тех пор, пока на поверхности и
в окружающей среде не установится равновесие. Г=х/S Х-число киломолей.
часто трудно непосредственно определить поверхность адсорбента, поэтому
адсорбцию рассчитывают на кг адсорбента Г=х/m. кол-во газа адсорбционного
адсорбентом зависит от природы газа, давления и t. I участок – кол-во
адсорбционного в-ва растет прямо пропорционально давлению. II участок в
меньшей степень, III участок не зависит от давления это соответствует
насыщению поверхности адсорбента молекулами газа. для участка II
справедливо уравнение Фрейндлиха X/m=R·p
1/n
;
R и n постоянные для каждого газа, находятся графически. в логарифмическом
виде
уравнение Лэнгмюра
r – tg угла наклона, то R=tgα.
*********************************************************************************
**********************************************************************************
УДЕЛЬНАЯ ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ. СХЕМА КОЛЬРАУША.
ЗАВИСИМОСТЬУДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ ОТ
КОНЦЕНТРАНЦИИ. ПОНЯТИЕ О КОНДУКТОМЕТРИЧЕСКОМ АНАЛИЗЕ.
. э/п называется способность веществ пропускать л.ток под действием л.
напряжением. э/п это величина обратная сопротивлению R. единица измерения
См- сименс сопротивление проводника рассчитывается по формуле
p удельное сопротивление, то есть сопротивление столба жидкости длиной
l=1m и S поперечного сечения 1м
2
L/S это постоянная сосуда, она определяется
экспериментально.
- удельная э/п. удельной э/п проводника 2ого
рода называется проводимость 1ь
3
раствора заключенного между платиновыми
электродами с поверхностью 1м
2
находящихся на расстоянии на 1 м друг от
друга. каппа определяют экспериментально с помощью моста Кольрауша,
питаемого высокочастотным переменным током.
р-р находит в спец. сосуд с впаянными платиновыми электродами. постоянный
ток не применяется, т.к. при этом будет протекать процесс электролиза,
который вызовет уменьшение конц. в-в и падение э/п. мост сопротивления АСД
состоит из электролитического сосуда с исследуемым р-ром сопротивлением
Rx известного сопротивления R и реахордной проволоки длиной 1м АС
натянутой на линейку с делениями. вдоль проволоки, представляющей собой
определенное сопротивление, перемещается подвижный контакт В.. В боковом
ответвлении ДВ помещен гальванометр G, перемещая контакт В вдоль
проволоки АС, находят такое его положение, когда в ответвлении ДВ
отсутствует ток (о) это возможно только в том случае когда:
Rx =
Определив Rx и постоянную сосуда L/S можно определит каппу.
Измерение э/п р-ра производят при постоянной т. по мере разбавления э/п
сначала растет достигает мах. значения, а потом начинает снижаться. это
объясняется тем, что в случае сильных электролитов в начальные периоды
разбавления ослабляются межионные эл. взаимодействия, и увеличивается
скорость движения ионов. при дальнейшем разбавлении в сильной степени
проявляется общее уменьшение конц. электролита.
**********************************************************************************
*********************************************************************************
ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТЬ. ЗАВИСИМОСТЬ
ЭКВИВАЛЕНТНОЙ ЭЛЕКТРОПРОВОДНОСТИ ОТ КОНЦЕНТРАЦИИ.
Удельная электропроводность зависит от многих факторов. пользоваться ей
неудобно, поэтому при изучении р-ров чаще пользуются экв.э/п λ которая
равна: λ=æ·V. λ
v
=
; λv э/п данного раствора. измеряется в См·м2·кг·экв-1. При
разб λv увеличивается, при бесконечно большом разб. экв. э/п достигает
своего наибольшего значения λ
∞
, которое при дальнейшем разб. меняется не
будет. во всех случаях λv<λ∞. f =
у сильных элеткролитов называют
коэффициентом э/п или кажущейся степенью диссоциации сильного
электролита. для слабых электролитов α =
истинное значение степени
диссоциации.
***********************************************************************************
***************************************************************************************************************
ЗАКОН РАЗБАВЛЕНИЯ.
Диссоциация слабых электролитов обратимый процесс. при любой т-ре в р-ре
находятся в равновесии катионы, анионы и недиссоциированные
молекулы.степень диссоциации зависит от разбавления: при увеличении
разбавления степень диссоциации увеличивается, при увеличении конц.
электролита степень дис. уменьшается. константа диссоциации для данного
электролита, растворителя и т. имеет определенное значение: R
,
математическое выражение закона разб.:
. С разб. р-ра
увеличивается степень диссоциации слабого электролита и эквивалентная
электропроводность, а К является постоянной прит=const. закон хорошо
применим только к слабым электролитам. совершенно не подчиняются этому
закону р-ры сильных электролитов.
**********************************************************************************
**********************************************************************************
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. МЕХАНИЗМ ВОЗНИКНОВЕНИЯ СКАЧКА
ПОТЕНЦИАЛА НА ГРАНИЦЕ «МЕТАЛЛ-РАСТВОР». ДВОЙНОЙ
ЭЛЕКТРИЧЕСКИЙ СЛОЙ. ПОНЯТИЕ О КОНТАКТНОМ И ДИФФУЗИОННОМ
ПОТЕНЦИАЛАХ.
гальванический элемент это прибор , в котором энергия протекающих хим.р-ций
превращается в электрическую. в простейшем случае г.э. состоит из 2ух разных
Ме, погруженных в растворы электролитов. причем основные процессы
протекают на границе проводников 1ого и 2ого рода. в г.э. непрерывно
протекают электронные ОВ процессы. в результате, на электродах г.э.
поддерживается разность потенциалов, определяющая ЭДС г.э.. при
погружении Ме в воду под действием диполей воды ионы, входящие в
кристаллическую решетку, отрываются и переходят в раствор, происходит
поверхностное растворение ме. на мет. пластине остаются в избытке
электроны, т.е. она зарядится отрицательно. через некоторое время между
пластиной и раствором установится равновесие, т.е. скорость растворения Ме
станет равной скорости всасывания ионов в пластинку. = ионы Ме
располагаются в близи –заряженной поверхности пластины, образуя двойной
электрический слой. I – неподвижный слой, т.е. слой ионов, расположенных в
пленке жидкости, смачивающей поверхность электрода. II подвижный слой. на
границе Ме – жидкость возникает равновесная разность потенциалов,
называемая электродным потенциалом. аналогичные процессы наблюдаются в
том случае, если пластину Ме погрузить в раствор какой-либо его раст. соли. в
этом случае в растворе уже имеются ионы ме. при установившемся равновесии
в системе протекают процессы: Ме
0
= Ме
п+
+ пē. в случае активных металлов,
стоящих в ряду напряжения до водорода, преобладает процесс 1. на
поверхности Ме скапливаются избыток электронов и ме приобретает
отрицательный электродный потенциал. в случае малоактивных ме
преобладает процесс перехода ē из р-ра к поверхности пластины, поэтому
пластина заряжается + и Ме приобретает +потенциал
**********************************************************************************
**********************************************************************************
ДИФФУЗИОННЫЙ ПОТЕНЦИАЛ. КОНЦЕНТРАЦИОННЫЕ ЦЕПИ.
Г.э. Выполненные из электродов одного и того же ме опущенного в растворы
солей различной конц. Примером подобного элемента может служить след. г.э.
катодом является тот электрод, который опущен в раствор с большей конц. в
результате работы элемента конц. р-ров постепенно выравниваются, а эдс
уменьшается ЭДС конц. элементов равна
;
в
концентрационных г.э. помимо электродных потенциалов возникающих на
границе Ме-р-р наблюдается еще возникновение небольшого потенциала в
месте соприкосновения двух р-ров данный потенциал искажает значения ЭДС,
для устранения диффузионного потенциала растворы разделяют стеклянной
трубкой, заполненной р-ром KCl.
***********************************************************************************
***********************************************************************************
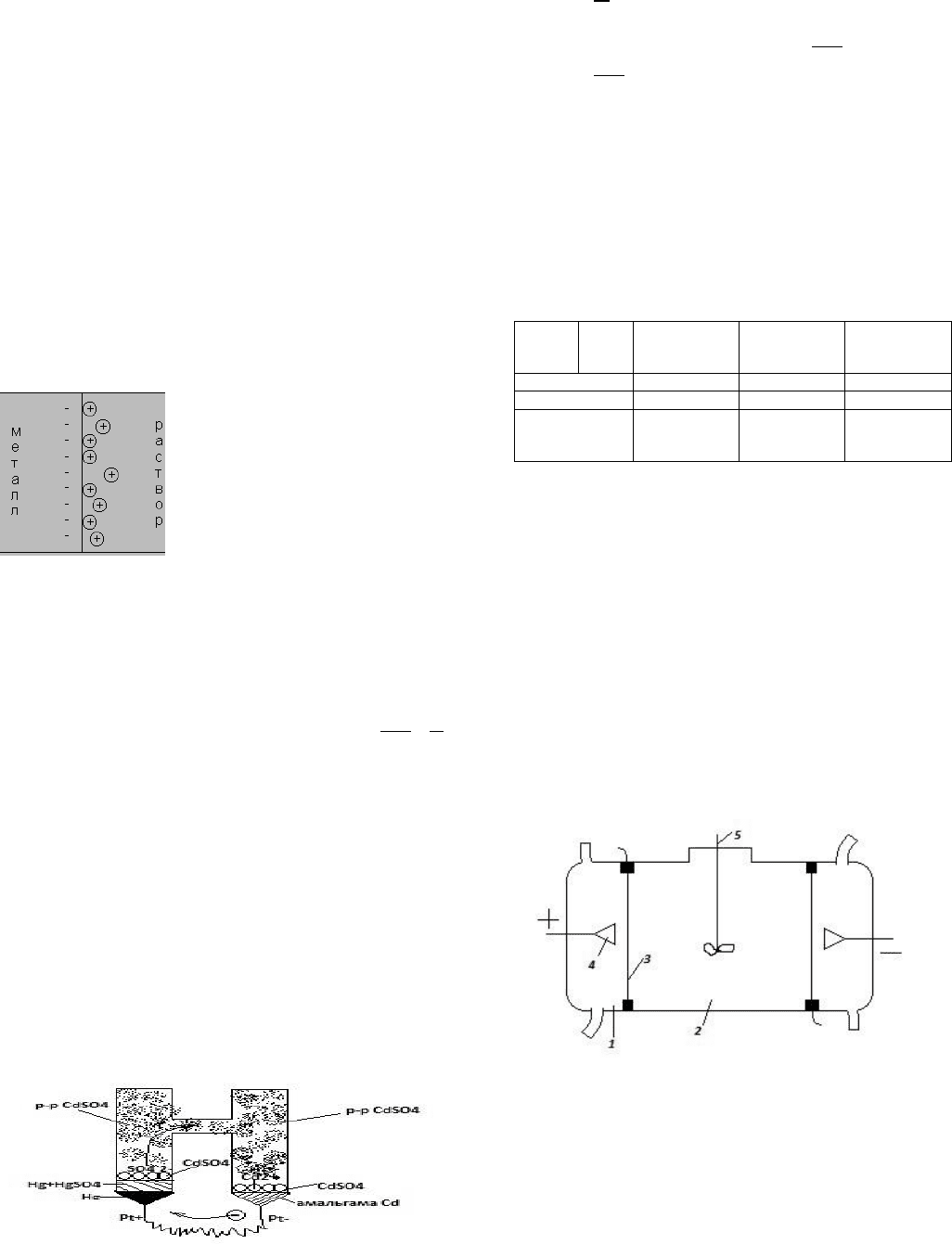
НОРМАЛЬНЫЕ ЭЛЕМЕНТЫ. УСТРОЙСТВО, ПРМЕНЕНИЕ И
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ВЕСТОНА.
элемент Вестона не используется как источник тока, он является нормальным
элементом. нормальные элементы используются в качестве эталонов при
измерении ЭДС других элементов.
В
+
Hg│Hg
2
SO
4
││CdSO
4
│Cd
-
Электроды обычно впаиваются в Н-образный
стеклянный сосуд, в одной части которого помещается ртуть, покрытая сверху
слоем Hg2S04. В другой части находится амальгама кадмия (около 10% кадмия
и 90% ртути). Сосуд наполняется сверху раствором сернокислого кадмия в
воде. Раствор этот некоторые конструкторы делают насыщенным, при чем
кристаллы сернокислого кадмия имеются в избытке;
**********************************************************************************
***********************************************************************************
УРАВНЕНИЕ НЕРНСТА ДЛЯ ОВ ЭЛЕКТРОДОВ.ОВ ПОТЕНЦИАЛЫ.
.При изучении явлений на границе Ме-р-р было установлено, что величина
электродного потенциала зависит от природы ме, т. и конц. ионов ме в р-ре
соли. зная эти величины можно рассчитать потенциал Ме по уравнению
Нернста:
R универсальная газовая постоянная = 8,314, F
постоянная Фарадея 95600, n –кол-во электронов, учавствующих в р-ции. При
Т=25 уравнение приобретает вид:
, при Т=18С
.
моляльная концентрация a=f·Cm, f коэффициент
активности. E
0
стандартный электродный потенциал. для измерения
потенциала данного электрода составляют гальваническую цепь, из
исследуемого электрода и электрода сравнения, потенциал которого известен и
измеряют ЭДС.
***************************************************************************************************************
***************************************************************************************************************
ПРЕДМЕТ КОЛЛОИДНОЙ ХИМИИ. КЛАССИФИКАЦИЯ, ПОЛУЧЕНИЕ И
ОТЧИСТКА КОЛЛОИДНЫХ СИСТЕМ.
Коллоидная химия изучает дисперсные системы. дисперсными системами
называются системы, состоящие из дисперсной фазы равномерно
распределенной в дисперсной среде. дисперсные системы классифицируются
по агрегатному состоянию в-ва (см. тему р-ры), и по агрегатному состоянию
дисперсной фазы, дисперсной среды.
д
фаза→
д
среда
↓
газ
жидкость
тв.в-во
газ
--------------
пар, туман
пыль, дым
жидкость
пена
эмульсии
суспензия
тв.в-во
пористый
шоколад,
пенобетон
пластилин,
маргарин
глина
сплавы
поскольку к.системы занимают промежуточное положение по размеру частиц
между грубыми взвесями и истинными р-рами, то существует 2 принципиально
разных способа получения золей: 1. метод дробления или дисперсионный
метод. 2. метод укрупнения частиц путем соединения (конденсации) атомов и
молекул под действием остаточных ванн-дер-ваальсовских сил. как и и том так
и в другом методах необходимы стабилизаторы в-ва, создающие защитные
адсорбционные слои вокруг частиц. роль стабилизаторов могут выполнять
различные пав. к дисперсному методу относится механическое раздробление
в-в в ступке или с помощью коллоидных мельниц, различных конструкций,
работающих по принципу удара, трения или вибрации. конденсацию частиц
истинных р-ров до размеров коллоидных частиц можно вызвать действием физ.
и хим. факторов: резкое охлаждение паров в-ва, замена лучшего растворителя
на худший, образование золей при хим. реакциях. примеси электролитов
сильно снижают устойчивость золей, поэтому к.р-ры необходимо очищать.
процесс отчистки золей называется диализом. он осуществляется в приборах
диализаторах. 1,1* - боковые части диализатора, 2- средняя часть, 3,3* -
перегородки, непроницаемые для коллоидных частиц, но пропускающие воду и
ионы электролита. 4,4* электроды, 5-мешалка. в среднюю часть подается
загрязненный электролитом, коллоидный раствор и чистая вода, через 3 и 3*
ионы электролита с помощью воды перемещаются к электродам и уносятся
водой из диализатора.
**********************************************************************************

*********************************************************************************
АБСОЛЮТНАЯ И ОТНОСИТЕЛЬНАЯ СКОРОСТЬ ПЕРЕДВИЖЕНИЯ ИОНОВ,
ПОДВИЖНОСТЬ. ЗАКОН КОЛЬРАУША.
эл.ток в растворах электролитов переносится ионами. от скорости
перемещения ионов к электродам зависит э/п данного раствора. скорость
движения ионов зависит от их природы растворителя, природы и концентрации.
на скорость движения ионов отрицательно влияет сольватация. наибольшими
скоростями обладают Н+ и ОН-, этим объясняется большая
электропроводимость р-ров сильных кислот и щелочей
, U абсолютные скорости движения ионов, n- число переноса оно
характеризует кол-во электричества перенесенного к электродам катионами и
анионами в долях. na+nk=1. для многовалентных ионов выражение чисел
переноса должны входить скорости деленные на заряд иона, т.к. например
SO4- переносят в 2 раза больше электричества чем Cl-. вместо абсолютных
скоростей ионов удобнее пользоваться пропорциональными или величинами
подвижностей. ℓk=FUk, ℓa=FUa. F постоянная Фарадея = 96500Кл/моль*К. U и ℓ
связаны с размером и массой ионов, температурой и природой растворителя.
Закон Кольрауша «эквивалентная электропроводность электронов при
бесконечном разбавлении, при постоянной температуре определяется только
суммой подвижностей катиона и аниона λ
∞
=ℓк+ℓа.
**********************************************************************************
**********************************************************************************
ЭДС ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ, КАК РАЗНОСТЬ РАВНОВЕСТНЫХ
КОНЦЕНТРАЦИЙ. ИЗМЕРЕНИЕ ЭДС МЕТОДОМ КОМПЕНСАЦИИ.
эдс это разность потенциалов, но истинное значение эдс гальванического
элемента нельзя определить подключением к электродам вольтметра, т.к.
прибор при этом покажет только часть эдс, которое называется рабочим
напряжением. в условиях когда гальванический элемент работает, т.е отдает
образующуюся в нем электроэнергию. рабочее напряжение всегда оказывается
меньше разности величин электродных потенциалов. истинную величину эдс
следует измерять при разомкнутых электродах, т.е в условиях когда через
гальванический элемент не проходит ток. этому требованию удовлетворяет
широкое применение в лаб. практике. метод компенсации. схема установки при
работе по методу компенсации состоит из цепи аккумулятора 1 и боковой цепи
2. в цепи 1 ток от аккумулятора Еа подается на реахордную проволоку АВ
длиной 1 метр натянутой на линейку с делениями и представляющую собой
сопротивление некоторой определенной цепи. в боковой цепи 2 параллельно
по отношению к эдс аккумулятора выключается одним из элементов: либо
элемент эдс, которого надо измерить Ех, либо нормальный элемент Вестона
Ек. здесь же находится чувствительный гальванометр соединенный проволокой
с подвижным контактом реохорда. при параллельном включении аккумулятора
и элементов Ех или Еw, токи в цепи будут направлены на противоположные
стороны. передвигая контакт вдоль реахордной поволоки нужно найти такое его
положение при котором в боковой цепи не будет протекать ток. этот момент
соответствует компенсации эдс исследуемого гальванического элемента
некоторой частью эдс аккумулятора.
**********************************************************************************
***********************************************************************************
КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ. МЕРЫ ЗАЩИТЫ ОТ КОРРОЗИИ.
Самопроизвольное разрушение металлических материалов, происходящее под
химическим воздействием окружающей среды, называется коррозией. К
важнейшим случаям коррозии относятся коррозия в газах (газовая коррозия) и
коррозия в растворах электролитов (электрохимическая коррозия). Коррозия в
газах происходит при повышенных температурах, когда конденсация влаги на
поверхности металла невозможна. Газовой коррозии подвергаются арматура
печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т. п.
В результате газовой коррозии на поверхности металла образуются
соответствующие соединения: оксиды, сульфиды и др. К электрохимической
коррозии относятся все случаи коррозии в водных растворах.
Электрохимической коррозии подвергаются, например, подводные части судов,
паровые котлы, проложенные в земле трубопроводы. В результате
электрохимической коррозии окисление металла может приводить как к
образованию нерастворимых продуктов (например, ржавчины), так и к переходу
металла в раствор в виде ионов. Атмосферная коррозия — коррозия во
влажном воздухе при обычных температурах. Поверхность металла, находяще-
гося во влажном воздухе, бывает покрыта пленкой воды, содержащей
различные газы, и в первую очередь — кислород. Коррозия в грунте - приводит
к разрушению проложенных под землей трубопроводов, оболочек кабелей,
деталей строительных сооружений. Металл в этих условиях соприкасается с
влагой грунта, содержащей растворенный воздух. Местная коррозия приводит
к появлению на поверхности металла углублений («язв»), которые со временем
могут превращаться в сквозные отверстия. Иногда развитие язв трудно
обнаружить, например, из-за остатков окалины на поверхности металла. Этот
вид коррозии особенно опасен для обшивки судов, для промышленной
химической аппаратуры и в ряде других случаев. Для предупреждения коррозии
и защиты от нее применяются разнообразные методы:
применение химически стойких сплавов;
защита поверхности металла покрытиями;
обработка коррозионной среды;
электрохимические методы.
Из химически стойких сплавов наиболее широкое применение имеют
нержавеющие стали, в состав которых входит до 18 % хрома и до 10 % никеля.
В качестве металлов для покрытия обычно применяют металлы, образующие
на своей поверхности защитные пленки. К таким металлам относятся хром,
никель, цинк, кадмий, алюминий, олово и некоторые другие. Метод обработки
внешней среды пригоден для случаев, когда защищаемое изделие
эксплуатируется в ограниченном объеме жидкости. Метод состоит в удалении
из раствора, в котором эксплуатируется защищаемая деталь, растворенного
кислорода или в добавлении к этому раствору веществ, замедляющих
коррозию, — ингибиторов. К электрохимическим методам защиты металлов
относятся катодная защита и метод протекторов. При катодной защите
защищаемая конструкция или деталь присоединяется к отрицательному полюсу
источника электрической энергии и становится катодом. В качестве анодов
используются куски железа. Метод протекторов осуществляется
присоединением к защищаемому металлу большого листа, изготовленного из
другого, более активного металла — протектора. В качестве протектора при
защите стальных изделий обычно применяют цинк или сплавы на основе
магния.
**********************************************************************************
