Буринська Н.М., Депутат В.М., Сударева Г.Ф., Чайченко Н.Н. Хімія. Підручник для 10 класу загальноосвітніх навчальних закладів. Профільний рівень
Подождите немного. Документ загружается.


71
Неметалічні елементи та їх сполуки
на чистоту. Якщо водень чистий, то пропустимо його над нагрітим у
пробірці купрум(ІІ) оксидом. Через деякий час поверхня оксиду почер-
воніє, а на стінках пробірки з’являться краплі води. Отже, внаслідок
реакції утворилися мідь і вода.
Окиснювальні властивості водень виявляє в реакціях з меншою кількі-
стю речовин, а саме: із лужними і лужноземельними металами з утворен-
ням твердих гідридів. Процес відновлення водню у них відповідає схемі:
Н
0
2
+ 2ē → 2Н
–1
і рівнянням реакцій:
H
2
+ 2Na = 2NaH; Н
2
+ Са = СаН
2
Натрій гідрид
Кальцій гідрид
Складанням схем електронного балансу розглянутих хімічних реак-
цій доведіть відновні та окиснювальні властивості водню.
Нагадуємо, що об’єми газуватих реагентів і продуктів реакцій під-
порядковуються закону об’ємних співвідношень:
об’єми газів, що вступають у реакцію та утворюються внаслідок
неї, співвідносяться як прості цілі числа.
Знання закону дає змогу легко обчислювати об’єми газів за рівнян-
ням хімічних реакцій, які ви здійснювали у 9-му класі.
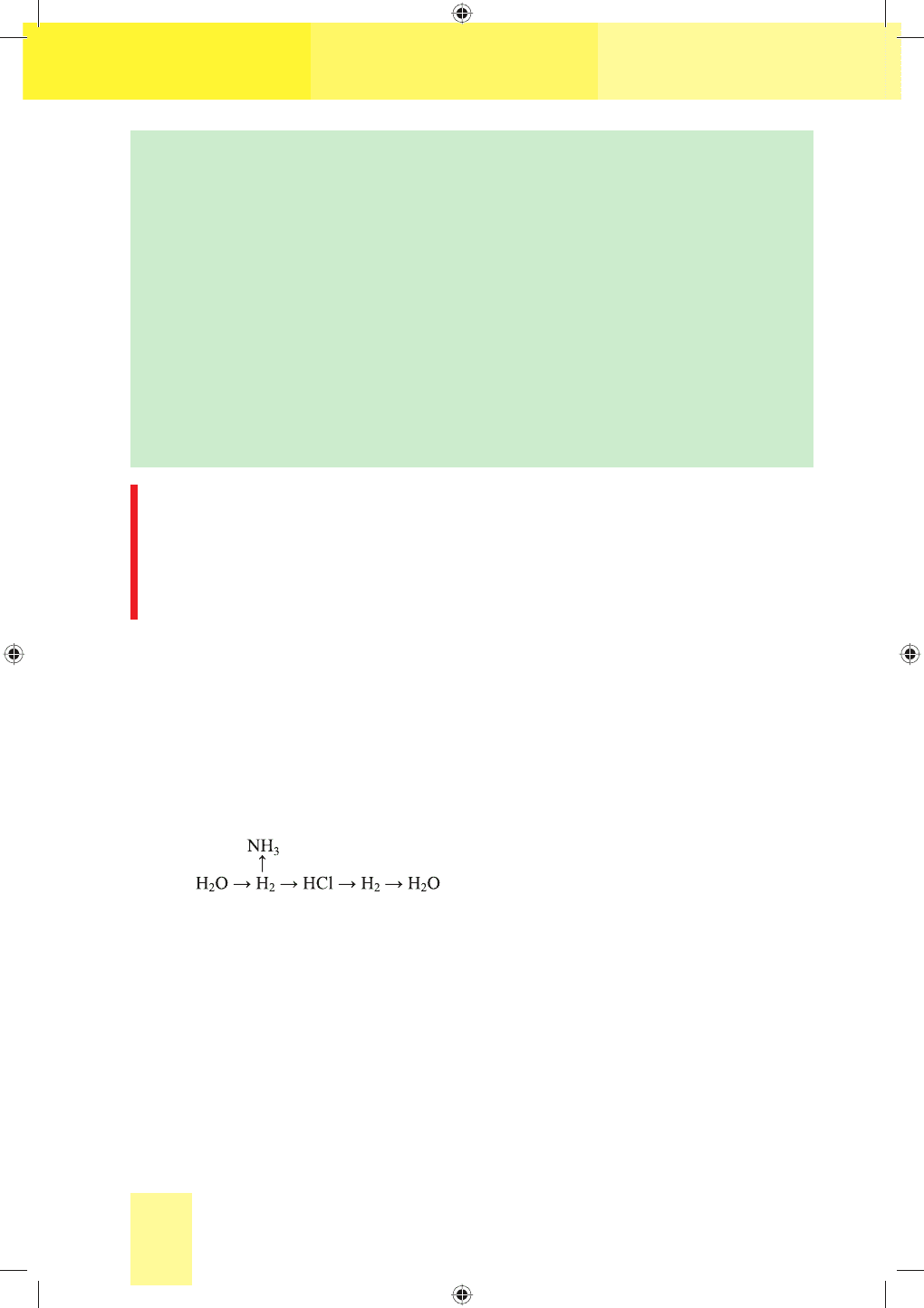
Застосування водню зумовлене його фізичними й хімічними вла-
стивостями. Раніше він широко використовувався в літальних апара-
тах (аеростатах, дирижаблях). Однак небезпечність водню різко об-
межила його застосування в цьому напрямку. Нині літальні апарати і
повітряні кулі наповнюють чистим гелієм або в суміші з воднем.
Водень є сировиною для добування амоніаку, який йде на виробництво
мінеральних добрив, хлоридної кислоти, метанолу, що використовується
для виробництва пластмас. У металургійній промисловості водень засто-
совують для добування металів з відповідних оксидів, у харчовій — для
перетворення олій на тверді жири. Реакція горіння водню в кисні застосо-
вується у водневому пальнику для зварювання та різання металів.
Рідкий водень є одним з найефективніших видів ракетного паль-
ного. У найближчому майбутньому можливе використання водню як
екологічно чистого пального для автомобілів: водневі двигуни не за-
бруднюють довкілля, оскільки виділяють тільки водяну пару. Однак
за сучасних технологій добування водню з води як палива є набагато
дорожчим, ніж бензину.
!
Коротко про головне
За стандартних умов водень — хімічно інертна речовина й вза-
ємодіє лише з фтором. При нагріванні, освітленні або в присутності
каталізатора водень реагує з великою кількістю простих і складних
Chemistry10kl_v17j.indd 71Chemistry10kl_v17j.indd 71 06.01.2011 15:05:3906.01.2011 15:05:39
72
Розділ 2
речовин, виявляючи відновні або окиснювальні властивості. Як
відновник водень вступає в реакцію з киснем, галогенами, сір-
кою, азотом, оксидами металічних елементів, ненасиченими
вуглеводнями тощо, як окисник — з лужними і лужноземель-
ними металами. Реакцію горіння водню у кисні використову-
ють для його перевірки на чистоту. Суміш двох об’ємів водню
та одного об’єму кисню називається гримучою сумішшю, вона є
вибухонебезпечною.
Водень застосовують для наповнювання повітряних кульок і
літальних апаратів (разом з гелієм), добування амоніаку, хлорид-
ної кислоти, метанолу, металів, для перетворення олій на тверді
жири, зварювання та різання металів, як ракетне паливо. У май-
бутньому можливе використання водню як екологічно чистого
пального.
Для допитливих. У 1889 р. харківський біохімік К. Данилев-
ський побудував перший в світі керований повітряний апарат, у
якому використовувався балон з воднем.
У 1937 р. німецький дирижабль «Гінденбург», найбільший у сві-
ті на той час, загинув внаслідок вибуху водню. Ця катастрофа покла-
ла край ері водневих дирижаблів.
?
Контрольні завдання
1. Речовина, за допомоги якої визначають чистоту водню, — це
А фтор; В азот;
Б кисень; Г купрум(ІІ) оксид.
2. Об’ємне співвідношення водню і кисню у «гримучій суміші»
А 1:2; Б 2:2; В 1:1; Г 2:1.
3. Складіть рівняння реакцій, схеми електронного балансу, що відповіда-
ють перетворенням:
4. Висловіть судження відносно використання водню та бензину як пали-
ва в автомобільному транспорті.
5. Складіть таблицю, що ілюструє залежність галузей використання вод-
ню від його властивостей.
6. Обчисліть об’єми газів, які складатиме суміш після реакцій:
а) 2 л хлору і 3 л водню; б) 10 м
3
азоту і 40 м
3
водню.
7. Обчисліть об’єми хлору та водню (н.у.) для добування 37 %-вої хлорид-
ної кислоти масою 1000 кг.
8
*
. Газ, що виділився під час реакції цинку масою 2,0 г із хлоридною кис-
лотою, пропустили при нагріванні над купрум(ІІ) оксидом масою 4,0 г.
Обчисліть масу добутої твердої суміші.
Chemistry10kl_v17j.indd 72Chemistry10kl_v17j.indd 72 06.01.2011 15:05:3906.01.2011 15:05:39
73
Неметалічні елементи та їх сполуки
ПРАКТИЧНА РОБОТА 3
ВІДНОВНІ ВЛАСТИВОСТІ ВОДНЮ
1. Складіть прилад, як показано на мал. 21, б.
2. Добудьте водень реакцією металу з кислотою й заповніть ним
окрему пробірку.
3. Перевірте водень на чистоту.
4. Якщо водень чистий, вставте газовідвідну трубку в пробірку з
порошком купрум(ІІ) оксиду якомога ближче до його поверхні. За-
паліть сухе пальне й нагрівайте пробірку з оксидом. Спостерігайте за
перебігом реакцій. Як тільки порошок почервоніє, нагрівання при-
пиніть.
5. Напишіть рівняння реакцій у послідовності їх перебігу, вка-
жіть тип. Установіть окисник і відновник.
6. Зробіть висновки з роботи.
Контрольні завдання
1. Поясніть, чому пробірку з купрум(ІІ) оксидом треба закріплю-
вати похило.
2. Укажіть ознаки, за якими визначається чистота одержано-
го водню, перебіг реакцій водню з кислотою та його взаємодії з
купрум(ІІ) оксидом.
3. Поясніть, яка властивість водню і за яких умов робить цей газ
небезпечним.
4. Назвіть фізичні властивості водню, які спостерігали під час до-
слідів.
5. Оцініть практичне значення реакції водню з купрум(ІІ) оксидом.
Chemistry10kl_v17j.indd 73Chemistry10kl_v17j.indd 73 06.01.2011 15:05:3906.01.2011 15:05:39

74
Розділ 2
ХІМІЧНІ ЕЛЕМЕНТИ VІІА ГРУПИ
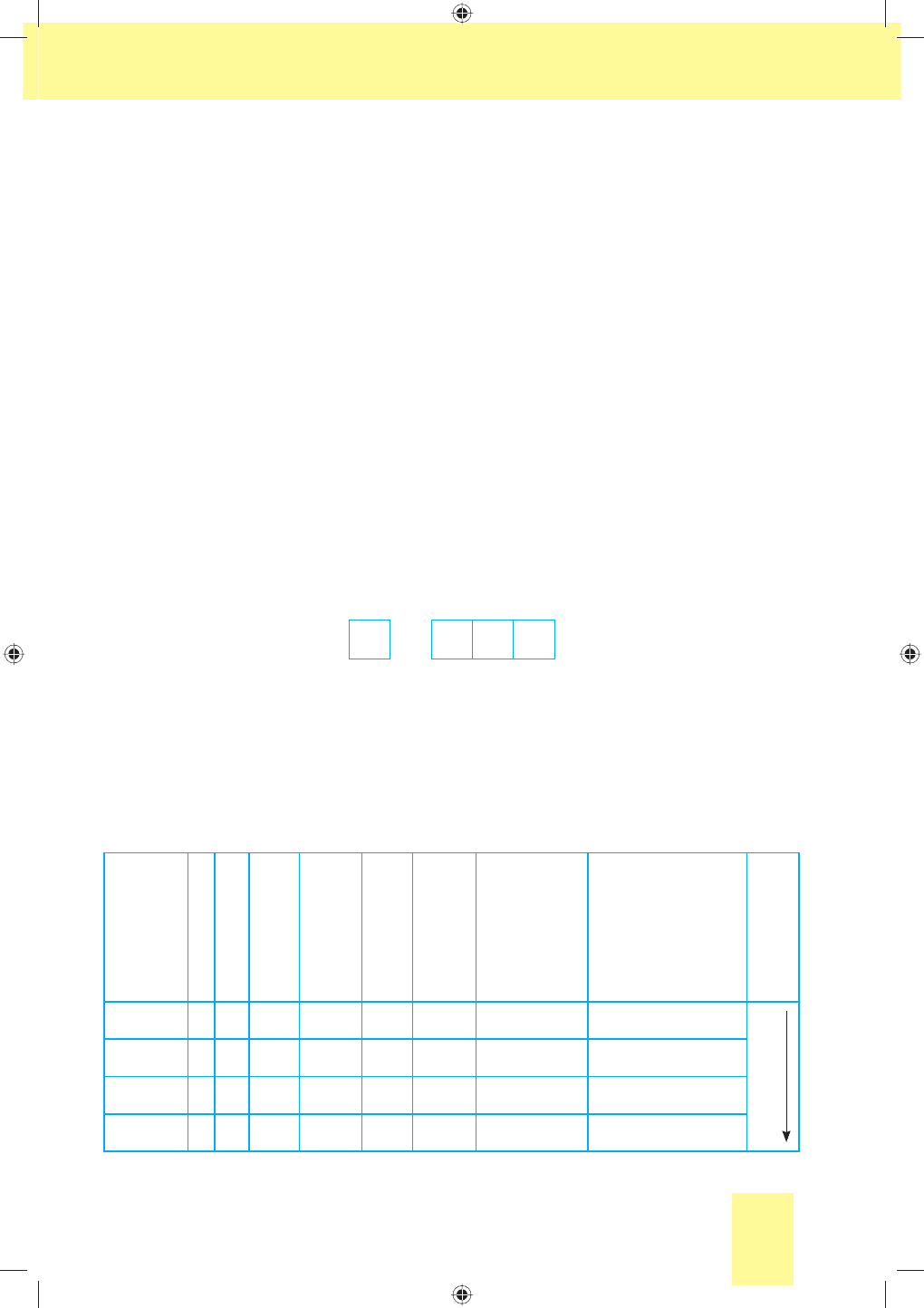
Як відомо, хімічні елементи VІІA групи періодичної системи Флуор
F, Хлор Cl, Бром Br, Іод I й Астат At називаються галогенами. Свою на-
зву галогени (у перекладі з грец. — «ті, що народжують солі») одержа-
ли завдяки здатності утворювати з металічними елементами солі, на-
приклад натрій хлорид NaCl, калій бромід KBr, кальцій флуорид CaF
2
,
алюміній іодид AlI
3
.
а
б
в
Мал. 22. Галогени:
а— фтор; б— хлор;
в— бром; г— йод;
ґ— астат
г ґ
Назви Хлору, Брому та Іоду пов’язані з властивостями їх простих
речовин (мал. 22): Хлор — за кольором (зеленкувато-жовтий), Бром —
із запахом (смердючий), Іод — за кольором пари (фіалковий). Назва
Флуору походить від латинського слова fluidus — плинний, оскіль-
ки добавки мінералу флюориту CaF
2
до металічних руд полегшують
їх плавлення.
Назва радіоактивного елемента Астат грецькою мовою
означає «нестійкий».
Chemistry10kl_v17j.indd 74Chemistry10kl_v17j.indd 74 06.01.2011 15:05:3906.01.2011 15:05:39
75
Неметалічні елементи та їх сполуки
§ 19. Загальна характеристика
Усвідомлення змісту цього параграфа дає змогу:
6 характеризувати і порівнювати хімічні елементи VІІА групи за
місцем у періодичній системі та електронною будовою їх атомів, по-
ширеність у природі;
6 оцінювати біологічну роль галогенів.
Електронна будова і властивості атомів елементів відображено у
табл. 4. Галогени у періодичній системі розташовані наприкінці кож-
ного періоду, крім першого, перед інертними елементами. Тому серед
елементів кожного періоду вони мають найбільший заряд ядра, най-
менший атомний радіус і, як наслідок, найвище значення електронега-
тивності, неметалічний характер властивостей.
Поясніть, чому в галогенів найменші атомні радіуси серед хімічних
елементів кожного періоду.
В атомів галогенів подібна будова зовнішнього електронного шару,
на якому сім валентних електронів — ns
2
np
5
, один з яких неспарений,
що відповідає графічно-електронній формулі:
ns np
↑↓ ↑↓ ↓↑ ↑
де n — номер періоду галогена.
Наявність одного неспареного електрона і нестача одного електро-
на до завершення стійкої восьмиелектронної оболонки зумовлюють
характерні для всіх галогенів валентність І та ступені окиснення –1 і,
крім Флуору, +1.
Т а б л и ц я 4
Загальна характеристика хімічних елементів VІІA групи
Хімічний
елемент
Період
Атомний номер
Відносна
атомна маса
Радіус
атома, нм
Електро-
негативність
Валентні
електрони
Валентність
Ступені
окиснення
Неметалічні
властивості
Флуор F 2 9 19 0,064 4,0 2s
2
2p
5
І –1, 0
Послаблюються
Хлор Cl 3 17 35,5 0,099 3,16 3s
2
3p
5
І, ІІІ, V, VII –1,0,+1,+3,+5,+7
Бром Br 4 35 80 0,114 2,96 4s
2
4p
5
І, ІІІ, V, VII –1,0,+1,+3,+5,+7
Іод I 5 53 127 0,133 2,66 5s
2
5p
5
І, ІІІ, V, VII –1,0,+1,+3,+5,+7
Chemistry10kl_v17j.indd 75Chemistry10kl_v17j.indd 75 06.01.2011 15:05:3906.01.2011 15:05:39
76
Розділ 2
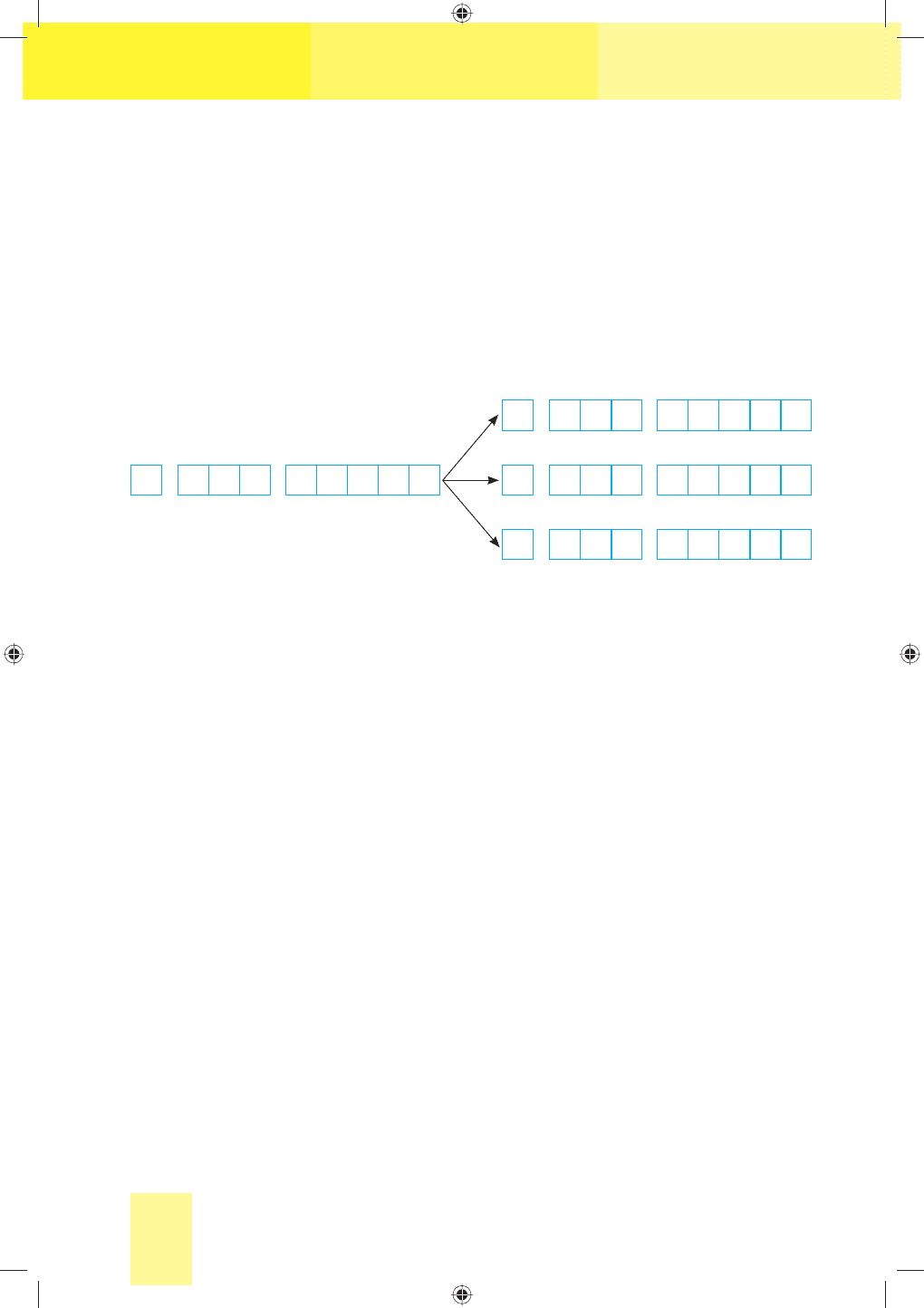
Але атоми галогенів, крім Флуору, здатні виявляти й інші валент-
ності та ступені окиснення, оскільки на зовнішньому енергетичному
рівні їх атомів є вакантний d-підрівень із п’ятьма електронними орбі-
талями, на які в збудженому стані атома можуть переходити валентні
електрони з s- та р-підрівнів (схема 2). Утворення неспареними електро-
нами відповідної кількості ковалентних зв’язків зумовлює виявлення
відповідних валентностей ІІІ, V, VІІ і ступенів окиснення +3, +5, +7.
С х е м а 2
Електронна конфігурація валентних електронів атомів
галогенів в основному і збудженому станах
ns np nd
ns np nd ns np nd
Основний стан ns np nd
Збуджений стан
↑↓ ↑↓
↑↓
↑
↑↓ ↑↓ ↑ ↑ ↑ ↑
↑↓ ↑ ↑
↑ ↑ ↑
↑ ↑
↑
↑ ↑ ↑
Проте зовнішній енергетичний рівень атома Флуору як елемента
другого періоду складається тільки з 2s- та 2р-підрівнів, на яких віль-
них орбіталей немає. Тому розпаровування електронних пар неможли-
ве, і Флуор у сполуках одновалентний і як найелектронегативніший
елемент не виявляє позитивних ступенів окиснення.
Поясніть, чому Флуор — найелектронегативніший хімічний елемент.
Отже, для всіх галогенів найнижчим ступенем окиснення є –1, а
найвищим, крім Флуору, +7.
Подібність електронної будови атомів галогенів зумовлює подібність
їх властивостей: усі вони є активними неметалічними елементами. Але
при переході від Флуору до Іоду зі зростанням розмірів атомів немета-
лічні властивості закономірно послаблюються.
Флуор та Іод існують у природі лише у вигляді одного ізотопу, Хлор
трапляється у вигляді двох ізотопів —
35
Сl і
37
Сl. Легкий ізотоп є більш
поширеним (атомна частка 75,53 %).
Доведіть розрахунками, що атомна частка
35
Сl дорівнює 75,53 %.
Прості речовини галогенів є неметалами. Їх назви збігаються з на-
звами відповідних елементів, але пишуться з маленької літери. Винят-
ком є назви простих речовин Флуору (фтор) та Іоду (йод). Молекули
галогенів складаються з двох атомів: F
2
, Cl
2
, Br
2
, I
2
.
Як неметалічні елементи галогени, крім Флуору, утворюють кис-
лотні оксиди Е
2
О
х
, де х — валентність галогену. Сполука Флуору з
Оксигеном OF
2
є флуоридом. Відповідні оксидам гідроксиди є оксиге-
Chemistry10kl_v17j.indd 76Chemistry10kl_v17j.indd 76 06.01.2011 15:05:3906.01.2011 15:05:39

77
Неметалічні елементи та їх сполуки
новмісними кислотами. Леткі сполуки галогенів з Гідрогеном нази-
ваються гідрогенгалогенідами, або галогеноводнями, і мають загальну
формулу НЕ. Їх водні розчини є безоксигеновими кислотами. Утворені
галогенами солі називаються відповідно флуоридами, хлоридами, бро-
мідами, іодидами.
Поширеність у природі. У зв’язку з великою активністю галогени
існують у природі лише у складі солей (мал. 23). Флуор у земній корі
найчастіше трапляється у вигляді флюориту, або плавикового шпа-
ту CaF
2
і кріоліту AlF
3
· 3NaF. Основними мінералами Хлору є галіт,
або кам’яна сіль NaCl, сильвін KCl, сильвініт NaCl · KCl, карналіт
KCl · MgCl
2
· 6H
2
O. Натрій хлорид у величезній кількості розчинений у
водах морів, океанів, деяких озер. Великі поклади кам’яної солі є біля
Артемівська в Донбасі, сильвініту — поблизу міст Калуш і Стебник у
Західній Україні.
а б в
г ґ д
Мал. 23. Природні сполуки Флуору: а— флюорит, або польовий шпат, б— кріоліт;
Хлору: в— галіт (кам’яна сіль), г— сильвін, ґ— сильвініт, д— карналіт
Бром та Іод — малорозповсюджені у земній корі елементи, найбіль-
ше їх у морській воді та водоростях.
Біологічна роль. Галогени з ґрунту засвоюються рослинами. З во-
дою та кормом вони потрапляють до організму тварин, з харчовими
продуктами і водою надходять в організм людини.
Флуор бере участь у забезпеченні нормального стану зубів, кісток,
волосся; має вплив на імунну систему, функцію залоз внутрішньої
Chemistry10kl_v17j.indd 77Chemistry10kl_v17j.indd 77 06.01.2011 15:05:3906.01.2011 15:05:39

78
Розділ 2
секреції. Нестача Флуору у питній воді та харчових продуктах вияв-
ляється в людини через карієс (руйнування твердої частини зубів),
його надлишок пошкоджує зубну емаль. Оптимальним є вміст Флу-
ору в питній воді близько 1 мг/л. Добова потреба людини у Флуорі
становить у середньому 2—3 мг і задовольняється в основному пит-
ною водою.
Хлор — це компонент тканин рослин, тварин і людини. У складі на-
трій хлориду бере участь у формуванні плазми крові. Хлоридна кисло-
та у шлунковому соку (0,4—0,5 %) забезпечує необхідну для перетрав-
лення їжі кислотність, запобігає розвитку в шлунку процесів гниття та
бродіння, впливу хвороботворних бактерій. Добова потреба людини у
Хлорі становить у середньому 3 г.
Іод у складі біологічно активних речовин бере участь в обміні ре-
човин. При дефіциті в організмі Іоду розвивається базедова хвороба і,
як наслідок, тяжке захворювання — зоб. Для людини добова потреба в
Іоді становить приблизно 0,2 г.
Бром разом з Іодом впливають на функцію щитоподібної залози, у
вигляді бромідної кислоти разом із хлоридною — на кислотність шлун-
кового соку.
Потребу в галогенах забезпечують різноманітні харчові продукти
(овочі, овочеві консерви, варення, чай, крупи, м’ясо, риба, курячі яйця
тощо).
!
Коротко про головне
Галогени (F, Cl, Br, І, At) — типові неметалічні елементи VІІА
групи періодичної системи. Електронна конфігурація атомів гало-
генів ns
2
np
5
, у сполуках виявляють ступені окиснення –1 та валент-
ність І, а також (крім F) непарні позитивні ступені окиснення +1,
+3, +5, +7 і валентності ІІІ, V, VІІ. Неметалічні властивості галоге-
нів зі збільшенням атомного номера поступово послаблюються.
Галогени утворюють прості речовини, які є неметалами; кис-
лотні оксиди (крім Флуору) і відповідні їм оксигеновмісні кис-
лоти; галогеноводні, водні розчини яких є безоксигеновими
кислотами; солі.
Галогени у природі існують лише в зв’язаному стані. Мають ве-
лике значення для функціонування живих організмів.
?
Контрольні завдання
1. Галоген, який має: а) найбільший атомний радіус; б) найбільшу
електронегативність, — це
А Br; Б Cl; В F; Г I.
2. Електронна конфігурація: а) атома Хлору; б) хлорид-іона Cl
–
— це
А 1s
2
2s
2
2p
6
3s
2
; В 1s
2
2s
2
2p
6
3s
2
3p
4
;
Б 1s
2
2s
2
2p
6
3s
2
3p
5
; Г 1s
2
2s
2
2p
6
3s
2
3p
6
.
Chemistry10kl_v17j.indd 78Chemistry10kl_v17j.indd 78 06.01.2011 15:05:4006.01.2011 15:05:40

79
Неметалічні елементи та їх сполуки
3. Поясніть, чому галогени
а) належать до неметалічних елементів;
б) мають ступінь окиснення –1, а також, крім Флуору, позитивні непар-
ні ступені окиснення;
в) у природі трапляються лише в зв’язаному стані.
4. Ізотопи Хлору різняться між собою
А числом протонів;
Б числом нейтронів;
В числом електронів.
5. Кожні 100 г маси тіла людини містять у середньому 70 мг Хлору, 50 мг
Іоду, 3,7 мг Флуору, 0,7 мг Брому. Обчисліть масу та кількість атомів
кожного з галогенів у вашому організмі.
6
*
. Вода Сакського озера (Крим) містить до 1 % магній броміду. На основі
цієї інформації складіть 1—2 завдання.
§ 20. Хлор. Фізичні властивості. Добування
Усвідомлення змісту цього параграфа дає змогу:
6 характеризувати фізичні властивості та способи добування хлору;
6 складати рівняння, схеми електронного балансу відповідних хіміч-
них реакцій.
Хлор уперше добув шведський хімік К. Шеєле (1774). Однак уче-
ний помилявся щодо природи добутого газу. У 1810 р. англійський уче-
ний Г. Деві висловив думку, що цей газ є простою речовиною. Через
два роки французький хімік і фізик Ж.-Л. Гей-Люссак дав цьому газу
сучасну назву хлор.
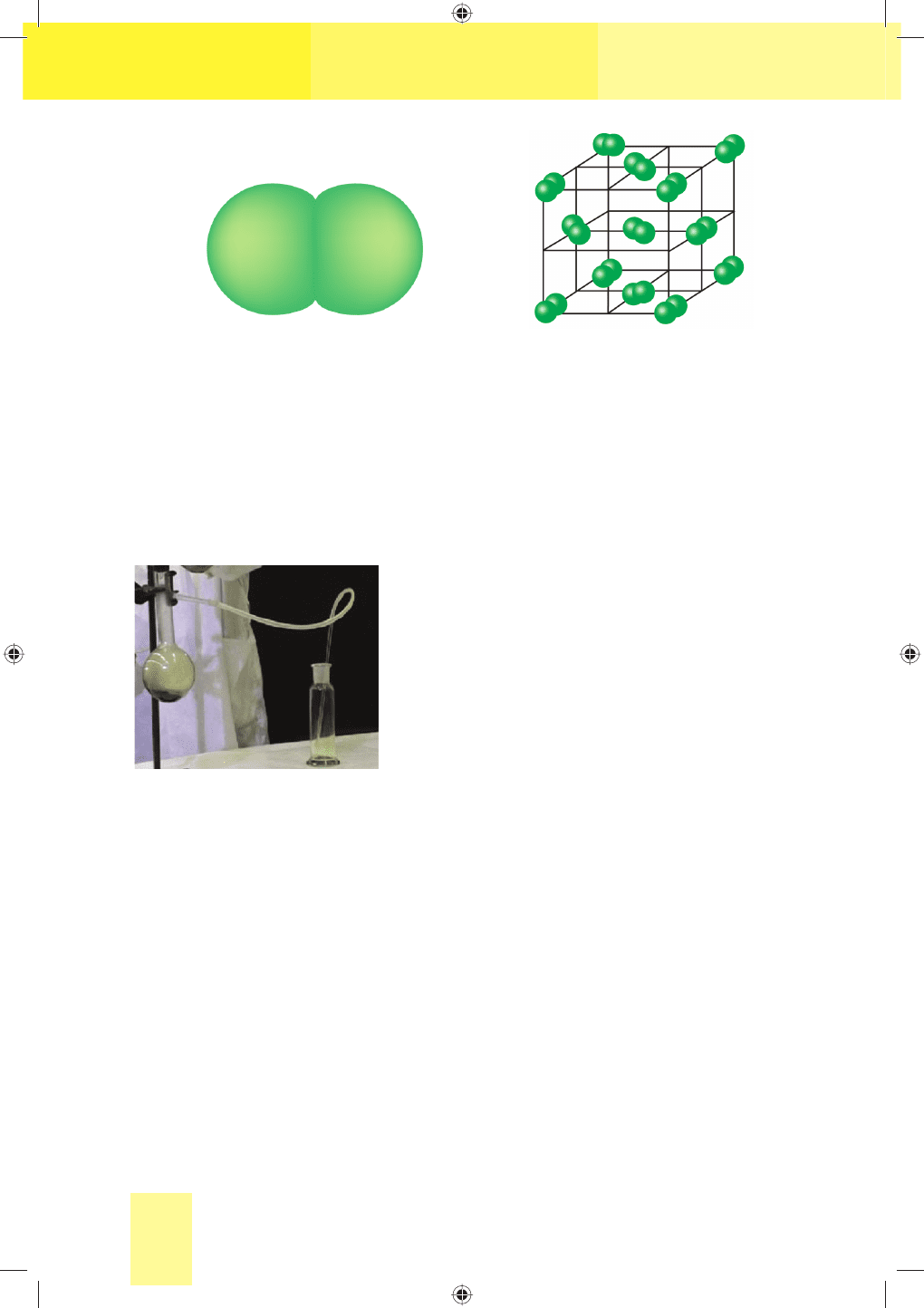
Фізичні властивості. Хлор складається з двохатомних неполяр-
них молекул, які в твердому стані утворюють молекулярну криста-
лічну ґратку (мал. 24). Тому хлор леткий, неелектропровідний, має
низькі температури плавлення і кипіння. За стандартних умов —
це газ зеленкувато-
жовтого кольору (див.
мал. 22, б), отруйний,
має різкий запах,
який нагадує запах
«хлорки». При охо-
лодженні до –34 °С
хлор перетворюєть-
ся на рідину жовто-
зеленкуватого ко-
льору, а при –101 °С
переходить у твердий
стан. Хлор у 2,5 раза
важчий за повітря.
К. Шеєле
(1742— 1786)
Ж.-Л. Гей-Люссак
(1778— 1850)
Chemistry10kl_v17j.indd 79Chemistry10kl_v17j.indd 79 06.01.2011 15:05:4006.01.2011 15:05:40
80
Розділ 2
Порівняно з воднем і киснем хлор знач но краще розчиняється у
воді: за н.у. в 100 об’ємах води розчиняється 460 об’ємів хлору, що
пояснюється хімічною взаємо дією з водою. Водний розчин хлору на-
зивають хлорною водою. Її формула Сl
2
. Свіжоприготовлена хлорна
вода має забарвлення й запах хлору.
Вдихання невеликої кількості хлору
спричиняє подразнення дихальних шля-
хів, а значної — призводить до смерті від
задухи. Поводитися з хлором треба дуже
обережно і роботи з ним виконувати тіль-
ки у витяжній шафі!
При отруєнні хлором слід вдихати пару
суміші спирту і 10 %-вого розчину амоніа-
ку (однакових об’ємів).
Добування. У лабораторії хлор звичай-
но добувають взаємодією концентрованої
хлоридної кислоти з манган(ІV) оксидом
MnO
2
при нагріванні (мал. 25):
4НCl + MnO
2
=
t
MnCl
2
+ Сl
2
↑ + 2Н
2
О
Реакція з калій перманганатом відбуватиметься без нагрівання:
16НCl + 2КMnO
4
= 2MnCl
2
+ 2КCl + 5Сl
2
↑ + 8Н
2
О
Крім сполук Мангану, для одержання хлору використовують берто-
летову сіль КСlО
3
, плюмбум(ІV) оксид РbО
2
тощо. Збирають хлор витіс-
ненням повітря у посудину дном донизу.
У промисловості хлор добувають електролізом розплаву або кон-
центрованого розчину натрій хлориду:
ел. струм
2NaCl (розплав) → 2Na + Cl
2
↑
ел. струм
2NaCl (розчин) + 2Н
2
О → Cl
2
↑ + Н
2
↑ + 2NaОН
а б
Мал. 24. Моделі молекули (а) та кристалічної ґратки (б) хлору
Мал. 25. Добування
ізбирання хлору
Chemistry10kl_v17j.indd 80Chemistry10kl_v17j.indd 80 06.01.2011 15:05:4006.01.2011 15:05:40
