Албертс Б., Брей Д. и др. Молекулярная биология клетки. Том 1
Подождите немного. Документ загружается.


121
Таблица 3-3. Соотношение между изменением свободной энергии и константой равновесия реакции (К)
К
АБ
=
[A][БA
][
(л/моль)
Свободная энергия
АБ – Свободная энергия А + Б
(ккал/моль)
10
5
-7,1
10
4
-5,7
10
3
-4,3
10
2
-2,8
10 -1,4
1 0
10
-1
1,4
10
-2
2,8
10
-3
4,3
10
-4
5,7
10
-5
7,1
Если реакция А + Б
АБ достигла равновесия, то относительные количества компонентов А, Б и АБ будут зависеть от разницы в их
свободной энергии, AG°. Приведенные выше значения рассчитаны для 37°С с помощью уравнения
или
где ∆G
0
выражена в килокалориях на моль и представляет собой изменение свободной энергии данной реакции в стандартных условиях
(концентрация всех компонентов составляет 1,0 моль/л).
если две взаимодействующие молекулы достаточно сблизились, они образуют множественные слабые связи, которые сохраняются до тех пор, пока
случайное тепловое движение не вызовет снова диссоциацию молекул.
В общем случае, чем сильнее связывание молекул в комплексе, тем меньше скорость диссоциации. В предельном случае, когда энергия
образовавшихся связей пренебрежимо мала по сравнению с энергией теплового движения, две молекулы диссоциируют сразу же после
столкновения. В другом предельном случае энергия связей столь велика, что диссоциации практически не происходит. Таким образом, величина
энергии взаимодействия - полезный показатель специфичности процесса узнавания.
Чтобы разобраться, как измеряют энергию взаимодействия, рассмотрим реакцию связывания молекулы А с молекулой Б. Эта реакция
будет протекать до тех пор, пока не достигнет положения равновесия, при котором скорости образующихся и диссоциирующих комплексов равны.
Используя равновесные концентрации молекул А, Б и комплекса АБ, можно определить константу равновесия К реакции (рис. 3-7). Эту
константу иногда называют константой сродства и обычно используют в качестве меры силы связывания между двумя молекулами: чем сильнее
связывание, тем выше значение константы сродства.
Константа равновесия реакции соединения двух молекул непосредственно связана с изменением в этой реакции стандартной свободной
энергии ∆ G°. Используя соответствующее уравнение (табл. 3-3), можно вычислить
∆
G° для ряда значений К. Константы сродства реакций
простого связывания в биологических системах обычно находятся в диапазоне от 10
3
до 10
12
л/моль, что соответствует энергиям связывания от 4 до
17 ккал/моль, или возникновению в среднем от 4 до 17 водородных связей.
Самые сильные взаимодействия имеют место тогда, когда биологическая функция требует, чтобы две макромолекулы оставались тесно
связанными в течение долгого времени, например, когда белок регуляторного гена связывается с ДНК, выключая ген (см. разд. 10.2.1). Самые
слабые взаимодействия происходят, когда функция требует быстрого изменения в структуре комплекса, например, когда два взаимодействующих
белка меняют партнеров при движениях белковой машины (см. разд. 1.3.1).
3.1.5. Атомы и молекулы находятся в постоянном движении [6]
Химические реакции в клетке происходят поразительно быстро. Например, типичная молекула фермента катализирует ~ 1000 реакций в
секунду, а для некоторых ферментов эта величина может достигать более 10
6
реакций в секунду. Поскольку для каждой реакции требуется
отдельное столкновение между ферментом и молекулой субстрата, такие скорости возможны только потому, что молекулы быстро перемещаются.
Существует три типа молекулярных движений: 1) перемещение молекулы с одного места на другое (трансляционное движение), 2) быстрые
колебания взад и вперед ковалентно связанных атомов друг относительно друга (вибрации) и 3) вращения. Все эти движения важны для приведения
в контакт взаимодействующих молекул.
Скорости движения молекул могут быть измерены с помощью многих пектроскопических методов, которые показывают, например, что
большой глобулярный белок постоянно находится в движении, вращаясь вокруг оси примерно миллион раз в секунду. Скорости диффузионных
столкновений, обусловленных трансляционными движениями, пропорциональны концентрации диффузионных молекул. На-

122
пример, если типичная внутриклеточная концентрация -1 мМ, то каждый участок белковой молекулы будет испытывать около 10
6
случайных
столкновений в секунду с молекулами АТР; если концентрация на порядок ниже, число столкновений упадет до 10
5
в секунду и т.д.
Если две молекулы столкнулись и находятся в правильной взаимной ориентации, химическая реакция между ними может произойти
очень быстро. Узнав о том, как быстро движутся и реагируют молекулы, мы не должны удивляться наблюдаемой скорости ферментативного
катализа.
3.1.6. Процесс молекулярного узнавания не может быть совершенно безошибочным [7]
Все молекулы обладают энергией: кинетической энергией трансляционных движений, вибраций и вращений и потенциальной энергией,
запасенной в электронных оболочках. Благодаря молекулярным столкновениям эта энергия случайным образом распределяется по разным атомам,
так что, хотя уровень энергии большинства атомов близок к среднему, небольшая часть атомов будет обладать значительной энергией.
Благоприятные конформации, или состояния молекул, соответствуют минимуму свободной энергии (см. разд. 2.4.1), но при сильных столкновениях
возникают высокие состояния энергии. Зная температуру, можно рассчитать вероятность того, что атом или молекула окажутся в этом
энергетическом состоянии (см. табл. 3-3). Вероятность высокого энергетического состояния становится меньше вероятности низкого
энергетического состояния по мере того, как увеличивается разность их свободных энергий. Она, однако, обращается в нуль лишь тогда, когда эта
разность значений энергий становится бесконечной.
Из-за элемента случайности при молекулярных взаимодействиях время от времени происходит небольшое число «побочных реакций».
Поэтому клетка часто ошибается. Иногда происходят даже энергетически невыгодные реакции. Например, два атома, связанные ковалентно, при
особо сильном столкновении могут разъединиться. Аналогичным образом специфичность фермента в отношении субстрата не может быть
абсолютной, так как способность отличить одну молекулу от другой не может быть совершенной. Ошибки могли бы быть полностью устранены
лишь в том случае, если бы в клетке развились механизмы с бесконечно большой разницей энергий альтернативных состояний. Поскольку это
невозможно, клетки вынуждены мириться с определенным уровнем ошибок и использовать различные репарирующие реакции, чтобы исправлять
те из них, которые являются наиболее опасными.
С другой стороны, как мы уже знаем, ошибки играют важную роль в живом мире. Если бы не случайные ошибки при синтезе ДНК, вряд
ли эволюция была возможной (см. разд. 3.2.4).
Заключение
В последовательности субъединиц макромолекул заключена информация, і определяющая пространственную конфигурацию их
поверхности. Именно она используется для узнавания друг друга разными молекулами и разными частями одной и той же молекулы посредством
слабых нековалентных связей. Молекулы находятся в постоянном быстром движении; если при соударении в результате случайной диффузии,
происходит узнавание, они связываются между собой с силой, которую можно выразить с помощью константы равновесия. Поскольку узнавание
может быть безошибочным лишь при увеличении энергии взаимодействия до бесконечно

123
большой величины, живые клетки постоянно допускают ошибки. При необходимости ошибки исправляются с помощью специальных механизмов
репарации.
3.2. Нуклеиновые кислоты [8]
3.2.1. Гены состоят из ДНК [9]
Еще в те времена, когда человек начал сеять культурные растения и разводить домашних животных, было очевидно, что каждое
зернышко или оплодотворенная яйцеклетка должны содержать скрытый план или схему развития организма. Уже в наше время возникла генетика -
наука, в основу которой легли представления о генах - невидимых, содержащих информацию элементах, равномерно распределяемых между двумя
дочерними клетками при каждом клеточном делении. Чтобы передать дочерним клеткам полный набор генов, перед делением клетка должна
сделать копию этих генов. Гены спермия и яйцеклетки передают наследственную информацию от поколения к поколению.
В наследовании биологических признаков используются совокупности атомов, подчиняющихся физическим и химическим законам.
Другими словами, гены должны состоять из молекул. Вначале трудно было представить себе природу этих молекул. Что это за молекула, которая
могла бы храниться в клетке, направлять процесс развития организма и быть в то же время способной к точной и практически неограниченной
репликации?
К концу XIX столетия биологи обнаружили, что хромосомы (которые становятся различимыми в ядре в начале деления) являются
носителями наследственной информации. Но данные о том, что веществом, из которого состоят гены, является дезоксирибонуклеиновая кислота
(ДНК) хромосом, были получены значительно позже при изучении бактерий. В 1944 г. было установлено, что очищенная ДНК одного
бактериального штамма способна передавать наследственные свойства этого штамма другому штамму, несколько отличному от первого. Это
открытие оказалось слишком неожиданным и не получило широкого признания до начала 50-х годов, так как считалось, что лишь белки обладают
достаточно сложной конформацией, чтобы быть носителями заключенной в генах информации. Сегодня представление о том, что именно ДНК
является носителем генетической информации (хранящейся в ее длинных полинуклеотидных цепях), столь прочно вошло в биологическое
мышление, что порой трудно осознать, какой огромный пробел в наших знаниях заполнило это представление.
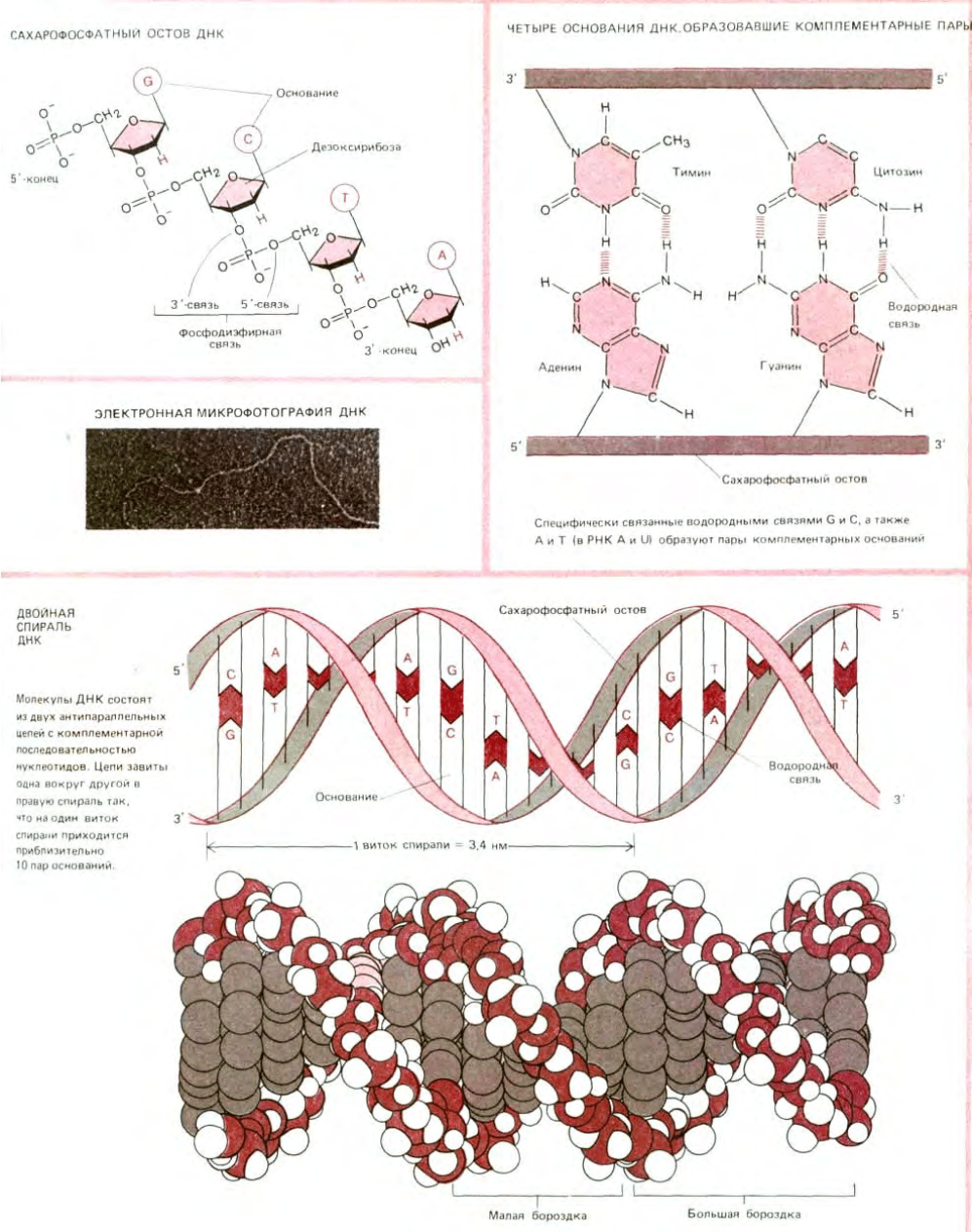
3.2.2. Молекулы ДНК состоят из двух длинных комплементарных цепей, удерживаемых вместе благодаря
спариванию оснований [10]
Учитывая простое химическое строение ДНК, легко понять, почему генетики с таким трудом признали в ней носителя наследственности.
ДНК - это длинный неразветвленный полимер, состоящий всего из четырех субъединиц-дезоксирибонуклеотидов, азотистые основания которых
представлены аденином (А), цитозином (С), гуанином (G) и тимином (Т). Нуклеотиды связаны между собой ковалентными фосфодиэфирными
связями, соединяющими 5'-атом углерода одного остатка с 3'-атомом углерода следующего остатка (схема 2-6). Основания четырех типов
«нанизаны» на сахарфосфатную цепь наподобие четырех разных типов бусинок, надетых на одну нитку.
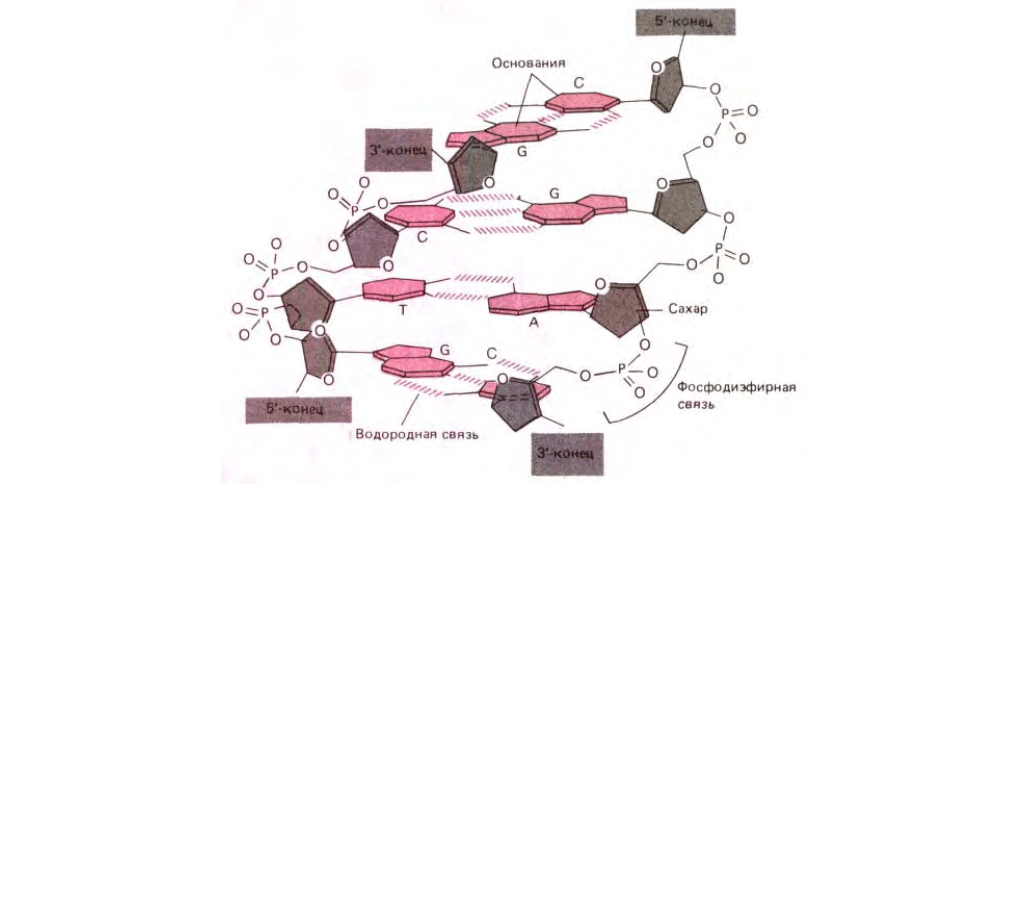
124
Рис. 3-8. Короткий участок двойной спирали ДНК. Показаны четыре пары комплементарных оснований (цветные) и дезоксирибоза (серая).
Следует обратить внимание, что две цепи ДНК закручены в противоположных направлениях и что каждая пара оснований удерживается вместе
либо двумя, либо тремя водородными связями (см. также схему 3-2).
Как же может длинная полинуклеотидная цепь кодировать программу развития целого организма или даже одной клетки? И как эта
программа передается от одного поколения клеток к другому? Ответ заключен в пространственной структуре молекулы ДНК.
Полученные в начале 50-х годов данные рентгеноструктурного анализа ДНК указывали на то, что молекула ДНК имеет форму спирали,
состоящей из двух цепей. Спиральное строение ДНК не вызвало удивления, поскольку, как мы уже убедились, спирализация - частое явление для
полимеров, состоящих из регулярно ориентированных субъединиц. Всех поразил тот факт, что ДНК состоит из двух цепей. В 1953 г. была
предложена модель структуры ДНК, удовлетворяющая рентгеноструктурным данным и связывающая воедино структуру и функцию ДНК (рис. 3-8
и схема 3-2).
Согласно этой модели, разработанной Уотсоном и Криком, все основания ДНК расположены внутри двойной спирали, а
сахарофосфатный остов - снаружи. Отсюда следует, что основания одной цепи должны быть очень сильно сближены с основаниями другой цепи.
Это предположение требовало наличия специфического связывания между большим пуриновым основанием (А или G, каждое из которых имеет
двойной гетероцикл) одной цепи и меньшим по размеру пиримидиновым основанием (Т или С с одинарным гетероциклом) другой цепи.
И данные ранних биохимических опытов, и выводы из построенной модели приводили к заключению, что между А и Т и между G и С
(так называемые пары оснований Уотсона и Крика) происходит комплементарное спаривание. Биохимические анализы препаратов ДНК,
выделенных из разных видов, показали, что, хотя нуклеотидный состав ДНК широко варьирует (например, содержание А у разных видов бактерий
колеблется от 13 до 36%), наблюдается общая закономерность: количество G всегда равно количеству С и количество А-количеству Т. Построенная
модель показала, что число эффективных водородных связей, которые могут образоваться между G и С или между А и Т будет в этом случае
больше, чем при любой другой комбинации. Таким образом, двухспиральная модель ДНК изящно объяснила количественные биохимические
результаты.

125
3.2.3. Структура ДНК дает ключ к пониманию механизмов наследственности [11]
Биологическая информация записана в гене в такой форме, что она может точно копироваться и передаваться клеткам-потомкам.
Огромное значение расшифровки структуры ДНК состоит в том, что предложенная Уотсоном и Криком модель позволила сформулировать общие
принципы важнейшего процесса передачи генетической информации. Поскольку каждая цепь содержит последовательность нуклеотидов, в
точности комплементарную последовательности цепи-партнера, то на деле обе цепи несут одну и ту же генетическую информацию. Если
обозначить две цепи А и А', то цепь А служит шаблоном, или матрицей, для образования новой цепи А', а цепь А' может играть ту же роль в
образовании новой цепи А. Таким образом, генетическая информация может копироваться при разделении цепей А и А', что позволяет каждой из
них служить матрицей для образования нового комплементарного партнера.
Уже сам по себе механизм комплементарного копирования указывает, что наследственная информация ДНК записана в линейной
последовательности нуклеотидов. Каждый нуклеотид - А, G, Т или С - можно рассматривать как букву в простом четырехбуквенном алфавите,
который используется для написания биологических инструкций в виде линейной «телеграфной ленты». Животные разных видов отличаются друг
от друга, потому что молекулы ДНК их клеток имеют различную последовательность нуклеотидов и, следовательно, различное информационное
содержание.
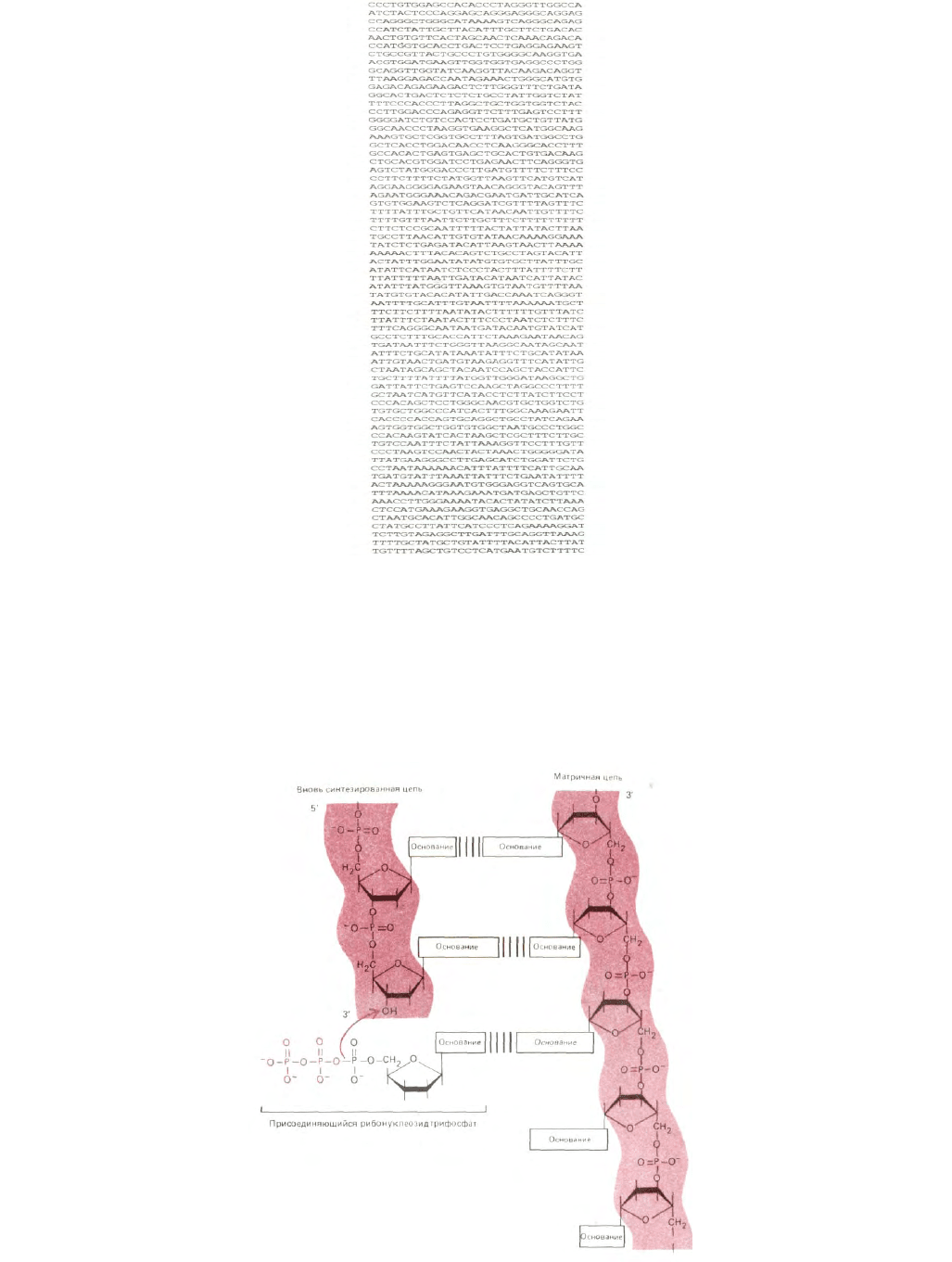
Число различных последовательностей ДНК, которые могут быть составлены из п нуклеотидов, равно 4
n
. Поэтому ДНК даже умеренной
длины способна обеспечить колоссальное биологическое разнообразие, а типичная клетка животного содержит ДНК длиной около метра (3·10
9
нуклеотидов). Записанный в виде линейной последовательности один необычно маленький ген человека занял бы четверть страницы текста (рис. 3-
9), а записанная в таком виде генетическая информация клетки человека представляла собой книгу в 500000 страниц!
Хотя принцип репликации генов прост и элегантен, реальный клеточный аппарат копирования сложен и включает в себя много
различных белков. Основная реакция показана на рис. 3-10. Фермент ДНК-полимераза катализирует присоединение дезоксирибонуклеотида к 3'-
концу цепи ДНК. Каждый нуклеотид вступает в реакцию в форме дезоксирибонуклеозидтрифосфата; высвобождение из этой активированной
формы пирофосфата и его последующий гидролиз обеспечивают энергией реакцию репликации ДНК и делают ее фактически необратимой (см.
разд. 5.3).
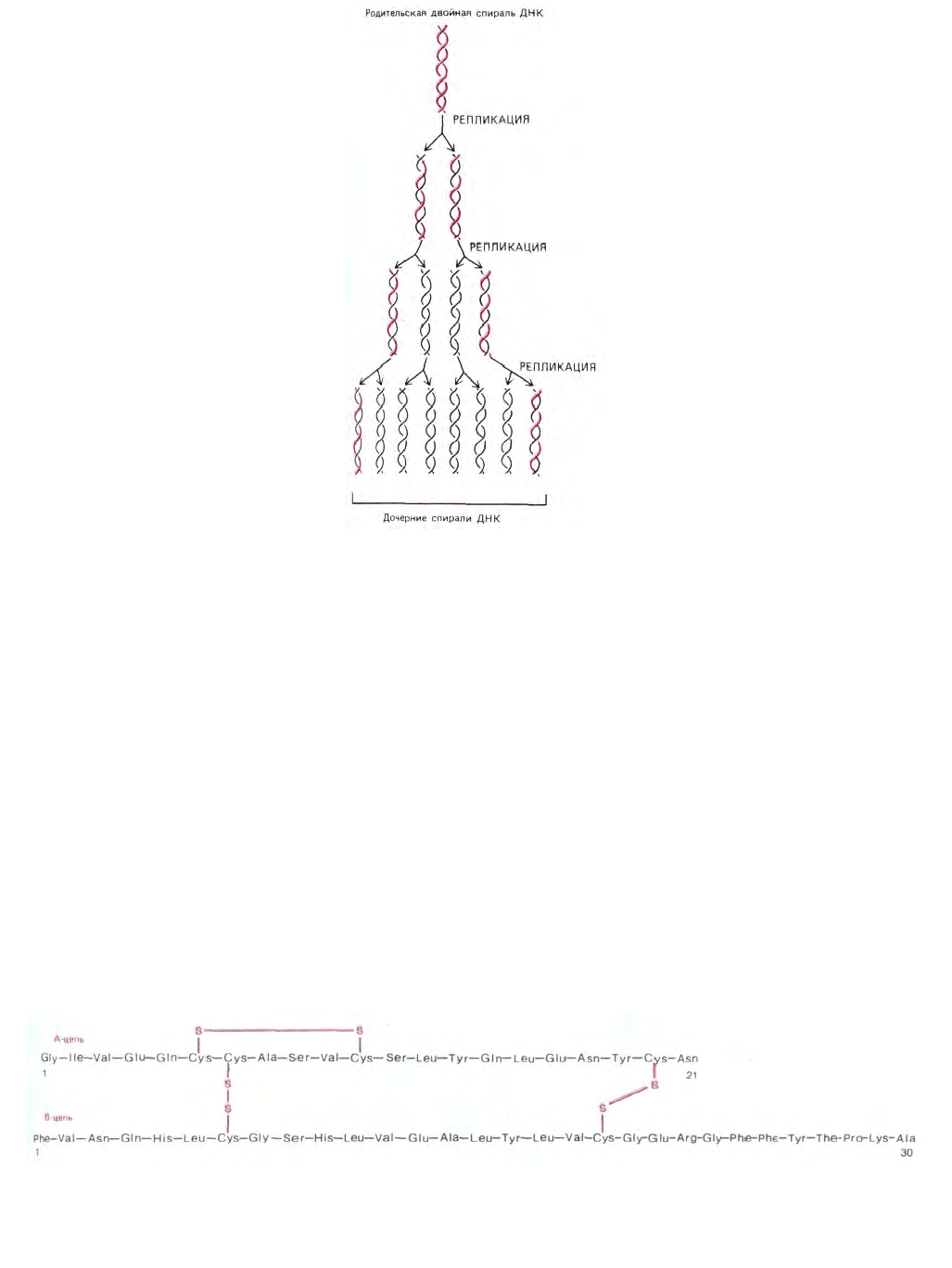
Репликация ДНК начинается с локального разделения двух комплементарных цепей. Затем каждая цепь используется в качестве матрицы
для образования новой молекулы ДНК путем последовательного присоединения дезоксирибонуклеотидов. Выбор каждого следующего нуклеотида
происходит на основе его способности образовывать комплементарную пару с очередным нуклеотидом родительской матричной цепи (рис. 3-10). В
результате генетическая информация полностью удваивается - в конце концов образуются две полные двойные спирали ДНК, каждая из которых
идентична родительской молекуле ДНК по последовательности нуклеотидов. Поскольку две цепи родительской молекулы в конце концов
оказываются в разных дочерних молекулах ДНК, механизм репликации называют «полуконсервативным» (рис. 3-11).
126
127
128
Рис. 3-9. Последовательность ДНК гена
β
-глобулина человека (одной из двух субъединиц молекулы гемоглобина, переносящего кислород в
крови взрослого человека). Показана только одна из двух цепей ДНК («кодирующая цепь»), вторая цепь имеет комплементарную
последовательность. Последовательность следует читать слева направо, строка за строкой, как обычный текст.
3.2.4. Ошибки репликации ДНК приводят к мутациям [12]
Наиболее впечатляющая особенность репликации ДНК - ее высокая точность. Для устранения неправильно расположенных нуклеотидов
используется несколько «корректорских» механизмов, в результате их работы последовательность нуклеотидов в молекуле ДНК копируется очень
точно (одна ошибка на 10
9
присоединенных нуклеотидов).
Но иногда, хотя и очень редко, репликативная машина пропускает несколько оснований или вставляет несколько лишних, включает Т
вместо С или А вместо G. Каждое такое изменение последовательности ДНК - генетическая ошибка, называемая мутацией. Такие ошибки будут
Рис. 3-10. Основная реакция при синтезе новых молекул ДНК -это добавление дезоксирибонуклеотида к 3'-концу растущей цепи. Показано, как
спаривание оснований поступающих дезоксирибонуклеотидов и исходной (матричной) цепи ДНК направляет образование дочерней цепи ДНК с
комплементарной последовательностью оснований.
129
Рис. 3-11. Полуконсервативная репликация ДНК. В каждом цикле репликации каждая из двух цепей ДНК используется в качестве матрицы для
образования новой комплементарной цепи. Поэтому на протяжении многих клеточных поколений исходные цепи сохраняют свою целостность.
воспроизводиться во всех последующих поколениях клеток, так как «плохие» последовательности ДНК копируются столь же успешно, как и
«хорошие». Последствия такой ошибки могут быть существенными, поскольку даже один измененный нуклеотид способен оказать большое
влияние на работу клетки, в зависимости от того, где эта мутация произошла.
В начале 40-х годов генетики окончательно доказали, что единицы последовательности, называемые генами, определяют структуру
индивидуальных белков. Поэтому мутация гена, вызванная изменением последовательности его ДНК, может инактивировать ключевой белок, и
клетка тогда погибнет. В результате измененная последовательность ДНК потеряется. Мутация может произойти в несущественном участке и не
будет иметь эффекта; такие мутации называют молчащими. Очень редко в результате мутации образуется ген с улучшенными или новыми
полезными функциями. В этих случаях несущий мутацию организм будет иметь преимущества и мутантный ген может в конце концов путем
естественного отбора заменить исходный ген в большей части популяции.
3.2.5. Последовательность нуклеотидов в гене определяет последовательность аминокислот в белке [13]
Химически ДНК относительно инертна. Содержащаяся в ней информация выражается опосредованно через другие молекулы: ДНК
направляет синтез специфических РНК и белковых молекул, которые и определяют химические и физические свойства клеток.
Примерно в то же время, когда биофизики с помощью дифракции рентгеновских лучей исследовали пространственную структуру ДНК,
биохимики интенсивно изучали химическое строение белков. Уже было известно, что белки - это цепи аминокислот, последовательно соединенных
пептидными связями; но лишь в начале 50-х годов, когда была определена последовательность аминокислот маленького белка инсулина (рис. 3-12),
было установлено, что каждый тип белка образует полипептидная цепь со строго определенной последовательностью аминокислот.
Подобно тому как для выяснения молекулярных основ генетики и наследственности решающую роль сыграла расшифровка структуры
ДНК, определение последовательности инсулина имело основополагающее значение для выяснения структуры и функций белков. Если инсулин
имеет определенную генетически детерминированную последовательность, то, видимо, то же относится и ко всем другим белкам. Более того,
можно предположить, что свойства того или иного белка должны зависеть от той конкретной последовательности, в которой расположены в этом
белке аминокислоты.
И ДНК, и белки образованы линейной последовательностью мономеров. В результате биохимического анализа белков - продуктов
мутантных генов - в конце концов было показано, что последовательность двух этих полимеров колинеарна: последовательность нуклеотидов
Рис. 3-12. Последовательность аминокислот инсулина крупного рогатого скота. Инсулин - маленький белок, состоящий из двух полипептидных
цепей, каждая из которых обладает уникальной, генетически детерминированной последовательностью аминокислот. Для обозначения
аминокислот использованы трехбуквенные символы, приведенные на схеме 2-5. Показаны дисульфидные (-S-S-) связи между остатками цистеина.
Изначально белок синтезируется как одна длинная полипептидная цепь (кодируемая одним геном), которая затем разделяется, давая две цепи (см.
рис. 3-48).
130
в участке ДНК, кодирующем белок, соответствует последовательности аминокислот в этом белке. Стало очевидным, что последовательность ДНК
содержит закодированную информацию о белковых последовательностях. Центральной проблемой молекулярной биологии стал вопрос о том, как
же клетка осуществляет такое биохимически сложное превращение, как перевод последовательности нуклеотидов ДНК в последовательность
аминокислот белка.
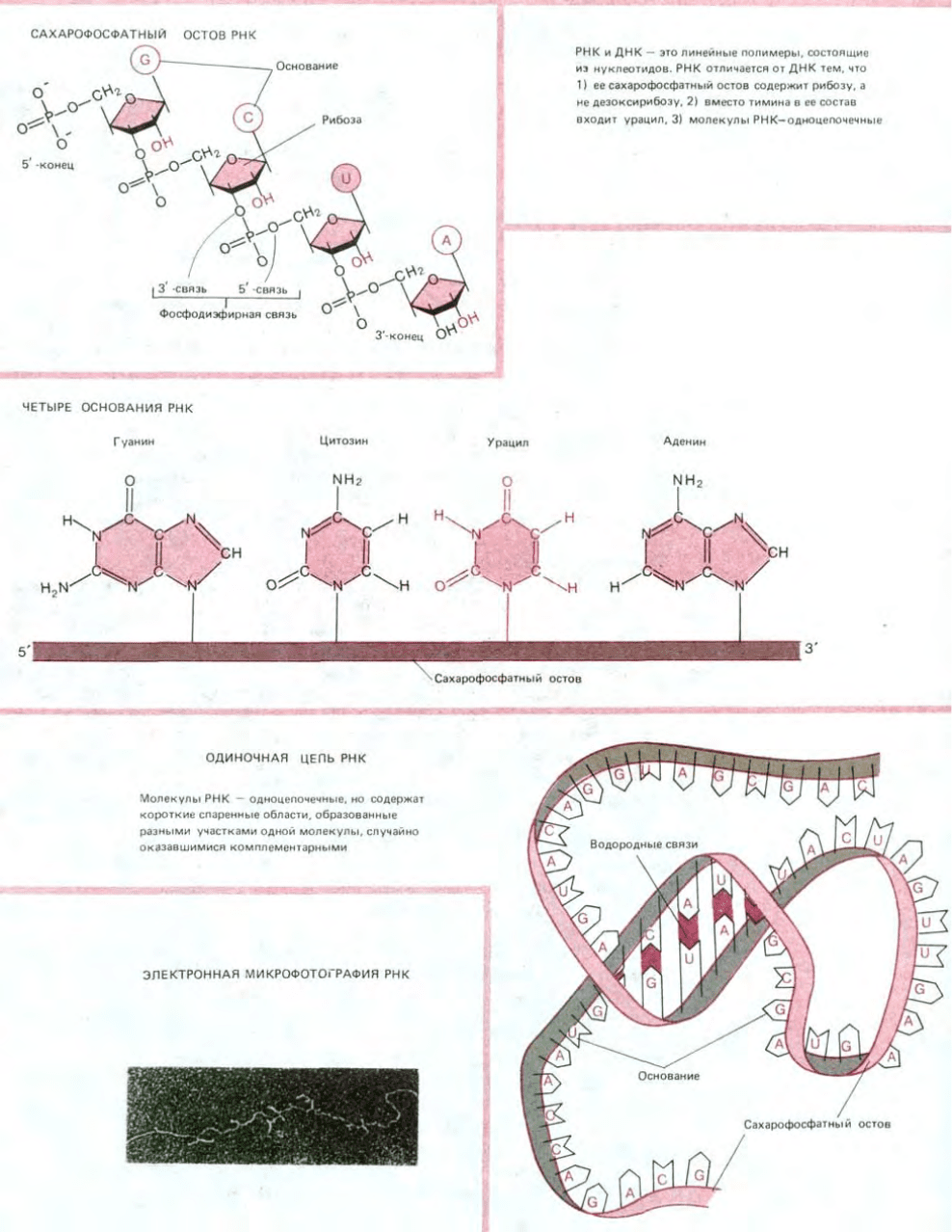
3.2.6. С последовательностей ДНК снимаются РНК-копии для синтеза белка [14]
При синтезе белка определенные участки ДНК, называемые генами, копируются в виде другого полинуклеотида - рибонуклеиновой
кислоты, или РНК, - отличающегося от ДНК как по химическому составу, так и по выполняемой функции. Подобно ДНК, РНК образована
линейной последовательностью нуклеотидов, но имеет два небольших химических отличия: 1) вместо дезоксирибозы сахарофосфатный остов
содержит сахар рибозу и 2) вместо основания тимина (Т) в РНК содержится близкородственное основание урацил (U) (см. рис. 3-6).
РНК сохраняет все информационное содержание той ДНК, копией которой она является, а также способность к спариванию
комплементарных оснований. Синтез молекул РНК называется транскрипцией ДНК; во многих отношениях он аналогичен репликации ДНК.
Одна из цепей ДНК служит матрицей, на которой испытывается способность очередных нуклеотидов к комплементарному спариванию. При
хорошем соответствии с ДНК-матрицей рибонуклеотид включается в растущую цепь РНК как ковалентно связанная составная часть. Таким
способом цепь РНК удлиняется последовательным добавлением одного нуклеотида.
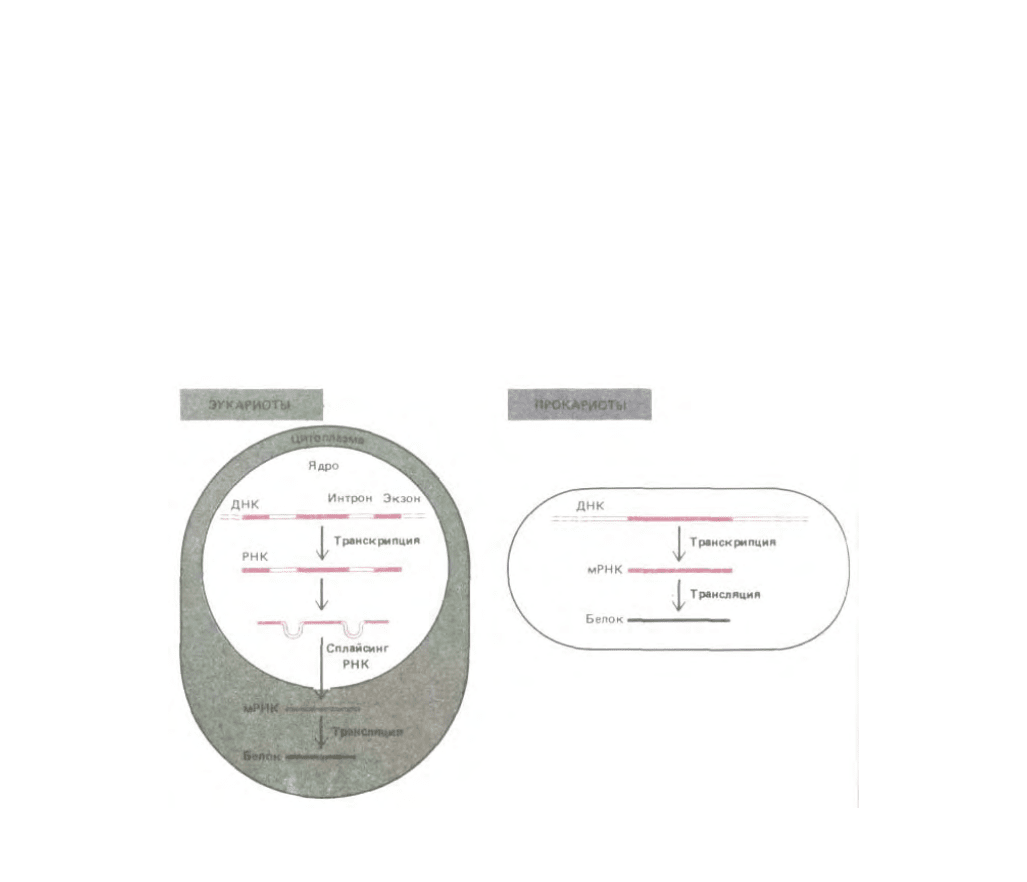
Транскрипция отличается от репликации ДНК рядом особенностей. Во-первых, РНК-продукт не остается комплементарно связанным с
ДНК-матрицей. Как только синтез копии РНК завершен, исходная двойная спираль ДНК восстанавливается, а молекула РНК освобождается. Таким
образом, молекулы РНК одноцепочечные. Более того, молекулы РНК короче ДНК, так как являются копиями участков ДНК ограниченной длины,
достаточной для кодирования одного или нескольких белков (рис. 3-13). РНК-транскрипты, направляющие синтез
Рис. 3-13. Передача информации от ДНК к белку осуществляется с помощью РНК-посредника, называемого мРНК. У прокариотических клеток
этот процесс проще, чем у эукариотических. У эукариот кодирующие участки ДНК-экзоны (выделены цветом) разделены некодирующими
участками (интронами). Показано, что для образования мРНК интроны должны удаляться.
