Вариант 56
Подождите немного. Документ загружается.

САМАРСКИЙ ГОСУДАРСТВЕННЫЙ АЭРОКОСМИЧЕСКИЙ
УНИВЕРСИТЕТ
Контрольная работа
по химии № 1 и № 2
Вариант № 56
Содержание
Контрольная работа № 1.............................................................................................3
17, 33, 41, 63, 82, 101, 126, 142, 164, 186, 216...........................................................3
Контрольная работа № 2...........................................................................................11
238, 256, 280, 296, 301, 321, 356, 386, 406, 416, 436...............................................11
Список литературы....................................................................................................20
2
Контрольная работа № 1
17, 33, 41, 63, 82, 101, 126, 142, 164, 186, 216
17. При взаимодействии 3,24 г трехвалентного металла с кислотой
вытесняется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалента,
молярную и относительную атомную массы металла.
Решение:
2Ме + 6Н
+
= 2Ме
3+
+ 3 Н
2
По закону эквивалентов:
3,24 г металла - « - « - 4,03 л Н
2
Э
Me
- « - « - 11,2 л Н
2
Отсюда молярная масса эквивалента металла
Э
Me
= 3,24 г * 11,2 л / 4,03 л = 9,00 г/моль
Отсюда, молярная масса металла равна:
Э
Me
* В
Me
= 9,00 г/моль * 3 = 27 г/моль
Атомная масса металла: 27 а.е.м.
33. Напишите электронные формулы атомов элементов с порядковыми
номерами 21 и 23. Сколько свободных 3d орбиталей в атомах этих элементов.
Решение:
Принцип наименьшей энергии требует, чтобы электроны заселяли АО в
порядке увеличения энергии электронов на этих орбиталях. Это отражает
общее правило – максимуму устойчивости системы соответствует минимум ее
энергии.
Энергия атомных орбиталей возрастает согласно ряду :
1sN<N2sN<N2pN<N3sN<N3pN<N4sN≈N3dN<N4pN<N5sN≈N4dN<N5pN<N6sN≈N4fN≈N5dN<N6pN<N7sN≈N5fN≈N6dN<N7p
Тогда:
21
Sc– 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
1
– d-элемент
23
Mo - 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
3
- d-элемент
3
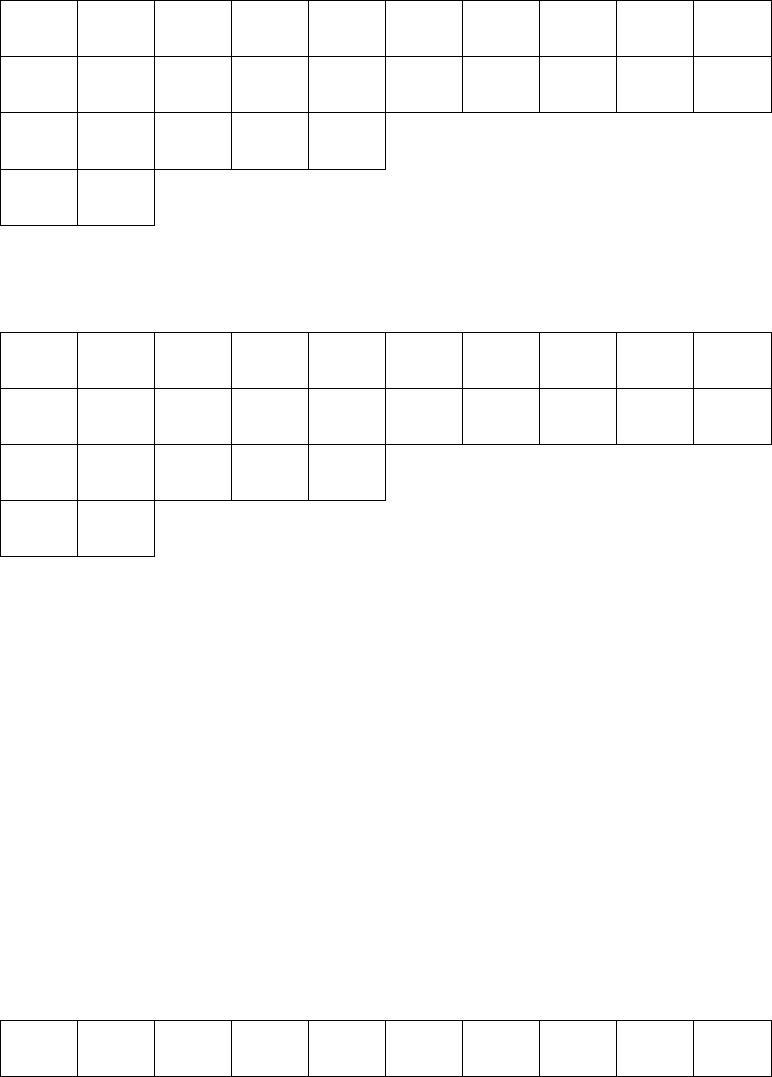
d-орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором m
l
=
–2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в
пространстве.
Каждый подуровень содержит 2l + 1 орбитали. Отсюда - 5 d-орбиталей.
s p d
n=4
↑↓
n=3
↑↓ ↑↓ ↑↓ ↑↓ ↑
n=2
↑↓ ↑↓ ↑↓ ↑↓
n=1
↑↓
21
Sc– 4 свободных 3d орбиталей
s p d
n=4
↑↓
n=3
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
n=2
↑↓ ↑↓ ↑↓ ↑↓
n=1
↑↓
23
Mo - 3 свободных 3d орбиталей
41. Исходя из положения германия и технеция в периодической системе,
составьте формулы мета- и ортогерманиевой кислот, и оксида технеция,
отвечающие их высшей степени окисления. Изобразите формулы этих
соединений графически.
Решение:
32
Ge - 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
2
- p-элемент
s p d
n=4
↑↓ ↑ ↑
В возбужденном состоянии:
s p d
4
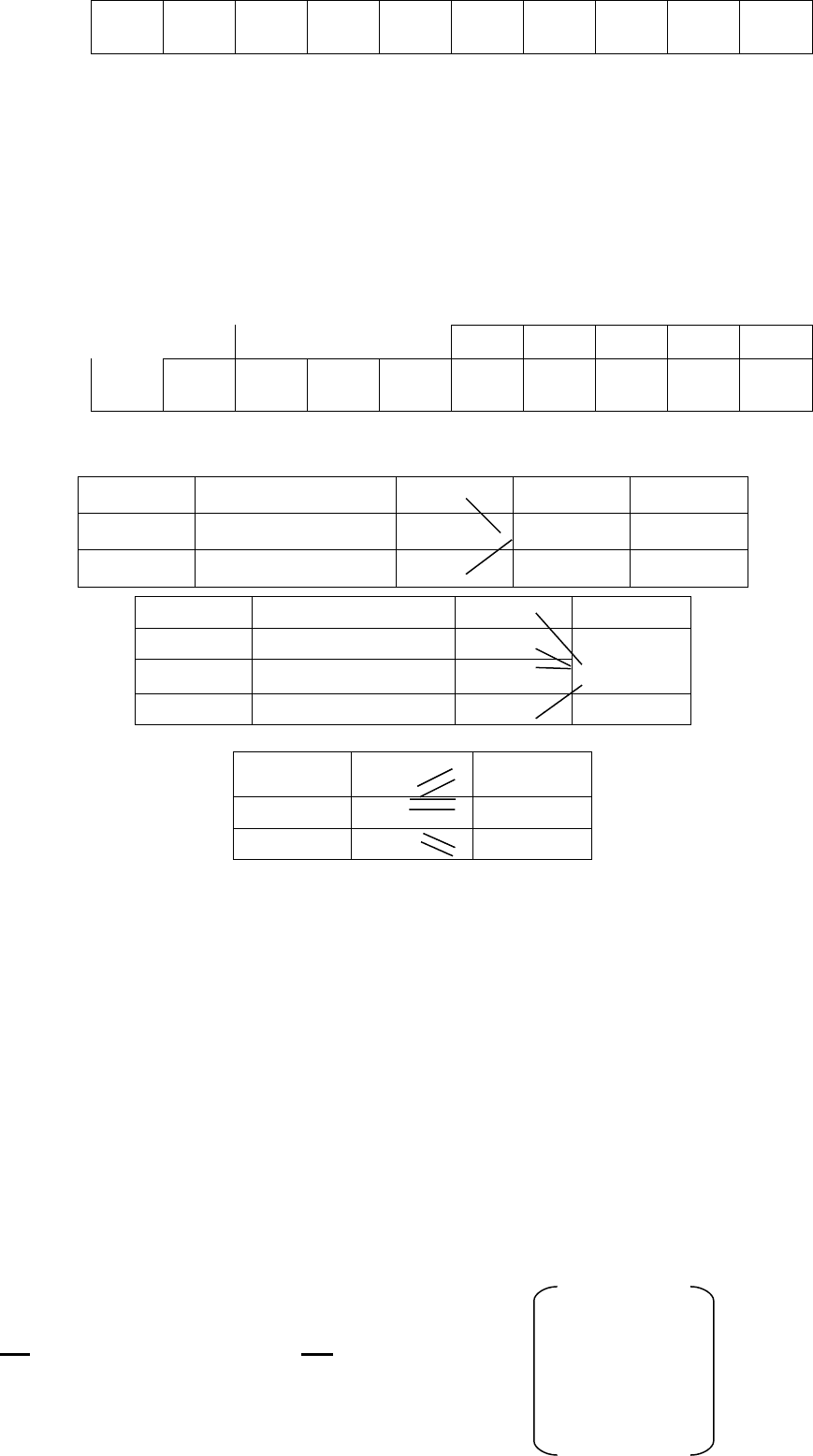
n=4
↑ ↑ ↑ ↑
Число неспаренных электронов равно 4, следовательно В = 4
Высшая степень окисления - Ge
+4
52
Те -1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
4
4f
0
Высшая степень окисления - Те
+6
В возбужденном состоянии:
4f
s p
↑ ↑
n= 5
↑ ↑ ↑ ↑
Формулы:
Н - О
мета – Н
2
Ge О
3
Ge =
О
Н - О
Н - О
орто – Н
4
Ge О
4
Н - О
Ge
Н - О
Н - О
О
Те О
3
Те О
О
63. Какой способ образования ковалентной связи называется донорно-
акцепторным. Какие химические связи имеются в ионах: NH
4
+
, BF
4
-
? Укажите
донор и акцептор.
Решение:
Химическая связь, образованная за счет пары электронов одного атома
(донора) и вакантной орбитали второго атома (акцептора), называется донорно-
акцепторной или донорно-акцепторным механизмом образования ковалентной
связи.
Н Н Н +
│ │ │
5
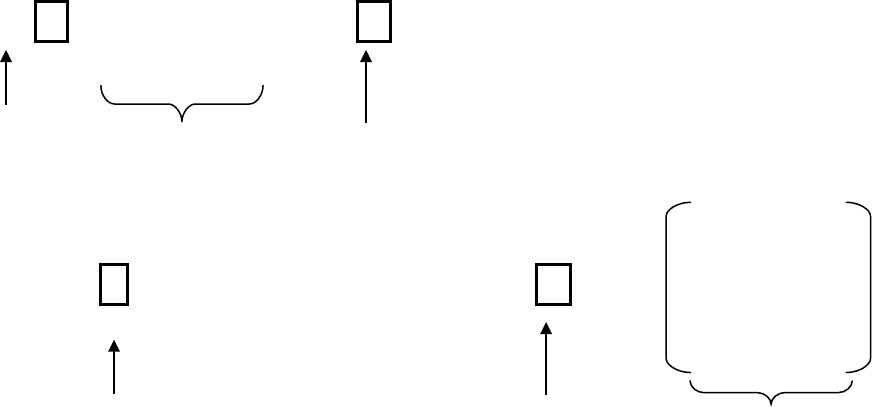
H
+
+ :
N ─Н → H
+
:
N ─Н → Н─ N ─Н
│ │ │
Н Н Н
акцептор донор Донорно-акцепторная связь Ион аммония
F F F
_
│
:
│ │
F ─ B
+ :
F
:
→ F ─ B
:
F → F ─ B ─ F
│
:
│ │
F F F
акцептор донор Донорно-акцепторная связь Тетрафторид бора
82. Газообразный этиловый спирт C
2
H
5
OH можно получить при
взаимодействии этилена C
2
H
4
и водяных паров
H
2
O. Напишите
термохимическое уравнение этой реакции, предварительно вычислив тепловой
эффект.
Решение:
C
2
H
4 (г)
+ H
2
O
(г)
= C
2
H
5
OH
(г)
По следствию из закона Гесса:
ΔH
0
реак
= Σ ΔH
0
прод
*n
i
- Σ ΔH
0
исх
*n
i
ΔH
0
реак
= ΔH
0
(C
2
H
5
OH
(г)
) - [ΔH
0
(C
2
H
4(г)
)
+ ΔH
0
(H
2
O
(г)
)
=
= (- 235,31 кДж/
моль * 1 моль) – (52,28 – 241,83) = -235,31 -52,28 + 241,83
= - 46,06 кДж
Термохимическое уравнение:
C
2
H
4 (г)
+ H
2
O
(г)
= C
2
H
5
OH
(г)
; ΔH
0
= - 46,06 кДж
101. Вычислите ΔG
0
298
для следующих реакций:
а) 2 NaF
(к)
+ Cl
2 (г)
= 2 NaCl
(к)
+ F
2 (г)
б) PbO
2 (к)
+ 2Zn
(к)
= Pb
(к)
+ 2ZnО
(к)
Решение:
Если ΔG
0
< 0, то процесс принципиально осуществим.
6
ΔG
0
для простых веществ равно 0.
а) ΔG
0
298
= 2 ΔG
0
298
(NaCl
(к)
) - 2 ΔG
0
298
(NaF
(к)
) = 2*(-284,03) – 2(-541,0) = +313,94
кДж
б) ΔG
0
298
= 2 ΔG
0
298
(ZnО
(к)
) - 2 ΔG
0
298
(PbO
2(к)
) = 2*(-318,2) – 2(-219,0) = - 417,4
кДж
Следовательно, реакция:
а) не возможна;
б) возможна.
121. Вычислите, во сколько раз уменьшится скорость реакции,
протекающей в газовой фазе, если понизить температуру от 120
0
до 80
0
С?
Температурный коэффициент скорости реакции равен 3.
Решение:
Δt = 120
0
- 80
0
= 40
0
γ = 3.
По уравнению Вант-Гоффа:
V
2
/V
1
= γ
Δt/ 10
= 3
40/10
= 3
4
= 81 раз
Ответ: Скорость реакции уменьшится в 81 раз.
142. Чему равна молярная концентрация эквивалента 30% раствора NaOH
плотностью 1,328 г/см
3
? К 1 л этого раствора прибавили 5 л воды.
Вычислите массовую долю полученного раствора.
Решение:
1) 30% раствор означает, что в растворе содержится 30 % NaOH безводной.
1 л 30% раствора NaOH весит:
m = V*ρ = 1 см
3
*1,328 г/см
3
= 1328 г
тогда масса NaOH:
1328 г * 30% /100% = 398,4 г
2) При прибавлении 5 л воды масса вновь полученного раствора составит:
5000 г + 1328 г = 6328 г
7

3) Массовая доля полученного раствора:
398,4 г/ 6328 г * 100% = 0,063 *100% = 6,3%
4) Эквивалентная масса NaOH:
Э = М(NaOH)/1 = 40 г/моль
5) Молярная концентрация эквивалента 30% раствора NaOH составит:
398,4 г/см
3
/40 г/моль = 9,96 моль/см
3
= 9,96 н
Ответ: 6,3 %; 9,96 н
164. Раствор, содержащий 3,04 г камфары C
10
H
16
O в 100 г бензола, кипит
при 80,714
0
С. Температура кипения бензола – 80,2
0
С.
Вычислите эбулиоскопическую константу бензола.
Решение:
ΔT = К
m*1000
M* m
1
где m = 3,04 г; m
1
= 100 г; М (C
10
H
16
O) = 152 г/моль
ΔT = 80,714
0
- 80,2
0
= 0,514
0
С
К
эб
=
ΔT *M m
1
m*1000
К
эб
= (0,514 *152*100) / (3,04*1000) = 2,57
0
Ответ: эбулиоскопическая константа бензола равна 2,57
0
186. Составьте молекулярные и ионно-молекулярные уравнения
взаимодействия в растворах между:
1) CuSO
4
+ H
2
S →
2) BaCO
3
+ HNO
3
→
3) FeC1
3
+ KOH →
Решение:
1) CuSO
4
+ H
2
S → CuS↓ + H
2
SO
4
8
Cu
2+
+ SO
4
2-
+ H
2
S = CuS↓ + 2 H
+
+ SO
4
2-
Cu
2+
+ H
2
S = CuS↓ + 2 H
+
2) BaCO
3
+ HNO
3
→ Ba (NO
3
)
2
+ CO
2
+ H
2
O
BaCO
3
+ 2 H
+
+ 2 NO
3
-
= Ba
2+
+ 2 NO
3
-
+ CO
2
+ H
2
O
BaCO
3
+ 2 H
+
= Ba
2+
+ CO
2
↑+ H
2
O
3) FeC1
3
+ 3 KOH → Fe(OH)
3
+ 3 KC1
3
Fe
3+
+ 3C1
-
+ 3 K
+
+ 3 OH
-
= Fe(OH)
3
↓ + 3 K
+
+ 3C1
-
Fe
3+
+ 3 OH
-
= Fe(OH)
3
↓
216. Какая из двух солей при равных условиях в большей степени
подвергается гидролизу: NaCN или NaC1O; MgC1
2
или ZnC1
2
? Почему?
Составьте ионно-молекулярные и молекулярные уравнения гидролиза
соответствующих солей.
Решение:
1) NaCN или NaC1O?
Степень гидролиза той или иной соли определяется константой
диссоциации слабого электролита.
Чем меньше константа диссоциации слабого электролита, входящего в
состав соли, тем больше степень гидролиза.
Поэтому, сравним К
дисс.
слабых кислот.
К
НCN
= 7,9*10
-10
К
НC1O
= 5,0*10
-8
Следовательно, NaCN подвергается гидролизу в большей степени.
NaCN + H
2
O ↔ NaOH + НCN
Na
+
+ CN
-
+ H
2
O ↔ Na
+
+ OH
-
+ НCN
CN
-
+ H
2
O ↔ OH
-
+ НCN
pH > 7 (щелочная реакция среды)
NaC1O + H
2
O ↔ NaOH + НC1O
Na
+
+ C1O
-
+ H
2
O ↔ Na
+
+ OH
-
+ НC1O
C1O
-
+ H
2
O ↔ OH
-
+ НC1O
9
2) MgC1
2
или ZnC1
2
?
В этом случае надо сравнивать произведения растворимости ПР.
ПР (Mg (OH)
2
) = 1,8*10
-11
ПР (Zn (OH)
2
) = 7,0*10
-18
Большему гидролизу подвергается Zn C1
2
Уравнения гидролиза:
MgC1
2
+ H
2
O ↔ MgOHC1 + HC1
Mg
2+
+ 2 C1
-
+ H
2
O ↔ MgOH
+
+ 2 C1
-
+ H
+
Mg
2+
+ H
2
O ↔ MgOH
+
+ H
+
pH < 7 (кислая реакция среды)
ZnC1
2
+ H
2
O ↔ ZnOHC1 + HC1
Zn
2+
+ H
2
O ↔ ZnOH
+
+ H
+
pH < 7 (кислая реакция среды)
10
