Труфанов О.В. Фитаза в кормлении сельскохозяйственных животных и птицы
Подождите немного. Документ загружается.

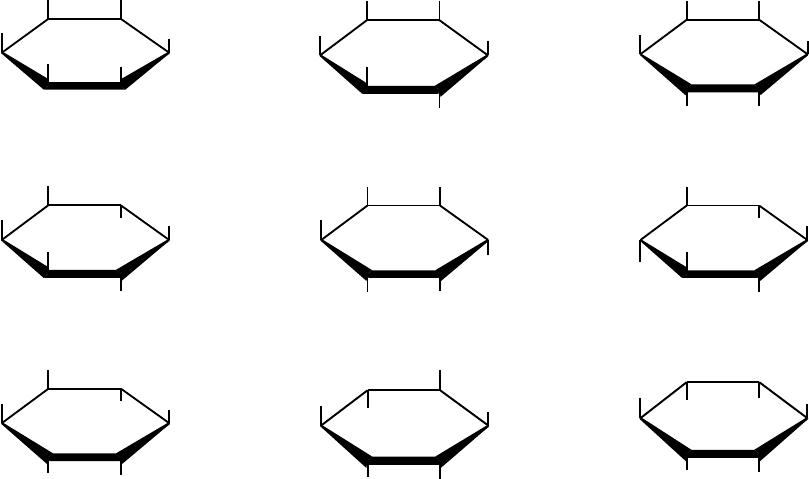
Другие формы также встречаются в живой природе, однако их биологическое
значение мало изучено. В соответствии с номенклатурой T. Posternak молекула
инозитола в мио-конформации имеет лишь одну плоскость симметрии,
проходящую через крайний левый и крайний правый атомы углерода (рис. 2).
Префиксы D и L указывают направление нумерации атомов углерода в
кольце: L – по часовой стрелке, D – против. В общей химии принято
нумеровать атомы, следуя самым коротким путем. Во избежание путаницы с
номенклатурой инозитолов и ферментов, связанных с их превращениями,
Международный союз теоретической и прикладной химии и Международный
биохимический союз (International Union of Pure and Applied Chemistry и
International Union of Biochemistry, IUPAC-IUB, 1989) рекомендуют нумеровать
атомы мио-инозитола в соответствии с D конфигурацией. Нумерацию
необходимо начинать с атома, участвующего в формировании сложноэфирной
связи в инозитол-содержащих фосфолипидах, используя мнемонический образ
черепахи, предложенный Agranoff B. W. (1978). Четыре лапы и хвост черепахи,
расположенные в одной плоскости, соответствуют пяти экваториальным
гидроксильным группам, а приподнятая голова – аксиальной гидроксильной
группе. Если смотреть на черепаху сверху, то нумерацию нужно начинать с
передней правой лапы, минуя голову и заканчивая задней правой лапой, т. е.
против часовой стрелки (Shears S. B., 2004); в этом случае плоскость симметрии
проходит через атомы C
2
и C
5
. Нумерация в L-конфигурации (по часовой
стрелке) начинается с левой передней лапы черепахи.
OH OH
OH
OH
OH
OH
OH OH
OH
OH
OH
OH
OH OH
OH
OHOH
OH
цис
эпи
алло
OH
OH
OH
OH
OH
OH
OH
OH
OH
OHOH
OH
OH
OH
OH
OH
OH
OH
мио
нео
сцилло
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
L-хиро
D-хиро
муко
Рис. 2. Конформации девяти стереоизомеров инозитола (проекции
Haworth). Семь изомеров имеют ось зеркальной симметрии и могут
нумероваться как по (L), так и против часовой стрелки (D); D- и L-
конформации хиро-изомеров не являются зеркально симметричными.
Ферменты, участвующие в синтезе и гидролизе фосфатов инозитола,
называют фитазами. В названиях фитаз существует путаница, поскольку ни
одна из них не гидролизует эфиры инозитола в соответствии с нумерацией
атомов. Фитазам принято присваивать номер атома, которой участвует в
образовании эфирной связи, гидролизуемой первой, с образованием
определенного D-мио-инозитолпентакисфосфата. Например, 3-фитаза сначала
осуществляет дефосфорилирование гидроксильной группы при атоме C
3
, в
результате чего образуется I(1,2,4,5,6)P
5
(D-мио-инозитол -1,2,4,5,6-
пентакисфосфат). Следует обратить внимание на то, что при дальнейшем
гидролизе эфирных связей нумерация атомов остается прежней. Однако
некоторые авторы упомянутую выше 3-фитазу именуют 4-фитазой, а другие –
6-фитазой, что может быть связано с различными способами нумерации атомов
углерода в инозитольном кольце. Поэтому необходимо помнить, что в
соответствии с рекомендациями IUPAC-IUB D-3-фитазе соответствует L-1-
фитаза, а D-6-фитазе – L-4-фитаза.
1.2. Химические свойства
Шесть остатков фосфорной кислоты, связанных с инозитолом, могут
принимать или отдавать до 12 протонов (ионов водорода), благодаря
многоступенчатой диссоциации которых фитиновая кислота проявляет
свойства как сильных, так и очень слабых кислот (pK
a
до 9,4) в зависимости от
ионной силы раствора, температуры и прочих факторов (Brown E. C. et. al.,
1961; Costello A. J. R. et. al., 1976; Torres J. et. al., 2005). В нейтральной среде
фосфатные группы фитиновой кислоты частично диссоциируют, приобретая по
одному или два отрицательных заряда, благодаря чему катионы (положительно
заряженные ионы металлов, протонированные аминогруппы и т. п.) могут
прочно хелатироваться двумя или более остатками фосфорной кислоты, либо
образовывать менее прочную ионную связь с одной фосфатной группой. Таким
образом, фитиновая кислота является полидентатным лигандом, способным
хелатировать катионы путем образования нескольких координационных связей.
В диапазоне рН от 0,5 до 10,5 конформация фитиновой кислоты
стерически стабильна и имеет одну аксиальную и пять экваториальных групп
(рис. 3). При более высоких значениях рН может происходить обращение
конформации, в результате которого образуются пять аксиальных групп и одна
экваториальная. Подобное превращение происходит с функциональными
группами в составе InsP
5
, особенно при атомах C
1
, C
3
и C
5
, поскольку эти
группы образуют «хелатирующую клетку» (англ. «chelation cage»),
стабилизированную катионами (Volkmann C. J. et. al., 2002). Именно
стабилизация катионами способствует кристаллизации фитиновой кислоты в
мио-конформации (He Z. Q. et. al., 2006; Rodrigues-Filho U. P. et. al., 2005).
Конформация низших фосфатов инозитола стабильна в более широких
диапазонах рН (Barrientos L. G., Murthy P. P. N. 1996).
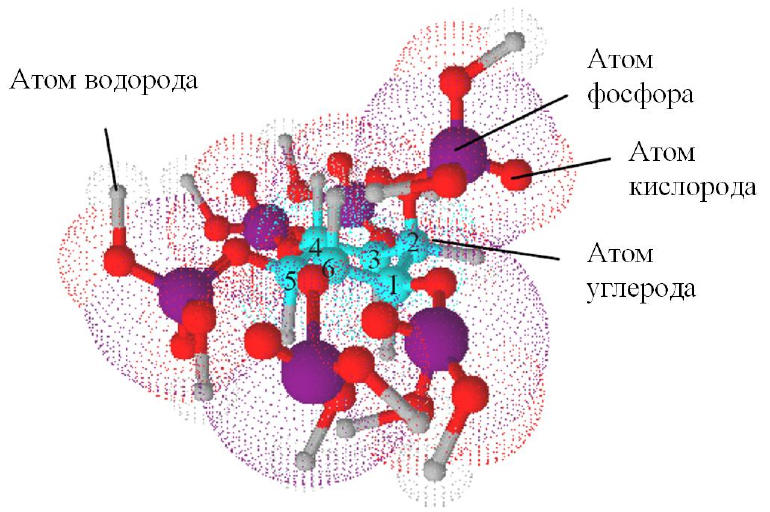
Рис. 3. Мио-инозитол-1,2,3,4,5,6-гексакисфосфат в конформации «лодка»
имеет 1 аксиальную и 5 экваториальных групп. Атомы кислорода (красные),
фосфора (пурпурные) и водорода (серые) входят в состав фосфатных групп,
расположенных на каждом из шести атомов углерода (голубые) инозитольного
кольца, пронумерованных в соответствии с рекомендациями IUPAC-IUB.
1.3. Фитин, фитаты и фитат
Термин «фитин» – это общее название солей фитиновой кислоты (чаще
всего кальциевых и магниевых), тогда как «фитаты» – это анионы фитиновой
кислоты с различной степенью диссоциации (Maga J. A., 1982). Довольно часто
в качестве собирательного названия солей фитиновой кислоты вместо термина
«фитин» употребляют термин «фитат».
Комплексообразующие свойства фосфатных групп позволяют фитиновой
кислоте эффективно хелатировать катионы металлов, особенно Cu
2+
и Zn
2+
,
которые, в свою очередь, обладают высоким сродством к инозитолфосфатам. В
зависимости от снижения прочности комплексов с фитиновой кислотой
катионы металлов можно расположить в следующей последовательности: Zn
2+
> Cu
2+
> Co
2+
> Mn
2+
> Ca
2+
(Maddaiah V. T. et. al., 1964). Vohra P. et. al. (1965),
использовавшие другой методический подход, получили несколько иной ряд:
Cu
2+
> Zn
2+
> Co
2+
> Mn
2+
> Fe
3+
> Ca
2+
. Сходным образом можно расположить
ионы металлов в зависимости от прочности образуемых ими комплексов с
фитиновой кислотой и низшими фосфатами инозитола (InsP
3
-InsP
6
) при pH 3-7:
Cu
2+
> Zn
2+
> Cd
2+
. Установлено также, что прочность комплексов снижается
при уменьшении количества фосфатных групп в составе фитата (Persson H.
et. al., 1998). Однако минеральный состав фитина биологического
происхождения редко определяется исключительно аффинностью катионов.
Результаты недавних исследований говорят о том, что фитин, обнаруженный в
живых организмах, содержит, главным образом, магний, кальций и калий
(Bohn L. et. al., 2007).
При избытке в растворе фитиновой кислоты преимущественно образуются
водорастворимые комплексы с катионами металлов в эквимолярном
соотношении, т. е. 1:1. При избытке катионов металлов образуются
слаборастворимые и нерастворимые соли (Torres J. et. al., 2005). Интересно, что
растворимость солей фитиновой кислоты достигает максимальных значений
как при очень низком, так и при очень высоком содержании катионов металлов
в растворе (Bullock J. I. et. al., 1995; Cheryan M. et. al., 1983; Nolan K. B. et. al.,
1987). Наличие катиионов нескольких металлов способствует образованию
нерастворимых комплексов. Например, растворимость значительно снижается в
присутствии в растворе катионов Ca
2+
одновременно с катионами других
металлов (Wise A., Gilburt D. J., 1983; Simpson C. J., Wise A., 1990). При
взаимодействии фитиновой кислоты с ионами какого-либо одного металла,
например марганца, кобальта, никеля, меди, олова или цинка, образуются
нерастворимые соли, в составе которых соотношение фитиновой кислоты и
катионов варьирует от 1:2 до 1:5. Добавление в раствор хлорид-ионов вызывает
более полную депротонизацию остатков фосфорной кислоты, смещая
стехиометрическое соотношение до 1:6 (Vasca E., et. al., 2002; Vohra P. et. al.,
1965).
Еще одним фактором, влияющим на растворимость солей фитиновой
кислоты, является уровень pH среды (Cheryan M., 1980). Фитаты кальция,
кадмия, цинка и меди лучше растворимы при значениях рН ниже 4-5, тогда как
фитат магния хорошо растворим в воде при pH 7,5 (Brown E. C. et. al., 1961;
Nolan K. B. et. al., 1987).
Нерастворимые комплексы фитиновой кислоты с металлами осаждаются в
виде аморфной массы, насыщенной водой (до 22 молекул воды на 1 молекулу
фитата), что затрудняет проведение кристаллографического анализа (Veiga N.,
et. al., 2006). При изучении кристаллической структуры фитата железа (III)
было обнаружено, что связь фосфата с железом соизмерима по прочности с
ковалентной. Осаждение комплексов начинается, когда от 2 до 4 ионов Fe
3+
взаимодействуют как минимум с 4 из 6 фосфатных групп молекулы фитиновой
кислоты (Mali G. et. al., 2006). Теоретически, каждая фосфатная группа
взаимодействует с двумя ионами железа, каждый из которых, в свою очередь,
связан с тремя фосфатными группами двух разных молекул фитата
(Thompson D. B., Erdman J. W. 1982). В действительности, даже в
экспериментальных условиях практически невозможно добиться полного
насыщения фитатов ионами железа.
1.4. Распространенность фитиновой кислоты в растительных
субстратах
1.4.1. Содержание фосфора в растительных кормах
На долю фитинового фосфора приходится большая часть общего фосфора,
содержащегося в семенах злаковых, бобовых и масличных культур. В целом,
фитиновый фосфор составляет 60-80% от общего количества фосфора в
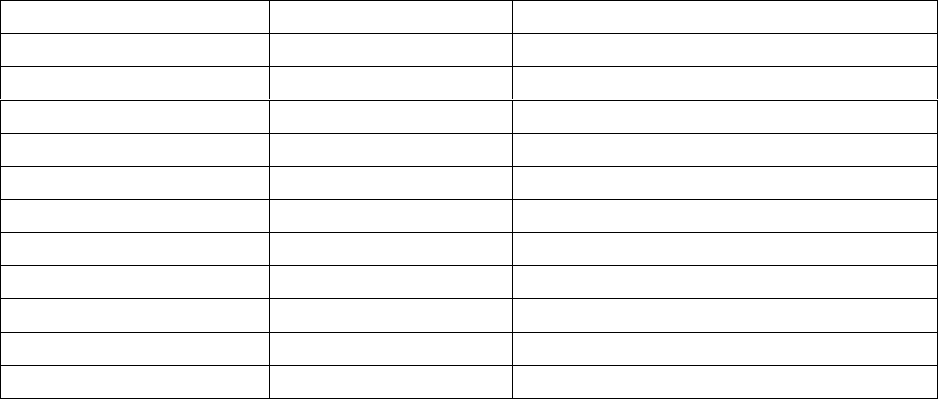
растительных компонентах кормов (таблица 1).
Таблица 1. Содержание общего и фитинового фосфора в различных
растительных кормах (по Cromwell G. L. 1980).
Растительный корм
Общий фосфор, %
Фитиновый фосфор, % от общего
Кукуруза
0,26
66
Сорго
0,31
68
Ячмень
0,34
56
Пшеница
0,30
67
Овес
0,34
56
Соя
0,61
61
Семена хлопчатника
1,07
70
Сезам
1,27
81
Пшеничные отруби
1,47
70
Пшеничная мучка
0,47
74
Люцерновая мука
0,30
0
Содержание элемента фосфора в фитиновой кислоте составляет 28,2%, а
количество связанного в форме фитатов фосфора в типичном рационе для
птицы находится в пределах 2,5-4 г/кг (Ravindran V. et. al., 1995).
1.4.2. Фитиновые глобоиды
Фитин запасается в виде электроноплотных сферических внутриклеточных
образований, называемых глобоидами (Pfeffer W., 1872). Глобоиды содержатся
главным образом в клетках алейронового слоя зерновок (например, пшеницы
или ячменя) или зародыша (в зерновках кукурузы) (O'Dell B. L. et. al., 1972).
Внутри клеток глобоиды локализованы в белок-запасающих вакуолях, в
которых различают три типа структур: матрикс, содержащий большую часть
запасных белков, кристаллоиды (сетчатая белковая структура с неизвестной
пока функцией) и глобоиды, состоящие из кристаллов солей фитиновой или
щавелево-уксусной кислот (Lott J. N. A., 1980). Количественное соотношение
этих трех типов структур в вакуолях зависит от вида растения. Например, в
состав белок-запасающих вакуолей пшеницы входят только белковый матрикс
и фитиновые глобоиды (Morrison I. N. et. al., 1975), что значительно облегчает
извлечение фитина. Даже вследствие небольшого повреждения клеток
алейронового слоя может происходить высвобождение фитина (Antoine C.
et. al., 2004). При микроскопическом исследовании зерен пшеницы можно
обнаружить слои из липидных капель вокруг глобоидов (Morrison I. N. et. al.,
1975), которые, по-видимому, являются частями мембраны вакуоли,
разрушенной в процессе приготовления препарата. Окруженные липидной
мембраной глобоиды характерны для растений семейств крестоцветные
(Gillespie J. et. al., 2005) и пасленовые (Jiang L. W. et. al., 2001).
Количество фитина в зерне зависит от размеров глобоидов. В зернах
дикого типа пшеницы (ДТ) обнаружены глобоиды диаметром до 4 мкм
(Antoine C. et. al., 2004), тогда как в зернах мутантной пшеницы с низким
содержанием фитиновой кислоты Js-12-LPA (от англ. low phytic acid) и тем же
содержанием общего фосфора глобоиды фитина имеют меньшие размеры и
организованы в кластеры (Joyce C. et. al., 2005). Такое же явление наблюдается
при выращивании ДТ-пшеницы в условиях дефицита фосфора (Batten G. D.,
Lott J. N. A., 1986) и при наличии lpa-мутации у других видов злаков, в том
числе риса (Liu J. C. et. al., 2004), кукурузы (Lin L. et. al., 2005) и ячменя
(Ockenden I. et. al., 2004).
Глобоиды ДТ- и lpa-пшеницы по составу различаются незначительно. С
использованием трансмиссионной электронной микроскопии и
рентгеноструктурного анализа было установлено, что в них содержится
одинаковое количество фосфора, калия, магния и кальция, однако в глобоидах
зерен ДТ-пшеницы медь и цинк присутствуют в более высоких концентрациях,
по сравнению с lpa-пшеницей (Joyce C. et. al., 2005; Guttieri M. et. al., 2003). Для
определения минерального состава фитиновых глобоид используют также
масс-спектрометрию с индуктивно связанной плазмой (ИСП-МС) (Bohn L.
et. al., 2007).
Несмотря на то, что медь характеризуется высокой аффинностью к
фитиновой кислоте, этот микроэлемент практически отсутствует в составе
фитина, а основными минералами (в порядке убывания концентрации)
являются K, Mg, Ca и Fe (Bohn L. et. al., 2007). Железо найдено в составе
глобоид как lpa-, так и ДТ-пшеницы, однако максимальное содержание этого
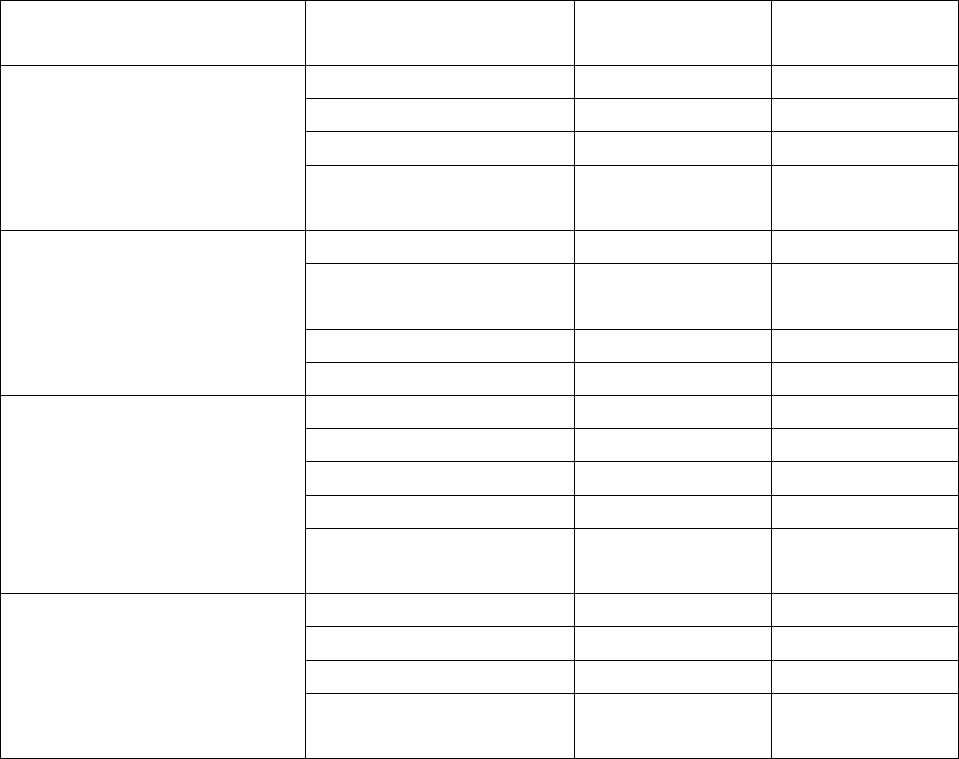
минерала характерно для глобоид в клетках зерен ДТ-пшеницы,
расположенных вблизи зародыша (Lott J. N. A., Spitzer E., 1980).
1.4.3. Содержание фитина в различных органах растений
Концентрация фитинового фосфора в различных органах растений не
одинакова. Большая часть фитина сосредоточена в семенах. Небольшие
количества фитина присутствуют в вегетативных органах, например корнях и
корнеплодах, следовые – в листьях. (Angel R. et. al., 2001). В семенах
большинства злаков фитин сосредоточен в алейроновом слое, а в семенах
двудольных растений, включая масличные и бобовые, он равномерно
распределен по всему объему зерен (Erdman J. W. Jr., 1979; Lott J. N. A., 1984;
Oberleas D. 1973) (таблица 2).
Таблица 2. Содержание фитиновой кислоты и фитатинового фосфора в
различных морфологических структурах зерен злаковых культур. По
Reddy N. R. et. al. (1982).
Злаковые культуры
Морфологические
структуры семян
Фитиновая
кислота, %
Фитатиновый
фосфор, %
Кукуруза
Эндосперм
0,04
0,01
Зародыш
6,39
1,80
Оболочка (отруби)
0,07
0,02
Среднее
содержание
0,89
0,25
Кукуруза с высоким
содержанием лизина
Оболочка (отруби)
0,25
0,07
Среднее
содержание
0,96
0,27
Эндосперм
0,04
0,01
Зародыш
5,72
1,61
Мягкая пшеница
Эндосперм
0,004
0,001
Зародыш
3,91
1,10
Оболочка (отруби)
0,00
0,00
Алейроновый слой
4,12
1,16
Среднее
содержание
1,14
0,32
Шелушенный рис
Эндосперм
0,01
0,004
Зародыш
3,48
0,98
Перикарпий
3,37
0,95
Среднее
содержание
0,89
0,25
1.4.4. Содержание фитина в различных видах растений
Среди кормовых субстратов наиболее высоким содержанием фитатов
отличаются мука из кунжута и рисовые отруби. В семенах масличных культур
и отрубях зерна злаковых содержится больше фитинового фосфора, чем в
зернах злаковых и бобовых культур (Ravindran V. et. al., 1995a). В семенах
злаковых и бобовых культур фитин является главным источником фосфора,
мио-инозитола и катионов во время прорастания и может составлять до 5% от
общего веса (De Boland A. R. et. al., 1975; Reddy N. R. et. al., 1982).
Эндосперм пшеницы и риса практически не содержит фитина, однако
значительные количества его содержатся в алейроновом слое и отрубях. В рисе
свыше 80% фитина находится в отрубях (O'Dell B. L. et. al., 1972). В кукурузе
90% фитина сконцентрировано в зародышевой части зерна.
Содержание фитина в растительных продуктах зависит от климатических
и географических условий выращивания, степени вызревания, а также
особенностей технологии переработки зерна (Reddy N. R. et. al., 1982;
Manangi M. K., Coon C. K., 2006). В рисе и пшенице содержание фитинового
фосфора возрастает по мере созревания зерна, а также вследствие применения
фосфатных удобрений (Asada K. et. al., 1969). В пшенице, выращенной в период
засухи, содержание фитиновой кислоты ниже в сравнении с пшеницей,
выращенной в условиях ирригации (Bassiri A., Nahapetion A. 1977).
Существенное влияние на содержание фитина в зерне пшеницы, ржи,
тритикале и овса оказывают также климатические особенности местности и
погодные условия в год выращивания (Miller G. A. et. al., 1980).
