Родионов А. И и др. Tехнологические процессы экологической безопасности /Основы энвайронменталистики
Подождите немного. Документ загружается.


361
Активность вещества как окислителя определяется величиной
окислительного потенциала. Из всех известных в природе окислите-
лей первое место занимает фтор, который, однако, из-за высокой аг-
рессивности не может быть использован на практике. Для других
веществ величина окислительного потенциала равна: для озона —
2,07; для хлора — 0,94; для пероксида водорода — 0,68; для перман-
ганата калия — 0,59.
Окисление хлором. Хлор и вещества, содержащие "активный"
хлор, являются наиболее распространенными окислителями. Их ис-
пользуют для очистки сточных вод от сероводорода, гидросульфида,
метилсернистых соединений, фенолов, цианидов и др. При введе-
нии хлора в воду образуются хлорноватистая [оксохлорат (I) водоро-
да] и соляная (хлороводородная) кислоты:
С1,+Н
2
0 = HOCl + HCl. (11.141)
Далее происходит диссоциация хлорноватистой кислоты, степень
которой зависит от рН среды. При рН = 4 молеку лярный хлор прак-
тически отсутствует:
HOCl + ОСГ (11.141а)
Сумма Cl
2
+ HOCl + OCl
-
называется свободным "активным''
хлором.
В присутствии аммонийных соединений в воде образуется хлор-
новатистая кислота, хлорамин NH
2
Cl и дихлорамин NHCl
0
. Хлор в
виде хлорамина называется связанным "активным" хлором.
Процесс хлорирования проводят в хлораторах периодического и
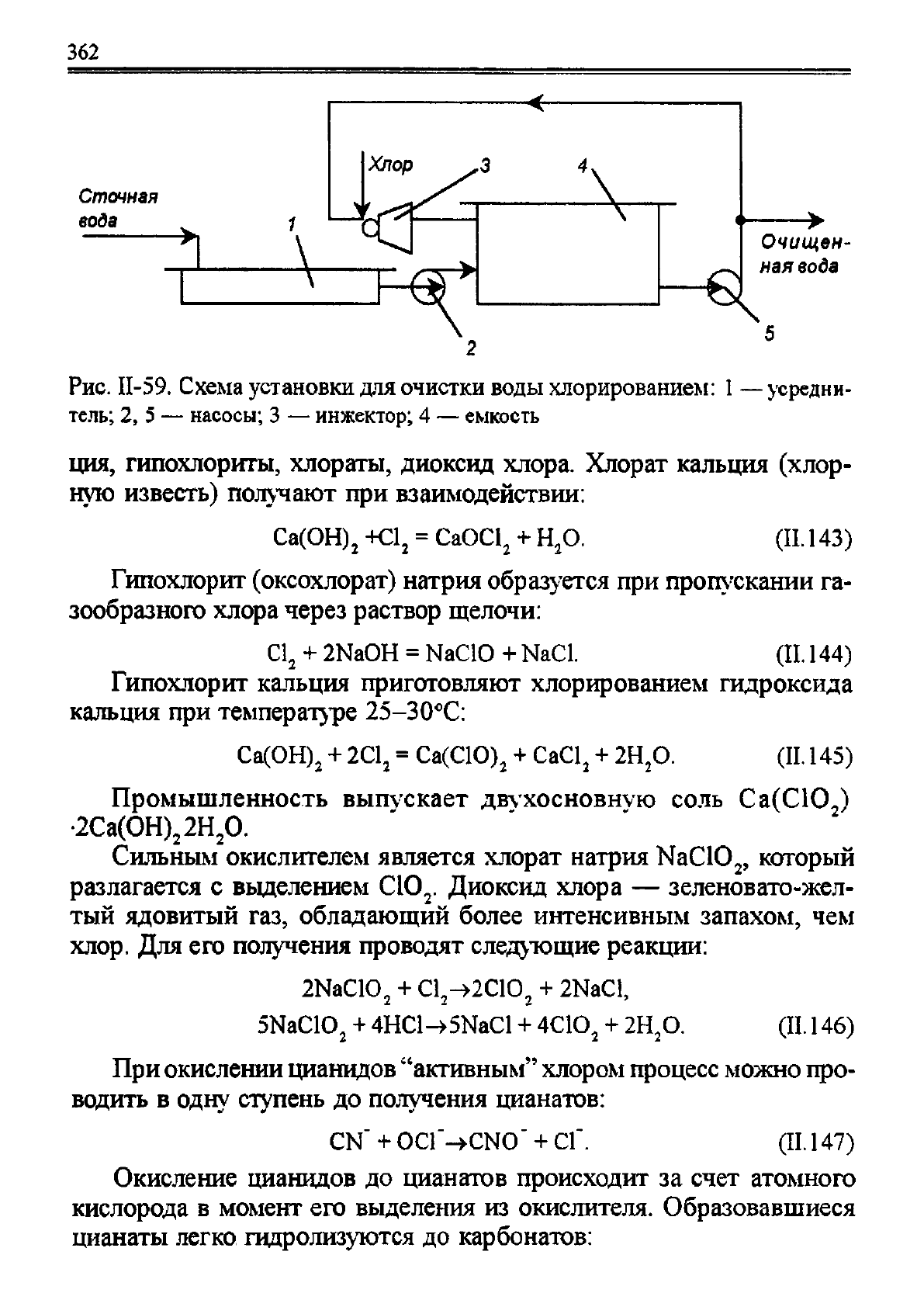
непрерывного действия, напорных и вакуумных. Принципиальная
схема очистки вод хлорированием показана на рис. 11-59. Хлориро-
вание проводится в емкости, включенной в систему
7
циркуляции. В
инжекторе газообразный хлор захватывается сточной водой, цирку-
лирующей в системе до тех пор, пока не будет достигнута заданная
степень окисления, после чего вода выводится для использования.
При обезвреживании вод от цианидов процесс проводят в ще-
лочной среде (рН = 9). Цианиды можно окислить до элементного
азота и диоксида углерода по уравнениям:
CN- + 2 ОН" + Cl
2
->CNO- + 2С1- + H
2
O,
2CNO" + 40Н" + 3Cl
2
->C0
2
+
6С1"
+ N
2
+ 2Н
2
0.
(И.
142)
Источниками "активного" хлора могут быть также хлорат каль-
362
Рис. И-59. Схема установки для очистки воды хлорированием:
1
— усредни-
тель; 2, 5 — насосы; 3 — инжектор; 4 — емкость
ция, гипохлориты, хлораты, диоксид хлора. Хлорат кальция (хлор-
ную известь) получают при взаимодействии:
Ca(OH)
2
+Cl
2
= CaOCl
2
+ H
2
O. (И. 143)
Гипохлорит (оксохлорат) натрия образуется при пропускании га-
зообразного хлора через раствор щелочи:
Cl
2
+ 2NaOH = NaClO + NaCl. (И. 144)
Гипохлорит кальция приготовляют хлорированием гидроксида
кальция при температуре 25-30°С:
Ca(OH)
2
+ 2С1
2
= Ca(ClO)
2
+ CaCl
2
+ 2Н
2
0. (II. 145)
Промышленность выпускает ДВУХОСНОВНУЮ соль Ca(ClO
2
)
•2Са(0Н)
2
2Н
2
0.
Сильным окислителем является хлорат натрия NaClO
2
, который
разлагается с выделением ClO
2
. Диоксид хлора — зеленовато-жел-
тый ядовитый газ, обладающий более интенсивным запахом, чем
хлор. Для его получения проводят следующие реакции:
2NaC10
2
+ С1
2
->2С10
2
+ 2NaCl,
SNaClO
2
+ 4НС1-» SNaCl + 4СЮ
2
+ 2Н
2
0.
(И.
146)
При окислении цианидов "активным" хлором процесс можно про-
водить в одну ступень до получения цианатов:
CN" + OCl ~»CNO + Cl". (II. 147)
Окисление цианидов до цианатов происходит за счет атомного
кислорода в момент его выделения из окислителя. Образовавшиеся
цианаты легко гидролизуются до карбонатов:

363
CNO- + 2Н
2
0->С0
3
2
- + NH/. (11.147a)
Скорость гидролиза зависит от рН среды. При рН=5,3 за сутки
гидролизуется около 80% цианатов. В двухступенчатом процессе ци-
аниды окисляются до N
2
и CO
2
. На первой ступени процесс протека-
ет по реакции (11.147). На второй ступени вводят дополнительное
количество окислителя и реакция протекает по уравнению:
2CNO- + ЗОС1"
+
Н
2
0->2С0
2
+ N
2
+ 20Н" +
ЗС1". (II.
1476)
Во время реакций рН поддерживают в пределах 8-11. Контроль
полноты окисления производят по остаточному "активному" хлору;
концентрация которого должна быть не менее 5—10 мг/л.
Товарный хлорат кальция содержит до 33% "активного" хлора, а
гипохлорит кальция — до 60%. Потребность реагентов X
1
(в кг/сут)
для окисления подсчитывается по формуле:
X
1
= X
cl
Qn/^ (11.148)
где
х
С1
— расход "активного" хлора, необходимого для окисления ци-
анидов, кг/м
3
; Q — расход воды, м
3
/сут; п — коэффициент избытка
реагента (п =1.2-1,3); а — содержание "активного" хлора в реагенте,
в долях единицы.
Окисление пероксидом водорода. Пероксид водорода является
бесцветной жидкостью, в любых соотношениях смешивается с во-
дой. Она может быть использована для окисления нитритов, альде-
гидов, фенолов, цианидов, серосодержащих отходов, активных кра-
сителей. Промышленность вытекает 85-95%-ный пероксид водо-
рода и пергидроль, содержащий 30% H
2
O
2
. Пероксид водорода ток-
сичен. ПДК в воде составляет 0,1 мг/л.
Пероксид водорода в кислой и щелочной средах разлагается по
следующим схемам:
2Н
+
+
H
2
O
2
+ 2е->2Н
2
0, 20Н"
+
H
2
O
2
+ 2е->2Н
2
0 + 20
2
".
(И.
149)
В кислой среде более отчетливо выражена окислительная функ-
ция, а в щелочной — восстановительная.
В кислой среде пероксид водорода переводит соли двухвалентно-
го железа в соли трехвалентного, азотистую кислоту — в азотную,
сульфиды — в сульфаты. Цианиды в цианаты окисляются в щелоч-
ной среде (рН = 9-12).
В разбавленных растворах процесс окисления органических ве-
ществ протекает медленно, поэтому используют катализаторы —

364
ионы металлов переменной валентности (Fe
2+
, Cu
2+
, Mn
2+
, Co
2+
, Cr
2+
,
Ag
+
). Например, процесс окисления пероксидом водорода с солью
железа протекает весьма эффективно при рН = 3-4,5. Продуктами
окисления являются
му
коновая и малеиновая кислоты.
В процессах водообработки используют не только окислитель-
ные, но и восстановительные свойства пероксида водорода. В нейт-
ральной и слабощелочной средах он легко взаимодейству ет с хлором
и гипохлоритами, переводя их в хлориды:
H
2
O
2
+ С1
2
-Ю
2
+ 2НС1, NaClO + H
2
O
2
-* NaCl + O
2
+ H
2
O. (II. 150)
Эти реакции используют при дехлорировании воды.
Избыток пероксида водорода можно удалять, обрабатывая его ди-
оксидом марганца:
MnO
2
+ H
2
O
2
+ 2НС1->МпС1
2
+ 2Н
2
0 + O
2
. (11.151)
Перспективным является окисление загрязнений пероксосерны-
ми кислотами: пероксомоносерной H
7
SO
5
и пероксодисерной H
2
S
2
O
8
.
Например, фенол окисляется пероксомоносерной кислотой (кислота
Каро) при рН - 10. Этим методом возможно снизить содержание
фенола до 5 10
-6
%. Скорость окисления зависит от соотношения
H
2
S0
5
/C
6
H
5
0H и повышается с ростом температуры.
Разрушение цианидов под действием пероксосерных кислот про-
текает также очень быстро. При этом в случае небольших концент-
раций цианидов (0,01-0,05%) в сточной воде используют H„S0
5
, а
при высоких концентрациях — H
2
S
2
O
8
. Оптимальным условиям со-
ответствует рН = 9. В нейтральной среде реакция окисления резко
замедляется под действием ионов железа, которые образуют ферро-
цианы, не подвергающиеся окислению.
Окисление кислородом воздуха. Кислород воздуха используют
при очистке воды от железа для окисления соединений двухвалент-
ного железа в трехвалентное с последующим отделением от воды
гидроксида железа. Реакция окисления в водном растворе протекает
по схеме:
4Fe
2+
+ O
2
+ 2Н
2
0 = 4Fe
3+
+ 40Н"; Fe
34
+ 3H
2
0 = Fe(OH)
3
+ ЗН
+
.
(11.152)
Окисление проводят при аэрировании воздуха через сточную воду
в башнях с хордовой насадкой. Образующийся гидроксид железа от-
стаивают в контактном резервуаре, а затем отфильтровывают. Ис-
пользование колонн с кусковой насадкой или кольцами Рашига не-
365
целесообразно, так как происходит зарастание насадки. Возможен
процесс упрощенной аэрации. В этом случае над поверхностью филь-
тра разбрызгивают воду, которая в виде капель падает на поверх-
ность фильтрующей загрузки. При контакте капель воды с воздухом
происходит окисление железа.
Кислородом воздуха окисляют также сульфидные стоки целлю-
лозных, нефтеперерабатывающих и нефтехимических заводов. Про-
цесс окисления гидросульфидной и сульфидной серы протекает че-
рез ряд стадий при изменении валентности серы с -2 до +6:
s
2
-->s->s o;-->s,o
2
--»so
2
-->so
no 2 3 3 4
(II. 152 a)
При этом при окислении гидросульфида и сульфида до тиосуль-
фата рН раствора повышается, при окислении гидросульфида до суль-
фида и сульфата рН раствора понижается, а при окислении сульфи-
да до сульфита и сульфата активная реакция среды не изменяется.
С повышением температуры и давления скорость реакции и глу-
бина окисления сульфидов и гидросульфидов увеличивается. Теоре-
тически на окисление Ir сульфидной серы расходуется Ir кислорода.
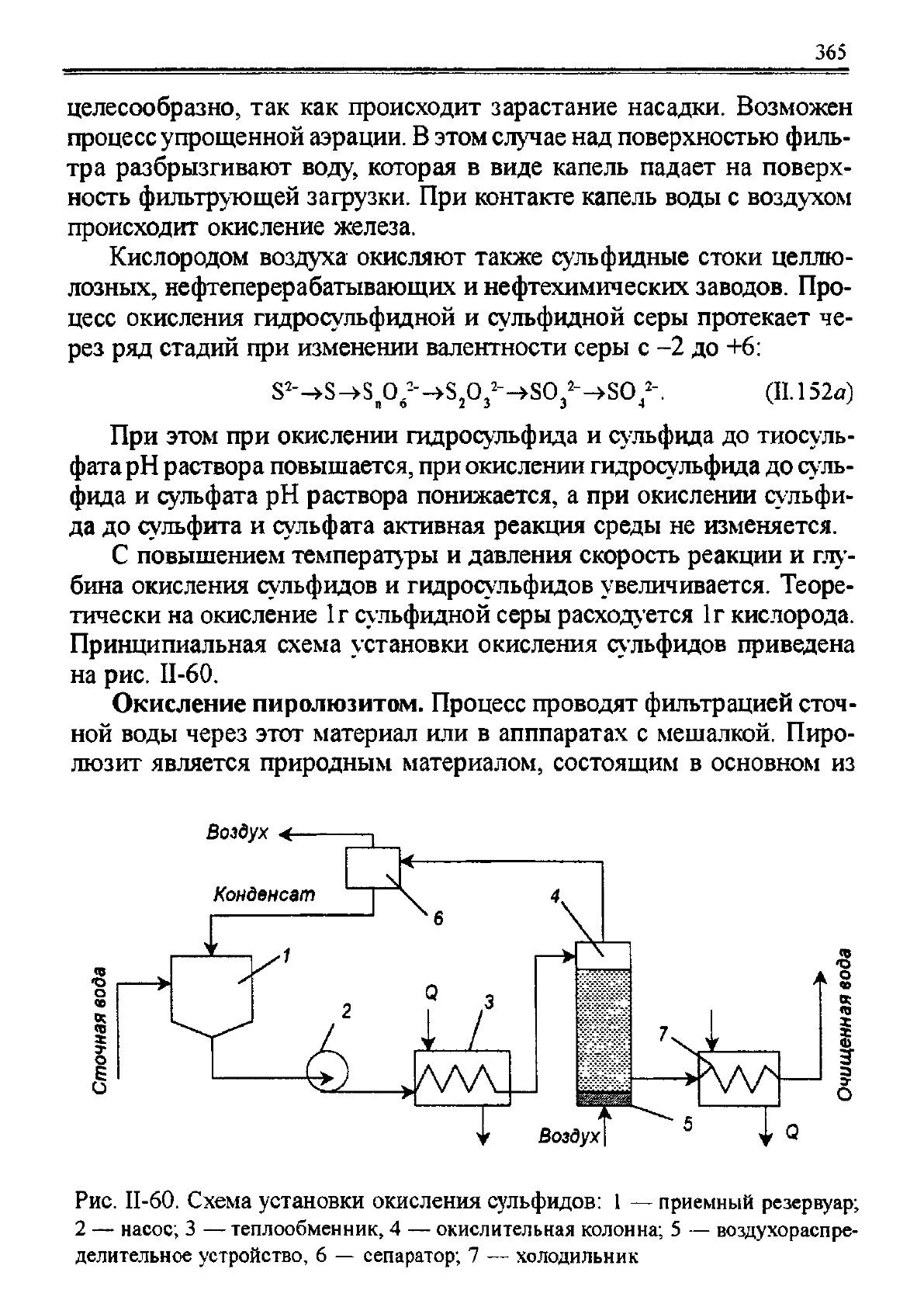
Принципиальная схема установки окисления сульфидов приведена
на рис. И-60.
Окисление пиролюзитом. Процесс проводят фильтрацией сточ-
ной воды через этот материал или в апппаратах с мешалкой. Пиро-
люзит является природным материалом, состоящим в основном из
<о
t
O
о
V
S
у
о
£
О
<0
•о
А °
и «о
о?
<0
X
ф
?
э-
О
Рис. II-60. Схема установки окисления сульфидов: 1 — приемный резервуар;
2 — насос; 3 — теплообменник, 4 — окислительная колонна; 5 — воздухораспре-
делительное устройство, 6 — сепаратор; 7 — холодильник

366
диоксида марганца. Его широко используют для окисления трехва-
лентного мышьяка в пятивалентный:
H
1
AsO. + MnO. + H.SO, = H.AsO, + MnSO, + Н,0. (II. 153)
33 i Z А 3 4 42
4
Повышение температуры способствует увеличению степени окис-
ления. Оптимальный режим окисления следующий: расход MnO
2
—
четырехкратный по сравнению со стехиометрическим, кислотность
воды 30-40 г/л, температура воды 70-80°С.
Озонирование. Окисление озоном позволяет одновременно обес-
печить обесцвечивание воды, устранение привкусов и запахов и обез-
зараживание. Озонированием можно очищать сточные воды от фе-
нолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ,
цианидов, красителей, канцерогенных ароматических углеводородов,
пестицидов и др.
Озон — газ бледно-фиолетового цвета. В природе находится в
верхних слоях атмосферы. При температуре -111,9°С озон превра-
щается в нестойкую жидкость темно-синего цвета.Физико-химичес-
кие свойства озона: относительная молеку лярная масса 48; плотность
(при температуре O
0
C и давлении 0,1 Мпа) 2,154 г/л; температура
плавления 192,5°С; теплота образования 143,64 кДж/моль; коэффи-
циент растворимости в воде при O
0
C — 0,49, при 20°С — 0,29; окис-
лительно-восстановигельный потенциал 2,07 В.
Чистый озон взрывоопасен, так как при его разложении высво-
бождается значительное количество тепла; очень токсичен. Макси-
мальная допу стимая концентрация в возду хе рабочей зоны равна
0,0001 мг/м
3
. Обеззараживающее действие озона основано на высо-
кой окислительной способности,
обу
словленной легкостью отдачи
им активного атома кислорода (O
3
= O
0
+ О). Озон окисляет все ме-
таллы, кроме золота, превращая их в оксиды.
В водном растворе озон диссоциирует быстрее, чем в воздухе.
Очень быстро диссоциирует в слабощелочных растворах. В кислот-
ных растворах озон проявляет большую стойкость. В чистом сухом
воздухе он разлагается очень медленно.
При обработке воды озоном происходит разложение органичес-
ких веществ и обеззараживание воды; бактерии погибают в несколь-
ко тысяч раз быстрее, чем при обработке воды хлором. Раствори-
мость озона в воде зависит от рН и содержания в воде растворимых
веществ. Небольшое содержание кислот и нейтральных солей увели-
чивает растворимость озона. Присутствие щелочей снижает раство-
римость O
3
.

367
Действие озона в процессе окисления может происходить в трех
различных направлениях: непосредственное окисление с участи-
ем одного атома кислорода; присоединение целой молекулы озона
к окисляемому веществу с образованием озонидов; каталитичес-
кое усиление окисляющего воздействия кислорода, присутствую-
щего в озонированном воздухе.
Механизм реакции разложения озона довольно сложен, по-
скольку на скорость деструкции влияет множество факторов: ус-
ловия перехода озона из газовой фазы в жидкость, соотношение
между парциальным давлением газа и его растворимостью в вод-
ном растворе, кинетика окисления озоном находящихся в воде
загрязнений.
При диспергировании озона в воду идут два основных про-
цесса — окисление и дезинфекция. Кроме того, происходит зна-
чительное обогащение воды растворенным кислородом. Окисле-
ние веществ может быть прямое и непрямое, а также может осу-
ществляться катализом и озонолизом.
Примером прямых реакций может служить окисление ряда
органических и минеральных веществ (Fe
2+
, Mn
2+
), которые после
озонирования осаждаются в форме нерастворимых гидроксидов
или переводятся в диоксиды и перманганаты.
Кинетика прямых реакций окисления может быть выражена
уравнением:
- ln[cj / [C
0
] = k[0
3
K
(П.
154)
где [с
о
], [сJ — соответственно начальная и конечная концентра-
ции вещества, мг/л; к — константа скорости реакции, л/(моль с);
[O
3
] — средняя концентрация озона во время прохождения реак-
ции, мг/л; т — продолжительность озонирования, с.
Непрямое окисление — окисление радикалами, например,
группой ОН и другими, образующимися в результате перехода
озона из газовой фазы в жидкость и его саморазложения. Интен-
сивность непрямого окисления прямо пропорциональна количе-
ству разложившегося озона и обратно пропорциональна концент-
рации присутствующих в воде загрязнителей.
Озонолиз представляет собой процесс фиксации озона на двой-
ной или тройной углеродной связи с последующим ее разрывом и
образованием озонидов, которые, как и озон, являются нестойки-
ми соединениями и быстро разлагаются:

368
R R"
4
C=C
y
+Or-
/ \
3
R R'"
R
R R"
4
C—C^ -
,/ \ / ^R'"
0.
•R—C—R' + R"—C-R"' + 1/2 O
2
.
IL IL
O O
Катализ — каталитическое воздействие озонирования заключа-
ется в усилении им окисляющей способности кислорода, который и
присутствует в озонированном воздухе.
Трудно четко определить последовательность и соотношение опи-
санных выше реакций, так как преобладание той или иной формы
окислительного воздействия зависит от многих параметров.
Озон получают из кислорода воздуха под действием электричес-
кого разряда в генераторах. Перед подачей воздуха или чистого кис-
лорода в генератор его предварительно осушают, так как с
у
величе-
нием влажности возду ха выход озона уменьшается. Расход энергии
на производство
1
кг озона из атмосферного воздуха составляет око-
ло 18 кВт ч; из кислорода — около 9 кВт ч.
Озон подают в сточную воду* в виде озоно-воздушной или озоно-
кислородной смеси. Концентрация озона в смеси — около 3%. Для
усиления процесса окисления смесь диспергируют в сточной воде на
мельчайшие пузырьки газа. Озонирование представляет собой про-
цесс абсорбции, сопровождаемый химической реакцией в жидкой
фазе. Расход озона, необходимого для окисления загрязнений, может
быть определен по уравнению массообмена:
M=P' FAc ,
~ ж ж'
где M — расход озона, переходящего из газовой фазы в жидкую, кг/с;
Р'
ж
— коэффициент массоотдачи в жидкой фазе при протекании в
ней химической реакции, м/с; F — поверхность контакта фаз, м
2
:
Ac^ — движущая сила процесса, кг/м
3
.
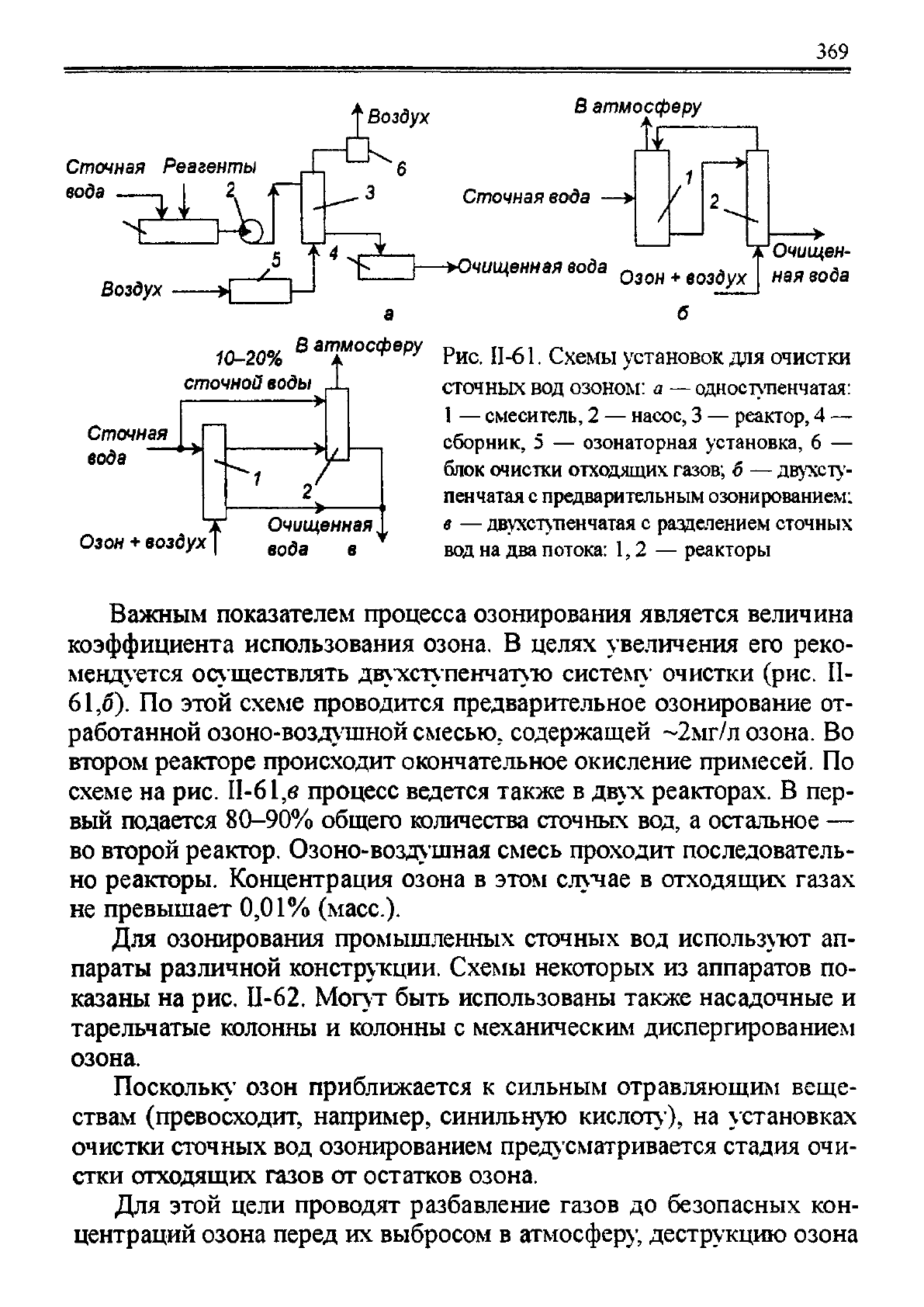
Технологические схемы установок для очистки сточных вод озо-
нированием показаны на рис. II-61. На установках предусматрива-
ется очистка отходящих газов после реактора от остатков озона. Од-
ноступенчатая установка представлена на рис. 11-61,«.
369
Сточная Реагенты
вода -
li
А
Воздух
C
4
-K
_ 3
А 4
Воздух
1
а
Сточная
вода
«
лв
/ В атмосферу
10-20% ж ^
сточной воды -L
>
1
п
Озон + воздух
Очищенная
вода в
В атмосферу
Сточная вода
±
—>
1
/
/
2
/
+Очищеннаявода
Озон
,
воз
^
б
ная вода
Рис. II-61. Схемы установок для очистки
сточных вод озоном: a — одноступенчатая:
1 — смеситель, 2 — насос, 3 — реактор, 4 —
сборник, 5 — озонаторная установка, 6 —
блок очистки отходящих газов; б — двухсту-
пенчатая с предварительным озонированием:
в — двухступенчатая с разделением сточных
вод на два потока: 1,2 — реакторы
Важным показателем процесса озонирования является величина
коэффициента использования озона. В целях увеличения его реко-
мендуется осуществлять двухступенчатую систему
1
очистки (рис. II-
61,6). По этой схеме проводится предварительное озонирование от-
работанной озоно-воздушной смесью, содержащей ~2мг/л озона. Во
втором реакторе происходит окончательное окисление примесей. По
схеме на рис. II-61,e процесс ведется также в двух реакторах. В пер-
вый подается 80-90% общего количества сточных вод, а остальное —
во второй реактор. Озоно-воздушная смесь проходит последователь-
но реакторы. Концентрация озона в этом случае в отходящих газах
не превышает 0,01% (масс.).
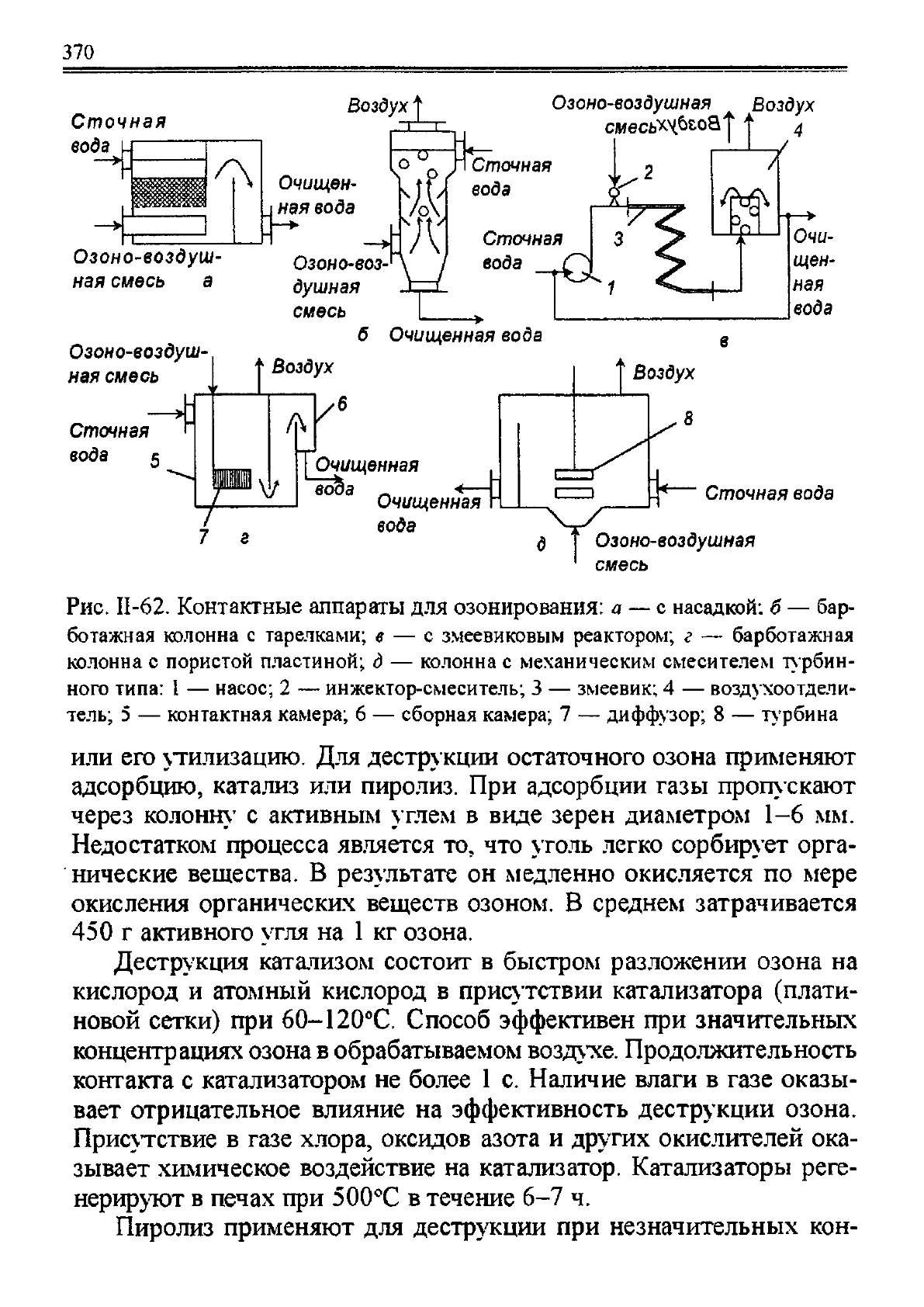
Для озонирования промышленных сточных вод ИСПОЛЬЗУЮТ ап-
параты различной конструкции. Схемы некоторых из аппаратов по-
казаны на рис. 11-62. Могут быть использованы также насадочные и
тарельчатые колонны и колонны с механическим диспергированием
озона.
Поскольку озон приближается к сильным отравляющим веще-
ствам (превосходит, например, синильную кислоту
),
на
у
становках
очистки сточных вод озонированием
преду
сматривается стадия очи-
стки отходящих газов от остатков озона.
Для этой цели проводят разбавление газов до безопасных кон-
центраций озона перед их выбросом в атмосфер}; деструкцию озона
370
Сточная
вода
Воздух t
If
Л
шш
Очищен-
ц пая вода
г*
Озоно-воздуш-
ная смесь а
Озоно-воздуш
пая смесь
Л
HfA
j
Озоно-воз-
1
^ /
TT
of.
Озоно-воздушная Воздух
смеськфгоЪ^ I 4
душная
смесь
Сточная
вода
Сточная
вода
б Очищенная вода
в
Воздух
Сточная
вода 5
Очищенная
вдйа
Очищенная
вода
Сточная вода
Озоно-воздушная
смесь
Рис. II-62. Контактные аппараты для озонирования: a — с насадкой: б — бар-
ботажная колонна с тарелками; в — с змеевиковым реактором; г — барботажная
колонна с пористой пластиной; д — колонна с механическим смесителем турбин-
ного типа: 1 — насос; 2 — инжектор-смеситель; 3 — змеевик; 4 — воздухоотдели-
тель; 5 — контактная камера; 6 — сборная камера; 7 — диффузор; 8 — турбина
или его утилизацию. Для деструкции остаточного озона применяют
адсорбцию, катализ или пиролиз. При адсорбции газы пропускают
через колонну' с активным углем в виде зерен диаметром 1-6 мм.
Недостатком процесса является то, что уголь легко сорбирует орга-
нические вещества. В результате он медленно окисляется по мере
окисления органических веществ озоном. В среднем затрачивается
450 г активного угля на 1 кг озона.
Деструкция катализом состоит в быстром разложении озона на
кислород и атомный кислород в присутствии катализатора (плати-
новой сетки) при 60-120°С. Способ эффективен при значительных
концентрациях озона в обрабатываемом воздухе. Продолжительность
контакта с катализатором не более 1 с. Наличие влаги в газе оказы-
вает отрицательное влияние на эффективность деструкции озона.
Присутствие в газе хлора, оксидов азота и других окислителей ока-
зывает химическое воздействие на катализатор. Катализаторы реге-
нерируют в печах при 5 00°С в течение 6-7 ч.
Пиролиз применяют для деструкции при незначительных кон-
