Расчёт абсорбционной установки
Подождите немного. Документ загружается.


Учреждение образования "БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ"
Заочный факультет
Кафедра процессов и аппаратов химических производств
Специальность 06
Специализация 1-48 01 02 05 Технология переработки эластомеров
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
КУРСОВОГО ПРОЕКТА
по дисциплине «Процессы и аппараты химических производств»
Тема «Расчёт абсорбционной установки»
Исполнитель
студентка __5_ курса группы__2_ _______ О.Ю. Ипонова
Руководитель
С.К. Протасов
Курсовой проект защищён с оценкой________

Изм. Лист № докум. Подпис
ь
Дата
Лист
1
БГТУ 00.00. ПЗ
Разраб.
Пров.
.
Утв.
Реферат
Лит. Листов
1
Руководитель____________________ С.К.
Протасов
Минск 2008
РЕФЕРАТ
2 листа иллюстрированного материала, 60 страниц, 33 рисунка,
6 литературных источников
АБСОРБЦИЯ, КОНЦЕНТРАЦИЯ, РЕЦИРКУЛЯЦИЯ, АБСОРБЕР,
НАСАДКА, ТЕПЛООБМЕННИК, ГИДРАВЛИЧЕСКОЕ СОПРОТИВЛЕНИЕ,
НАСОС
Целью курсового проекта является расчёт проекта абсорбционной
установки.
В курсовой проект входит литературный обзор заданной теме, в котором
описаны теоретические основы разрабатываемого процесса, основные
технологические схемы для проведения абсорбции. Представлен подробный расчёт
типового оборудования для проектируемой установки.
В проекте описана технологическая схема проектируемого процесса.
Приведен подробный расчет абсорбера и теплообменника.
Помимо основного оборудования также приведён расчёт вспомогательного
оборудования: насоса и вентилятора.

Изм
.
Лис
т
№ докум. Подпи
сь
Дат
а
Лист
1
БГТУ 00.00.ПЗ
Разраб.
Пров.
.
Утв.
Содержание
Лит. Листов
1
\
СОДЕРЖАНИЕ
Введение………………………………………………………………………….
1. Описание принятых инженерных решений…………………………………
1.1. Теоретические основы разрабатываемого процесса.…...………………
1.1.1 Равновесие между фазами…………………………………………….
1.1.2. Материальный баланс и расход абсорбента…………………………
1.1.3. Скорость процесса…………………………………………………….
1.2. Основные технологические схемы для проведения
абсорбции………..
1.3. Типовое оборудование для проектируемой
установки…………………
1.3.1. Поверхностные и пленочные абсорберы……………………………
1.3.2. Насадочные абсорберы……………………………………………….
1.3.3. Барботажные (тарельчатые) абсорберы……………………………...
1.3.4. Распыливающие абсорберы…………………………………………..

Изм
.
Лист № докум. Подпис
ь
Дата
Лист
1
БГТУ 00.00.ПЗ
Разраб.
Пров.
Утв.
Введение
Лит. Листов
1
2. Обоснование и описание установки………………………………………….
3. Подробный расчёт абсорбера. ……………………………………………….
3.1. Масса поглощаемого вещества и расход
поглотителя………………….
3.2. Движущая сила массопередачи…………………………………………..
3.3. Коэффициент массопередачи…………………………………………….
3.4. Скорость газа и диаметр абсорбера………………………………………
3.5. Плотность орошения и активная поверхность насадки…………………
3.6. Расчёт коэффициентов массоотдачи……………………………………..
3.7. Поверхность массопередачи и высота абсорбера………………………
3.8. Гидравлическое сопротивление абсорберов…………………………….
4. Подробный расчёт теплообменника………………………………..………..
5. Расчёт вспомогательного оборудования…………………………………….
5.1. Расчёты вентилятора………………………………………………………
5.2. Расчет
насоса………………………………………………………………
Заключение……………………………………………………………………….
Список использованной литературы …………………………………………...
ВВЕДЕНИЕ
Химическая промышленность - прогрессивная,
быстроразвивающаяся отрасль тяжелой индустрии страны. Химия все
больше проникает во все сферы народного хозяйства. Химизация хозяйства
позволяет решать важные технические и экономические проблемы,
создавать новые материалы с наружными свойствами, повышать
производительность труда. Крупные потребители продукции отрасли - это
машиностроение, текстильная, целлюлозно-бумажная промышленность,
транспорт, строительство. Интенсификация сельского хозяйства немыслима
без применения минеральных удобрений. Важную роль играет химическая
промышленность в увеличении выпуска и расширении ассортимента
товаров народного потребления.
Современная химическая технология дает возможность
использовать практически неограниченный круг сырья, заменить дорогое
сырье дешевым и широко распространенным, перерабатывать отходы
других производств. Химическая промышленность открывает широкие
возможности для комплексного использования сырья, что устанавливает
сложные производственные связи со многими отраслями промышленности.
Химическая индустрия комбинируется с черной и цветной металлургией,
коксованием угля, переработкой нефти, деревообрабатывающей
промышленностью.
Химическая промышленность объединяет около 30
специализированных отраслей, разнородных по сырью и назначению
выпускаемой продукции, но сходных по технологии производства. В ее
составе выделяют три основные группы отраслей: 1) горно-химическая;
2) основная (неорганическая) химия; 3) промышленность органического
синтеза /1/.

Изм
.
Лист № докум. Подпис
ь
Дата
Лист
1
БГТУ 01.00.ПЗ
Разраб.
Пров.
.
Утв.
Литературный обзор
ит. Листов
28
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1. Теоретические основы разрабатываемого процесса
Абсорбцией называют процесс поглощения газов или паров из газовых или
парогазовых смесей жидкими поглотителями (абсорбентами).
При физической абсорбции поглощаемый газ (абсорбтив) не
взаимодействует химически с абсорбентом. Если же абсорбтив образует
абсорбентом химическое соединение, то процесс называется хемосорбцией.
Физическая абсорбция в большинстве случаев обратима. На этом свойстве
абсорбционных процессов основано выделение поглощенного газа из раствора –
десорбция /1/.
1.1.1. Равновесие между фазами.
При абсорбции содержание газа в растворе зависит от свойств газа и
жидкости, давления, температуры и состава газовой фазы (парциального давления
растворяющегося газа в газовой смеси).
В случае растворения в жидкости бинарной газовой смеси (распределяемый
компонент А, носитель В) взаимодействуют две фазы (Ф-2), число компонентов
равно 3 (К-3) и, согласно правилу фаз, число степеней свободы системы равно
трем.
Для данной системы газ – жидкость переменными являются температура,
давление и концентрации в обеих фазах. Следовательно, в состоянии равновесия
при постоянной температуре и общем давлении зависимость между парциальным
давлением газа А (или его концентрацией) и составом жидкой фазы однозначна.
Эта зависимость выражается законом Генри: парциальное давление p
А
растворенного газа пропорционально его мольной доле x
A
в растворе (1.1) или
растворимость газа (поглощаемого компонента А) в жидкости при данной
температуре пропорциональна его парциальному давлению над жидкостью (1.2):
P
*
A
= E
.
x
A
(1.1)
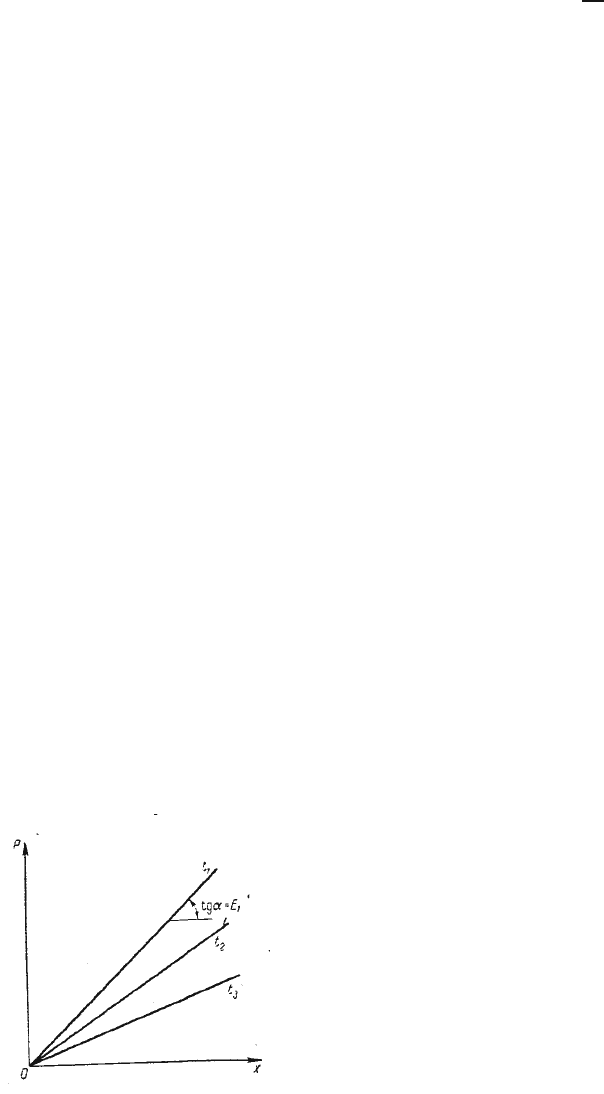
х
А
¿
=
1
Е
⋅р
А
(1.2)
где p
*
A
– парциальное давление поглощаемого газа, находящегося в
равновесии с раствором, имеющим концентрацию x
A
(в мол. долях); x
*
A
–
концентрация газа в растворе (в мол. долях), равновесном с газовой фазой, в
которой парциальное давление поглощаемого компонента равно p
A
; Е –
коэффициент пропорциональности, называемый коэффициентом, или константой
Генри.
Для идеальных растворов на диаграмме p-x (рис.1.1) зависимость
равновесных концентрацией от давления изображается прямой, имеющей наклон,
равный Е – коэффициенту Генри. Из рис.1.1 следует, что с повышением
температуры (при прочих равных условиях) увеличивается значение Е и
соответственно уменьшается, согласно уравнению (1.2), растворимость газа в
жидкости.
Растворимость газа в жидкости при различных температурах
Рис.1.1
Если y
A
– мол. доля извлекаемого компонента А в газовой смеси и Р – общее
давление в системе, то парциальное давление p
A
по закону Дальтона, можно
выразить зависимостью:
p
A
= P
.
y
A
(1.3)
Подставив значение p
A
в уравнение 1.1, получим:

у
А
¿
=
Е
Р
⋅х
А
(1.4)
или закон Генри может быть представлен в форме
y
*
A
= m
.
x
(1.5)
где m = E/P – коэффициент распределения, или константа фазового
равновесия.
Уравнение 1.5 показывает, что зависимость между концентрациями
компонента в газовой смеси и в равновесной с ней жидкости выражается прямой
линией, проходящей через начало координат и имеющей угол наклона, тангенс
которого равен m. Числовые значения величины m зависят от температуры и
давления в системе: уменьшаются с увеличением давления и снижением
температуры. Таким образом, растворимость газа в жидкости увеличивается с
повышением давления и снижением температуры.
Когда в равновесии с жидкостью находится смесь газов, закону Генри может
следовать каждый из компонентов смеси в отдельности.
Закон Генри применим к растворам газов, критические температуры которых
выше температуры раствора, и справедлив только для идеальных растворов.
Поэтому он с достаточной точностью применим лишь к сильно разбавленным
реальным растворам, приближающимся по свойствам к идеальным, т.е.
соблюдается при малых концентрациях растворенного газа или при его малой
растворимости. Для хорошо растворимых газов, при больших концентрациях их в
растворе, растворимость меньше, чем следует из закона Генри. Для систем,
подчиняющихся этому закону, коэффициент m в уравнении 1.5 является величиной
переменной и линия равновесия представляет собой кривую, которую строят
обычно по опытным данным.
Для описания равновесия между газом и жидкостью уравнение 1.5
применимо только при умеренных давлениях, невысоких температурах и
отсутствии химического взаимодействия между газом и поглотителем.
При повышенных давлениях (порядка десятков атмосфер и выше) равновесие
между газом и жидкостью не следует закону Генри, так как изменение объема

жидкости вследствие растворения в ней газа становится соизмеримым с
изменением объема данного газа. При этих условиях константу фазового
равновесия можно определить следующим образом:
m=
Е
f
0
,
(1.6)
где f
0
– фугитивность (летучесть) поглощаемого газа, выраженная в единицах
давления.
Для бинарных растворов величина может быть найдена следующим образом:
ln=
f
0
x
=ln E−
A
R⋅T
[
1−
(
1−x
)
2
]
,
(1.7)
где А – постоянная.
При выражении состава фаз не в абсолютных, а в относительных
концентрациях видоизменяется и запись закона Генри. Так, например,
использовании относительных мольных концентраций на основе зависимости 1.6
выражение 1.5 можно записать в виде:
Y
¿
1+Y
¿
=
m⋅X
1+ X
откуда по правилу пропорций
Y
¿
1+Y
¿
−Y
¿
=
m⋅X
1+X −X
или
Y
¿
=
m⋅X
1+ X−m⋅X
=
m⋅X
1+
(
1−m
)
⋅X
(1.8)
Следовательно, при выражении закона Генри в относительных
концентрациях равновесие в системе газ-жидкость изображается также кривой
линией. Однако для сильно разбавленных растворов (малые концентрации Х газа в

жидкости) можно принять (1-m)
.
X ≈ 0. Тогда знаменатель уравнения 1.8 обращается
в единицу и уравнение принимает вид
Y
*
= m
.
X (1.9)
При таком выражении закон Генри изображается прямой линией.
В случае абсорбции многокомпонентных смесей равновесные зависимости
значительно сложнее, чем при абсорбции одного компонента, особенно тогда,
когда раствор сильно отличается от идеального. При этом парциальное давление
каждого компонента в газовой смеси зависит не только от его концентрации в
растворе, но также и от концентрации в растворе остальных компонентов, т.е.
является функцией большого числа переменных. Поэтому, как правило, в
подобных случаях равновесные зависимости основываются на опытных данных /1/.
1.1.2. Материальный баланс и расход абсорбента.
Примем расходы фаз по высоте аппарата постоянными и выразим
содержание поглощаемого газа в относительных мольных концентрациях.
Обозначим: G - расход инертного газа, кмоль/сек; Y
н
и Y
к
- начальная и конечная
абсорбтива в газовой смеси, кмоль/кмоль инертного газа; L - расход абсорбента,
кмоль/сек; его концентрации X
н
X
к
, кмоль/кмоль абсорбента. Тогда уравнение
материального баланса будет:
G
.
(Y
н
–Y
к
) = L
.
(X
н
–X
к
) (1.10)
Отсюда общий расход (в кмоль/кмоль)
L=G⋅
(
Y
н
−Y
к
)
(
X
к
−Х
н
)
(1.11)
а его удельный расход (в кмоль/кмоль инертного газа)
l=
L
G
=
(
Y
н
−Y
к
)
(
X
к
−Х
н
)
(1.12)
Это уравнение можно переписать так:
Y
н
–Y
к
= l
.
(X
к
–X
н
) (1.13)
