Пророков В.Н. Химия. Сборник вопросов и задач: учебное пособие для старшеклассников
Подождите немного. Документ загружается.

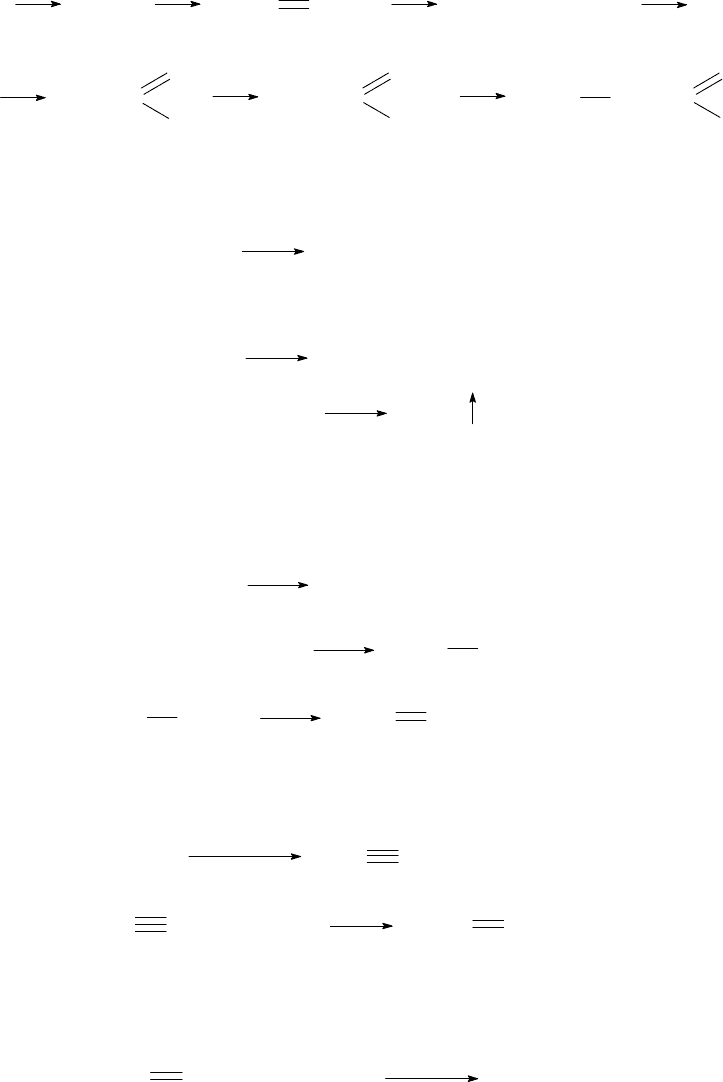
150
14. Взаимосвязь между классами органических соединений
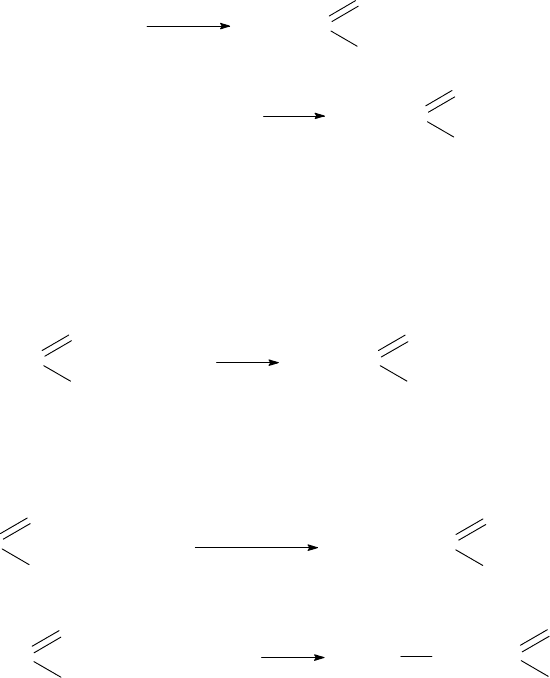
Между различными классами органических веществ существует генетиче-
ская взаимосвязь, позволяющая осуществлять синтезы нужных соединений, ос-
новываясь на выбранной схеме превращений. В свою очередь, простейшие ор-
ганические вещества могут быть получены из неорганических веществ. В каче-
стве примера рассмотрим практическое осуществление реакций согласно сле-
дующей схеме:
CCH
4
CH
2
CH
2
CH
3
CH
2
OH
CH
3
C
O
H
CH
3
C
O
OH
H
2
N CH
2
C
0- 4
- 2 - 2
- 3
- 1
- 3
+1
- 3 +3 - 3
- 1
+3
метан
этилен
этанол
этаналь уксусная к-та
аминоуксусная к-та
O
OH
.
1) Из углерода (графита) метан можно получить прямым синтезом:
t
CH
4
C + 2H
2
,
или в две стадии – через карбид алюминия:
3C + 4Al Al
4
C
3
t
Al
4
C
3
+ 12H
2
O
CH
4
+ Al(OH)
3
.
2) Этилен из метана можно получить разными способами в несколько ста-
дий, например, можно провести синтез Вюрца с последующим дегидрировани-
ем этана:
CH
4
+ Br
2
CH
3
Br + HBr
νh
2CH
3
Br + 2Na
CH
3
CH
3
+ 2NaBr
CH
3
CH
3
Ni, t
CH
2
CH
2
+ H
2
,
или осуществить термический крекинг метана и частичное гидрирование полу-
ченного ацетилена:
2CH
4
1500 C
o
CH CH + 3H
2
CH CH + H
2
Ni
CH
2
CH
2
.
3) Этиловый спирт получается при гидратации этилена в присутствии неор-
ганической кислоты:
CH
2
CH
2
+ H
2
O
H
+
, t
CH
3
CH
2
OH
.
151
4) Уксусный альдегид (этаналь) можно получить дегидрированием этанола
на медном катализаторе, или при окислении спирта оксидом меди(II):
CH
3
CH
2
OH
200 C
Cu
o
CH
3
C
O
H
+ H
2
CH
3
CH
2
OH + CuO
t
CH
3
C
O
H
+ Cu + H
2
O
.
5) Уксусный альдегид легко окисляется до уксусной кислоты, например, по
реакции «серебряного зеркала», или при взаимодействии с подкисленным рас-
твором KMnO
4
или K
2
Cr
2
O
7
при нагревании. Схематично это можно показать
следующим уравнением (попробуйте составить полные уравнения реакций):
CH
3
C
O
H
+ [O]
CH
3
C
O
OH
.
6) Синтез аминоуксусной кислоты проводится через промежуточную ста-
дию получения хлоруксусной кислоты:
CH
3
C
O
OH
+ Cl
2
P
ClCH
2
C
O
OH
ClCH
2
C
O
OH
+ 2NH
3
H
2
N CH
2
C
O
OH
+ NH
4
Cl
(красн.)
+ HCl
.
Обратите внимание на то, что галогенопроизводные органических соеди-
нений, ввиду их высокой реакционной активности, часто используются в орга-
нических синтезах в качестве исходных и промежуточных веществ.

152
13. Примеры вариантов заданий для подготовки
к единому государственному экзамену по химии
Внимательно прочитайте и проанализируйте каждое задание. Для экономии
времени пропускайте задание, которое не удаётся выполнить сразу, и перехо-
дите к следующему. К пропущенному заданию вы сможете вернуться после
выполнения всей работы, если останется время.
При выполнении работы вы можете пользоваться периодической системой
химических элементов Д.И. Менделеева, таблицей растворимости солей, ки-
слот и оснований в воде, электрохимическим рядом напряжений металлов (они
прилагаются к тексту работы), а также непрограммируемым калькулятором, ко-
торый
выдается на экзамене.
За выполнение различных по сложности заданий дается один или более
баллов. Баллы, полученные вами за выполненные задания, суммируются. По-
старайтесь выполнить как можно больше заданий и набрать наибольшее коли-
чество баллов.
Вариант № 1
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером
выполняемого вами задания (А1 – А30) поставьте знак « × » в клеточку, но-
мер которой соответствует номеру выбранного вами ответа.
А1. Число электронов в ионе железа Fe
2+
равно
1) 54 2) 28 3) 58 4) 24
А2. Среди элементов VIА группы максимальный радиус атома имеет
1) кислород 2) сера 3) теллур 4) полоний
А3. Соединения с ковалентной неполярной связью расположены в ряду:
1) O
2
, Cl
2
, H
2
2) HCl, N
2
, F
2
3) O
3
, P
4
, H
2
O
4) NH
3
, S
8
, NaF
А4. Наибóльшую степень окисления сера проявляет в соединении
1) CaS 2) Li
2
SO
3
3) CaSO
4
4) H
2
S
153
А5. Веществом молекулярного строения является
1) озон
2) оксид бария
3) графит
4) сульфид калия
А6. Амфотерным гидроксидом и кислотой соответственно являются
1) H
2
SO
4
и Zn(OH)Cl
2) Ca(OH)
2
и Be(OH)
2
3) KHSO
4
и NaOH
4) Al(OH)
3
и HNO
3
А7. В каком ряду химические элементы расположены в порядке усиления
металлических свойств?
1) Na, Mg, Al
2) Al, Mg, Na
3) Cа, Mg, Be
4) Mg, Be, Cа
А8. Формула высшего оксида хлора
1) Cl
2
O 2) ClO
2
3) Cl
2
O
5
4) Cl
2
O
7
А9. Верны ли следующие суждения о меди?
А. Для меди характерны степени окисления + 1 и + 2.
Б. Медь вытесняет цинк из раствора сульфата цинка.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А10. Оксид кальция взаимодействует с каждым из трёх веществ:
1) кислород, вода, серная кислота
2) соляная кис
л
ота, углекислый газ, вода
3) оксид магния, оксид серы(IV), аммиак
4) железо, азотная кислота, оксид фосфора(V)
А11. Гидроксид хрома(III) взаимодействует с каждым из двух веществ:
1) СО
2
и HCl
2) SiО
2
и NaOH
3) NО и NaNO
3
4) H
2
SO
4
и NaOH

154
А12. Карбонат кальция реагирует с
1) HCl 2) MgO 3) Pb 4) H
2
O
А13. В схеме превращений
Fe(OH)
3
⎯
→
⎯
t
o
X
1
⎯
⎯
→
⎯
+
HCl
X
2
веществом «X
2
» является
1) Fe
2
O
3
2) FeO 3) FeCl
3
4) FeCl
2
А14. Изомерами являются
1) диметилпропан и пентан
2) циклопентан и циклогексан
3) пропан и пропен
4) этан и пропан
А15. В молекуле какого вещества все атомы углерода находятся в состоянии
sp
2
-гибридизации?
1) гексана 2) гексена 3) этана 4) этена
А16. Характерной реакцией для многоатомных спиртов является
взаимодействие с
1) H
2
2) Сu
3) Ag
2
O (NH
3
р-р)
4) Cu(OH)
2
А17. Уксусная кислота не взаимодействует с
1) CuO 2) Cu(OH)
2
3) Na
2
CO
3
4) Na
2
SO
4
А18. В схеме превращений
C
6
H
5
CH
3
→ X → C
6
H
5
–CH
2
OH
веществом «Х» является
1) C
6
H
5
OH
2) C
6
H
5
–CH
2
Cl
3) C
6
H
5
Cl
4) C
6
H
5
COOH
А19. К реакциям замещения относится взаимодействие
1) этена и воды
2) брома и водорода
3) брома и пропана
4) метана и кислорода

155
А20. С наибольшей скоростью протекает реакция между
1) AgNO
3
(р-р) и NaCl (р-р)
2) CaCO
3
и HCl (р-р)
3) Zn и H
2
SO
4
4) Mg и O
2
А21. В системе
2CO
(г) + O
2
(г) 2CO
2
(г) + Q
смещению химического равновесия в сторону исходных веществ
будет способствовать
1) увеличение давления
2) увеличение концентрации оксида углерода(IV)
3) уменьшение температуры
4) увеличение концентрации кислорода
А22. Неэлектролитами являются все вещества, указанные в ряду:
1) этанол, хлорид калия, сульфат бария
2) растительное масло, гидроксид калия, ацетат натрия
3) сахароза, глицерин, метанол
4) сульфат натрия, глюкоза, уксусная кисл
ота
А23. С выпадением осадка протекает реакция ионного обмена
между растворами
1) гидроксида натрия и хлорида бария
2) сульфата хрома(III) и гидроксида калия
3) нитрата кальция и бромида натрия
4) хлорида аммония и нитрата алюминия
А24. В какой реакции оксид серы(IV) является восстановителем?
1) SO
2
+ 2NaOH = Na
2
SO
3
+ H
2
O
2) SO
2
+ 2H
2
S = 3S + 2H
2
O
3)
SO
2
+ H
2
O H
2
SO
3
4)
2SO
2
+ O
2
2SO
3
А25. Щелочную реакцию среды имеет раствор каждой из двух солей:
1) КCl и Na
2
S
2) К
2
SiO
3
и Na
2
CO
3
3) FeCl
2
и NН
4
Cl
4) CuSO
4
и Na
2
SO
4

156
А26. Верны ли следующие суждения?
А. Алканы вступают в реакции полимеризации.
Б. Этилен обесцвечивает раствор перманганата калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А.27. Пропанол-1 образуется в результате реакции, схема которой
1)
СН
3
СН
2
СНО + H
2
→
2)
СН
3
СН
2
СНО + Cu(OH)
2
→
3)
СН
3
СН
2
Сl + H
2
O →
4)
СН
3
СН
2
СНО + Ag
2
O →
А28. Белки приобретают жёлтую окраску под действием
1) HNO
3
(конц.)
2) Cu(OH)
2
3) H
2
SO
4
(конц.)
4) [Ag(NH
3
)
2
]OH
А29. Основной составной частью природного газа является
1) ацетилен 2) метан 3) пропан 4) бутан
А30. Согласно уравнению реакции
2СО
(г) + О
2
(г) = 2СО
2
(г) + 566 кДж
при сжигании оксида углерода(II) выделилось 152 кДж теплоты.
Объём (н.у.) сгоревшего газа составил
1) 6 л 2) 12 л 3) 44,8 л 4) 120 л
Часть 2
Ответом к заданиям этой части (В1 – В10) является набор цифр или чис-
ло, которые следует записать в бланк ответов № 1 справа от номера соот-
ветствующего задания, начиная с первой клеточки. Каждую цифру и запя-
тую в записи десятичной дроби пишите в отдельной клеточке в соответ-
ствии с приведенными в бланке образцами.
В заданиях В1 – В5 на установление соответствия запишите в таблицу
цифры выбранных вами ответов, а затем получившуюся последователь-
ность цифр перенесите в бланк ответов № 1 без пробелов и других симво-
лов. (Цифры в ответе могут повторяться.)

157
В1. Установите соответствие между названием органического соединения и
классом, к которому оно принадлежит.
НАЗВАНИЕ СОЕДИНЕНИЯ КЛАСС ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
А) диметилбензол 1) сложные эфиры
Б) гексанол-3 2) углеводороды
В) метилформиат 3) спирты
Г) стирол 4) карбоновые кислоты
5) аминокислоты
6) простые эфиры
А Б В Г
В2. Установите соответствие между веществами, вступившими в реакцию,
и продуктами их взаимодействия.
ФОРМУЛЫ РЕАГИРУЮЩИХ
ВЕЩЕСТВ
ПРОДУКТЫ
ВЗАИМОДЕЙСТВИЯ
А)
32
NH O+→
1)
3
HNO
Б)
Pt
32
NH O+⎯⎯→
2)
32
HNO O
+
В)
222
NO O Н O++ →
3)
22
N Н O
+
Г)
t
3
NH CuO+⎯⎯→
o
4)
22
Cu N Н O
+
+
5)
2
NO Н O
+
А Б В Г
В3.Установите соответствие между формулой вещества и продуктом, который
образуется на катоде в результате электролиза его водного раствора.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТ ЭЛЕКТРОЛИЗА
А) Cu(NO
3
)
2
1) металл
Б) AgNO
3
2) водород
В) СaCl
2
3) кислород
Г) Na
2
SO
4
4) хлор
5) оксид серы (IV)
6) оксид азота (IV)
A Б В Г

158
В4. Установите соответствие между названием соли и её способностью
к гидролизу.
НАЗВАНИЕ СОЛИ СПОСОБНОСТЬ К ГИДРОЛИЗУ
А) карбонат натрия 1) гидролиз по катиону
Б) хлорид аммония 2) гидролиз по аниону
В) сульфат калия 3) гидролиз по катиону и аниону
Г) сульфид алюминия 4) гидролизу не подвергается
А Б В Г
В5. Установите соответствие между веществами, вступающими в реакцию,
и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А)
KHCO
3
+ KOH →
1) KNO
3
+ CO
2
+ H
2
O
Б)
KHCO
3
+ HCl →
2) KCl + Na
2
CO
3
В)
K
2
CO
3
+ HNO
3
→
3) K
2
CO
3
+ H
2
O
Г)
K
2
CO
3
+ ВаCl
2
→
4) KCl + H
2
O + CO
2
5) ВаСO
3
+KCl
А Б В Г
Ответом к заданиям В6 – В8 является последовательность цифр. Запи-
шите три выбранные цифры в порядке возрастания сначала в текст рабо-
ты, а затем перенесите их в бланк ответов № 1 без пробелов и других сим-
волов.
В6. С водородом взаимодействует каждое из двух веществ:
1) бензол, пропан
2) бутен, этан
3) дивинил, этен
4) стирол, бутадиен-1,3
5) дихлорэтан, бутан
6) этин, бутин-1
Ответ: _________________ .

159
В7. Метанол взаимодействует с веществами:
1) хлороводород
2) карбонат натрия
3) глицин
4) гидроксид железа(III)
5) бензол
6) метановая кислота
Ответ: _________________ .
В8. И с анилином, и с аланином способны реагировать
1) хлор
2) бромоводород
3) этан
4) пропен
5) серная кислота
6) гидроксид калия
Ответ: ________________ .
Ответом к заданиям В9, В10 является число. Запишите это число в текст
работы, а затем перенесите его в бланк ответов № 1 без указания единиц
измерения.
В9. Определите массу воды, которую надо добавить к 20 г 70%-го раствора
уксусной кислоты для получения 3%-го раствора уксуса.
Ответ: __________ г. (Запишите число с точностью до целых.)
В10. Рассчитайте массу свинца, полученного в результате взаимодействия
6,6 г цинка с избытком раствора нитрата свинца.
Ответ: __________ г. (Запишите число с точностью до целых.)
Не забудьте перенести все ответы в бланк ответов № 1.
