Ответы на вопросы по физической химии для аспирантуры РАН
Подождите немного. Документ загружается.

Термодинамическая энтропия — аддитивная термодинамическая величина, функция
состояния термодинамической системы.
Энтропия, функция состояния S термодинамической системы, изменение которой dS для
бесконечно малого обратимого изменения состояния системы равно отношению количества теплоты
полученного системой в этом процессе (или отнятого от системы), к абсолютной температуре
Величина dS является полным дифференциалом, т.е. ее интегрирование по любому
произвольно выбранному пути дает разность между значениями энтропии в начальном (А) и
конечном (В) состояниях:
Теплота не является функцией состояния, поэтому интеграл от δQ зависит от выбранного
пути перехода между состояниями А и В. Энтропия измеряется в Дж/(моль·град).
где р - давление, μi - химический потенциал
i-го компонента.
Простые формулы связывают энтропию с теплоемкостями при постоянном давлении Ср и
постоянном объеме Cv: С помощью энтропии формулируются
условия достижения термодинамического равновесия системы при постоянстве ее внутренней
энергии, объема и числа молей i-го компонента (изолированная система) и условие устойчивости
такого равновесия: Это означает, что энтропия изолированной
системы достигает максимума в состоянии термодинамического равновесия. Самопроизвольные
процессы в системе могут протекать только в направлении возрастания энтропии.
Для изолированных систем второй закон утверждает: dS і 0, (4.2) т.е. энтропия
изолированных систем в необратимых процессах может только возрастать, а в состоянии
термодинамического равновесия она достигает максимума (dS = 0,
d 2S < 0).
При любых процессах, протекающих в термодинамических изолированных системах,
энтропия либо остается неизменной, либо увеличивается. Таким образом, энтропия указывает
направление самопроизвольно протекающих процессов. Рост энтропии указывает на приближение
системы к состоянию термодинамического равновесия. В состоянии равновесия энтропия принимает
максимальное значение. Закон возрастания энтропии можно принять в качестве еще одной
формулировки второго закона термодинамики.
Связь энтропии со статическим весом.
5. Зависимость энтропии, внутренней энергии и энтальпии от давления и
объема. Зависимость энтропии от температуры. Третье начало термодинамики.
II. Поверхностные явления, адсорбция
1. Свойства поверхности раздела фаз. Поверхностное натяжение. Адсорбция.
Адсорбционная формула Гиббса. Адсорбция на твердых поверхностях. Физическая и
химическая адсорбции. Уравнение Ленгмюра. Полимолекулярная адсорбция. Уравнение БЭТ.
Определение удельной поверхности.

Поверхностное натяжение, стремление вещества (жидкости или твердой фазы) уменьшить
избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию).
Определяется как работа, затрачиваемая на создание единицы площади поверхности раздела фаз
(размерность Дж/м2). Согласно другому определению, поверхностное натяжение – сила, отнесенная
к единице длины контура, ограничивающего поверхность раздела фаз (размерность Н/м); эта сила
действует тангенциально к поверхности и препятствует ее самопроизвольному увеличению.
Поверхностное натяжение – основная термодинамическая характеристика поверхностного
слоя жидкости на границе с газовой фазой или другой жидкостью.
Так как появление поверхности жидкости требует совершения работы, каждая среда
«стремится» уменьшить площадь своей поверхности:
в невесомости капля принимает сферическую форму (сфера имеет наименьшую площадь
поверхности среди всех фигур одинаковой ёмкости).
струя воды «слипается» в цилиндр.
маленькие объекты с плотностью, большей плотности жидкости, способны «плавать» на
поверхности жидкости, так как сила тяготения меньше силы, препятствующей увеличению площади
жидкости.
С поверхностью жидкости связана свободная энергия
где σ — коэффициент поверхностного натяжения, S — полная площадь поверхности
жидкости[1]. Так как свободная энергия изолированной системы стремится к минимуму, то
жидкость (в отсутствие внешних полей) стремится принять форму, имеющую минимальную
площадь поверхности. Таких образом задача о форме жидкости сводится к изопериметрической
задаче при заданных дополнительных условиях (начальное распределение, объём и т. п.).
Поверхностное натяжение зависит от температуры. Для многих однокомпонентных
неассоциированных жидкостей (вода, расплавы солей, жидкие металлы) вдали от критической
температуры хорошо выполняется линейная зависимость: где s и s0 –
поверхностное натяжение при температурах T и T0 соответственно, α≈0,1 мН/(м·К) – температурный
коэффициент поверхностного натяжения. Основной способ регулирования поверхностного
натяжения заключается в использовании поверхностно-активных веществ (ПАВ).
Поверхностное натяжение, важнейшая термодинамическая характеристика поверхности
раздела фаз (тел), определяемая как работа обратимого изотермического образования единицы
площади этой поверхности. П. н. на границе двух конденсированных фаз обычно называется
межфазным натяжением. Работа образования новой поверхности затрачивается на преодоление сил
межмолекулярного сцепления (когезии) при переходе молекул вещества из объёма тела в
поверхностный слой. Равнодействующая межмолекулярных сил в поверхностном слое не равна
нулю (как в объёме тела) и направлена внутрь фазы с большей когезией. Таким образом, П. н. —
мера некомпенсированности межмолекулярных сил в поверхностном (межфазном) слое или, что то
же, избытка свободной энергии в поверхностном слое по сравнению со свободной энергией в
объёмах соприкасающихся фаз. В соответствии с определениями П. н. его выражают в дж/м2 или н/
м (эрг/см2 или дин/см).
Благодаря П. н. жидкость при отсутствии внешних силовых воздействий принимает форму
шара, отвечающую минимальной величине поверхности и, следовательно, наименьшему значению
свободной поверхностной энергии. П. н. не зависит от величины и формы поверхности, если объёмы
фаз достаточно велики по сравнению с размерами молекул; при повышении температуры, а также
под действием поверхностно-активных веществ оно уменьшается.
Адсорбция (лат. ad — на, при; sorbeo — поглощаю) — процесс концентрирования вещества
из объёма фаз на границе их раздела.
В общем случае причина адсорбции - нескомпенсированность межмолекулярных сил вблизи
этой поверхности, т.е. наличие адсорбционного силового поля.Поглощаемое вещество, ещё
находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле
под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом —
адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на
границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть
перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция.
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она
характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е.
экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте
сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на
угле.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия
молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в
отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться
по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим
энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её
протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или
серебре при высоких температурах.
Следует подчеркнуть, что явления физической и химической адсорбции чётко различаются в
очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса
адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно.
Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по
законам физической адсорбции, но при повышении температуры начинает протекать химическая
адсорбция. При повышении температуры увеличение химической адсорбции с некоторой
температуры начинает перекрывать падение физической адсорбции, поэтому температурная
зависимость адсорбции в этом случае имеет четко выраженный минимум.
Изотерма адсорбции
В равновесной адсорбционной системе параметры, определяющие равновесие, - это ai
парциальные давления р (или сi) и температура Т. Они связаны так называемым термическим
уравнением:
Три частных случая термического уравнения (когда Т, р или a - константы) играют особую
роль в теории адсорбции:
а= - уравнение изотермы адсорбции,
Т= - уравнение изобары адсорбции,
Р- - уравнение изостеры адсорбции.
Изотерма- это зависимость относительной концентрации от давления адсорбата при
постоянной температуре: С=f(p) при Т=const.
Первым фундаментальным уравнением изотермы адсорбции является уравнение Ленгмюра,
применяемое для мономолекулярной адсорбции в области малых и средних насыщений (в
отсутствие капиллярной конденсации):
где a0– емкость монослоя, b– константа, зависит от температуры и рода
адсорбента;

где a – количество вещества, адсорбированного при давлении p; a0 – предельная
концентрация поглощенного компонета в адсорбенте, достигаемая при = 1 (p* – давление
насыщения при заданной температуре); b – коэффициент, зависящий от температуры.
Изотерма Ленгмюра имеет вид кривой с насыщением (рис. 13.1.1.1). В области больших
давлений при bp 1 величина а = а0, что соответствует заполнению монослоя. В области малых
давлений уравнение Ленгмюра сводится к уравнению Генри. Для расчета значений а0 и константы
равновесия b уравнение мономолекулярной адсорбции записывают в линейном виде, например:
= a0b – аb.
Полимолекулярная адсорбция
Увеличение толщины слоя адсорбированных молекул адсорбтива до двух и более слоев
молекул характеризует полимолекулярную адсорбцию, теоретические положения которой в 1914 г.
впервые разработал венгерский ученый М. Поляни, описавший сорбционное равновесие исходя из
энергетического уровня молекул сорбата при полимолекулярной адсорбции. теорию (БЭТ)
полимолекулярной адсорбции, утверждая, что на поверхности адсорбента имеется ряд активных
центров адсорбции (т. е. адсорбция локализована), обусловливающих наличие монослоя, на котором
адсорбируется второй, третий и т. д. слой молекул, не взаимодействующих со смежными слоями.
Аналитическое описание теории БЭТ приведено в работах . Поэтому запишем уравнение БЭТ в
конечном виде
уравнение полимолекулярной адсорбции БЭТ: где a0–
емкость монослоя, C1– константа, зависит от температуры и рода адсорбента и адсорбата, ps–
давление насыщенного пара;
удельная поверхность
усреднённая характеристика пористости или дисперсности соответственно микропористых
или тонкоизмельчённых (диспергированных) твердых тел. Удельную поверхность выражают
отношением общей поверхности тела к его объёму или массе. Удельная поверхность
пропорциональна дисперсности или, что то же, обратно пропорциональна размеру частиц
дисперсной фазы.
От величины удельной поверхности зависят поглотительная способность адсорбентов,
эффективность твёрдых катализаторов, свойства фильтрующих материалов.
Удельную поверхность чаще всего определяют по количеству адсорбированного материалом
инертного газа и по воздухопроницаемости слоя порошка или пористого материала. Адсорбционные
методы позволяют получать наиболее достоверные данные.
III Электрохимия
1. Активность ионов. Ионная сила раствора. Зависимость коэффициента активности
иона от ионной силы раствора. Теория Дебая-Хюккеля.
Активность (ионов) — эффективная концентрация с учетом электростатического
взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую
величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется
коэффициентом активности: γ = a/c.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в
растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда.
Формула впервые была выведена Льюисом:
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
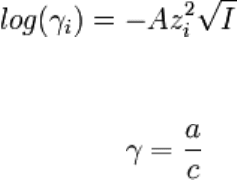
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в
растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная
сила раствора. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила
обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая —
Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь
между коэффициентом активности иона ze и ионной силы раствора I в виде:
где γ - коэффициент активности, А - постоянная, не зависящая от заряда иона и ионной силы
раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
Отношение активности (a) к общей концентрации вещества в растворе (c, в моль/л), то есть
активность ионов при концентрации 1 моль/л, называется коэффициентом активности:
В бесконечно разбавленных водных растворах неэлектролитов коэффициент активности
равен единице. Опыт показывает, что по мере увеличения концентрации электролита величины f
уменьшаются, проходят через минимум, а затем снова увеличиваются и становятся существенно
большими единицы в крепких растворах. Такой ход зависимости f от концентрации определяется
двумя физическими явлениями.
Первое особенно сильно проявляется при малых концентрациях и обусловлено
электростатическим притяжением между противоположно заряженными ионами. Силы притяжения
между ионами преобладают над силами отталкивания, т.е. в растворе устанавливается ближний
порядок, при котором каждый ион окружен ионами противоположного знака. Следствием этого
является усиление связи с раствором, что находит отражение в уменьшении коэффициента
активности. Естественно, что взаимодействие между ионами возрастает при увеличении их зарядов.
При возрастании концентрации все большее влияние на активность электролитов оказывает
второе явление, которое обусловлено взаимодействием между ионами и молекулами воды
(гидратацией). При этом в относительно концентрированных растворах количество воды становится
недостаточным для всех ионов и начинается постепенная дегидратация, т.е. связь ионов с раствором
уменьшается, следовательно, увеличиваются коэффициенты активности.
Известны некоторые закономерности, касающиеся коэффициентов активности. Так, для
разбавленных растворов (приблизительно до m = 0,05) соблюдается соотношение 1 - f = k√m. В
несколько более разбавленных растворах (т ≈ 0,01) величины f не зависят от природы ионов. Это
обусловлено тем, что ионы находятся на таких расстояниях друг от друга, на которых
взаимодействие определяется только их зарядами.
При более высоких концентрациях наряду с зарядом на величину активности начинает
оказывать влияние и радиус ионов.
Для оценки зависимости коэффициентов активности от концентрации в растворах, где
присутствует несколько электролитов, Г. Льюис и М. Рэндалл ввели понятие о ионной силе I,
которая характеризует интенсивность электрического поля, действующего на ионы в растворе.
Ионная сила определяется как полусумма членов, полученных умножением моляльностей каждого
иона mi на квадрат его валентности Zi:
I = 1/2∑miZi. (IX.18)
ДЕБАЯ - ХЮККЕЛЯ ТЕОРИЯ, статистич. теория разбавленных растворов сильных
электролитов, позволяющая рассчитать коэф. активности ионов. Основана на предположении о
полной диссоциации электролита на ионы, которые распределены в растворителе, рассматриваемом
как непрерывная среда. Каждый ион действием своего электрич. заряда поляризует окружение и
образует вокруг себя некоторое преобладание ионов противоположного знака - т. наз. ионную
атмосферу. В отсутствие внеш. электрич. поля ионная атмосфера имеет сферич. симметрию и ее
заряд равен по величине и противоположен по знаку заряду создающего ее центр. иона. Потенциал j
суммарного электрич. поля, создаваемого центр. ионом и его ионной атмосферой в точке,
расположенной на расстоянии r от центр. иона, м.б. рассчитан, если ионную атмосферу описывать
непрерывным распределением плотности r заряда около центр. иона. Для расчета используют ур-ние
Пуассона (в системе СИ):
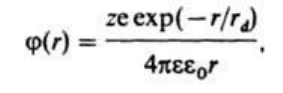
n2j = -r/ee0,
где n2-оператор Лапласа, e - диэлектрич. проницаемость растворителя, e0 - электрич.
постоянная (диэлектрич. проницаемость вакуума). Для каждого i-го сорта ионов r описывается ф-
цией распределения Больцмана; тогда в приближении, рассматривающем ионы как точечные заряды
(первое приближение Д.-Х.т.), решение ур-ния Пуассона принимает вид:
где z - зарядовое число центр. иона, rd - т. наз. дебаевский радиус экранирования (радиус ионной
атмосферы). На расстояниях r > rd потенциал j становится пренебрежимо малым, т. е. ионная
атмосфера экранирует электрич. поле центр. иона.
В отсутствие внешнего электрического поля ионная атмосфера имеет сферическую
симметрию, и её заряд равен по величине и противоположен по знаку заряду создающего её
центрального иона. В этой теории не уделено почти никакого внимания образованию пар
противоположно заряженных ионов путём непосредственного взаимодействия между ними.
2. Равновесие в растворах электролитов. Протолитическая теория кислот. Константа
основности оснований.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны
реакции, идущие с равными скоростями в противоположных направлениях. При химическом
равновесии концентрации реагентов, температура и другие параметры системы не изменяются со
временем.
Электролитами называют вещества, проводящие электрический ток за счет движения ионов (а
не электронов, как в проводниках-металлах).
Из этого определения видно, что вещества-электролиты должны содержать ионы, которые
могут двигаться. Это могут быть твердые, жидкие и даже газообразные вещества (правда, на
практике к газам, находящимся в таком состоянии – состоянии плазмы, термин «электролит» обычно
не применяют).
Ионной проводимостью в твердом состоянии обладают некоторые оксиды (например, ZrO2,
содержащий примесь СаО) при высоких (порядка 1000 °С) температурах (рис.). Примесь оксида
кальция создает кислородные вакансии (на рисунке ионы кальция затемнены, а пустыми
прямоугольниками обозначены места, в которых отсутствуют ионы кислорода) в кристаллической
решетке оксида циркония, по которым и может происходить диффузия этих ионов. Высокая
температура обеспечивает их подвижность. Это так называемые твердые электролиты,
используемые, например, в топливных элементах.
Электролитами принято называть вещества (главным образом, кислоты, основания и соли),
которые при растворении в воде дают подвижные ионы, т.е. растворы которых являются
электролитами в буквальном смысле слова. Поэтому обсуждаемые в настоящей главе растворы
принято называть растворами электролитов, хотя по существу правильнее было бы называть их
«растворы-электролиты».
Способность образовывать ионы является свойством не вещества самого по себе, а пары
вещество–растворитель
Протолитическая теория кислот и оснований , предложенная в 1923 г. независимо
датским ученым Бренстедом и английским ученым Лоури. Согласно этой теории кислотами
являются вещества, молекулы или ионы, отщепляющие при данной реакции протоны. Основаниями
являются вещества, молекулы или ионы, присоединяющие протоны. Как те, так и другие получили
общее название протолитов.
Реакция отщепления протона изображается уравнением:
кислота « основание + Н+
Кислота и основание такого процесса называется сопряженными. Это кислотно-основная
пара. Например, ион H3О+ — кислота , сопряженная основанию H2O, а хлорид-ион Cl- —
основание , сопряженное кислоте HCI.
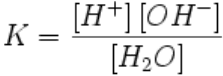
Свободные протоны в растворах самостоятельно не существуют. Они переходят от кислоты
к какому-либо основанию . Поэтому в растворе всегда протекают два процесса:
кислота1 « основание1 + Н+
основание2 + Н+ « кислота2
и равновесие между ними изображают уравнением
кислота1 + основание2 « основание1 + кислота2
Таким образом, из кислоты и основания всегда получаются новые сопряженные кислота
и основание . Протолитическая теория рассматривает реакцию нейтрализации как переход
протона кислоты к основанию .
3. Ионное произведение воды. рН-растворов. Индиеаторы. Буфферные растворы.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов
гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Вывод значения ионного произведения воды
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно
вычислить по формуле: где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически
постоянная и составляет (1000 г/л)/(18 г/моль) = 55,72 моль/л.
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется
ионным произведением воды. Она является постоянной не только для чистой воды, но также и для
разбавленных водных растворов веществ. C повышением температуры диссоциация воды
увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Практическое значение ионного произведения воды
Практическое значение ионного произведения воды велико, так как оно позволяет при
известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+]
или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для
удобства представления пользуются не абсолютными значениями концентраций, а взятыми с
обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH)
и гидроксильным показателем (pOH).
Так как Kв — константа, при добавлении к раствору кислоты (ионов H+), концентрация
гидроксид-ионов OH− будет падать и наоборот. В нейтральной среде [H+] = [OH−] = моль/л. При
концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет
кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л)
— щелочной. Чистая вода очень плохо проводит электрический ток, но всё же обладает
измеримой электрической проводимостью, которая объясняется небольшой диссоциацией воды
на ионы водорода и гидроксид-ионы. Для воды и разбавленных водных растворов при
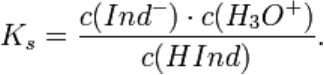
неизменной температуре произведение концентраций ионов водорода и гидросид-ионов есть
величина постоянная. Эта постоянная величина называется ионным произведением воды.
Растворы, в которых концентрация ионов водорода и гидроксид-ионов одинаковы, называются
нейтральными растворами.
Если концентрация ионов водорода в водном растворе известна, то тем самым определена и
концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щёлочности
раствора можно количественно охарактеризовать концентрацией ионов водорода. Кислотность
и щелочность раствора можно выразить другим, более удобным способом: вместо концентрации
ионов водорода указывают её десятичный логарифм, взятый с обратным знаком.
Эта величина называется водородным показателем и обозначается через рН:
рН=-lg[H+]
Для измерения рН существуют различные методы. Приближённо реакцию
раствора можно определить с помощью специальных реактивов, называемых
индикаторами, окраска которых меняется в зависимости от концентрации ионов
водорода. Наиболее распространённый индикатор – метиловый оранжевый,
метиловый красный, фенолфтолеин.
ИНДИКАТОРЫ (от лат. indicator – указатель) – вещества, позволяющие следить за составом
среды или за протеканием химической реакции. Одни из самых распространенных – кислотно-
основные индикаторы, которые изменяют цвет в зависимости от кислотности раствора. Происходит
это потому, что в кислой и щелочной среде молекулы индикатора имеют разное строение.
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в
растворе при изменении кислотности (рН). Индикаторы широко используют в титровании в
аналитической химии и биохимии. Из-за субъективности определения цвета, индикаторы pH не
всегда удобны, для точного измерения pH используют pH-метры с цифровой индикацией.
Измерение pH с помощью индикаторной бумаги
Ks:
Формы применения индикаторов
Индикаторы обычно используют, добавляя несколько капель водного или спиртового
раствора, либо немного порошка (например, смесь мурексида с хлоридом натрия) к пробе
исследуемого раствора. Так, при титровании, в аликвоту исследуемого раствора добавляют
индикатор, и наблюдают за изменениями цвета в точке эквивалентности.
Другой способ применения - использование полосок бумаги, пропитанных раствором
индикатора или смеси индикаторов и высушенных (например, "Универсальный индикатор"). Такие
полоски выпускают в самых разнообразных вариантах - с нанесенной на них цветной шкалой -
эталоном цвета (в том числе для окрашенных или мутных сред), или с напечатанными числовыми
значениями рН; для точного измерения в узких диапазонах рН, и для ориентировочного
исследования растворов; в рулончиках, коробках и пеналах, или в виде отрывных книжечек.
Современные индикаторные полоски могут быть изготовлены с красителем - индикатором,
привитым к целлюлозе или иному полимеру. Это делает их устойчивыми к вымыванию, вплоть до
многократного использования.
4. Окислительно-восстановительное равновесие. Электродные потенциалы. Электроды
первого рода. Нормальный потенциал.Водородный электрод. Ряд напряжений.
Химические реакции, протекающие с изменением степени окисления элементов, входящих в
состав реагирующих веществ, называются окислительно-восстановительными.
Окисление — это процесс отдачи электронов атомом, молекулой или ионом.
Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является
атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, восстановитель — окисляется.
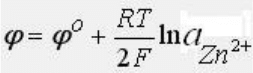
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и
принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во
многих случаях происходит не полный перенос электронов, а только смещение электронного облака
от одного атома к другому.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO,
является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном
состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах
при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C.
Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является
окислительно-восстановительная реакция, которая может быть разбита на две полуреакции:
окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона).
Электричество вырабатывается вследствие различия электростатического потенциала двух
электродов. Эта разность потенциалов создаётся в результате различий индивидуальных
потенциалов двух металлов электродов по отношению к электролиту.
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической
ячейки вытекает из "пары" электродов. Таким образом, невозможно определить величину для
каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки.
Для этого установлен стандартный водородный электрод, для которого этот потенциал точно
определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен,
может быть соотнесён со стандартным водородным электродом с образованием гальванической
ячейки - и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные
потенциалы, знак окисляющегося металлического электрода должен быть изменён на
противоположный при подсчёте общего потенциала ячейки. Также нужно иметь ввиду, что
потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно
различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-
либо электродного потенциала на основании двух других следует проявлять внимательность.
Электроды первого рода
Состоят из металла, погруженного в раствор, содержащий ионы этого металла. В этом случае
электродный потенциал определяется концентрацией катионов металла и почти не зависит от
концентрации анионов. В этом случае говорят, что электрод обратим относительно катиона.
Например электрод, состоящий из цинковой пластинки схематично записывается так: Zn2+Zn, на
нем протекает реакция :
Zn2+ + 2е = Zn
а потенциал записывается как: К электродам первого рода относят
амальгамные электроды, которые отлячаются тем, что вместо чистого металла используется раствор
данного металла в ртути (амальгамма).
Нормальный потенциал, стандартный потенциал, физико-химическая величина, условно
характеризующая равновесную разность потенциалов между электродом и раствором в том случае,
когда вещества, участвующие в электродной реакции, находятся в стандартном состоянии, т. е. их
активности (активные концентрации) равны 1. Поскольку фактическая разность потенциалов
электрода и раствора недоступна измерению, пользуются величинами, характеризующими
потенциалы различных электродов относительно некоторого электрода сравнения. Обычно
электродом сравнения служит нормальный водородный электрод (Н. В. Э.), потенциал которого
принимается равным нулю при любой температуре. Потенциал электрода, заряжающегося
отрицательно относительно Н. В. Э., имеет знак минус, заряжающегося положительно — знак плюс.
Совокупность Н. п. реакций разряда-ионизации металлов и водорода, расположенных в порядке их
возрастания, называется рядом напряжений. Элементы с менее положительными Н. п. вытесняют
элементы с более положительными Н. п. из раствора, содержащего их катионы. Н. п. вычисляют из
результатов измерений эдс гальванических элементов, а также из стандартных значений изменения
гиббсовой энергии (свободной энергии) DG° при реакции. Величины Н. п. могут быть использованы
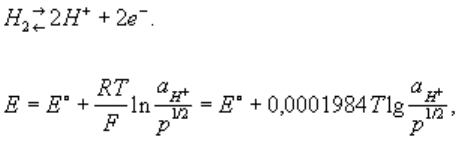
для вычислений DG° и констант равновесия химических реакций. Такие вычисления необходимы
для оценки возможности протекания химических реакций и для термодинамических расчётов.
Водородный электрод
платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в
раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током
газообразного водорода. Потенциал В. э. возникает за счёт обратимо протекающей реакции
Между водородом, адсорбированным платиновой чернью, и ионами водорода в
растворе устанавливается равновесие. Потенциал электрода Е определяется уравнением Нернста:
где Т — абсолютная температура (К), аН+ — активная
концентрация ионов водорода (г-ион/л), р — давление водорода [кгс/см2 (атм)], Е° — нормальный
(или стандартный) потенциал В. э. при р = 1 кгс/см2 (1 атм) и aH+ = 1. При любой заданной
температуре Е° условно принято считать равным нулю. От потенциала стандартного В. э.
отсчитывают потенциалы всех других электродов (так называемая водородная шкала потенциалов).
При работе с В. э. необходима тщательная очистка водорода от примесей. Особенно опасны
соединения серы и мышьяка, а также кислород, реагирующий с водородом на поверхности платины
с образованием воды, что приводит к нарушению равновесия. В. э. применяют как электрод
сравнения.
Ряд напряжений (реже — ряд активностей), последовательность расположения металлов и
их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов.
Электродом сравнения обычно служит стандартный водородный электрод. Поэтому в Р. н.
включают и водород, электродный потенциал которого принимается равным нулю.
Наибольшие отрицательные потенциалы характерны для щелочных металлов (около — 3 в),
за ними следуют щёлочноземельные металлы и т. д.; наиболее положительные потенциалы имеют
благородные металлы (около + 1,5 в; численные значения см. в ст. Металлы, табл. 2 и 3). В Р. н.
часто включают неметаллы, ионы и некоторые химические соединения. Наиболее распространённые
металлы расположены в Р. н. в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co,
Ni, Sn, Pb, H2, Cu, Hg, Ag, Au (см. там же).
Место каждого элемента в Р. н. несколько условно, так как величина электродного
потенциала зависит от температуры и состава раствора, в который погружены электроды, в
частности от активности (или концентрации) ионов данного вещества в электролите. Большое
значение имеет состояние поверхности электрода (гладкая, шероховатая), в особенности наличие на
ней окисной защитной плёнки (см. Пассивирование). Р. н., обычно, приводимый в учебной
литературе, относится к водным растворам при температуре 25 °С, давлении газов 1 атм и при
активности ионов, участвующих в электрохимической реакции, равной 1. При изменении
концентраций и растворителя последовательность веществ в Р. н. может изменяться, особенно для
веществ, близко расположенных в этом ряду.
Важнейшие следствия, вытекающие из Р. н. и широко используемые в химической практике:
1) каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие в
Р. н. правее данного металла; 2) все металлы, расположенные в Р. н. левее водорода, способны
вытеснять его из кислот; 3) чем дальше расположены друг от друга два металла в Р. н., тем большее
напряжение может давать построенный из них гальванический элемент. Р. н. составляется на основе
термодинамических характеристик электрохимических процессов, поэтому он позволяет судить
лишь о принципиальной возможности этих процессов; реальное же их осуществление во многом
определяется кинетическими факторами.
5. Электроды второго рода. Каломельный электрод. Окислительно-восстановительные
электроды.
Электроды второго рода
Состоят из металла, покрытого слоем труднорастворимой соли этого металла и опущенного в
раствор соли, образующей такой же анион, как и труднорастворимое соединение металла.
Электроды второго рода обладают высокой стабильностью потенциалов и применяются в качестве
электродов сравнения.
