Ответы на билеты по аналитической химии для кооперативного техникума
Подождите немного. Документ загружается.

цвет при изменении потенциала системы. Необратимые индикаторы – подвергаются необратимому
окислению или восстановлению, в результате чего цвет индикатора изменяется необратимо.
Редокс-индикаторы существуют в двух формах окисленной (Ind
ок.
) и восстановленной (Ind
вос
.), причем
цвет одной формы отличается от другой. Ind
ок.
+ nē <=> Ind
вос
. При проведении окислительно-
восстановительного титрования необходимо подбирать индикатор таким образом, чтобы потенциал
индикатора находился в пределах скачка потенциала на кривой титрования. Многие индикаторы
окислительно-восстановительного титрования обладают кислотными или основными свойствами и могут
менять свое поведение в зависимости от рН среды. Титрование индикаторным методом возможно, если
для данной реакции ЭДС ≥ 0,4 В. При ЭДС = 0,4 – 0,2 В используют инструментальные индикаторы.
20.
Перманганатометрия – метод объемного (титриметрического) химического анализа,
основанный на применении стандартного раствора перманганата калия KMnO
4
. При действии
восстановителей перманганат-ион в кислотной среде переходит в бесцветный катион
марганца(2+):
MnO
4-
+ 8H
+
+ 5ē = Mn
2+
+ 4H
2
O (стандартный потенциал при 25° С равен +1,53 В).
Окончание титрования устанавливается по отсутствию розовой окраски перманганат-иона
или с помощью индикатора (например, дифениламина). Применение перманганатометрии
несколько осложняется реакцией, которая может идти в конце титрования в случае недостаточной
кислотности раствора и приводит к ошибкам аналитического определения восстановителей:
2MnO
4-
+ 3Mn
2+
+ 2H
2
O = 5MnO
2
+ 4H
+
.
Эта реакция ускоряется в присутствии диоксида марганца. Поэтому необходимо подкисление
раствора, для которого обычно используют серную кислоту, так как соляная кислота (хлорид-
ионы) и азотная (примеси оксидов азота) могут окисляться перманганатом калия и тем самым
искажать результаты титрования.
При хранении раствора KMnO
4
идет его постепенное разложение с выделением кислорода и
образованием MnO
2
, что ведет к изменению концентрации исходного раствора. Поэтому для
титрования используют только свежеприготовленный раствор KMnO
4.
Для приготовления
стандартного раствора перманганата калия рекомендуется использовать дважды перегнанную
дистиллированную воду (при вторичной перегонке к воде добавляют немного KMnO
4
). Если нет
возможности использовать бидистиллят, приготовленный раствор KMnO4 кипятят, охлаждают и
отделяют выпавший осадок MnO
2
фильтрованием через стеклянный фильтр. Концентрацию
(нормальность) раствора KMnO4 устанавливают титрованием точной навески щавелевой кислоты
или оксалата натрия, согласно уравнению реакции:
5Na
2
C
2
O
4
+ 2KMnO
4
+ 8H
2
SO
4
→ 2MnSO
4
+ 5Na
2
SO
4
+ K
2
SO
4
+ 10CO
2
+ 8H
2
O.
Перманганатометрически определяют железо(2+), хром(3+), таллий(1+), вольфрам(V),
ванадий(IV), сурьму(III), пероксид водорода, гидразин, органические вещества.
Перманганатометрическое титрование применяется для определения очень сильных
21
восстановителей, реагирующих с катионами железа(3+), переводя их в катионы железа(2+),
которые оттитровывают перманганатом калия. Метод используется также для косвенных
определений, например в феррометрии, суть которого заключается в восстановлении окислителей
катионами железа(2+), избыток которого реагирует с перманганатом калия. Обратным
перманганатометрическим титрованием определяют восстановители, медленно реагирующие с
KMnO
4
– такие как иодиды, цианиды, тиоцианаты и т.п.
21.
Методы осаждения имеют ограниченное значение в связи с нестехиометрическим
протеканием реакций. Удовлетворительны с этой точки зрения реакции осаждения галогенидов и
тиоцианата серебра (аргентометрия), а также ряда соединений ртути (I) (меркуриметрия).
Наиболее важными требованиями, которые предъявляются к реакциям осаждения в
титриметрическом анализе, являются следующие: достаточно малая растворимость осадка и
быстрое его образование при добавлении титранта, минимальное соосаждение примесей и
наличие индикатора, позволяющего фиксировать конец реакции.
В практике применяют также титриметрические методы, основанные на реакциях
осаждения гексацианоферратом(II) калия (солей бария, свинца и циркония), диметилглиоксимом и
другими реагентами. Однако с появлением комплексонов практическое значение многих
титриметрических методов осаждения резко упало, поскольку методы комплексонометрического
титрования оказались более быстрыми, точными и надежными.
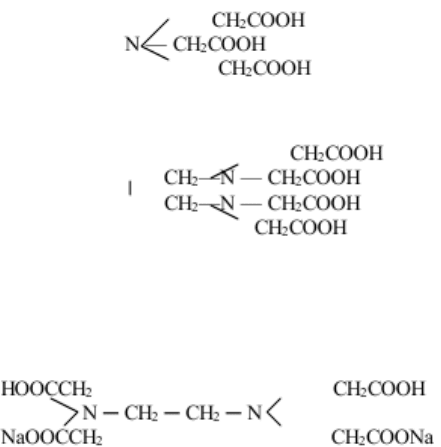
Основу метода комплексонометрического титрования составляют реакции образования
устойчивых комплексных соединений. Наиболее широкое применение в качестве титрантов
получили комплексоны, представляющие собой полиаминополикарбоновые кислоты и их соли.
Например: Нитрилотриуксусная кислота (НТА или Н
3
Y) – комплексон I
Этилендиамминтетрауксусная кислота (ЭДТУК или Н
4
Y) – комплексон II
На практике наиболее часто применяют двунатриевую соль этилендиамминтетрауксусной
кислоты - комплексон III или трилон Б (Nа-ЭДТА или ЭДТА, сокращенно Nа
2
Н
2
Y), в связи с
хорошей растворимостью соли в воде:
22

В качестве индикаторов в комплексонометрии применяют так называемые
металлохромные индикаторы, которые позволяют визуально определить точку эквивалентности,
например, хромоген чёрный. Металлохромные индикаторы – это органические красители,
образующие окрашенные комплексные соединения с ионами определяемого металла, менее
прочные, чем комплекс металла с комплексоном.
22.
Аргентометрические методы применяют для определения концентрации главным образом
галогенидов, например хлорида:
Ag
+
+ С1
-
= AgCl
Основными рабочими растворами аргентометрии являются растворы нитрата серебра,
хлорида натрия и тиоцианата калия или аммония. Хранят раствор AgNO
3
в склянках из темного
стекла, так как на свету соли серебра неустойчивы. Точную концентрацию раствора AgNO
3
обычно устанавливают по NaCl. Растворы NaCl и KSCN (или NH
4
SCN) готовят из
перекристаллизованных препаратов.
В аргентометрии применяют различные способы установления точки эквивалентности как
с помощью индикаторов, так и без них:
1. Метод равного помутнения (метод Гей-Люссака).
2. Метод Фольгарда.
3. Метод Фаянса
4. Метод Мора.
В методе Мора индикатором является хромат калия. Метод основан на образовании
кирпично-красного осадка хромата серебра Ag
2
CrО
4
в точке конца титрования. При
аргентометрическом титровании хлорида концентрация ионов в точке эквивалентности составляет
[Ag
+
] = [С1
—
] = 1,33 • 10
-5
моль/л, при которой осадок хромата серебра «на глаз» не будет заметен.
Для визуального обнаружения осадка необходимо перетитровать анализируемый раствор на одну
каплю раствора AgNO
3
.
Титрование с хроматом в качестве индикатора проводится в нейтральной или
слабощелочной среде, когда рН раствора больше 6,5, но меньше 10,5. В более кислой области
происходит протонирование хромата (CrO
4
2—
+ Н
+
= HCrO
4
—
, 2 HCrO
4
—
= Cr
2
O
7
2—
+ H
2
O) и
чувствительность индикатора падает, а в более щелочных растворах, чем рН 10,5, оксид или
гидроксид серебра может выпадать ранее хромата ( Ag
+
+ OH
—
= AgOH, 2AgOH = Ag
2
O + H
2
O).
23

Метод Мора обычно применяют для определения хлоридов и бромидов. Иодиды и
тиоцианаты не определяются, так как вследствие адсорбции установление точки эквивалентности
становится затруднительным и погрешность анализа существенно возрастает.
23.
Физико-химические методы анализа (ФХМА) основаны на зависимости физ. св-в в-ва от
его природы, причем аналитический сигнал представляет собой величину физ. св-ва,
функционально связанную с концентрацией или массой определяемого компонента. В отличие от
химических методов анализа, где аналит. сигналом служит масса в-ва или его объем, в физико-
химических методах анализа в качестве аналит. сигнала используют интенсивность излучения,
силу тока, электропроводность, разность потенциалов и др. По сравнению с классическими
химическими методами ФХМА отличаются меньшим пределом обнаружения, временем и
трудоёмкостью. ФХМА позволяют проводить анализ на расстоянии, автоматизировать процесс
анализа и выполнять его без разрушения образца (недеструктивный анализ).
Важное практич. значение имеют методы, основанные на исследовании испускания и
поглощения электромагн. излучения в разл. областях спектра. К ним относится спектроскопия,
нефелометрия и турбидиметрия, фотометрияи др.
При выполнении физико-химических методов анализа используют специальную, иногда
довольно сложную, измерит. аппаратуру, в связи с чем эти методы часто наз. инструментальными.
Почти во всех физико-химических методах анализа применяют два основных приема:
методы прямых измерений и титрования. В прямых методах используют зависимость аналит.
сигнала от природы анализируемого в-ва и его концентрации. Зависимость сигнала от природы в-
ва - основа качеств. анализа. В количеств. анализе используют зависимость интенсивности
сигнала от концентрации в-ва. Чаще всего она имеет вид I = a + bс , где I- интенсивность сигнала,
с - концентрация, а и b – постоянные. В ряде физико-химических методов анализа данное ур-ние
установлено теоретически, напр. закон Бугера-Ламберта-Бера в фотометрическом анализе.
Численные значения констант а и b определяют экспериментально с помощью следующих
методов:
1) Метод градуировочного графика. Измеряют интенсивность аналит. сигнала у неск.
стандартных образцов или стандартных р-ров и строят градуировочный график в координатах
24

I = f(с) или I = f(lgc), где с - концентрация компонента в стандартном р-ре или стандартном
образце. В тех же условиях измеряют интенсивность сигнала у анализируемой пробы и по
градуировочному графику находят концентрацию.
2) Метод стандартных серий применяют в тех случаях, когда ур-ние связи I = bc
соблюдается достаточно строго. Измеряют аналит. сигнал у неск. стандартных образцов или р-ров
и рассчитывают b = I
ст
/с
ст
;. В тех же условиях измеряют интенсивность сигнала у анализируемой
пробы I
x
и по соотношению c
x
= I
x
/b или cx = c
ст
I
x
/IСТ рассчитывают концентрацию.
3) Метод добавок. Измеряют интенсивность аналит. сигнала пробы I
x
, а затем
интенсивность сигнала пробы с известной добавкой стандартного р-ра I
x+ст
. Концентрацию в-ва в
пробе рассчитывают по соотношению с
x
= с
ст
I
x
/(I
x+ст
- I
x
).
В методах титрования измеряют интенсивность аналит. сигнала I в зависимости от объема
V добавленного титранта. По кривой титрования I=f (V)находят точку эквивалентности и
рассчитывают результат по обычным ф-лам титриметрич. анализа.
Колориметрический метод анализа – визуальный метод фотометрического анализа,
основанный на установлении концентрации р-римого окрашенного соед. по интенсивности или
оттенку его окраски. Чаще всего такое соед. образуется в результате взаимод. определяемого
компонента с подходящим реагентом. Это взаимод. должно быть возможно более полным;
необходимо также устранить влияние мешающих в-в. После завершения р-ции цвет полученного
р-ра сравнивают с цветом серии стандартных р-ров с известными концентрациями того же
соединения. Часто пользуются визуальными колориметрами. В колориметрах погружения
наблюдатель уравнивает окраски исследуемого и стандартного р-ров, меняя толщину их слоев.
Для этого р-ры помещают в цилиндры с прозрачным дном, через к-рое проходит свет от
источника; в них погружают монолитные стеклянные цилиндры, способные перемещаться в
вертикальном направлении. Поскольку, по закону Бэра, концентрация р-ра обратно
пропорциональна толщине его слоя, можно вычислить концентрацию окрашенного соед. в
исследуемом р-ре, зная его концентрацию в стандартном р-ре. В визуальных колориметрах
диафрагменного типа для уравнивания окрасок р-рителя и исследуемого р-ра их рассматривают
через светофильтр и изменяют отверстие диафрагмы. Количеств, анализ проводят по
градуировочной кривой в координатах размер диафрагмы - концентрация в-ва, построенной с
помощью серии стандартных р-ров для данного светофильтра и данной толщины слоя.
Колориметрический анализ отличается простотой и быстротой проведения эксперимента, но по
сравнению со спектрофотометрией не очень точен. Ниж. границы определяемых концентраций
варьируют от 10
-3
до 10
-8
моль/л.
25
