Ответы на билеты по аналитической химии для кооперативного техникума
Подождите немного. Документ загружается.


12.
Общепринятой классификации анионов не существует. Разными авторами предложены различные
системы классификации их. Рассмотрим классификацию, по которой все анионы делятся на три
аналитические группы в зависимости от растворимости их бариевых и серебряных селей. В данном случае
групповыми реагентами являются растворимые соли бария и серебра (табл. 1).
Таблица № 1
Классификация анионов
Группа Анионы Групповой реагент Характеристика группы
1 SO
4
2-
, SO
3
2-
, СO
3
2-
,
РO
4
3-
, SiO
3
2-
Хлорид бария ВаСl
2
в
нейтральном или слабо-
щелочном растворе
Соли бария практически нерастворимы в воде,
но растворяются в разбавленных кислотах (за
исключением BaSO4). Соли серебра
растворимы в кислотах
2 С1
-
, Вг
-
, I
-
, S
2-
Нитрат серебра AgNO
3
и
присутствии HNO
3
Соли серебра практически нерастворимы в
воде и разбавленной кислотах. Соли бария
растворимы в воде.
3 NO
3
-
, NO
2
-
, CH
3
COO
-
Группового реагента нет Соли бария и серебра растворимы в воде
Анализ анионов имеет свои особенности. В отличие от катионов, анионы обычно не мешают обнаружению
друг друга. Поэтому многие из них обнаруживают дробным методом в порциях исследуемого раствора. К
систематическому ходу анализа прибегают лишь в наиболее сложных случаях, например, при наличии в
растворе анионов-восстановителей или окислителей. Если в ходе анализа смеси катионов групповые
реагенты служат для последовательного отделения групп, то при анализе смеси анионов они используются
лишь для предварительного обнаружения той или иной группы. Это значительно облегчает работу, т.к.
отсутствие хотя бы одной из групп позволяет не производить реакций на относящиеся к ней анионы.
Схема анализа по идентификации сухой соли
1. Окраска сухого вещества:
черная: MnO , CuО , CoS , NiS , HgS , S
2
Ag , PbS , FeS и др;
оранжевая: Cr
2
O
7
2−
и др;
желтая: CdS , HgO , CrO
4
2−
;
красная: Co
+ 2
, Fe (SCN)
3
;
2 .Окраска пламени.
3. Проверка на наличие кристаллизационной воды.
4. Действие кислот на сухую соль.
5. Подбор растворителя(при комнатной температуре, при нагревании):H
2
SO
4
, HCl ,CH
3
COOH, H
2
O
«царская водка», сплавление с Na
2
CO
3
и последующее выщелачивание. Следует помнить, что практически
все нитраты, все соли калия, натрия и аммония растворимы в воде.
6. Контроль pH раствора (только для растворимых в воде объектов).
7. Предварительные испытания (NH
4
+
, Fe
3+
, Fe
2+
).
11
8. Обнаружение группы катионов, анионов.
9. Обнаружение катиона.
10. Обнаружение аниона.
13.
Количественный анализ — раздел аналитической химии, в задачу которого входит определение
количества (содержания) элементов (ионов), радикалов, функциональных групп, соединений или
фаз в анализируемом объекте. Количественный анализ позволяет установить элементный и
молекулярный состав исследуемого объекта или содержание отдельных его компонентов.
Теоретической основой методов количественного анализа являются различные разделы химии и
физики. Например, теории осаждения, кислотно-основных, окислительно-восстановительных
процессов и реакций комплексообразования, теории физико-химических методов анализа.
В зависимости от объекта исследования различают неорганический и органический анализ. В
свою очередь их разделяют на элементарный анализ, задача которого — установить, в каком
количестве содержатся элементы (ионы) в анализируемом объекте, на молекулярный и
функциональный анализы, дающие ответ о количественном содержании радикалов, соединений, а
также функциональных групп атомов в анализируемом объекте.
Во всех методах количественного анализа прибегают к точному измерению определенной
физической величины, например массы, объема, интенсивности окраски, электрической
проводимости и т. д. Разнообразные количественные методы разделяют на три класса:
химические, физико-химические и физические методы. Первыми, наиболее хорошо
разработанными методами химического анализа стали гравиметрический и титриметрический. В
первом из них решающее значение имеет точное измерение массы, во втором-—точное измерение
объема. Поэтому гравиметрический метод называли весовым, а титримет-рический—объемным.
В физических методах измеряют непосредственно определяемое физическое свойство без
проведения химических реакций. Например, для определения содержания различных веществ
(кислот, щелочей и др.) иногда достаточно измерить их плотность. На основе измерения
электрической проводимости можно определить содержание воды в концентрированной серной
или уксусной кислотах. Измеряемые свойства зависят от концентрации раствора, но не зависят от
массы или объема анализируемого вещества. Поэтому при анализе физическими методами нет
необходимости брать строго определенное количество данного вещества, т. е. не нужно брать
навеску или отмерять строго определенный объем раствора.
12
14.
Одной из главных операций количественного анализа является измерение массы. В гравиметрическом
анализе используют прямое измерение массы при помощи взвешивания. Определяемую составную часть
выделяют либо в чистом виде, либо в виде определенного соединения. Определение массы является не
только начальной, но и конечной стадией анализа. Для измерения массы с точностью до 0,1 — 0,01 г
служат технохимические весы. Ими пользуются тогда, когда не нужна большая точность взвешивания или
в том случае, когда надо грубо прикинуть размер навески для более точного взвешивания. Для
взвешивания с точностью до 0,0002 г служат аналитические весы. Рычажные технохимические и
аналитические весы имеют одни и те же рабочие части. Различие между ними только в размере деталей,
точности их изготовления.
Гравиметрический анализ основан на законе сохранения массы веществ при химических превращениях,
законе постоянства состава и законе эквивалентов. Большую роль в гравиметрическом анализе играет
превращение определяемой составной части в малорастворимое соединение. Осадок этого соединения
выделяют, высушивают, прокаливают и взвешивают. По массе его рассчитывают содержание определя-
емой составной части. Осадками являются гидроксиды металлов, карбонаты, сульфаты, фосфаты, оксалаты,
а также комплексные соединения металлов с органическими реактивами (оксихинолином, купфероном,
диметилглиоксимом). Например, при определении железа его осаждают в виде Fe(ОН)
3
раствором аммиака.
Гидроксид железа (III) прокаливают и переводят в Fe
2
О
3
, и уже по массе оксида железа (III) Fе
2
О
3
определяют содержание железа. В ходе подобного определения можно выделить две формы вещества:
осаждаемую и гравиметрическую. В данном случае осаждаемой формой будет Fe(ОН)
3
, поскольку все
железо в растворе переведено в осадок в виде Fe(ОН)
3.
Гравиметрической формой будет оксид железа
Fе
2
О
3
, поскольку по массе этого осадка рассчитывают содержание железа во взятой навеске. Осаждаемая и
гравиметрическая формы могут совпадать. Например, барий осаждают в виде ВаSО
4
и взвешивают также а
виде ВаSО
4
, так как при прокаливании его химический состав не изменяется.
Гравиметрическим методом был установлен химический состав большого числа веществ. Он являлся
основным методом определения атомных масс. Его используют для определения гигроскопической влаги у
широкого круга веществ, кристаллизационной воды, сульфат-иона, диоксида кремния, щелочных,
щелочноземельных и многих других металлов. Гравиметрические определения требуют больших затрат
времени, хотя он и обеспечивает высокую точность, не требует сложной аппаратуры и доступен для любой
химической лаборатории.
Гравиметрические определения можно подразделить на 3 типа:
1.Определяемую составную часть выделяют и взвешивают. Примером может служить
определение зольности различных видов топлива (каменного угля, горючих сланцев, торфа).
2.Определяемую составную часть удаляют, а остаток взвешивают. Примерами могут служить
определения гигроскопичности различных материалов, кристаллизационной воды в солях.
13
3.Определяемую составную часть переводят в химическое соединение. Последнее изолируют и
переводят в гравиметрическую форму, массе осадка которой рассчитывают содержание определяемой
составной части.
Гравиметрические методы, связанные с получением осадков, включают следующие операции:
1. отбор средней пробы;
2. взятие навески;
3. растворение навески;
4. осаждение определяемой составной части;
5. фильтрование и промывание осадков;
6. высушивание и прокаливание осадков;
7. взвешивание осадков;
8. вычисление результатов анализа.
Правила обращения с весами
1. Установленные весы нельзя сдвигать с места. После перестановки весы должны быть
установлены вновь строго по отвесу.
2. Необходимо твердо помнить, что нагрузка на весах изменяется только после арретирования.
3. Взвешиваемые предметы должны находиться в температурном равновесии с весами. Если
взвешиваемые предметы имеют температуру, отличающуюся от температуры весовой комнаты, то их
выдерживают в эксикаторе (обычно .15—20 мин).
4. Взвешиваемый предмет должен быть сухим и не иметь загрязнений на своей поверхности.
5. Если весы помещены в шкаф, то во время взвешивания открывают только боковые дверцы шкафа.
6. Нельзя нагружать весы выше их предельной нагрузки.
7. Твердые вещества взвешивают на часовом стекле или в стаканчике, жидкости, летучие и
гигроскопические вещества—в бюксе.
8. Разновес берут только пинцетом.
9. Разновес помещают в центре чашки.
Правила взвешивания на аналитических весах
1. Размер навески предварительно определяют на технохимических весах.
2. Взвешивают только сидя.
3. Перед взвешиванием устанавливают нулевую точку весов.
4. Взвешиваемый предмет помещают на левую чашку весов.
5. Разновес помещают на правую чашку весов.
6. При добавлении и снятии разновеса предварительно медленно, осторожно и плавно поворачивают
диск арретира.
7. Вращением большого и малого лимба устанавливают десятые и сотые доли грамма, уменьшая
каждый раз массу в 2 раза.
8. Когда масса взвешиваемого предмета найдена с точностью 0,01 г, арретир поворачивают до отказа
и после прекращения колебания фиксируют положение неподвижной линии на шкале экрана
14
вейтографа и арретируют весы. Шкала вейтографа в этом случае указывает на тысячные и
десятитысячные доли грамма, т. е. на 3-й и 4-й знак после запятой.
9. Записывают в журнал массу взвешиваемого предмета.
10. Убирают разновес в гнезда футляра и проверяют правильность записи.
11. Большой и малый лимб ставят в нулевое положение.
15.
Вода в твердых телах может быть гигроскопической и кристаллизационной. Количество
гигроскопической воды в веществе зависит от влажности воздуха и непостоянна при изменении
условий хранения вещества или при его измельчении. Вещества, содержащие
кристаллизационную воду, называются кристаллогидратами. Для практического определения
содержания кристаллизационной воды в кристаллогидрате необходимо установить по
справочнику, при какой температуре данный кристаллогидрат разлагается на безводную соль и
воду. Так, например, СuSО
4
●5Н
2
О обезвоживается при 220°С, СоСl●6Н
2
О - при 160-170°С,
NiSО
4
●7Н
2
О - при 250-280°С, NiС1
2
●6Н
2
О - при 175-250°С. Именно при этой температуре воду из
кристаллогидрата выпаривают в сушильном шкафу до постоянной' массы. Затем, зная массу
кристаллогидрата и массу его безводной соли, рассчитывают количество воды в кристаллогидрате
и устанавливают его формулу.
Для практического определения кристаллизационной воды в кристаллогидрате необходимы
следующие приборы и оборудование - сушильный шкаф, аналитические весы, эксикатор, бюкс с
крышкой, шпатель. Прежде всего необходимо хорошо вымыть бюкс, высушить его, а затем
поместить вместе с крышкой, поставленной на ребро, в сушильный шкаф при температуре 120-
125°С на 30-40 минут. Горячий бюкс с крышкой охлаждают в эксикаторе 15-20 минут, затем бюкс
с крышкой взвешивают на аналитических весах. Операцию высушивания и взвешивания бюкса
повторяют. Если масса бюкса не изменится или изменится не более чем на 0,0002 г, высушивание
считается законченным. В высушенный бюкс помещают ≈1 г кристаллической соли, закрывают
крышкой и взвешивают. Открытый бюкс вместе с крышкой ставят в сушильный шкаф на 45 минут
и сушат при необходимой температуре. Затем закрытый бюкс охлаждают в эксикаторе 15-20
минут и взвешивают. Для того чтобы убедиться в полноте обезвоживания, бюкс с веществом
вновь помещают в сушильный шкаф при той же температуре на 15-20 минут, затем охлаждают и
взвешивают. Высушивание повторяют до тех пор, пока масса бюкса между операциями не будет
меняться менее, чем на 0,0002 г. По результатам взвешивания вычисляют процентное содержание
воды в кристаллогидрате и число моль воды, приходящееся на один моль безводной соли.
Рассчитывают абсолютную и относительную погрешности опыта.
15
16.
Титриметрический или объемный метод анализа является одним из методов количественного анализа. В основе
этого метода лежит точное измерение объемов растворов двух веществ, реагирующих между собой. Количественное
определение с помощью титриметрического метода анализа выполняется довольно быстро, что позволяет проводить
несколько параллельных определений и получать более точное среднее арифметическое. В основе всех расчетов
титриметрического метода анализа лежит закон эквивалентов: C
1
• V
1
= C
2
• V
2
По характеру химической реакции, лежащей в основе определения вещества, методы титриметрического анализа
подразделяют на следующие группы: метод нейтрализации или кислотно-основного титрования; метод окисления-
восстановления; метод осаждения и метод комплексообразования. Различают прямое, обратное и заместительное
титрование.
Титрование – это постепенное прибавление титрованного раствора реагента (титранта) к анализируемому раствору
для определения точки эквивалентности. Титриметрический метод анализа основан на измерении объема реагента
точно известной концентрации, затраченного на реакцию взаимодействия с определяемым веществом. Точка
эквивалентности – момент титрования, когда достигнуто эквивалентное соотношение реагирующих веществ.
Достигнув точки эквивалентности, титрование заканчивают и отмечают объем раствора, пошедший на данную
реакцию. Следовательно, в титриметрическом методе анализа первостепенное значение имеет точное определение
точки эквивалентности. Точку эквивалентности (т.э.) определяют по изменению окраски индикатора или с помощью
инструментальных индикаторов, приборов фиксирующих измене какого-то свойства среды в процессе титрования.
Индикаторы – это вещества, которые изменяют свое строение и физические свойства при изменении среды. В
области точки эквивалентности индикатор изменяет свой цвет, образует осадок или вызывает какой-то другой
наблюдаемый эффект. Индикаторы – это вещества, которые позволяют с известной степенью достоверности
установить конечную точку титрования (к.т.т.). При правильном выборе индикатора точка эквивалентности (т.э.)
должна совпадать с конечной точкой титрования (к.т.т.), либо быть минимальной.
При проведении титриметрического анализа применяют растворы реактивов с точной концентрацией – титранты
(вторичные стандартными или рабочие растворы). Концентрацию титрантов устанавливают с помощью специальных
веществ, называемых стандартами (первичными стандартами или установочными веществами). Процесс определения
концентрации вторичного стандартного раствора титрованием по первичному стандартному раствору называется
стандартизацией раствора. К стандартам предъявляются определенные требования. Они должны иметь: большую
молярную массу, так как это снижает ошибку при взвешивании; постоянный состав, отвечающий определенной
формуле и не изменяющейся при хранении, высушивании, взвешивании; они должны легко очищаться
кристаллизацией; быть устойчивыми к окислению, не поглощать влагу и СО
2
из воздуха.
Кислотно-основное титрование(метод нейтрализации)
Метод кислотно-основного титрования основан на использовании реакции нейтрализации между кислотой и
основанием: Н
+
+ ОН
—
<=> Н
2
О. Точка эквивалентности в кислотно-основном титровании определяется по
изменению рН раствора. Поэтому для определения характера среды и для приблизительной оценки рН используют
кислотно-основные индикаторы. Кислотно-основные индикаторы – это довольно сложные органические вещества,
слабые электролиты, обладающие кислотными или основными свойствами. Существуют одноцветные
(фенолфталеин) и двухцветные (метиловый оранжевый, лакмус) индикаторы. Если индикатор является слабой
кислотой, то уравнение его диссоциации можно записать следующим образом: НInd ↔ Н
+
+ Ind
—
. Ионизированная и
16

неионизированная формы индикатора придают раствору различную окраску. В зависимости от характера среды
равновесие в системе может смещаться в сторону молекулярной или ионной форм индикатора и от этого будет
зависеть окраска раствора. Границы интервала рН, в котором происходит изменение окраски раствора индикатора: рН
= рК
HInd
± 1. Интервал рН, в котором индикатор изменяет свою окраску, называется интервалом перехода индикатора
(ИП).
17.
Концентрация — величина, характеризующая количественный состав раствора. Согласно правилам
ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества
растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение
неоднородных величин.Те величины, которые являются отношением однотипных величин (отношение
массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму
раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют
термин концентрация и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
1. Массовая доля (также называют процентной концентрацией)
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в
долях единицы.
, где:
m
1
— масса растворённого вещества, г (кг);
m — общая масса раствора, г (кг).
2. Объёмная доля
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля
измеряется в долях единицы или в процентах.
, где:
V
1
— объём растворённого вещества, л;
V — общий объём раствора, л.
3. Молярность (молярная объёмная концентрация)
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора.
Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают
в моль/л или ммоль/л. Также распространено выражение в «молярности», которое принято обозначать М.
Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
, где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
4. Моляльность (молярная весовая концентрация)
17

Моляльность — количество растворённого вещества (число молей) в 1000 г растворителя. Измеряется в
молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг
называют 0,5-моляльным.
, где:
ν — количество растворённого вещества, моль;
m
2
— масса растворителя, кг.
5. Нормальная концентрация (мольная концентрация эквивалента)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную
концентрацию выражают в моль/л (имеется в виду моль эквивалентов). Для записи концентрации таких
растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль/л, называют
децинормальным и записывают как 0,1 н.
, где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — фактор эквивалентности.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество.
Например, одномолярный раствор H
2
SO
4
будет однонормальным, если он предназначается для реакции со
щёлочью с образованием гидросульфата KHSO
4
, и двухнормальным в реакции с образованием K
2
SO
4
.
6. Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
, где:
m
1
— масса растворённого вещества, г;
V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной
реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал
массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в
граммах) соответствует 1 мл титрованного раствора.
7. Мольная доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех
компонентов. Мольную долю выражают в долях единицы.
, где:
νi — количество i-го компонента, моль;
n — число компонентов;
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы
выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную
массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают,
18

сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты
(например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm).
Иногда используют также отношение масс (отношение массы растворённого вещества к массе
растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму
растворителя).
18.
Основное уравнение процесса нейтрализации – взаимодействие: H
+
+ OH
−
→ H
2
O. Титрантами
в методе ацидиметрии являются HCl, H
2
SO
4,
в методе алкалиметрии – NaOH, KOH. Эти вещества
являются вторичными стандартами и не соответствуют требованиям, предъявляемым к
стандартным веществам, поэтому их концентрацию определяют по первичным стандартам. В
качестве таковых выступают: бура Na
2
B
4
O
7
⋅10H
2
O, Na
2
CO
3
(безводный), H
2
C
2
O
4
⋅ 2H
2
O . Методы
нейтрализации позволяют определять кислоты, гидроксиды, соли, гидролизующиеся по катиону
(аниону), и другие вещества, реагирующие в стехиометрических соотношениях с кислотами и
гидроксидами, а также различные смеси.
Процесс нейтрализации можно представить
графически в виде кривой титрования,
изображающей изменение рН титруемого раствора
по мере добавления к нему стандартного раствора
кислоты или щелочи (рис. 1). Момент
эквивалентности устанавливают индикаторным
методом по изменению окраски индикатора, 1-2
капли которого добавляют в титруемый раствор.
Резкое изменение рН вблизи ТЭ называется
скачком титрования. Индикаторы в методе
нейтрализации – это сложные органические
кислоты или гидроксиды, при диссоциации
которых происходит изменение структуры их
молекул, т.е. появление или исчезновение хромофорных групп. Область значений рН, в которой
индикатор изменяет свою окраску, называется интервалом перехода индикатора. Его можно
рассчитать по формуле: pH = pK
инд
± 1. Вместо интервала перехода окраски индикатора
пользуются также показателем титрования индикатора (рТ). рТ – это оптимальное значение рН
титруемого раствора, при котором наблюдается наиболее резкое изменение окраски идикатора,
свидетельствующее об окончании титрования. Значения величины рТ приблизительно совпадают
со значениями величин рК
инд
.
19
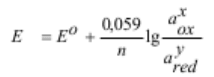
Для надежного фиксирования точки эквивалентности надо подобрать такой индикатор,
интервал перехода которого попадал бы в скачок титрования. Например, при титровании сильной
кислоты сильным основанием (рис.1) скачок титрования находится в диапазоне рН от 4 до 10 (при
концентрации реагирующих веществ, равной 0,1eмоль/дм
3
). В данном случае могут использоваться
метилоранж (интервал перехода 3,1 – 4,4) и фенолфталеин (интервал перехода 8,0 – 9,6)
Рис 1. Кривая титрования сильного основания (NaOH) сильной кислотой (НСl).
19.
В окислительно-восстановительном титровании используют реакции, протекающие с изменением
степени окисления реагирующих веществ – окислительно-восстановительные реакции. Каждую
окислительно-восстановительную реакцию можно представить как сумму двух полуреакций. Одна
реакция отражает превращение окислителя, а вторая – восстановителя. Ox
1
+ n ē = Red
1
; Red
2
- n ē = Ox
2
Недостатком окислительно-восстановительных реакций в большинстве случаев является их небольшая
скорость, это затрудняет процесс титрования. Для ускорения реакций, протекающих с маленькой
скоростью, применяют нагревание. Если нагревание использовать нельзя (вещество разлагается или
улетучивается), то увеличивают концентрацию вещества или используют катализаторы. Окислительно-
восстановительные реакции количественно характеризуются окислительно-восстановительным
потенциалом или редокс-потенциалом. Электродный потенциал Е ( или φ) зависит от природы
окислительно-восстановительной пары, активности ионов окислителя и восстановителя, температуры.
Количественно зависимость от этих параметров определяется уравнением Нернста:
Если титрант – окислитель, то титрование называют окислительным. Если титрант – восстановитель, то
титрование восстановительное.По типу применяемого титранта методы окислительно-
восстановительного титрования делятся на следующие виды:
• пермангатометрическое – титрант раствор KMnO
4
;
• Иодометрическое титрование – титранты растворы I
2
и Na
2
S
2
O
3
;
• Броматометрическое – титрант раствор КВrО
3
;
• Бромометрическое – титрант раствор Вr
2
( (КВrО
3
+ КВr)
• Хроматометрическое – титрант раствор К
2
Сr
2
О
7
и т.д.
Редокс-титрование может быть выполнено различными способами: прямое титрование, обратное
титрование и заместительное титрование. Для определения точки эквивалентности используют
различные индикаторы:1) Окислительно-восстановительные индикаторы (редокс-индикаторы),
изменяющие цвет при изменении октслительно-восстановительного потенциала системы.
2) Специфические индикаторы, изменяющие свой цвет при появлении избытка титранта или
исчезновении определяемого вещества. Примером является крахмал – индикатор на наличие I
2
.Редокс-
индикаторы делятся на: обратимые и необратимые. Обратимые индикаторы – обратимо изменяют свой
20
