Остроушко А.А. Защита атмосферы от выбросов токсичных веществ
Подождите немного. Документ загружается.

121
катализатора заданным объемом такого раствора, сушку осуществляли при
90
о
С. Остальные составы готовили также пиролизом полимерно-солевых
композиций из соответствующих солей.
Катализатор (удельная поверхность порядка 8-15 м
2
/г) перетирали в
агатовой ступке и смешивали в массовых соотношениях 4:1 с
предварительно измельченным активированным углем типа БАУ (удельная
поверхность около 100 м
2
/г, зольность 4 мас. %). В золе присутствовали
оксиды алюминия, железа, кремния, а также микропримеси других металлов.
Каталитическую активность по окислению углерода кислородом воздуха
определяли гравиметрическим методом в открытом реакторе, слой смеси
порошкового катализатора с углеродом помещался в керамические лодочки.
Реакцию окисления углерода оксидом азота NO исследовали аналогичным
образом в проточном кварцевом реакторе,
через который пропускали со
скоростью 30 мл/мин оксид азота, получаемый по реакции между крепким
раствором нитрита натрия или калия (квалификация “хч”) и подкисленным
соляной кислотой “хч” раствором сульфата железа(II) “хч”. Первый раствор
по каплям приливали ко второму.
Для выбора оптимального состава катализатора предварительно были
синтезированы составы Cs
x
La
1-x
VO
4±y
c x от 0 до 0.5 и структурой монацита, а
также M
0,1
La
1,9
Cu
0,95
V
0,05
O
4±y
(M = K, Cs), относящиеся к структурному типу
К
2
NiF
4
. Получены однофазные образцы. Введение щелочных металлов
приводило к изменению параметров кристаллической решетки типа К
2
NiF
4
.
Указанные параметры при введении более крупного иона цезия были больше
на 0.2 %, чем при замещении лантана калием. Активность сложных оксидов
оценивали по реакции окисления углерода кислородом воздуха со
ступенчатыми двадцатиминутными изотермическими выдержками
реакционных смесей от 100 до 600
о
С. В качестве образца сравнения
использовали углерод без катализатора или с добавками индифферентных
веществ, равными по массе катализатору. Условную температуру зажигания
реакции (T
ig.
) определяли из температурных зависимостей степени выгорания

122
углерода. Активность сложных оксидов Cs
x
La
1-x
VO
4±y
была выше (T
ig.
300-
310
о
С), чем у M
0,1
La
1,9
Cu
0,95
V
0,05
O
4±y
. Анализ активности катализаторов
последнего типа подтвердил ее связь с атомной массой щелочного металла,
входящего в структуру. Для состава, содержавшего цезий, температура
зажигания составляла 330, а с калием – 340
о
С. На образцах без катализатора
температура зажигания составила 410
о
С. Оптимальным составом
катализатора был Cs
0.3
La
0.7
VO
4±y
, его и использовали для дальнейших
экспериментов. Более высокое содержание цезия дополнительного эффекта
повышения каталитической активности обычно не давало и приводило к
повышению расхода реактивов, содержащих цезий. Гетерогенный
катализатор валового состава Ag
0.25
La
0.75
MnO
3±y
(T
ig.
360
о
С), проявляющий
высокую активность при окислении монооксида углерода СО и органических
соединений, также уступал в данном случае Cs
0.3
La
0.7
VO
4±y
.
Таблица 6.5
Температура зажигания реакций окисления углерода
Температура зажигания T
ig
,
о
C № Образец
Содержание
промотора m,
мас. %
Воздух Оксид азота
1 Углерод 0 410 >500
2 Углерод + катализатор 0 300-310 380
3
Углерод + катализатор +
промотор
1 350 480
4
Углерод + катализатор +
промотор
5 290 440
5
Углерод + катализатор +
промотор
10 270 360
123
Изотермические эксперименты для изучения кинетики окисления
углерода проводили в практически значимом интервале температур
эксплуатации катализаторов: 300-400
о
С. В качестве промотора для
Cs
0.3
La
0.7
VO
4±y
, как сказано выше, применяли сульфат цезия. Степень
превращения определяли при выдержках, начиная с 5 минут, до 1-1.5 часов.
При относительно малых длительностях эксперимента заметно влияние
времени нагрева образцов, а также наличие индукционного периода реакции,
связанного с сорбцией кислорода на поверхности угля. В ходе исследований
подтверждено, что добавки сульфата цезия к катализатору существенно
повышают скорость окисления углерода кислородом и снижают температуру
зажигания реакции (табл. 6.5, рис. 6.3). При окислении углерода в
кинетическом режиме на внешних поверхностях зерен зависимости степени
превращения (α) от времени (τ) при изотермических выдержках должны
описываться уравнением “сжимающейся сферы”:
[1-(1-α)
1/3
] = Kτ (1).
Экспериментальные данные в пределах погрешности измерений могут
быть в целом описаны уравнением (1), что подтверждается обработкой
данных в координатах приведенного времени. Однако в некоторых случаях
наблюдаются отклонения от этой зависимости при относительно высоких
степенях превращения. Степень превращения оказалась несколько ниже
расчетной. Это может быть обусловлено наличием на завершающей
стадии
остатков наиболее крупных или трудноокисляемых частиц, поскольку
использованные угольные порошки не были строго монодисперсными и
однородными: для их получения используется сырье естественного
происхождения. Кроме того, определенный вклад могут вносить частицы
угля, имеющие форму, отклоняющуюся от сферической. Такие частицы
сходны с устойчивыми цепочками в саже. Для подобных образований
зависимость степени превращения
от времени описывается уравнением
“сжимающегося цилиндра”, что также приводит к некоторому снижению
скорости общего окислительного процесса:
124
[1-(1-α)
1/2
] = Kτ (2).
Для практической реализации окисления углеродистых частиц в газовых
потоках целесообразен их контакт на достаточно высокой скорости с
твердыми поверхностями, например специальным отражателем для
разрушения ансамблей частиц. Для описания наблюдаемого процесса
горения угля оказалось пригодным также уравнение реакции первого
порядка по углероду:
ln(1/1-α)=Kτ (3).
Расчет констант
скорости реакции горения по уравнениям (1) и (3) дал
близкие результаты.
125
В присутствии катализаторов на основе ванадата лантана-цезия общая
константа скорости окисления углерода (К) была выше (табл. 6.6), чем в их
отсутствие. Эффективные энергии активации окисления угля с
катализаторами для образцов 2-4 и 5 укладываются в рамки данных,
полученных другими авторами [36]. Следовательно, можно считать, что
режим окисления близок к режиму горения отдельных частиц
в газовой
0 1000 2000 3000 4000 5000
0.0
0.1
0.2
0.3
0.4
0 1000 2000 3000
0.0
0.1
0.2
0.3
0.4
0 1000 2000 3000 4000 5000
0.0
0.1
0.2
0.3
0.4
0 100020003000
0.0
0.2
0.4
0.6
0 1000 2000 3000
0.0
0.2
0.4
0.6
0.8
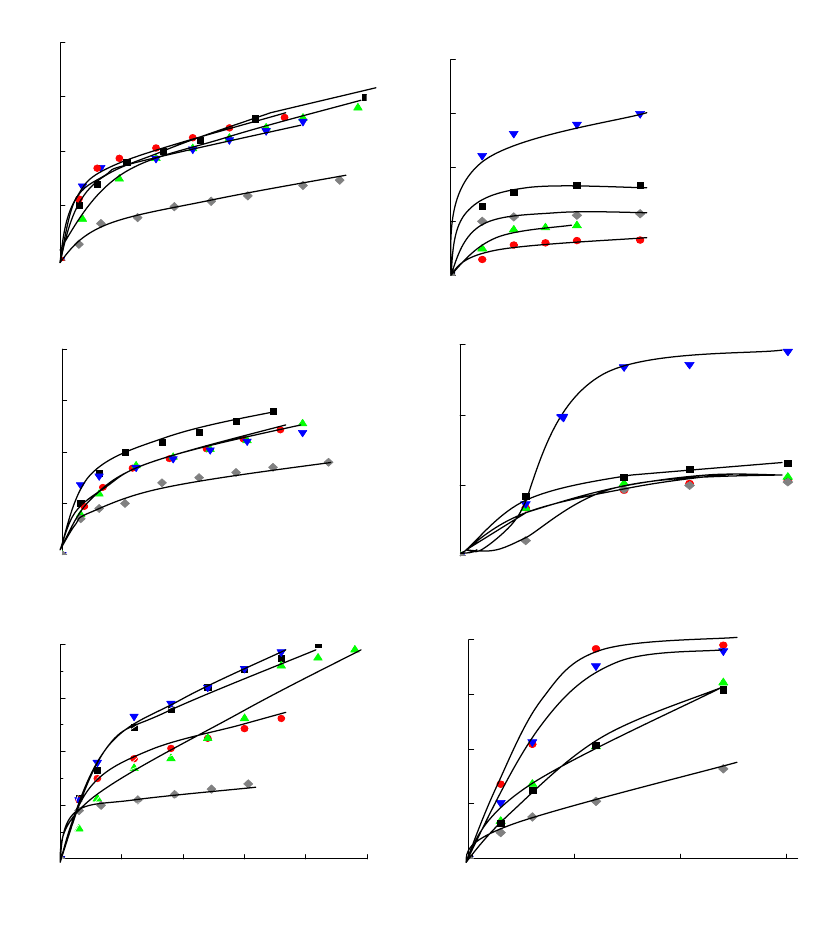
Рисунок 6.3 Примеры полученных зависимостей степени удаления углерода (С) от
продолжительности протекания процесса (t, с) при окислении оксидом азота (1) кислородом
воздуха (2): а – 300
о
С, б – 350
о
С, в – 400
о
С. Для всех графиков обозначения: ромбики - углерод
без катализатора; квадратики – углерод с катализатором без промотора; кружки – углерод с
катализатором, содержащим 1 мас. % промотора; треугольники вершиной вверх – то же с
содержанием промотора 5 мас. %; треугольники вершиной вниз – то же с содержанием промотор
а
10 мас. %.
0 1000 2000 3000 4000 5000
0.0
0.1
0.2
0.3
0.4
t, c t, c
C
C
C
C
C
C
1 2
а
а
б б
в
в
126
среде. Так или иначе, соответствуют этой модели и предэкспоненциальные
множители.
Обращает на себя внимание, что при введении 1 мас. % сульфата цезия
свойства катализатора резко изменяются: Е и T
ig.
увеличиваются (табл. 6.5,
6.6, рис. 6.4, 6.5). При этом сильно возрастает и предэкспоненциальный
множитель, за счет чего скорость окисления углерода в целом возрастает.
Наблюдаемое явление может быть связано с изменениями природы
имеющихся в катализаторе фаз и степени контактирования на границе
катализатора с частицами углерода. С увеличением содержания в
катализаторе сульфата цезия энергия активации горения
снижается, также
как и температура зажигания. При наличии 10 мас. % сульфата цезия (табл.
6.2) Е имеет значение, характерное для процессов горения слоя.
Таблица 6.6
Кинетические параметры реакции каталитического окисления углерода
кислородом [45]
Предэкспоненциальный
множитель (lgK
0
[1/с])
№ Состав образцов
Содержа-
ние про-
мотора m,
мас. %
Эффектив-
ная энергия
активации
Е,
кДж/моль
Экспе-
римент
1* 2* 3*
1 Углерод 0 55 0.52 1.80 1.69 3.10
2
Углерод +
катализатор
0 70 1.93 2.42 2.05 3.40

127
3
Углерод +
катализатор +
промотор
1 88 3.64 3.18 2.48 3.76
4
Углерод +
катализатор +
промотор
5 80 3.30 2.84 2.29 3.60
5
Углерод +
катализатор +
промотор
10 25 -1.40 0.54 0.99 2.50
6
Углерод +
Ag
0.25
La
0.75
MnO
3±y
0 88 3.53 3.18 2.48 3.76
*Рассчитано по уравнениям [40]:
1 - Вулиса Л.А. lgK
0
=1.75
.
10
-4
Е-0.5;
2 - Кнорре Г.Ф., Палеева И.И., Арефьева К.М. lgK
0
=0.991
.
10
-4
Е+0.398;
3 - Шестакова С.М. lgK
0
=0.838
.
10
-4
Е+2 [46].
128
100 200 300 400 500 600
0
20
40
60
80
100
C, %
T,
O
C
A(2)
B(2)
C(1)
D(2)
E(1)
F(1)
G(1)
H(1)
I(1)
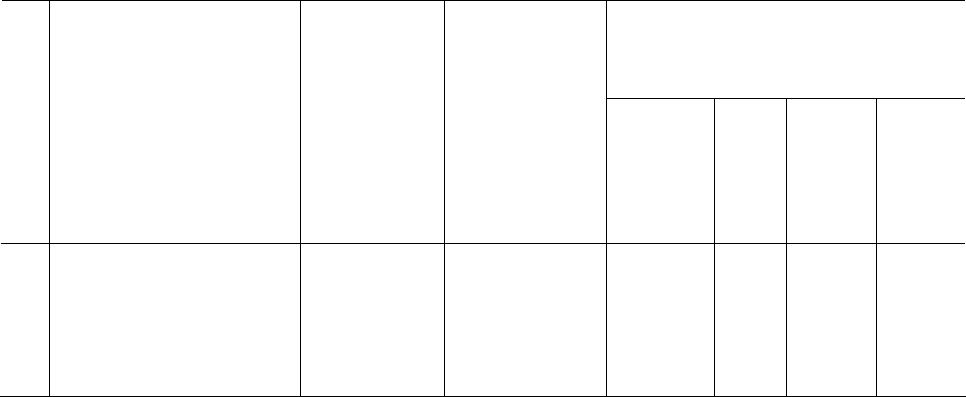
Рис. 6.4. Температурные зависимости (Т
о
С) степени удаления углерода
(С, %) с двадцатиминутной экспозицией при окислении оксидом азота (1) и
кислородом воздуха (2): A(2) [9] и C(1) – углерод без катализатора; F(1) –
углерод с катализатором без промотора; G(1) – углерод с катализатором,
содержащим 1 мас. % промотора; H(1) – то же с содержанием промотора 5
мас. %; D(2) и I(1) – то же с содержанием промотора 10 мас. %; B(2) и E(1) –
углерод с промотором.
129
0246810
0
100
200
300
400
500
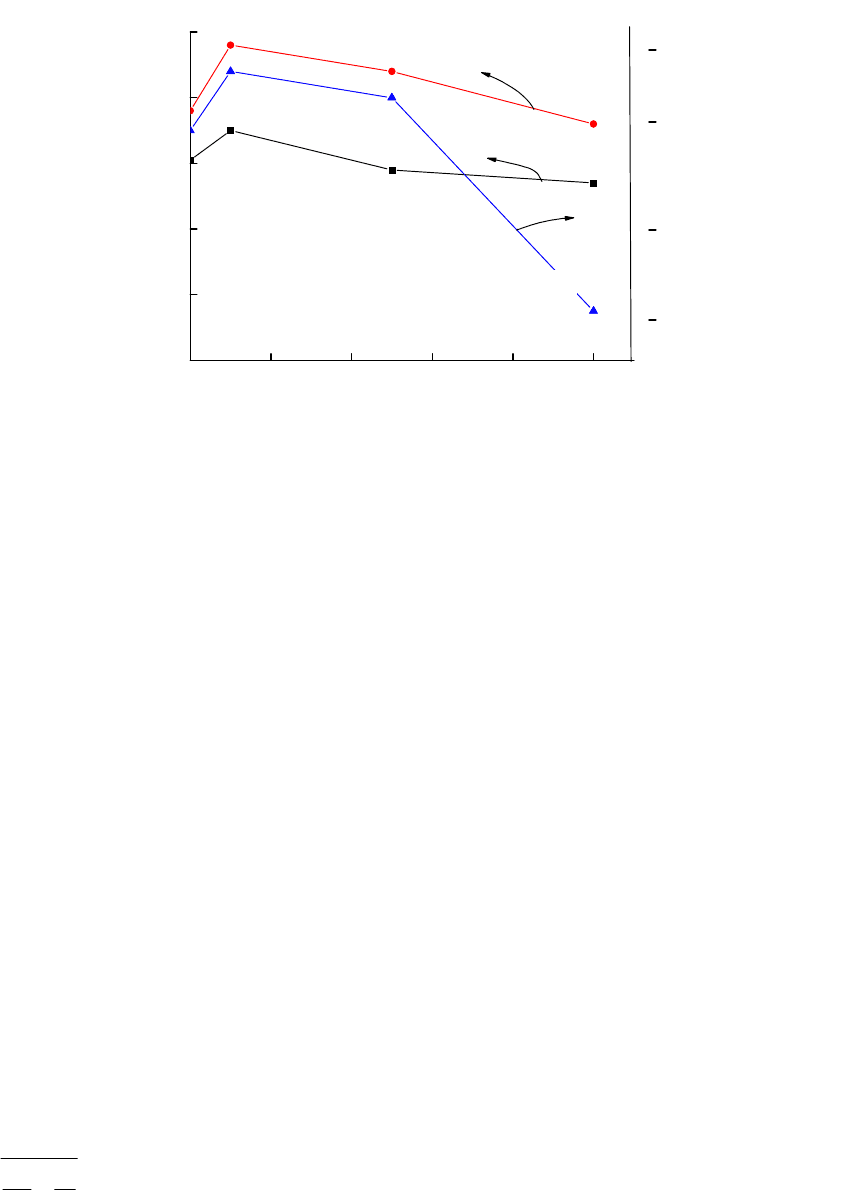
Рис. 6.5. Зависимость условной температуры зажигания T
ig
(
O
C) и
эффективной энергии активации Е от количества введенного промотора m (%
мас.) при окислении углерода оксидом азота (1) и кислородом воздуха (2).
Для некаталитического окисления углерода полученная энергия активации
имеет промежуточное значение между горением частиц и окислением
углерода в слое. Значения K
0
(табл. 6.6) процесса окисления в данном случае
не соответствуют величинам, рассчитанным по уравнениям горения частиц.
Поскольку скорость некаталитического окисления углерода в целом ниже, то
существенное влияние на параметры горения оказывают реакции на
внутренней поверхности частиц, связанные с необходимостью внутренней
диффузии кислорода и обратного транспорта продуктов окисления в
соответствии с уравнением, полученным
Хитриным Л.Н.:
,
1
1
0
D
R
K
C
K
C
S
+
=
β
(4)
где С
0
– концентрация кислорода в окружающей среде; D – коэффициент
диффузии; К
1
– суммарная константа скорости реакции; R – радиус частицы.
Здесь также необходимо учитывать фактор β, стехиометрический
коэффициент (соотношение массы прореагировавшего углерода к массе
E
A
,
кДж/моль
75
50
25
Т
ig
,
О
С
m, % мас.
1
2
2

130
израсходованного кислорода), определяемый соотношением выхода СО и
СО
2
при окислении углерода:
()
,1
32
12
ξβ
−= (5)
где ξ=1 при выходе СО; ξ=0 при выходе СО
2
и ξ=0.33 при соотношении СО/
СО
2
=1; 12 и 32 – молекулярные массы углерода и кислорода.
Значение β в присутствии катализаторов вероятно существенно выше.
Катализаторы в принципе могут оказывать воздействие как на реакцию
углерода с кислородом воздуха (6), так и на окисление образующегося при
этом СО (7):
С + 1/2О
2
→ СО (6)
СО + 1/2О
2
→ СО
2
(7).
Понятно, что обе эти реакции являются достаточно сложными. В
зависимости от воздействия катализатора на процессы (6), (7) может
изменяться и общий механизм окисления. В отсутствие промотора или при
его малом количестве, в силу ограниченной поверхности соприкосновения
углерода (учитывая размер частиц) и катализатора, можно сделать
предположение о более сильном влиянии на
окисление СО (7). Это
увеличивает значение фактора β. Реакция (7) в присутствии катализатора
локализуется, вероятно, на поверхности сложного оксида. При этом
эффективная энергия активации сравнима со значениями Е процесса
окисления СО на сложнооксидных катализаторах, которая составляет от 64
до 132 кДж/моль, что подтверждает сделанное предположение. Оценка
удельной скорости окисления на поверхности катализатора СО,
возникающего
при сгорании углерода, дает величины близкие к скорости
собственно каталитического окисления СО, полученные в работе. Для
процесса окисления углерода в присутствии катализаторов в температурном
интервале 300-400
О
С количество сгорающего СО находится в пределах
1.3÷6.1
.
10
17
молек/м
2.
с. При 240
о
С на сложнооксидных катализаторах сгорает
2.12
.
10
17
÷3.44
.
10
18
молек/м
2.
с СО. Элементарным актом, определяющим
